Similar presentations:
Анилин - представитель ароматических аминов
1. АНИЛИН - представитель ароматических аминов
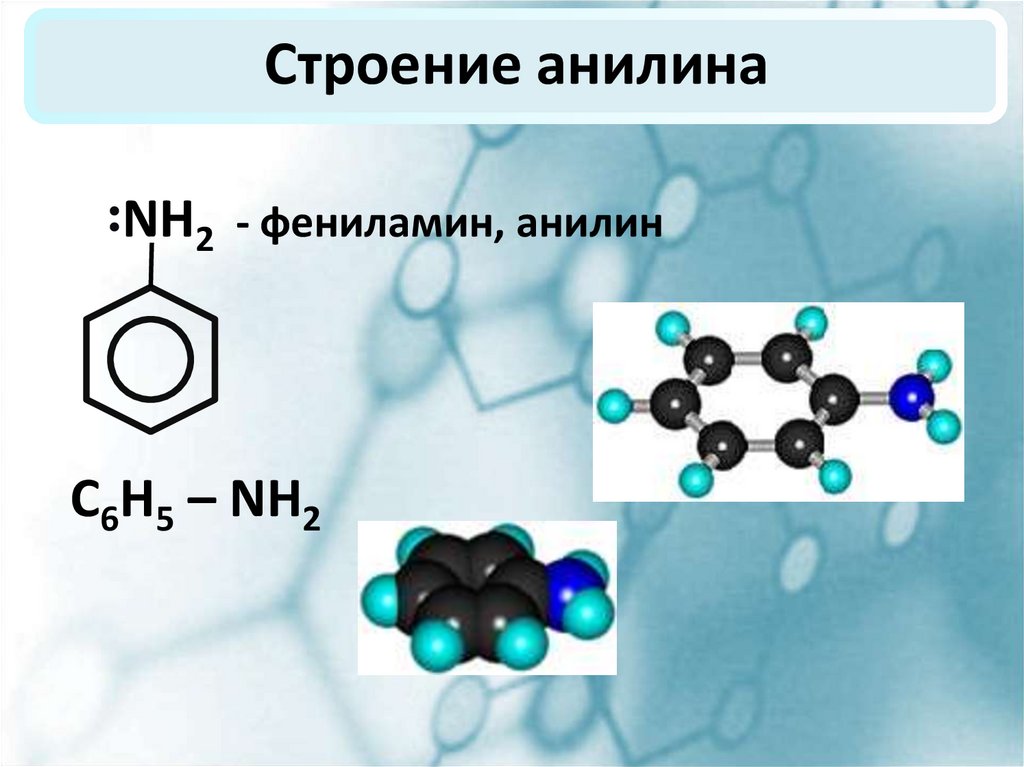
2. Строение анилина
NH2 - фениламин, анилинС6Н5 – NH2
3. Физические свойства
• Анилин – бесцветнаямаслянистая жидкость,
малорастворимая в воде,
со слабым характерным
запахом. Тяжелее воды.
При окислении на
воздухе становится
светло-коричневого
цвета. Сильно ядовит!
Затвердевает при
температуре -60С, кипит
при 1740С
4. Химические свойства
Влияние бензольного ядра на аминогруппуNH2
• Бензольное ядро оттягивает
свободную электронную пару от азота
на себя. На атоме азота уменьшается
электронная плотность и оон слабее
притягивает к себе протоны Н+ от
воды => меньше образуется
свободных гидроксогрупп ОН- в
растворе => основные свойства
анилина проявляются меньше.
Анилин очень слабое основание,
слабее чем амины, не изменяет цвет
индикаторов.
5. Химические свойства
1.Взаимодействует с сильными кислотами, образуясоли
С6Н5–NH2 + HCl
С6Н5–NH3 Cl
хлорид фениламмония – хорошо
растворим в воде, при добавлении щелочи
образует анилин:
[С6Н5–NH3]Cl + NaOH
С6Н5–NH2 + NaCl + H2O
2. Взаимодействует с азотистой кислотой,
образуя фенол
С6Н5NН2 + HNO2 → С6Н5OH + N2 + H2O
6. Химические свойства
Влияние аминогруппы на бензольное кольцоNH2
6
2
4
• Аминогруппа подает электронную
плотность на бензольное кольцо. В
результате этого происходит
поляризация единого 6-рэлектронного облака и
перераспределение электронной
плотности внутри кольца. Она
сгущается у 2, 4, 6 атомов углерода.
Атомы водорода в этих положениях
становятся более подвижными и
легче замещаются.
7. Химические свойства
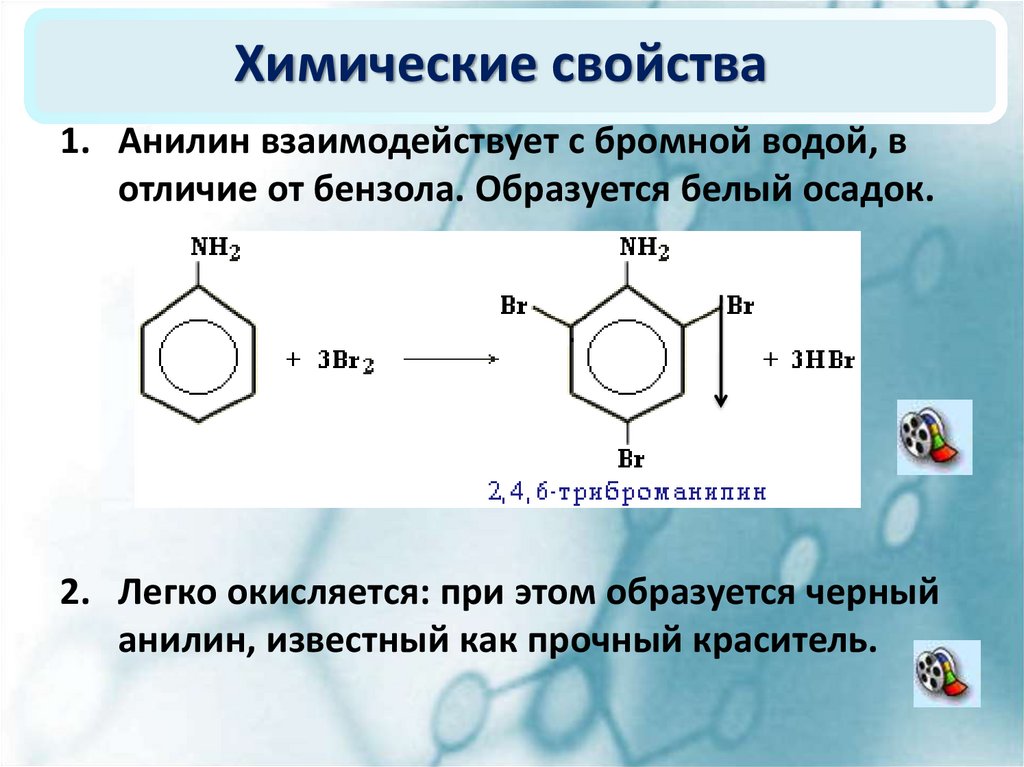
1. Анилин взаимодействует с бромной водой, вотличие от бензола. Образуется белый осадок.
2. Легко окисляется: при этом образуется черный
анилин, известный как прочный краситель.
8. Химические свойства
• Качественная реакция на анилин –реакция с хлорной известью Са(Cl)OCl –
появляется характерное фиолетовое
окрашивание.
9.
10. Получение анилина
1. Реакция Зинина – восстановлениенитробензола водородом при t = 3000C
300 С
C6H5 – NO2 + 6 Н К C6H5 – NH2 + 2Н2О
2. В промышленности – восстановление
нитробензола металлами, например
чугунными стружками, в кислой среде.
4С6Н5NО2 + 9Fe + 4H2O
4С6Н5NН2 +3Fe3O4
3. Действием аммиака на хлорбензол:
t,p,k
С6Н5Сl + 2 NH3 → С6Н5NН2 + NH4Cl
0
11.
Синтезы на основе анилинаСинтетические
красители;
индикаторы
Лекарственные
препараты:
сульфаниламид и его
производные; анестезин,
новокаин и т.д.
Пестициды
Стабилизирующие
добавки к
полимерам
Взрывчатые
вещества
11









 chemistry
chemistry








