Similar presentations:
Химические уравнения
1.
ТЕМАХИМИЧЕСКИЕ
УРАВНЕНИЯ
2. “Все изменения,которые случаются в действительности,находятся в таком состоянии,что сколь от одного тела отнимается,столько
прибавляется кдругому,так что где убудет немного
материи,то умножится в другом месте”
М.В.Ломоносов(1756г)
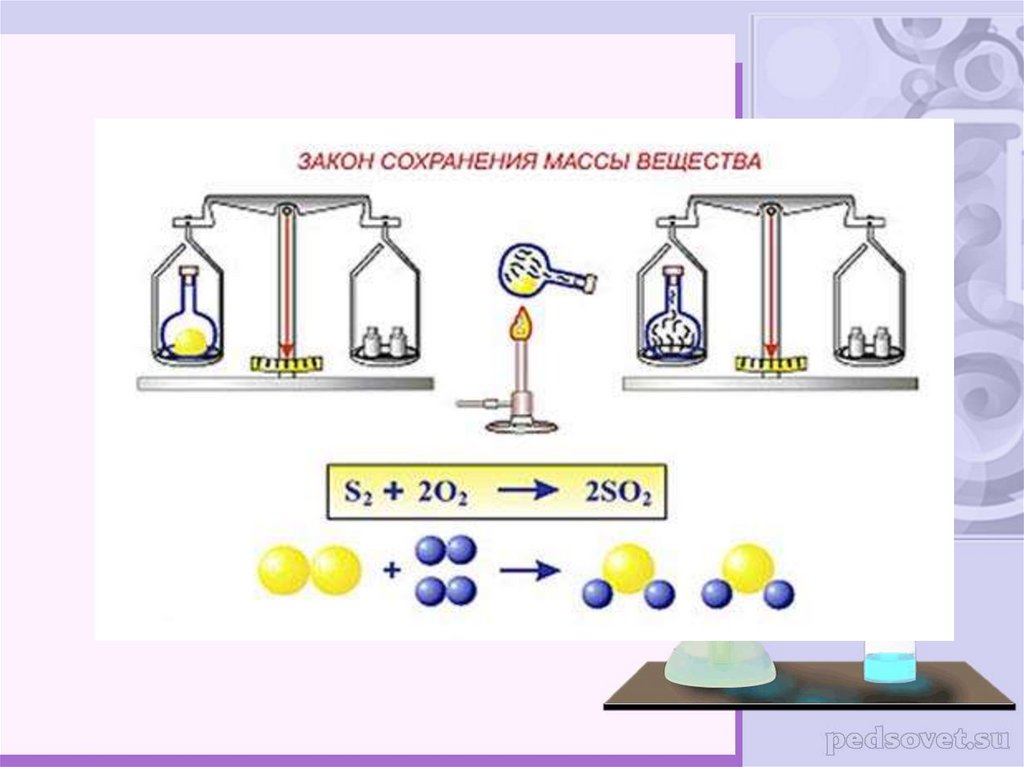
3. Современная формулировка закона сохранения массы веществ:
Масса веществ,вступивших вхимическую реакцию,равна массе
веществ,получившихся в результате
её.
4.
5.
Химическое уравнение– запись химической реакции
при помощи химических
формул веществ и
коэффициентов.
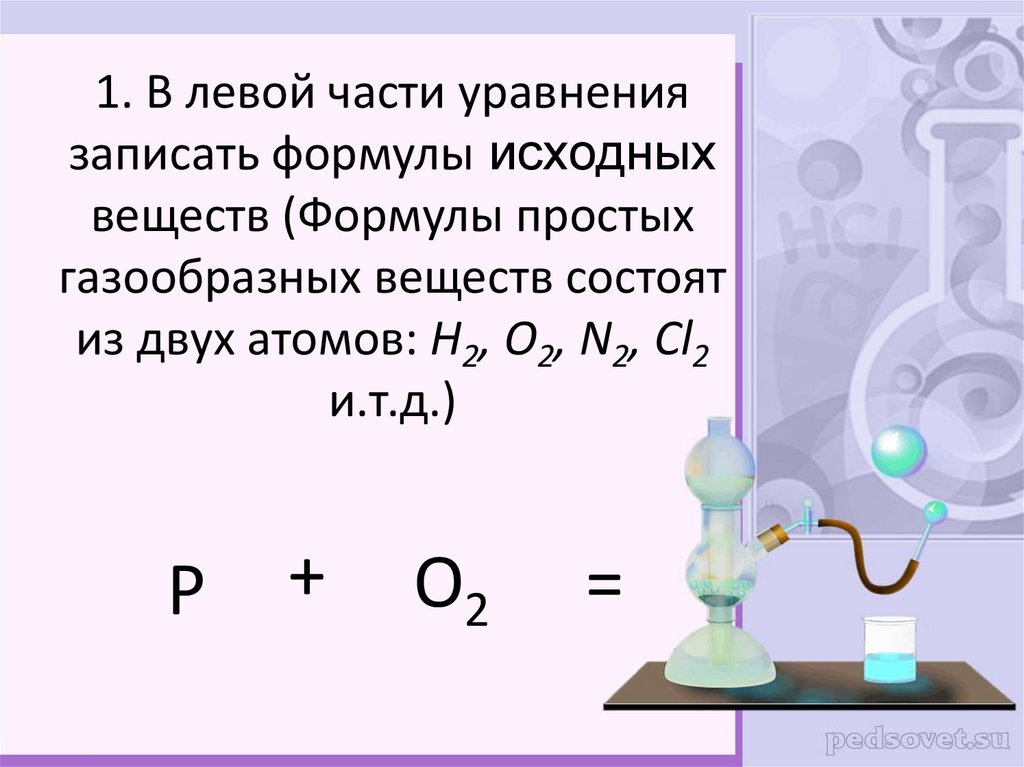
6. Пример: Составить уравнение реакции взаимодействия фосфора и кислорода.
7. 1. В левой части уравнения записать формулы исходных веществ (Формулы простых газообразных веществ состоят из двух атомов: Н2,
О2, N2, Cl2и.т.д.)
P
+
O2
=
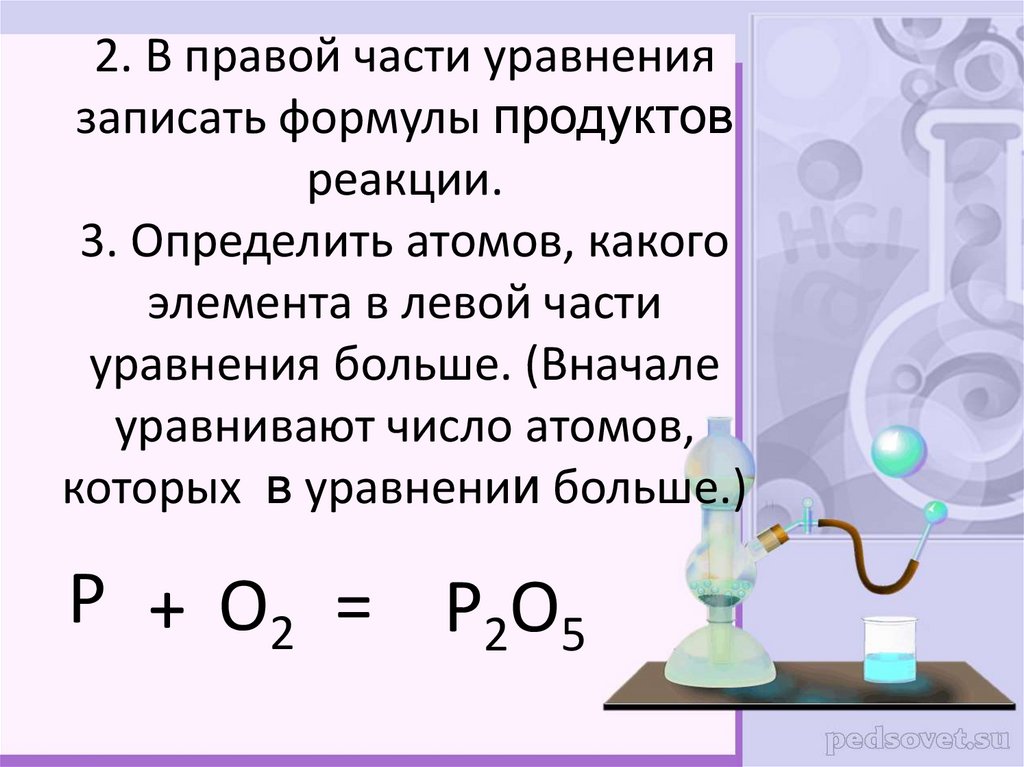
8. 2. В правой части уравнения записать формулы продуктов реакции. 3. Определить атомов, какого элемента в левой части уравнения
больше. (Вначалеуравнивают число атомов,
которых в уравнении больше.)
P + O2 = P2O5
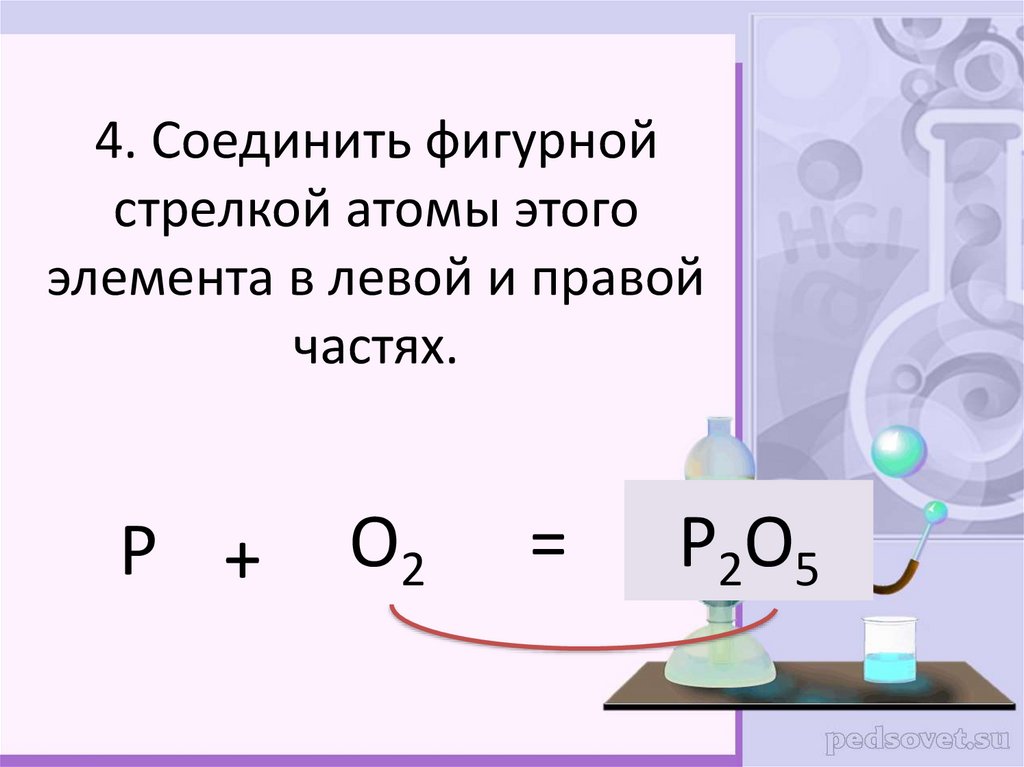
9. 4. Соединить фигурной стрелкой атомы этого элемента в левой и правой частях.
P +O2
=
P2O5
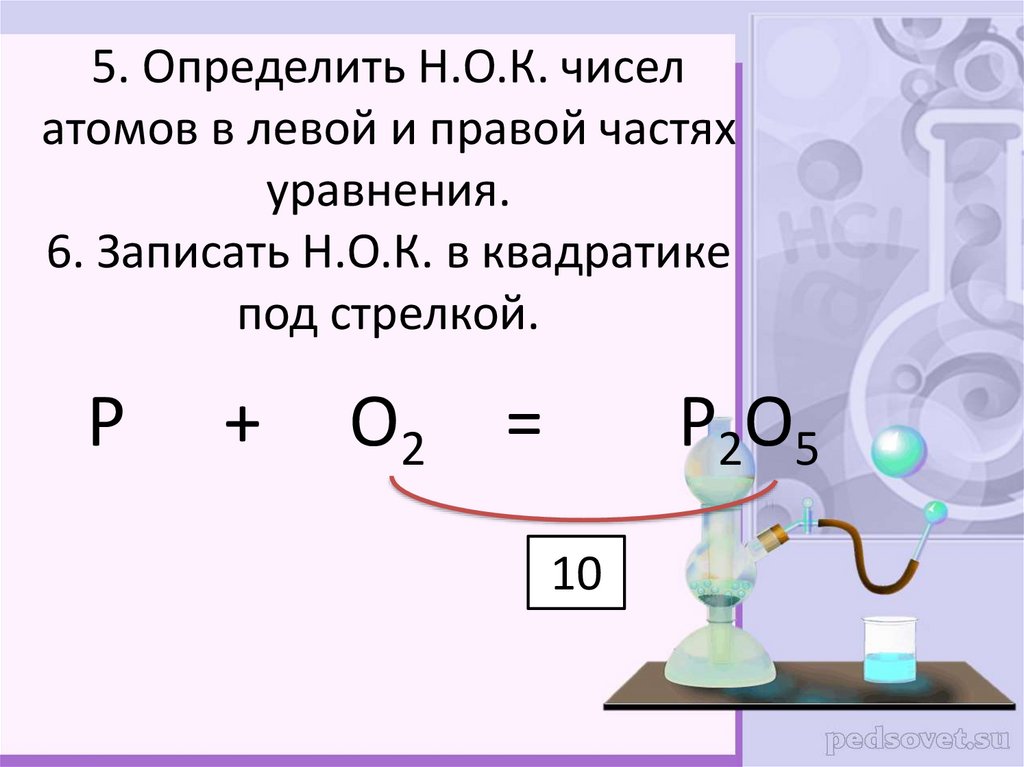
10. 5. Определить Н.О.К. чисел атомов в левой и правой частях уравнения. 6. Записать Н.О.К. в квадратике под стрелкой.
P+
O2
=
P2O5
10
11. 7.Разделить Н.О.К. на число атомов каждого соединенного элемента. 8. Записать полученный коэффициент перед формулой.
P+ 5 O2
10 : 2 = 5
= 2 P2O5
10
10 : 5 = 2
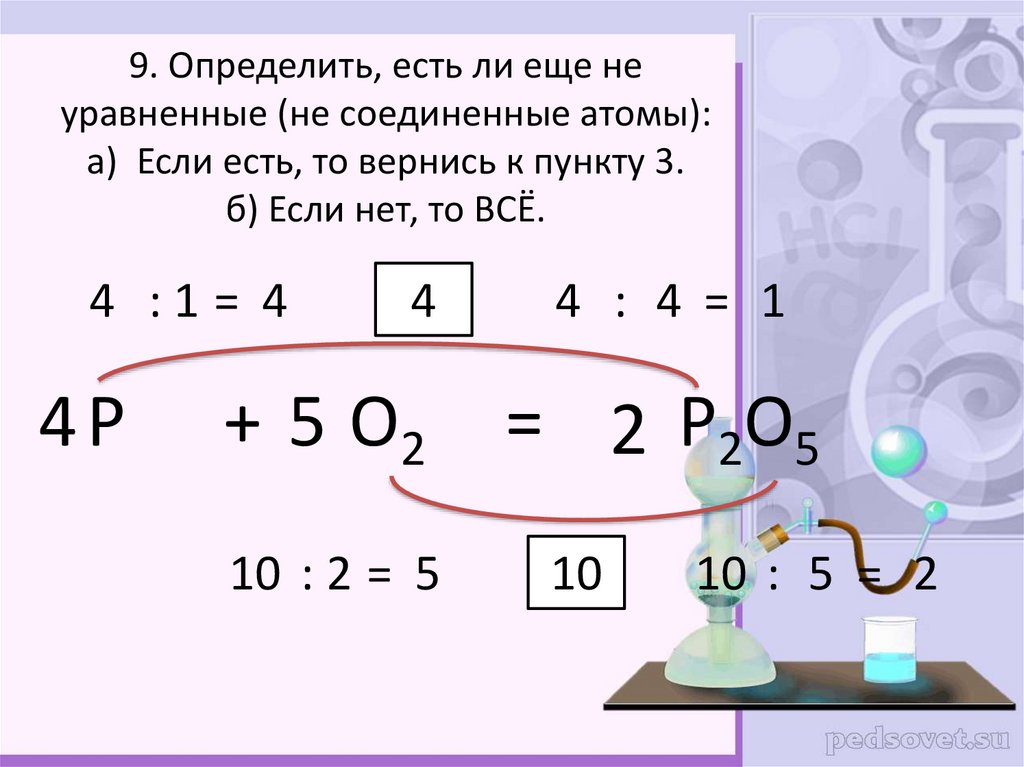
12. 9. Определить, есть ли еще не уравненные (не соединенные атомы): а) Если есть, то вернись к пункту 3. б) Если нет, то ВСЁ.
9. Определить, есть ли еще неуравненные (не соединенные атомы):
а) Если есть, то вернись к пункту 3.
б) Если нет, то ВСЁ.
4 :1= 4
4P
4
+ 5 O2
10 : 2 = 5
4 : 4 = 1
= 2 P2O5
10
10 : 5 = 2
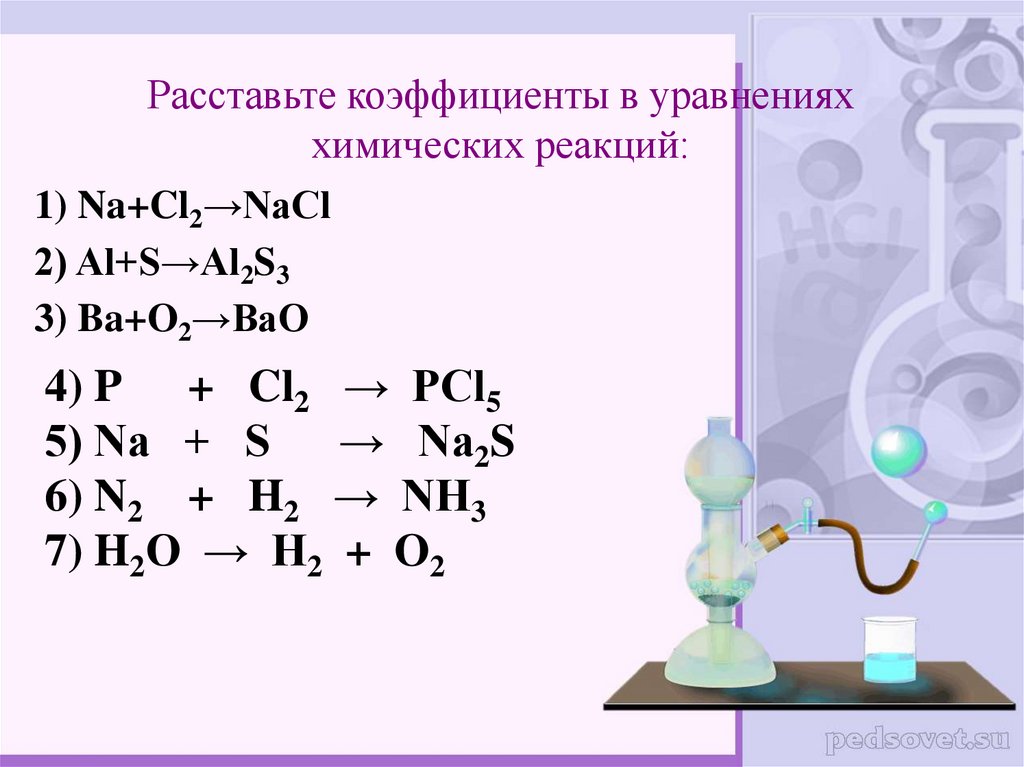
13. Расставьте коэффициенты в уравнениях химических реакций:
1) Na+Cl2→NaCl2) Al+S→Al2S3
3) Ba+O2→BaO
4) P + Cl2 → PCl5
5) Na + S → Na2S
6) N2 + H2 → NH3
7) H2O → H2 + O2
14.
«Единственныйпуть,
ведущий к знанию,
- это
деятельность»
Б.Шоу








 chemistry
chemistry








