Similar presentations:
Атом. Первые представления об атоме
1. Атом
2. Атом
Понятие об атомеВиды радиоактивных излучений
Модели атома
Опыт Резерфорда
Размер ядра
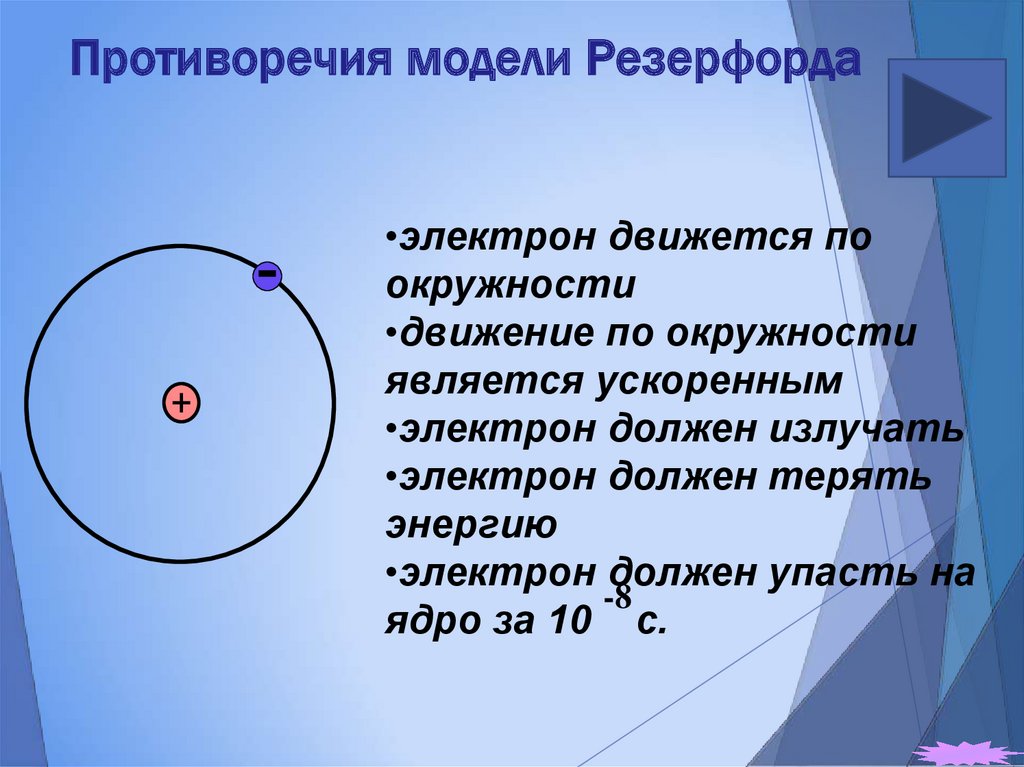
Противоречия модели атома Резерфорда
Постулаты Бора
3. Первые представления об атоме.
ДемокритАтом – «неделимый» (греч.)
1896 г. - Дж. Дж. Томсон – открытие
электрона при исследовании «катодных
лучей».
Атом имеет сложное строение.
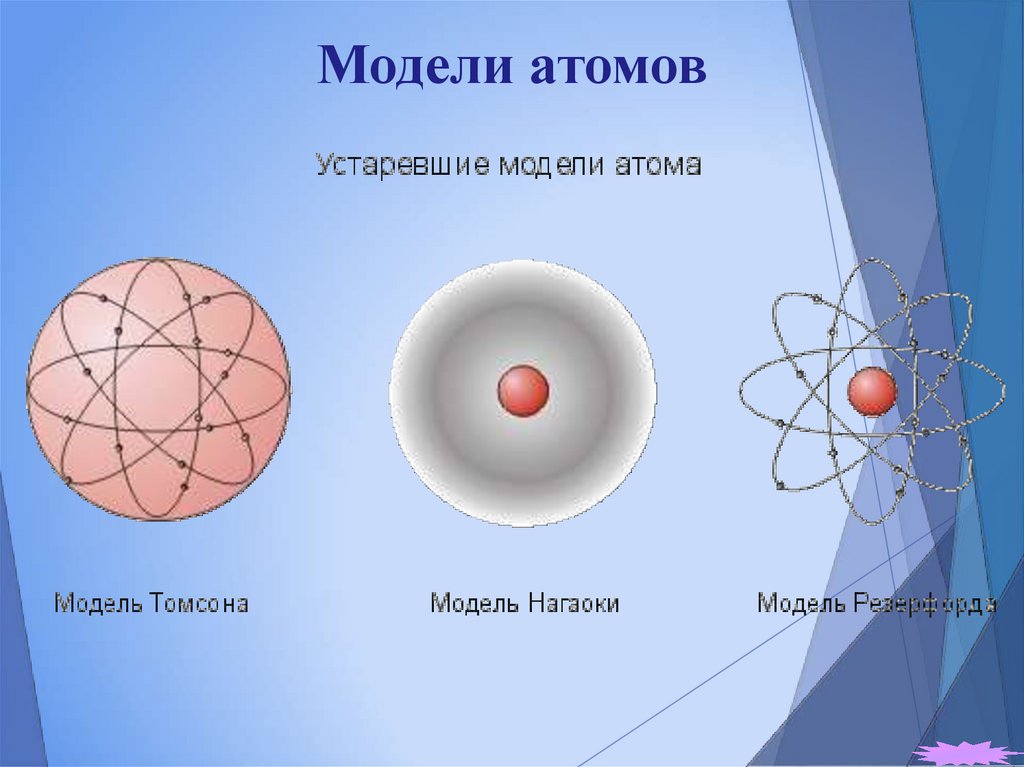
4. Модели атомов
Кусочки материи.Предположение
Демокрита
Модель атома Томсона
Модель атома БораМодель атома Нагаоки
Резерфорда
5. Кусочки материи. Предположение Демокрита
Демокрит полагал, что свойства того или иноговещества определяются формой, массой, и пр.
характеристиками образующих его атомов. Так,
скажем, у огня атомы остры, поэтому огонь
способен обжигать, у твёрдых тел они шероховаты,
поэтому накрепко сцепляются друг с другом, у воды
— гладки, поэтому она способна течь. Даже душа
человека, согласно Демокриту, состоит из атомов.
Он предполагал, но ошибся.
6. Модель атома Нагаоки
Ранняя планетарная модель атома Нагаоки. В 1904 годуяпонский физик Хантаро Нагаока предложил модель атома,
построенную по аналогии с планетой Сатурн. В этой модели
вокруг маленького положительного ядра по орбиталям
вращались электроны, объединённые в кольца. Модель
оказалось ошибочной, но некоторые важные её положения
вошли в модель Резерфорда.
Модель оказалось ошибочной
7. Модель атома Томсона
Первая попытка создания модели атома на основенакопленных экспериментальных данных принадлежит
Дж. Томсону (1903 г.). Он считал, что атом представляет собой
электронейтральную систему шарообразной формы радиусом
примерно равным 10–10 м. Положительный заряд атома
равномерно распределен по всему объему шара, а
отрицательно заряженные электроны находятся внутри него.
Для объяснения линейчатых спектров испускания атомов
Томсон пытался определить расположение электронов в
атоме и рассчитать частоты их колебаний около положений
равновесия. Однако эти попытки не увенчались успехом.
Через несколько лет в опытах великого английского физика
Э. Резерфорда было доказано, что модель Томсона неверна.
8. Модель атома Бора-Резерфорда
Планетарная модель атома Бора-Резерфорда. В 1911 годуЭрнест Резерфорд, проделав ряд экспериментов, пришёл к
выводу, что атом представляет собой подобие планетной
системы, в которой электроны движутся по орбитам вокруг
расположенного в центре атома тяжёлого положительно
заряженного ядра («модель атома Резерфорда»). Однако такое
описание атома вошло в противоречие с классической
электродинамикой. Дело в том, что, согласно классической
электродинамике, электрон при движении с
центростремительным ускорением должен излучать
электромагнитные волны, а следовательно, терять энергию.
Расчеты показывали, что время, за которое электрон в таком
атоме упадёт на ядро, совершенно ничтожно. Для объяснения
стабильности атомов Нильсу Бору пришлось ввести постулаты,
которые сводились к тому, что электрон в атоме, находясь в
некоторых специальных энергетических состояниях, не излучает
(«модель атома Бора-Резерфорда»). Постулаты Бора показали,
что для описания атома классическая механика неприменима.
Дальнейшее изучение излучения атома привело к созданию
квантовой механики, которая позволила объяснить
подавляющее большинство наблюдаемых фактов.
9.
Открытие радиоактивности1896 г.
Анри Беккерель
Радиоактивность – спонтанное
излучение атомов.
10.
В настоящее время под радиоактивностьюпонимают способность некоторых атомных ядер
самопроизвольно (спонтанно) превращаться в
другие ядра с испусканием различных видов
радиоактивных излучений и элементарных
частиц.
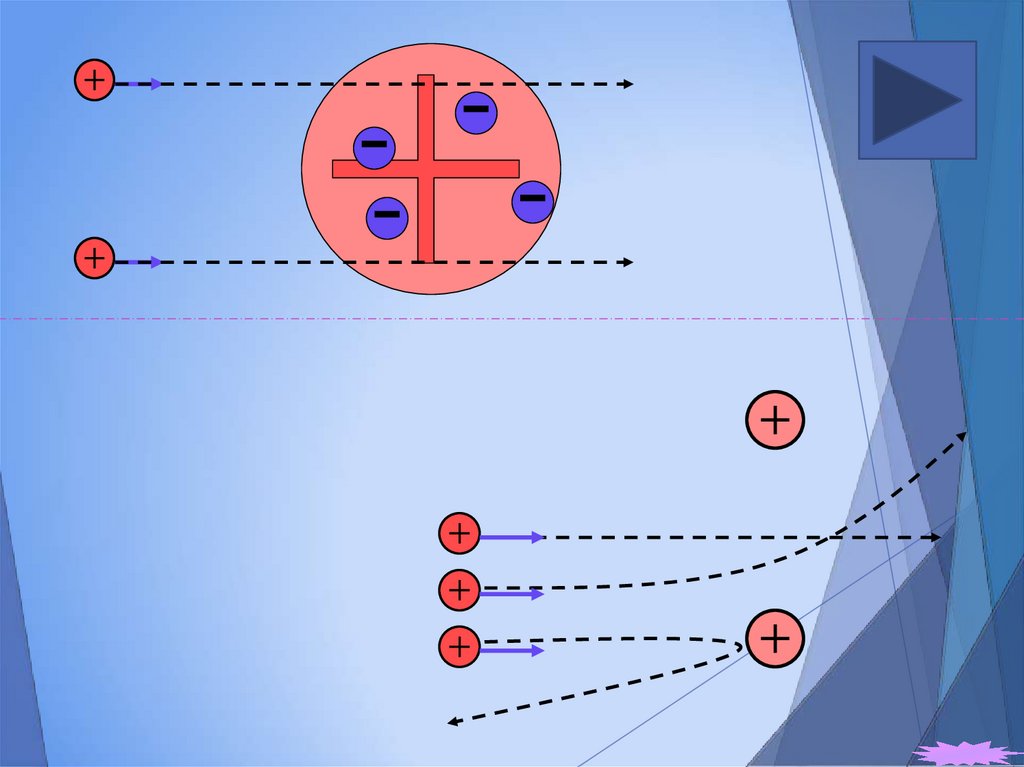
В 1899 году Эрнест Резерфорд в результате
экспериментов обнаружил, что радиоактивное
излучение неоднородно и под действием
сильного магнитного поля распадается на две
составляющие, - и -лучи. Третью
составляющую, -лучи, обнаружил французский
физик Поль Виллард в 1900 году.
В последующих исследованиях Резерфорда было показано, что -излучение
представляет собой поток -частиц, которые являются не чем иным, как ядрами
изотопа гелия 4Не, а -излучение состоит из электронов. Наконец, -излучение
оказывается родственником светового и рентгеновского излучений и является
потоком высокочастотных электромагнитных квантов, испускаемых атомными
ядрами.
11. Виды излучений
- ядра атома гелия (2p+2n)- электроны, образующиеся в
ядре атома при распаде
нейтронов
n p e
- электромагнитное излучение
большой энергии
12.
Модели атомов13. Модели атомов
Дж. Дж. Томсон1896 г.
«сливовый пудинг»
q
Э. Резерфорд
1906 г. (1911 г.)
планетарная (ядерная) модель
эл
q
q
эл
qя
qат 0
qат 0
dат
dат
rат ~ 10
rя ~ 10
10
15
м
м
dяд
тя 99,9% тат
14. Модели атомов по Резерфорду
Атом гелияАтом бора
15. Опыт Резерфорда
- ядра атома гелия (2p+2n)16.
Опыт Резерфорда17. Размеры ядра
rяЕк Еп
m
Fk rя
2
2
m
1 е 2е
2 rя
2 4 0 rя
2
1 4 е 2
rя
2
4 0 т
q я q
Fk k
rя2
q я e
q 2e
k
1
4 0
18.
19. Противоречия модели Резерфорда
•электрон движется поокружности
•движение по окружности
является ускоренным
•электрон должен излучать
•электрон должен терять
энергию
•электрон должен упасть на
-8
ядро за 10 с.
20. Постулаты Бора
Нильс Бор 1913 г.-Электроны движутся вокруг ядер по круговым
орбитам, среди которых разрешенными
являются только определенные орбиты.
Находясь на них электрон не излучает.
-При переходе электрона с орбиты с более
высокой энергией на орбиту с более низкой
энергией атом излучает квант энергии; при
переходе электрона с орбиты с более низкой
энергией на орбиту с более высокой энергией
атом поглощает квант энергии.
21. Первый постулат Бора
-Электроны движутся вокруг ядер по круговым орбитам,среди которых разрешенными являются только
определенные орбиты. Находясь на них электрон не
излучает.
L m r
- момент импульса
h
m r n
2
h
2
n 1,2,3,.... n – главное квантовое число
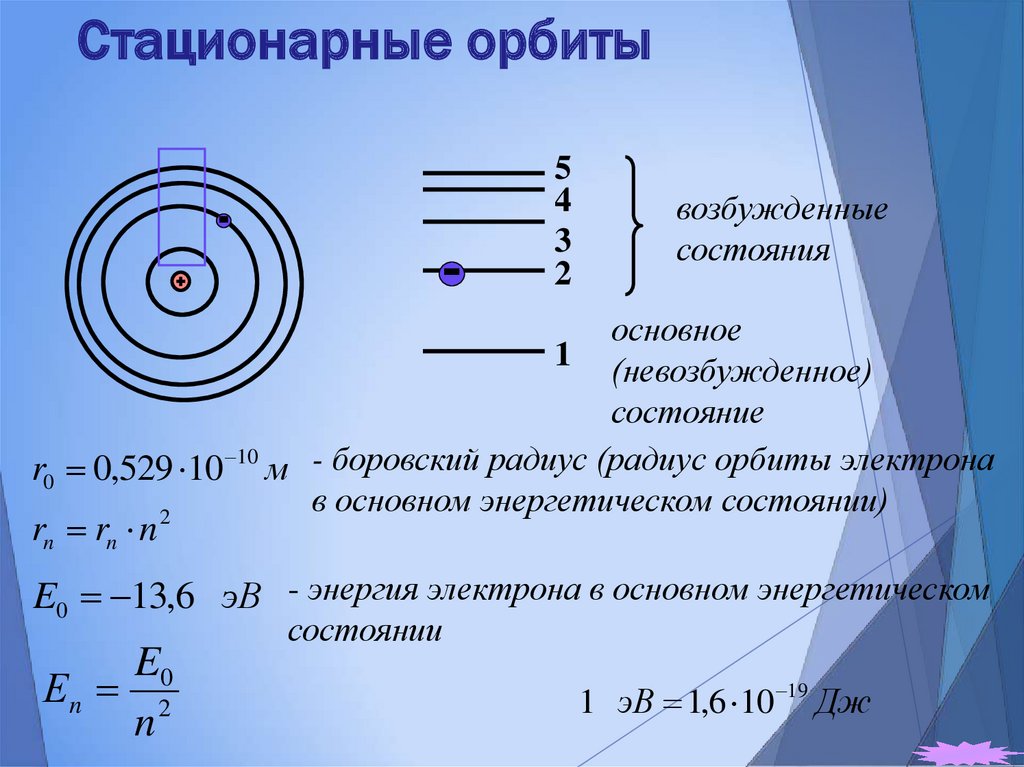
22. Стационарные орбиты
54
3
2
возбужденные
состояния
основное
1 (невозбужденное)
состояние
r0 0,529 10 10 м - боровский радиус (радиус орбиты электрона
в основном энергетическом состоянии)
2
rn rn n
E0 13,6 эВ - энергия электрона в основном энергетическом
E0
Еn 2
n
состоянии
1 эВ 1,6 10 19 Дж
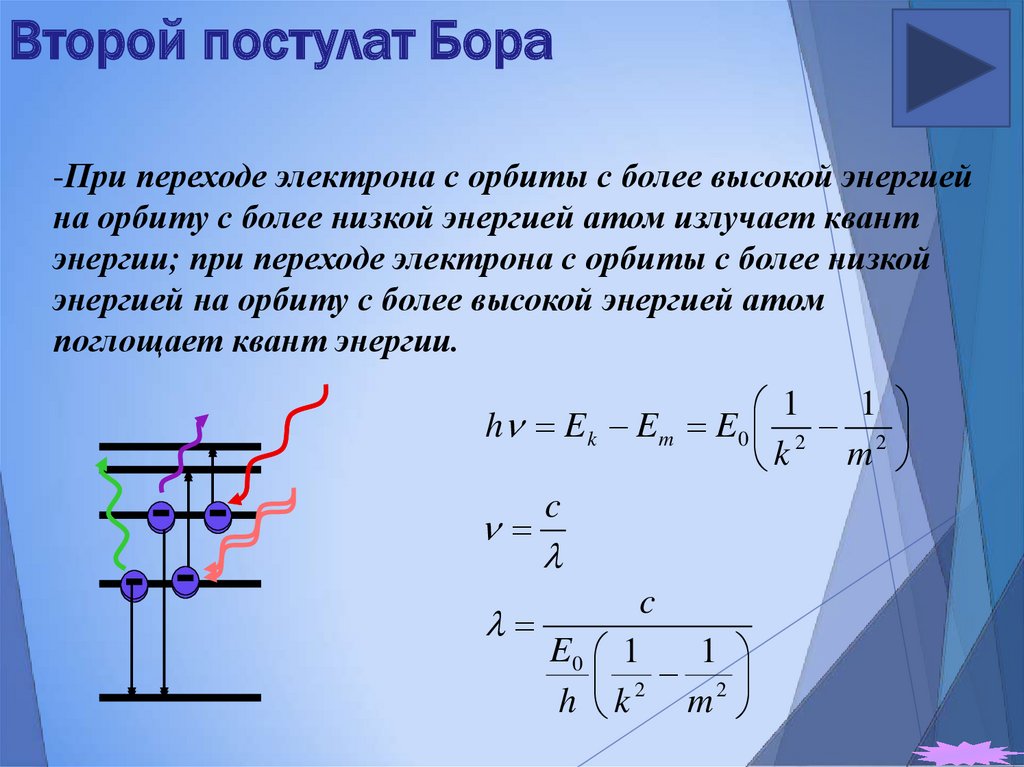
23. Второй постулат Бора
-При переходе электрона с орбиты с более высокой энергиейна орбиту с более низкой энергией атом излучает квант
энергии; при переходе электрона с орбиты с более низкой
энергией на орбиту с более высокой энергией атом
поглощает квант энергии.
1
1
h E k E m E 0 2 2
m
k
c
c
E0 1
1
2 2
h k
m
24. Презентация выполнена учителем физики ГБОУ СОШ 118 Пшеничной Л.В.
Санкт-Петербург2017-2018 учебный год
25. Используемая литература
Изображения : http://www.vupkro.ru/Enc.ashx?item=478805http://www.fizika.ru/theory/tema-17/index2.htm
http://www.webknow.ru/fizika_00507.html
http://www.artgide.com/967-.html
http://www.parta.by/index.php?do=news&action=articles&id=28&page=4&PHPSESSID=08a22656b7e0305e4f8e6d348047
6056&lang=ru&PHPSESSID=08a22656b7e0305e4f8e6d3480476056
http://www.japanoffline.ru/ind12.html
http://technomag.edu.ru/doc/58252.html
Видеоматериал: http://rutube.ru/tracks/1423074.html
http://rutube.ru/tracks/1422403.html
http://rutube.ru/tracks/1422401.html
http://rutube.ru/tracks/1381586.html
Информация (текст): http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC
http://ru.wikipedia.org/wiki/%D0%94%D0%B5%D0%BC%D0%BE%D0%BA%D1%80%D0%B8%D1%82
http://ru.wikipedia.org/wiki/%D0%A2%D0%BE%D0%BC%D1%81%D0%BE%D0%BD,_%D0%94%D0%B6%D0%BE%D0
%B7%D0%B5%D1%84_%D0%94%D0%B6%D0%BE%D0%BD
http://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D0%B3%D0%B0%D0%BE%D0%BA%D0%B0,_%D0%A5%D0%B0%D0
%BD%D1%82%D0%B0%D1%80%D0%BE
http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B7%D0%B5%D1%80%D1%84%D0%BE%D1%80%D0%B4,_%D0%
AD%D1%80%D0%BD%D0%B5%D1%81%D1%82
http://www.fizmir.org/bestsoft/9_1.htm




















 physics
physics








