Similar presentations:
Виды химической связи
1.
2.
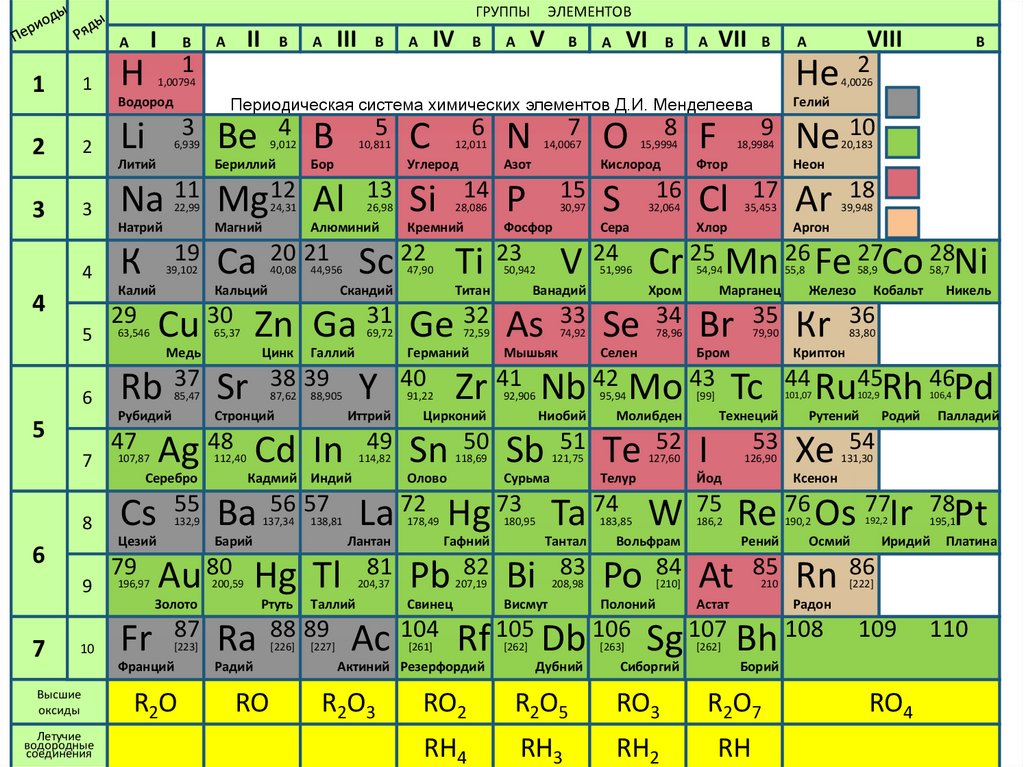
ГРУППЫI
A
1
1
H
B
1
2
3
3
Li
6,939
5
7
19
К
39,102
9
29
7
Высшие
оксиды
Летучие
водородные
соединения
IV
A
B
V
A
B
47
14
Si
28,086
Кремний
47,90
Скандий
7
N
14,0067
Азот
Sc 22 Тi
44,956
Цинк
Галлий
38 39
87,62
VI
A
B
15
30,97
Фосфор
23
A
VII
B
Стронций
Иттрий
49
112,40
Cs
55
132,9
114,82
Кадмий Индий
Ва
56 57
137,34
He
Франций
R2O
Rа
Радий
RO
Таллий
88 89
[226]
204,37
[227]
18,9984
Фтор
Cl
Sn
50
118,69
33
74,92
Мышьяк
17
35,453
34
Se
78,96
Ниобий
Sb
35
Br
79,90
Свинец
Ar
51
121,75
Молибден
Тe
52
127,60
Телур
Тантал
Bi
83
208,98
Висмут
Технеций
53
I
126,90
Йод
75
186,2
Вольфрам
Po
84
[210]
Полоний
58,9
Железо
Актиний Резерфордий
R2O3
[262]
[263]
Дубний
Сиборгий
58,7
Кобальт
Никель
36
Кr
44
101,07
83,80
Ru45Rh 46Pd
102,9
Рутений
Xe
106,4
Родий
Палладий
54
131,30
Ксенон
Re 76 Os 77Ir
192,2
190,2
Рений
85
At
210
Астат
Осмий
78
Pt
195,1
Иридий
Платина
Rn 86
[222]
Радон
Ac 104 Rf 105 Db 106 Sg 107 Bh 108
[261]
18
39,948
Криптон
[99]
183,85
Гафний
82
20,183
55,8
Марганец
Бром
95,94
Сурьма
207,19
Ne 10
Аргон
54,94
Хром
Селен
180,95
Pb
4,0026
Неон
Хлор
51,996
Ванадий
Цирконий
Олово
81
200,59
[223]
Сера
92,906
178,49
Au 80 Hg Tl
87
16
32,064
9
F
B
Гелий
Zr 41 Nb 42 Мо 43 Тс
91,22
Лантан
Ртуть
S
La 72 Hg 73 Та 74 W
138,81
Барий
8
15,9994
VIII
2
A
V 24 Cr 25 Mn 26 Fe 27Со 28Ni
50,942
72,59
40
О
Кислород
Р
Титан
Германий
Y
88,905
Ag 48 Cd In
107,87
Fr
26,98
69,72
85,47
196,97
13
65,37
Rb 37 Sr
79
12,011
Углерод
Алюминий
40,08
6
С
Cu 30 Zn Ga 31 Ge 32 As
63,546
Золото
10
Бор
Кальций
Цезий
6
10,811
20 21
Са
Серебро
8
B
5
В
24,31
Магний
Рубидий
5
9,012
22,99
Медь
6
III
Na 11 Mg12 Al
Калий
4
4
Be
Бериллий
Натрий
4
A
Периодическая система химических элементов Д.И. Менделеева
Литий
3
B
1,00794
Водород
2
II
A
ЭЛЕМЕНТОВ
[262]
109
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
RO4
110
3.
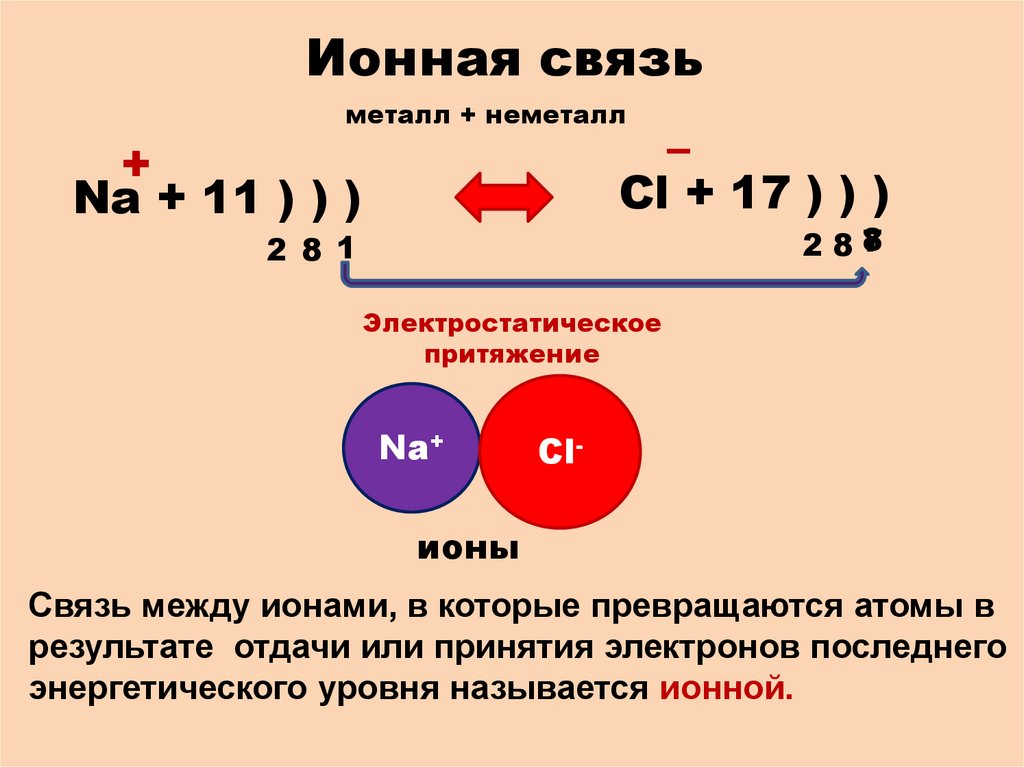
Ионная связьметалл + неметалл
–
Cl + 17 ) ) )
+
Na + 11 ) ) )
8
287
2 8 1
Электростатическое
притяжение
Na+
Cl-
ионы
Связь между ионами, в которые превращаются атомы в
результате отдачи или принятия электронов последнего
энергетического уровня называется ионной.
4.
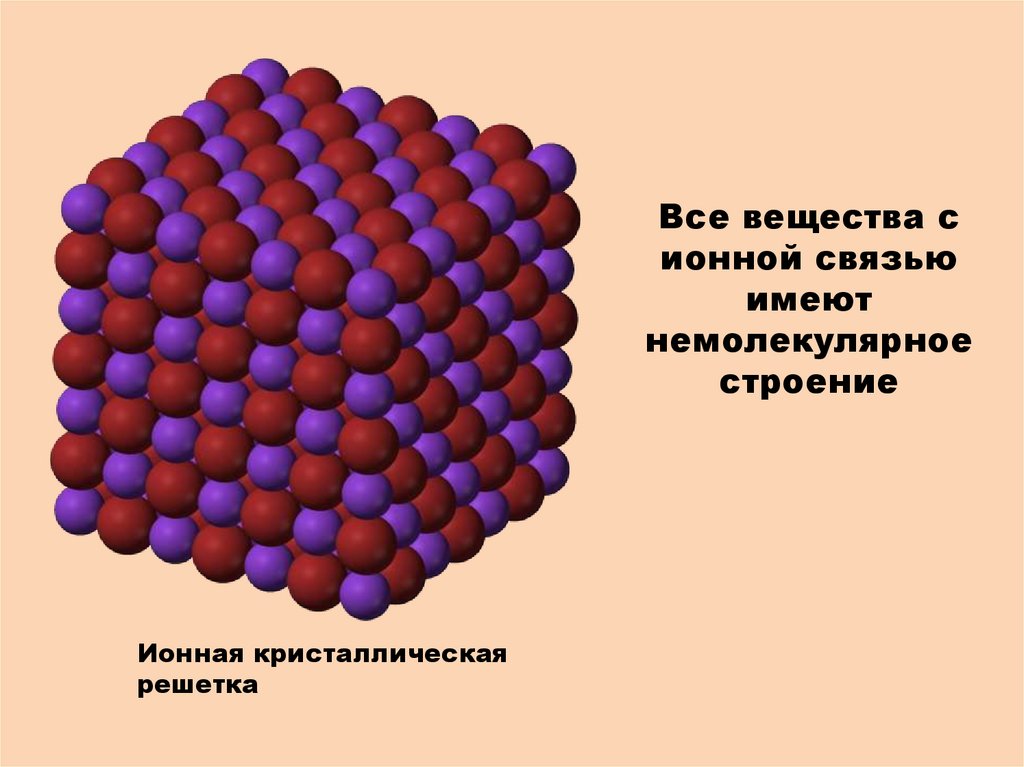
Все вещества сионной связью
имеют
немолекулярное
строение
Ионная кристаллическая
решетка
5.
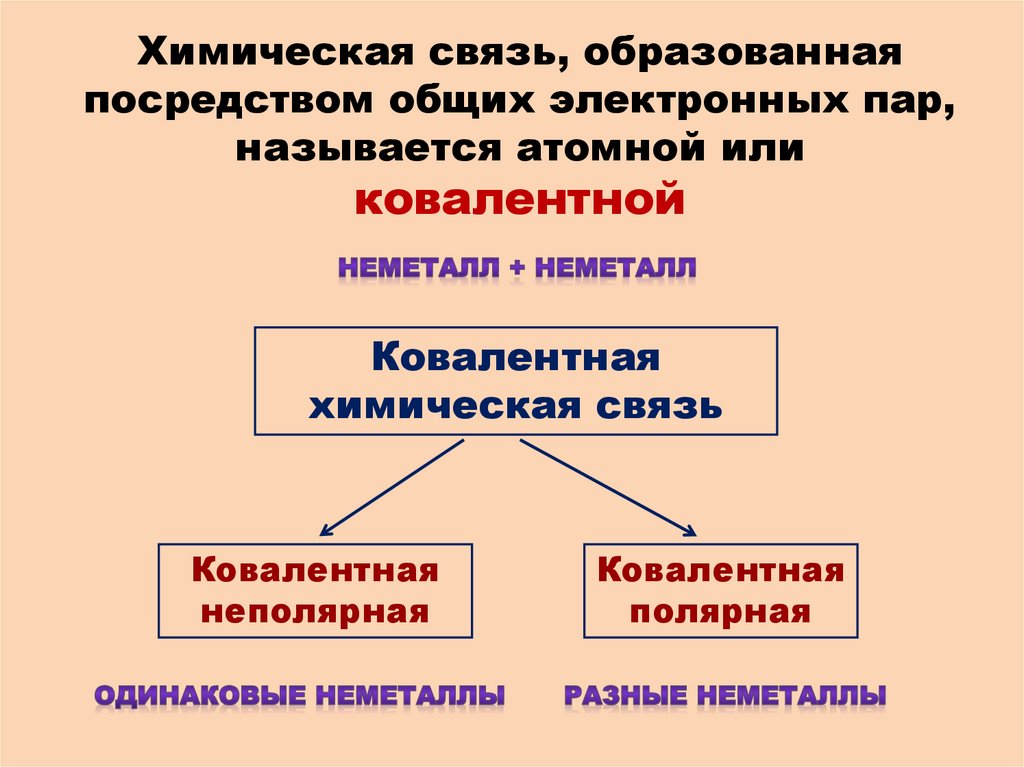
Химическая связь, образованнаяпосредством общих электронных пар,
называется атомной или
ковалентной
Ковалентная
химическая связь
Ковалентная
неполярная
Ковалентная
полярная
6.
Определение:Ковалентной неполярной
называется связь, которая возникает
между одинаковыми неметаллами.
7.
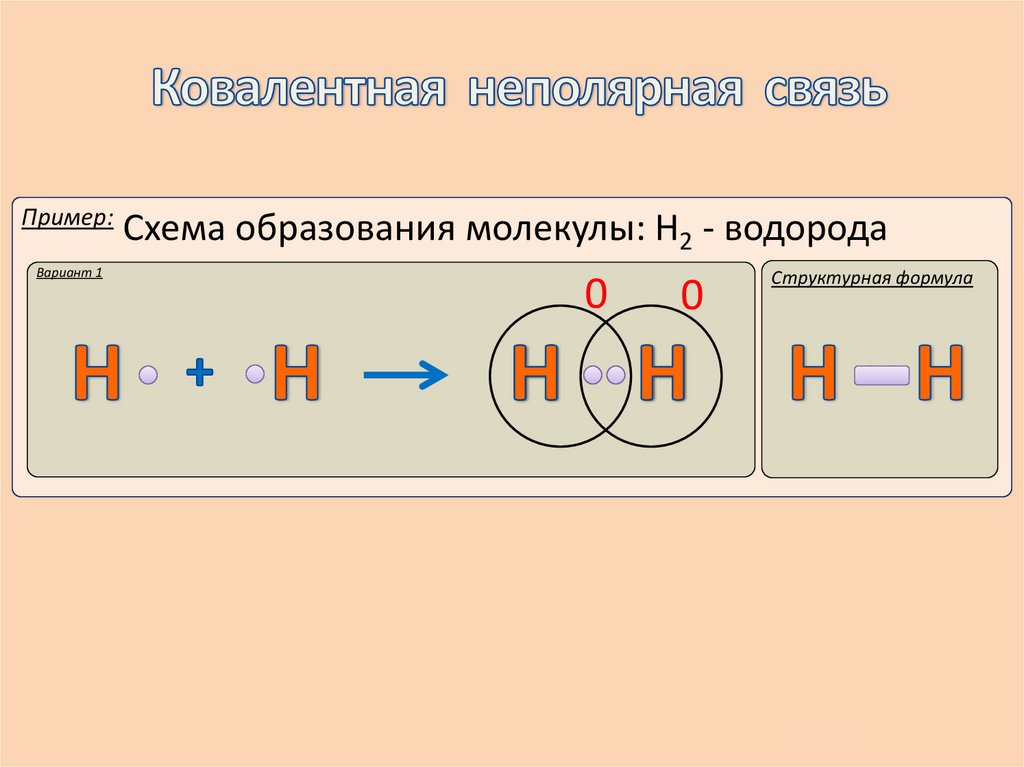
Пример:Вариант 1
Схема образования молекулы: Н2 - водорода
0
0
Структурная формула
8.
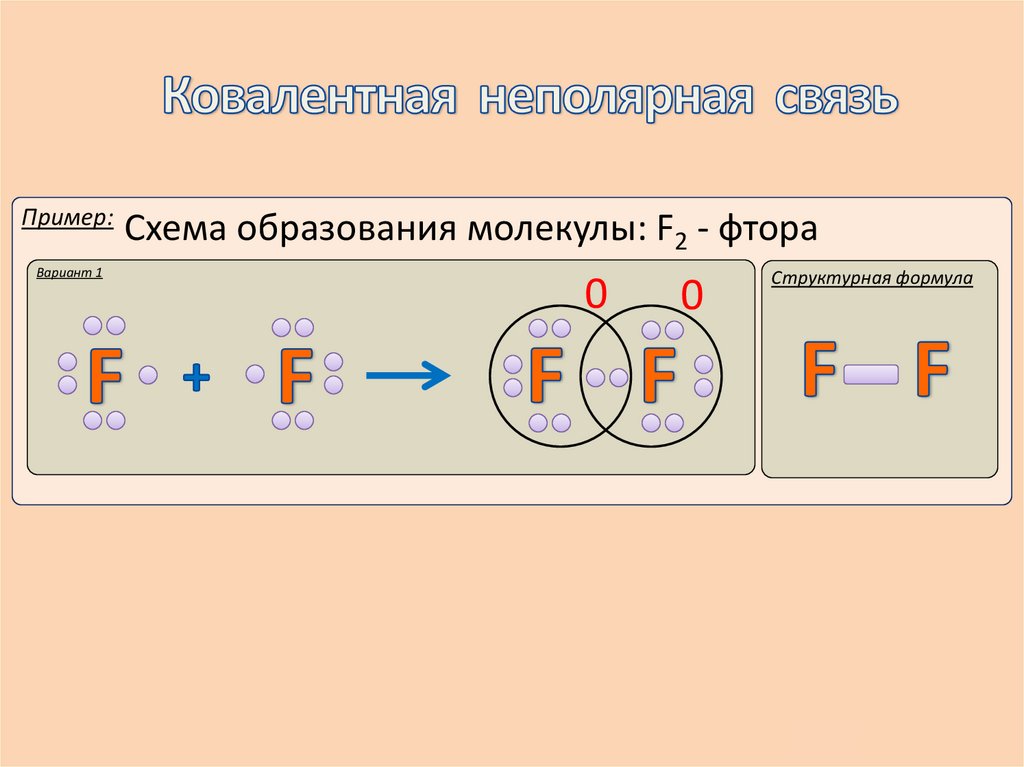
Пример:Вариант 1
Схема образования молекулы: F2 - фтора
0
0
Структурная формула
9.
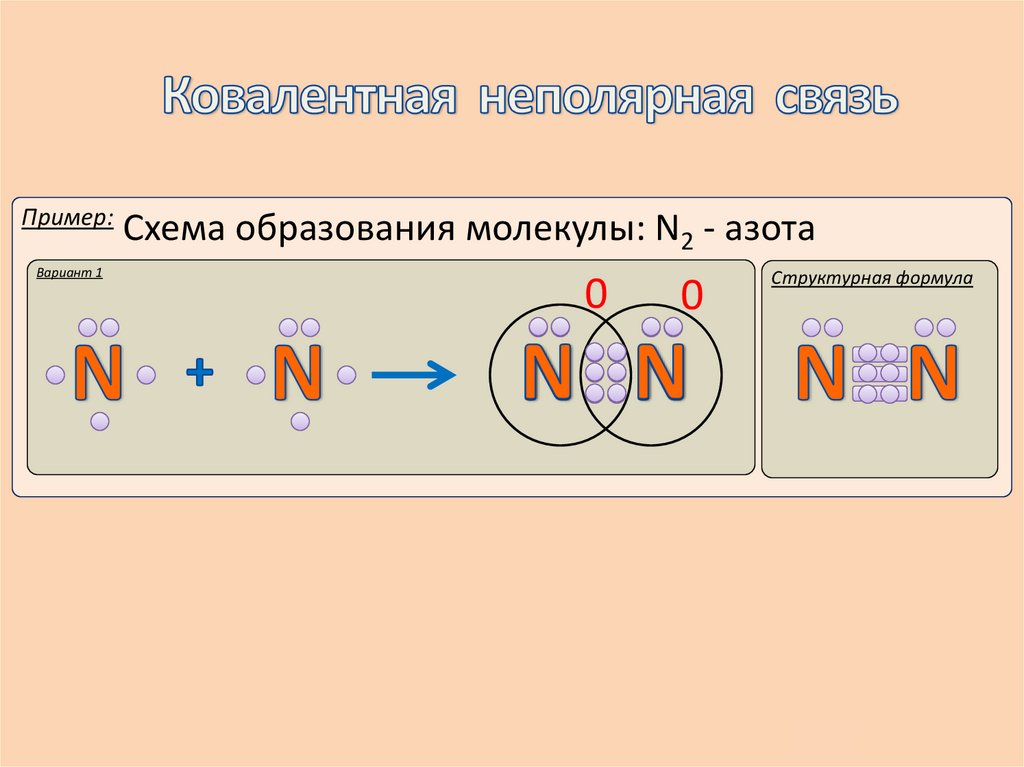
Пример:Вариант 1
Схема образования молекулы: N2 - азота
0
0
Структурная формула
10.
11.
Определение:Определение:
Ковалентной
полярной называется
Электроотрицательность
(ЭО) - ….. связь,
которая возникает между неметаллами с разной
электроотрицательностью.
Определение:
Электроотрицательность (ЭО) – это
способность атомов химического элемента
оттягивать к себе общие электронные пары,
участвующие в образовании химической связи.
12.
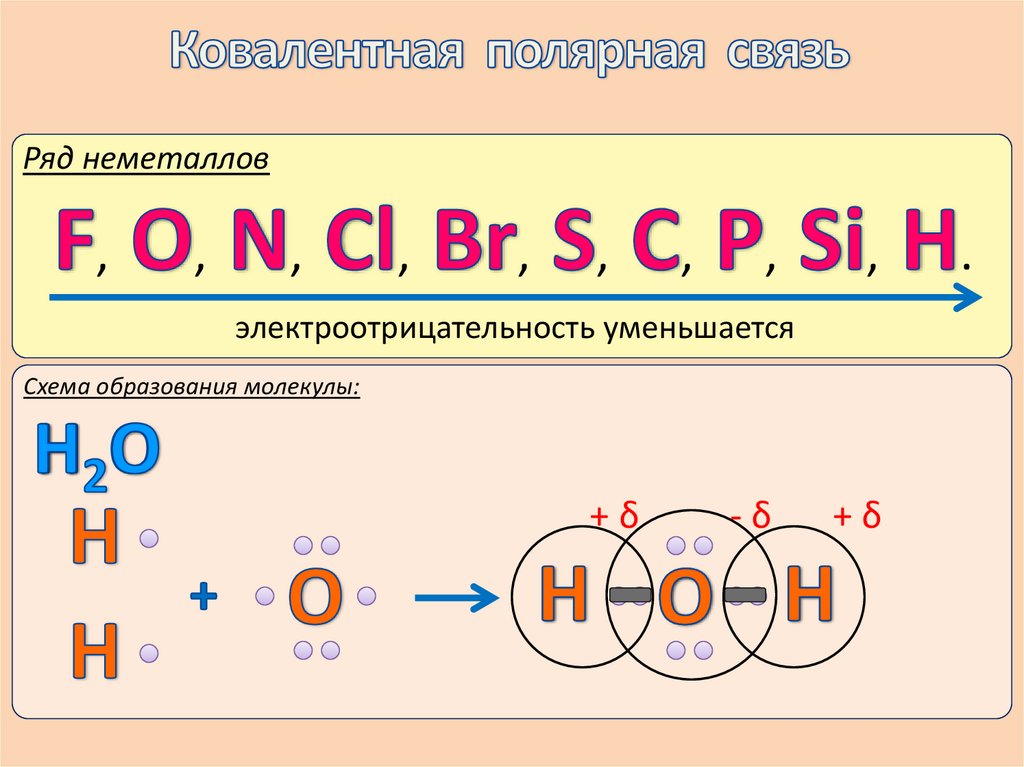
Ряд неметаллов,
,
,
,
,
,
,
,
,
.
электроотрицательность уменьшается
Элемент с меньшей
большей ЭО, при образовании
ковалентной полярной связи, приобретает
частично положительный
отрицательный заряд
заряд (-(+δ).
δ).
«δ» – греч. дельта
Далее
13.
Ряд неметаллов,
,
,
,
,
,
,
,
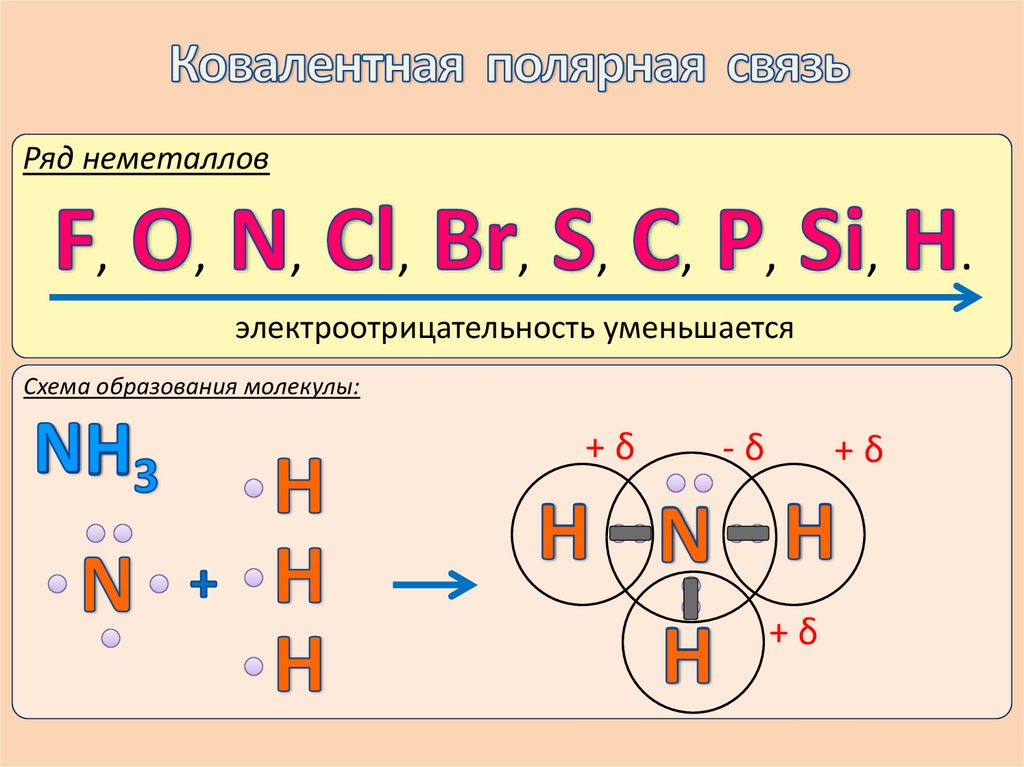
электроотрицательность уменьшается
Схема образования молекулы:
+δ
-δ
,
.
14.
Ряд неметаллов,
,
,
,
,
,
,
,
,
электроотрицательность уменьшается
Схема образования молекулы:
+δ
-δ
+δ
.
15.
Ряд неметаллов,
,
,
,
,
,
,
,
,
электроотрицательность уменьшается
Схема образования молекулы:
+δ
-δ
+δ
+δ
.
16.
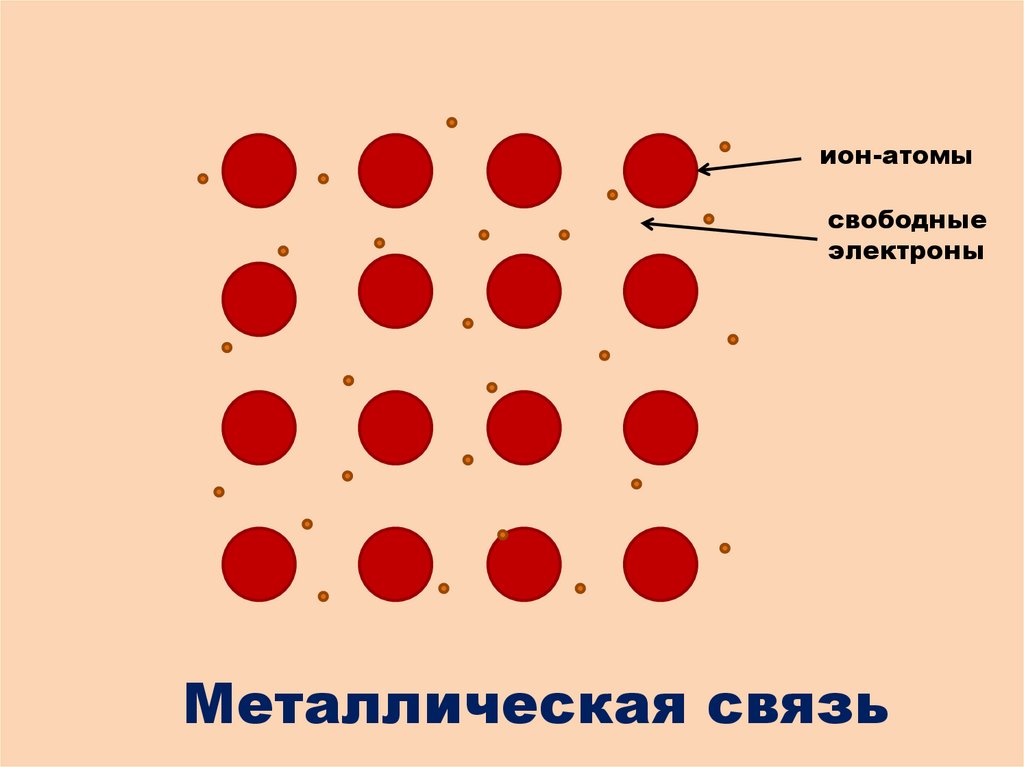
++
+
+
ион-атомы
свободные
электроны
+
+
+
+
+
+
+
+
+
+
+
+
Металлическая связь
17.
Как определить вид связи в веществе?Определите природу химических
элементов
Если
только металл
металл и неметалл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь
ковалентная
Если
связь ионная
ЭО элементов
различна
связь
ковалентная
полярная
18.
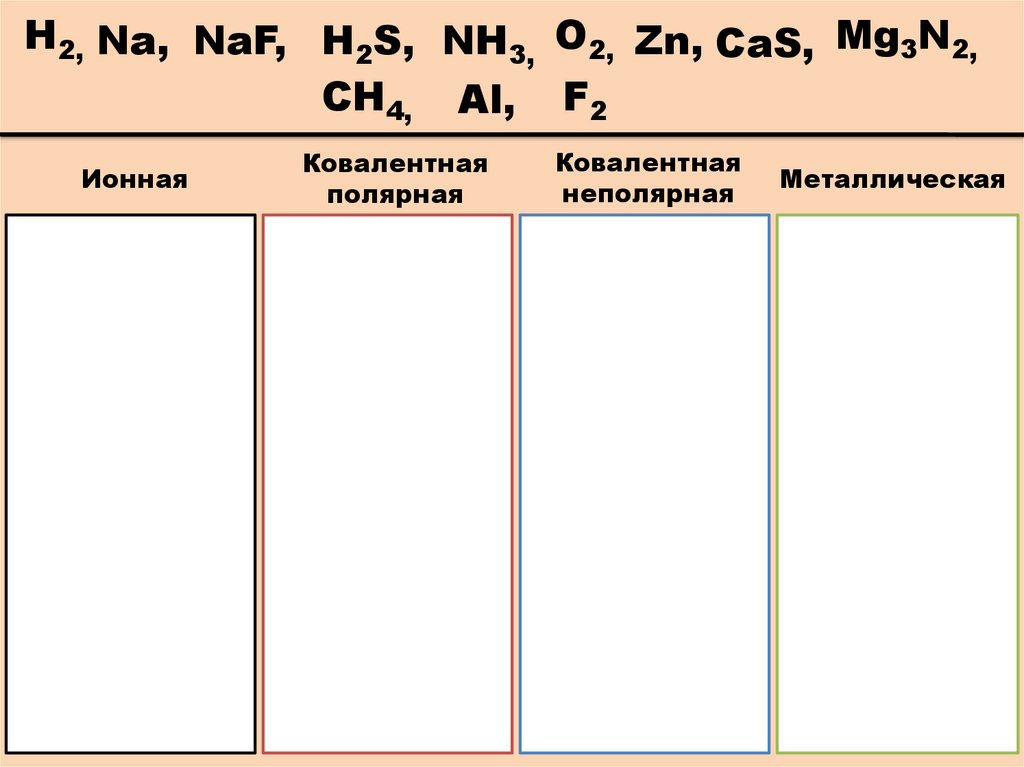
Определите вид связив следующих веществах:
Н2, Na, NaF, H2S, NH3, O2, Zn,
CaS, Mg3N2, CH4, Al, F2
19.
Н2, Na, NaF, H2S, NH3, O2, Zn, CaS, Mg3N2,CH4, Al, F2
Ионная
Ковалентная
полярная
Ковалентная
неполярная
Металлическая
20. Химическую связь между атомами водорода одной молекулы (или её части) и атомами наиболее электоротрицательных элементов,
имеющих неподелённые электронныепары, (фтор, кислород, азот) другой
молекулы (или её части) называют
водородной.
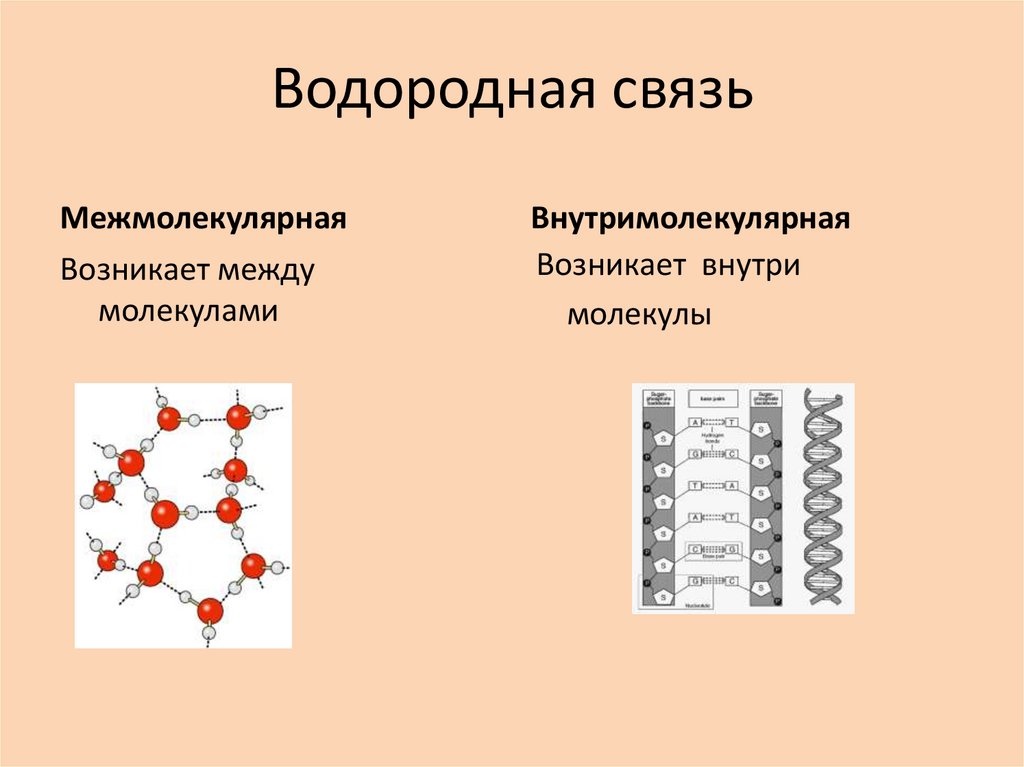
21. Водородная связь
МежмолекулярнаяВозникает между
молекулами
Внутримолекулярная
Возникает внутри
молекулы
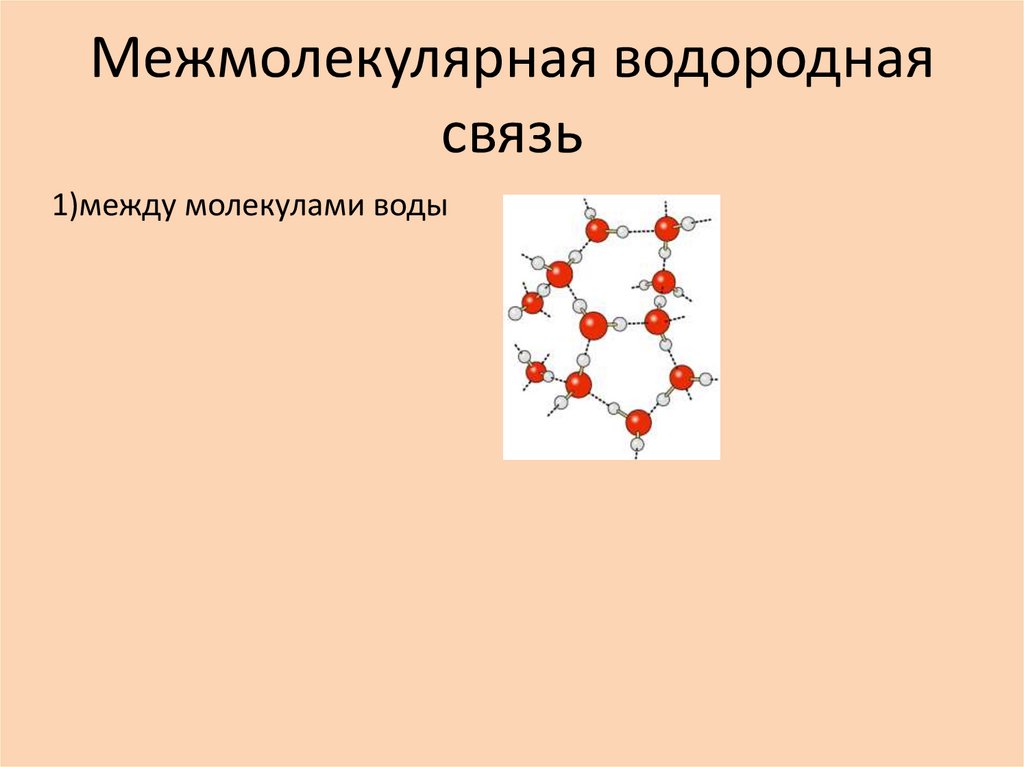
22. Межмолекулярная водородная связь
1)между молекулами воды23. Межмолекулярная водородная связь
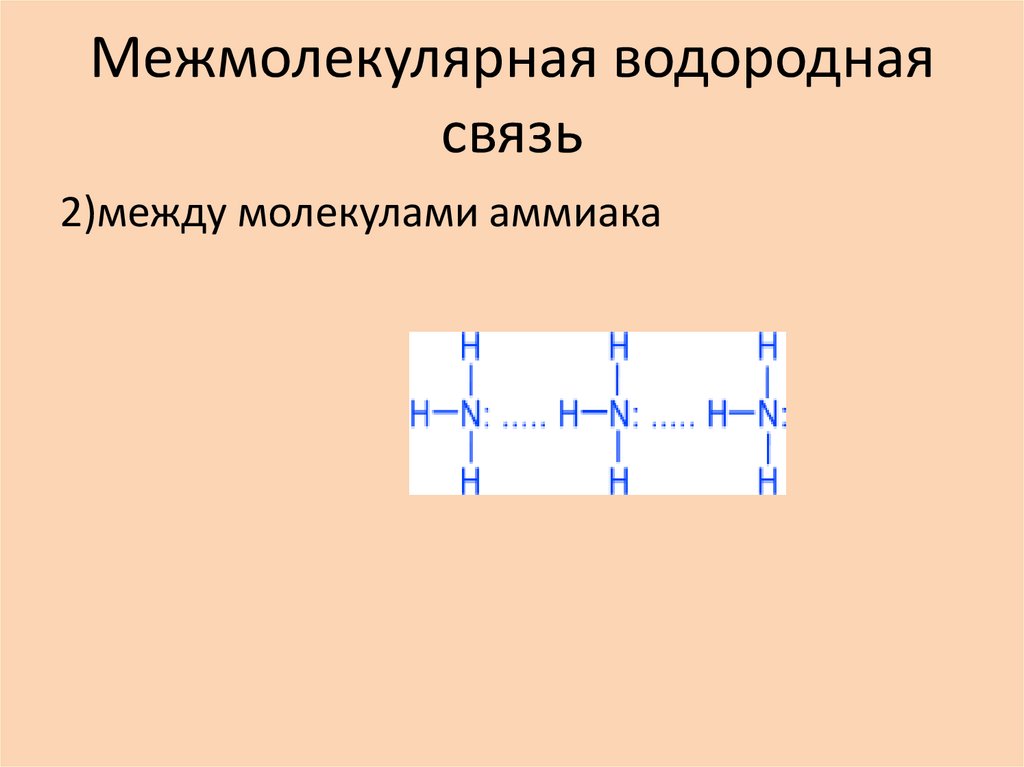
2)между молекулами аммиака24. Межмолекулярная водородная связь
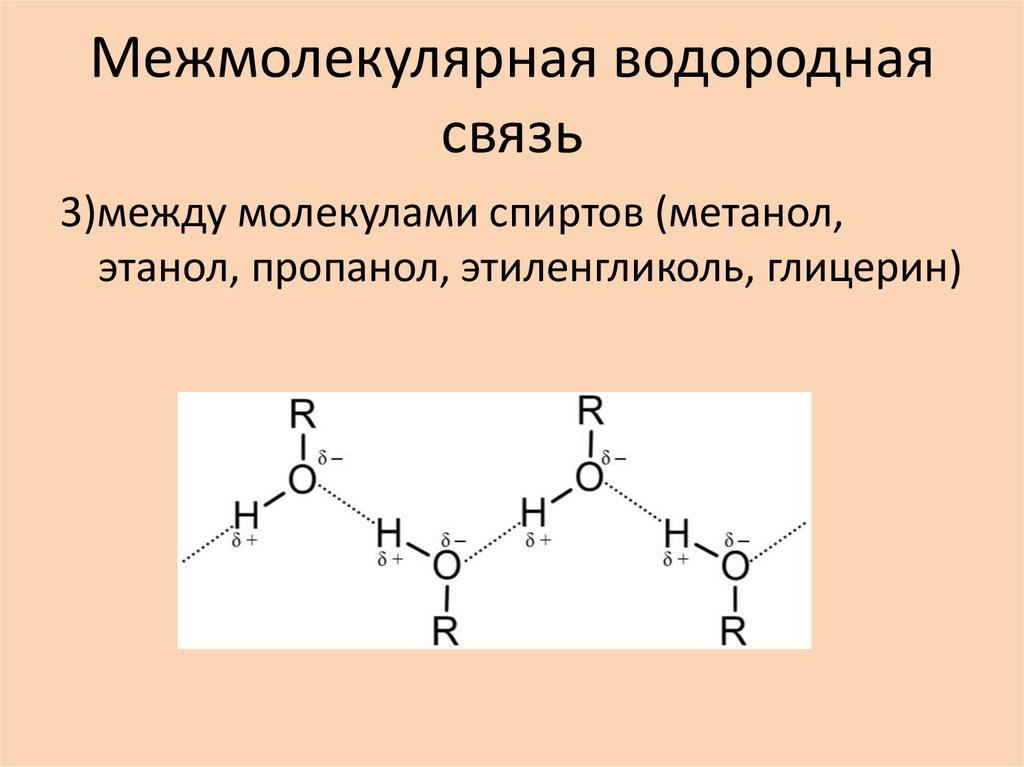
3)между молекулами спиртов (метанол,этанол, пропанол, этиленгликоль, глицерин)
25. Межмолекулярная водородная связь
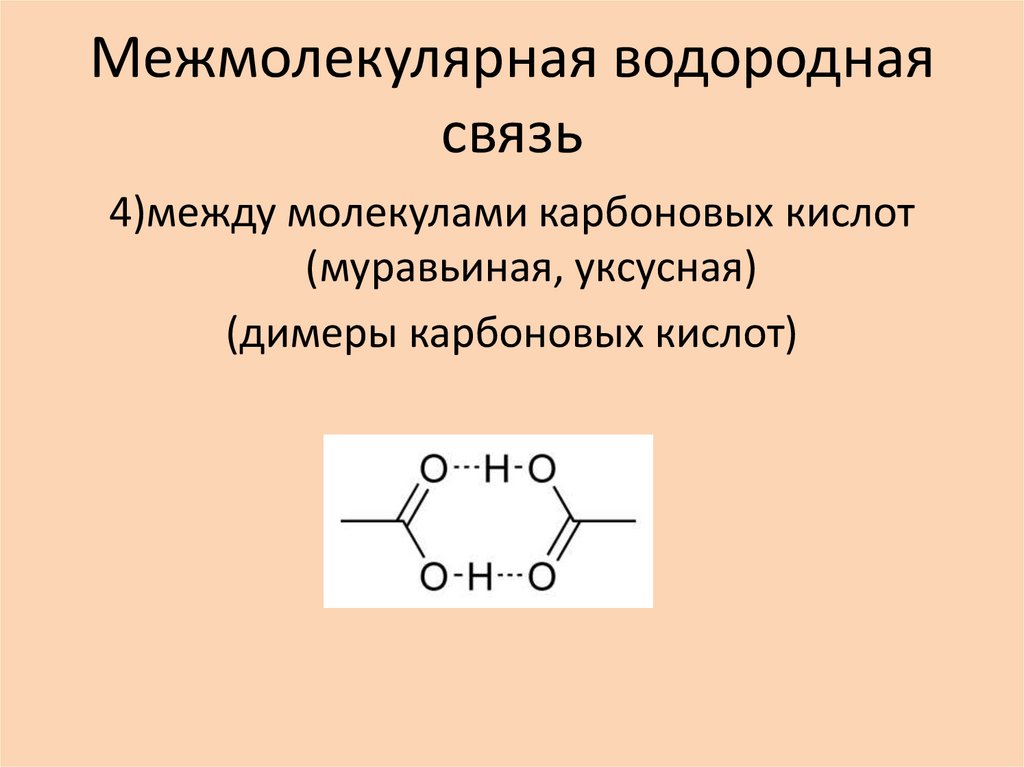
4)между молекулами карбоновых кислот(муравьиная, уксусная)
(димеры карбоновых кислот)
26. Внутримолекулярная водородная связь
возникает1)внутри молекул белков (водородная связь
удерживает витки спирали пептидной
молекулы)
27. Внутримолекулярная водородная связь
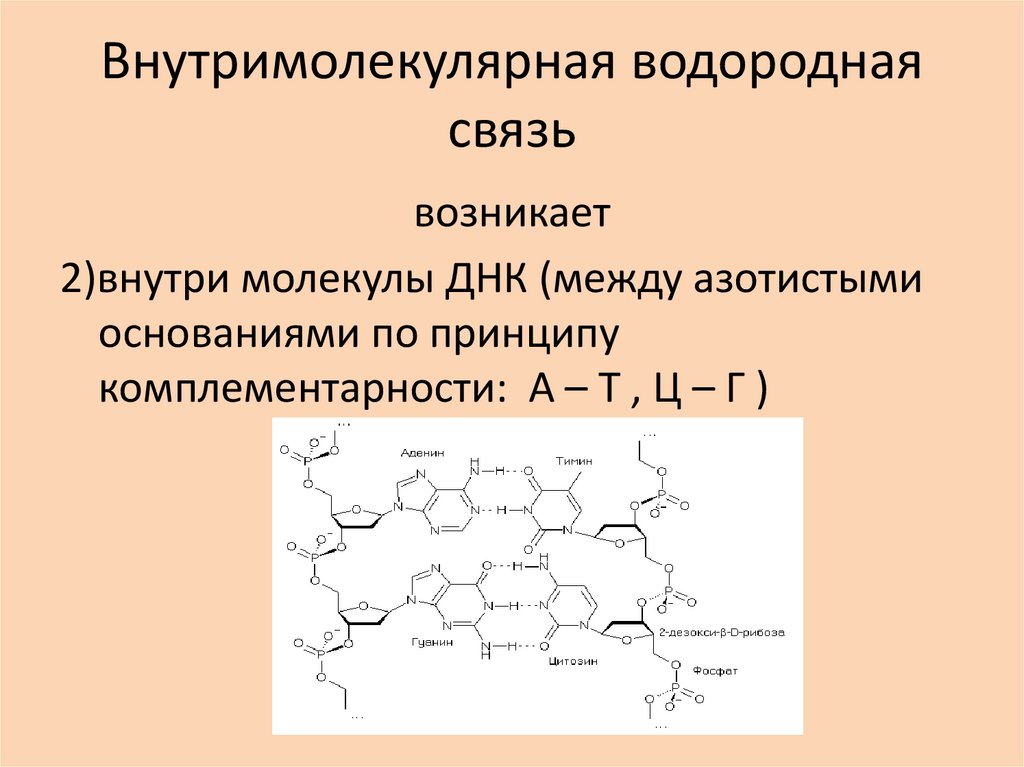
возникает2)внутри молекулы ДНК (между азотистыми
основаниями по принципу
комплементарности: А – Т , Ц – Г )










 chemistry
chemistry








