Similar presentations:
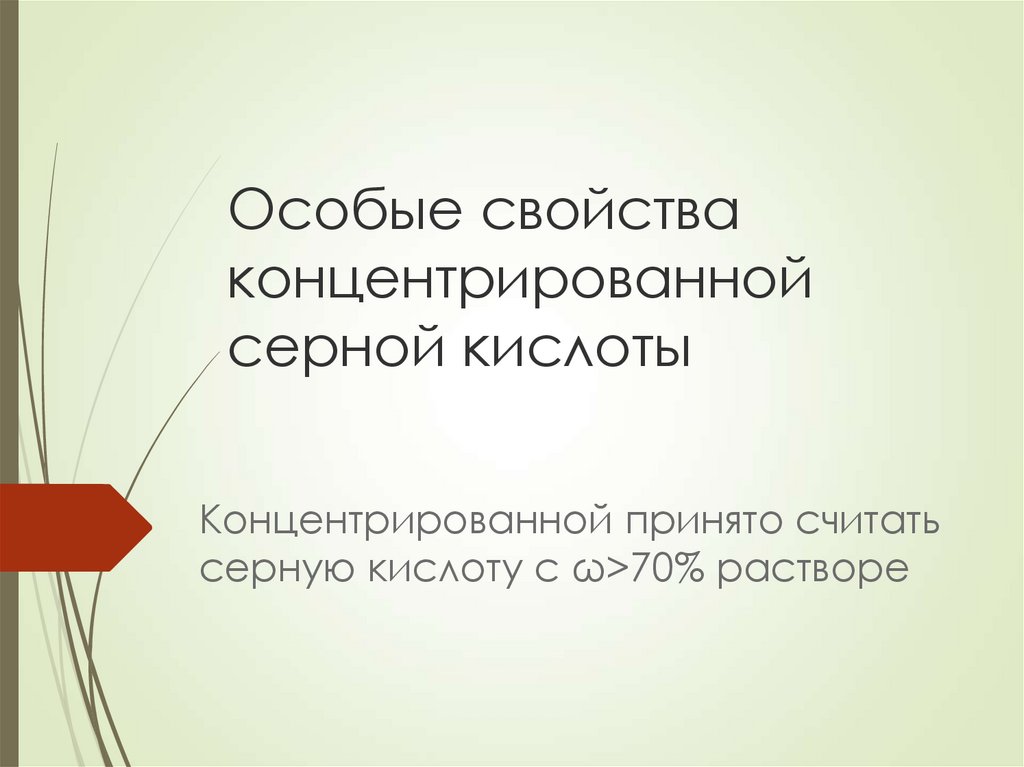
Особые свойства концентрированной серной кислоты
1. Особые свойства концентрированной серной кислоты
Концентрированной принято считатьсерную кислоту с ω>70% растворе
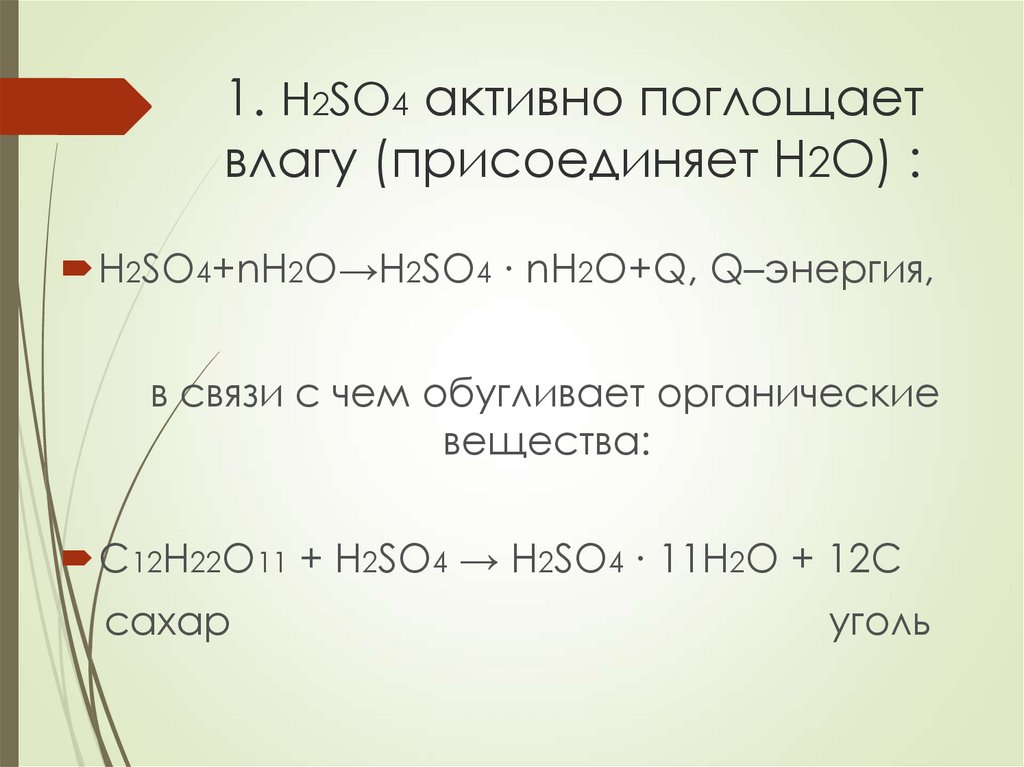
2. 1. H2SO4 активно поглощает влагу (присоединяет H2O) :
H2SO4+nH2O→H2SO4 ∙ nH2O+Q, Q–энергия,в связи с чем обугливает органические
вещества:
C12H22O11 + H2SO4 → H2SO4 ∙ 11H2O + 12C
сахар
уголь
3. 2. Получение более летучих кислот вытеснением их из кристаллических солей:
Использование H2SO4 основано на еёнелетучести и высокой термической
устойчивости.
NaCl + H2SO4 → NaHSO4 + HCl↑
KNO3 + H2SO4 → KHSO4 + HNO3↑
В приведённых реакциях при сильном нагревании
образуются средние соли – сульфаты.
Этот способ нельзя применить для получения HBr, HI, H2S
(окисляются концентрированной H2SO4 )
4. 3. H2SO4–сильный окислитель металлов:
Реакции протекают без выделения H2 по схеме(в т.ч. с Ме, стоящими в ЭХРН после Н): H2
Ме+H2SO4(конц) → сульфат+H2O+X
X: SO2↑ или S↓ или H2S↑
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Ме с переменной степенью окисления образуют
соли в высшей степени окисления :
2Fe+6H2SO4→Fe2(SO4)3+3SO2↑+6H2O (условие: ↑tº C)
При комнатной tº С, «на холоду», H2SO4 (конц)
пассивирует Al, Fe, Cr.
5. 4. H2SO4 (конц) окисляет некоторые неметаллы:
Реакции протекают при нагревании;основным продуктом восстановления
кислоты в этом случае является SO2↑:
2P+5H2SO4(конц) → 2H3PO4+5SO2↑+2H2O
C+2H2SO4(конц)→CO2↑+SO2↑+ 2H2O
S+2H2SO4(конц) →3SO2↑+2H2O



 chemistry
chemistry








