Similar presentations:
Строение атомного ядра. Ядерные силы
1. Строение атомного ядра Ядерные силы
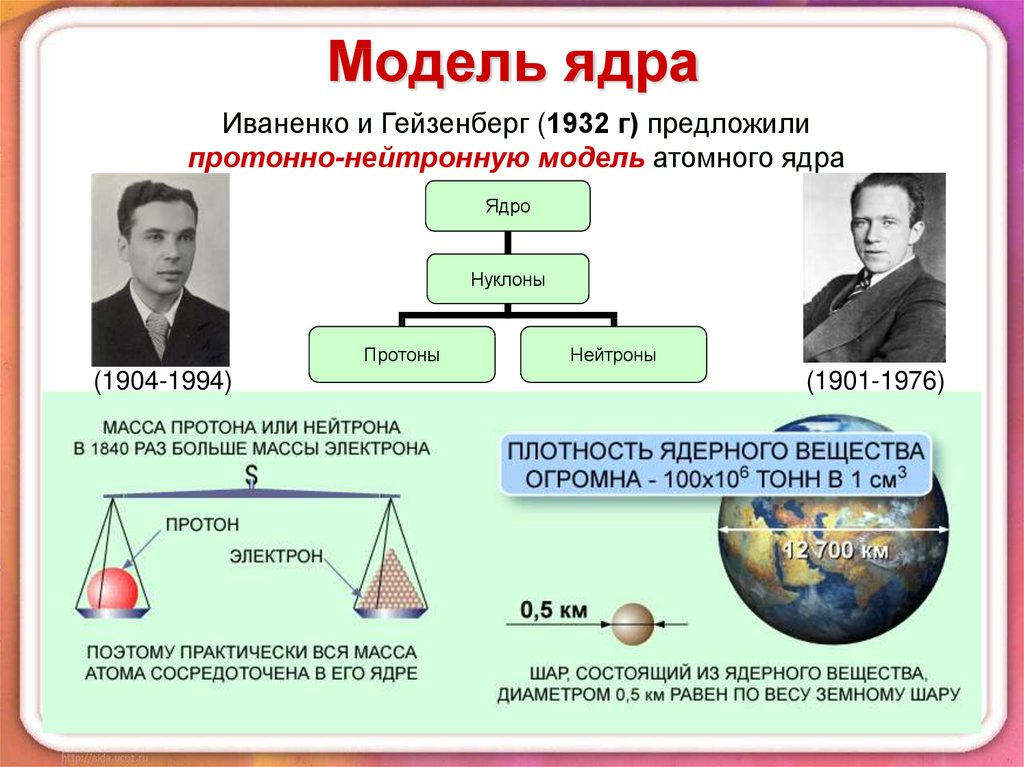
2. Модель ядра
Иваненко и Гейзенберг (1932 г) предложилипротонно-нейтронную модель атомного ядра
Ядро
Нуклоны
Протоны
(1904-1994)
Нейтроны
(1901-1976)
3.
Состав атомного ядра• Общее число нуклонов в данном ядре
называется массовым числом, обозначается
• Число протонов в ядре называется
зарядовым числом, обозначается
(оно равно номеру химического элемента)
• Число нейтронов в ядре обозначается
• Ядро атома обозначают так же, как и
соответствующий химический элемент,
ставя перед ним вверху – массовое число,
а внизу - зарядовое число
207
• Например: 235
Pb
82
92
U
4.
Протонно-нейтронная модель ядра1
1
p
протон
+
Ядро
Z – число протонов в ядре
N – число нейтронов в ядре
m p mN 1а.е.м.
me mядра
нейтрон 1
0
n
А = Z+N – массовое число
А = М (округляют до целого числа)
Сколько протонов и нейтронов содержится в ядре изотопов урана?
А) 235
92
U
А=235
Б) 238
Z=92
92
N=A-Z = 235-92=143
U
А=238
Z=92
N=A-Z = 238-92=146
5. Изотопы
• У одного и того же химического элементавстречаются атомы с различными по массе
ядрами.
• Ядра с одинаковым зарядом, но разными массами
назвали изотопами.
• Изотопы (от греческих слов isos – одинаковый и topos
– место) имеют одинаковый порядковый номер в
таблице Менделеева
• У изотопов одинаковое число протонов, но разное
число нейтронов.
• Изотопы
физические
3 свойства
1 имеют разные
2
• Например:
водород1 имеет три изотопа
1
1
H
протий
Н
Н
дейтерий
тритий
6.
99,985%0,015%
Природный изотопный состав Н
10 15 10 16%
7.
17С 1906 г. известно
35
17
Cl
Cl
37
17
М = 35,457
Cl
92
U
239
92
U
234
92
U
235
92
U
238
92
U
М = 238,0289









 physics
physics








