Similar presentations:
Алюминий и его соединения
1.
Алюминий иего соединения
2.
Цели и задачиЦели и Задачи:
- Образовательные
- Развивающие
- Воспитательные
3.
ОбразовательныеОбразовательные
Сформировать представление у учащихся о строении,
важнейших свойствах алюминия и его соединений, нахождении в
природе и применении.
4.
РазвивающиеРазвивающие
На основе теории строения атома и периодической системы
химических элементов Д. И. Менделеева развить представления
у учащихся о строении алюминия и взаимосвязи строения и его
свойств.
5.
ВоспитательныеВоспитательные
Воспитание познавательного интереса у учащихся, расширение
их кругозора в связи с изучением применения алюминия в
различных областях народного хозяйства.
6.
Положение алюминия впериодической системе.
13Al
1s22s22p63s23p1
3
S
P
7.
Открытие алюминия.Первые упоминания об «легком серебристом
металле» можно встретить
у Плиния старшего, и относятся они к событиям
почти двух тысячелетней давности.
В XVI веке Парацельс Филипп
Ауреол Теофраст Бомбаст фон Гогенгейм,
установил, что вещества и минералы, которые он
исследовал - «есть соль некоторой квасцовой
земли», в состав которой входит окись
неизвестного металла, впоследствии названная
глиноземом.
Квасцы, заинтересовавшие Парацельса, были
известны с давних времен. По свидетельству
греческого историка Геродота, жившего в V веке до
н. э .,древние народы применяли при крашении
тканей для закрепления их цвета минеральную
породу, которую они называли «алюмен», т. е.
«связующая». Этой породой и были квасцы.
8.
Открытие алюминия.Первым, кому удалось получить металлический
алюминий, был датский ученый
Эрстед. В 1825 году в одном из химических
журналов он опубликовал свою статью, в
которой писал, что в результате проведенных
им опытов образовался
«кусок металла, с цветом и блеском, несколько
похожим на олово».
Вскоре, опыты Эрстеда продолжил другой
ученый – Вёлер, который в конце 1827 года
наконец опубликовал свои методы получения
металла. Еще 18 лет у него ушло на
модернизацию своего метода. В 1855 году на
парижской выставке был показан алюминий,
полученный по технологии французского химика
Сент-Клер.
9.
Открытие алюминия.В 1865 году русский ученый Н. Н. Бекетов
предложил способ, который быстро нашел
применение на алюминиевых заводах Франции в
1886 году, независимо друг от друга американский
студент Холл и французский инженер Эру
разработали электролитический способ
производства этого металла, без которого
немыслимо получение металла и сегодня.
Примерно в это время алюминий из драгоценного,
постепенно становится промышленный
металлом. Это произошло как раз во время, т.к.
начинало развиваться машиностроение и вотвот должна было появится авиация .
У алюминия в то время был только один
недостаток – прочность. Но в начале
20 века немецкий химик Вильм запатентовал
сплав, впоследствии названный дюралем или
дюралюминием и имевший прочности в два раза
большую чем у самого алюминия. Вскоре
появились первые самолеты, сделанные из этого
сплава, и в дальнейшем алюминий твердо стал
«крылатым металлом».
10.
Нахождение в природе.Бокситы
Криолит
Нефелин
Каолин
Корунд
11.
Получение.Электролиз:
- это окислительно-восстановительный процесс, происходящий на
электродах при прохождении электрического тока через раствор или
расплав электролита.
криолит
2Al2О3 = 4Al + 3О2.
AlF3 . 3NaF
При электролизе получают металл с содержанием алюминия около
99,7%.
12.
Физические свойстваАлюминий — серебристо-белый металл,
обладающий высокой тепло- и
электропроводностью. Поверхность
металла покрыта тонкой, но очень
прочной пленкой оксида алюминия Аl2Oз.
13.
Химические свойстваВзаимодействие с
простыми
веществами.
Взаимодействие алюминия с водой (в
вакууме, без защитной плёнки).
2Al + 6HOH = 2Al(OH)3 + 3H2
Отношение алюминия к концентрированным кислотам
Концентрированные серная и азотная кислоты на холоде не
действуют на алюминий (пассивируют). При нагревании алюминий
способен восстанавливать эти кислоты без выделения водорода:
14.
Амфотерные свойстваАлюминий амфотерен, т.к. может реагировать не
только с кислотами, но и с щелочами.
Взаимодействие с кислотами
Взаимодействие с щелочами
2Al + 2NaOH + 4H2O = 2NaH2AlO3 + 3H2
Алюминат натрия
15.
АлюминотермияАлюминотермия - это способность получать
различные металлы из их оксидов путем
восстановления алюминием. Алюминотермией
можно получить только те металлы, у которых
теплоты образования оксидов меньше теплоты
образования Аl2Oз, например:
16.
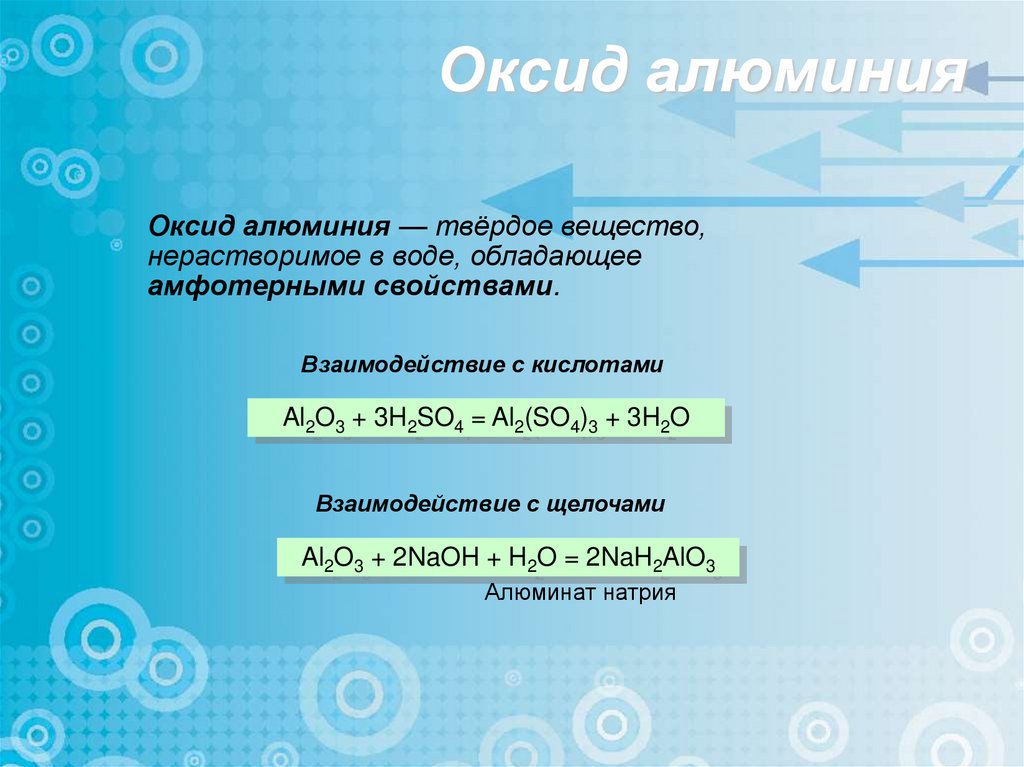
Оксид алюминияОксид алюминия — твёрдое вещество,
нерастворимое в воде, обладающее
амфотерными свойствами.
Взаимодействие с кислотами
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Взаимодействие с щелочами
Al2O3 + 2NaOH + H2O = 2NaH2AlO3
Алюминат натрия
17.
Оксид алюминияAl2O3 имеет 9 кристаллических модификаций. Самая
распространенная a - модификация. Она наиболее химически
инертна, на ее основе выращивают монокристаллы различных
камней для использования с ювелирной промышленности и
технике.
В лаборатории оксид алюминия получают, сжигая порошок
алюминия в кислороде или прокаливая его гидроксид:
Искусственный рубин.
18.
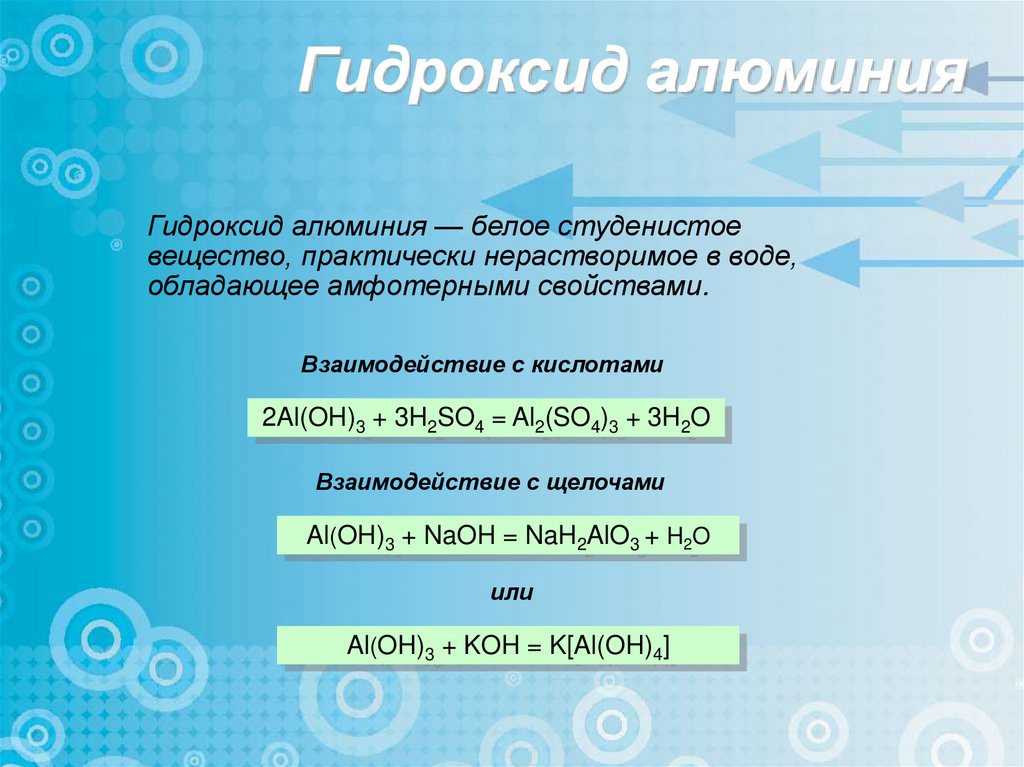
Гидроксид алюминияГидроксид алюминия — белое студенистое
вещество, практически нерастворимое в воде,
обладающее амфотерными свойствами.
Взаимодействие с кислотами
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Взаимодействие с щелочами
Al(OH)3 + NaOH = NaH2AlO3 + H2O
или
Al(OH)3 + KOH = K[Al(OH)4]
19.
Соли алюминияСоли алюминия. Из гидроксида алюминия можно получить
практически все соли алюминия. Почти все соли алюминия и
сильных кислот хорошо растворимы в воде и при этом
сильно гидролизованы.
Галогениды алюминия хорошо растворимы в воде, и по своей
структуре являются димерами:
Сульфаты алюминия легко, как и все его соли,
гидролизуются:
20.
Применение алюминия1. Ракето- и самолётостроение.
2. Электротехника (линии электропередач)
3. Строительство (алюминиевые крепления,
«Краска-серебрянка»)
4. Посуда из алюминия.
5. Упаковочный материал (фольга).
21.
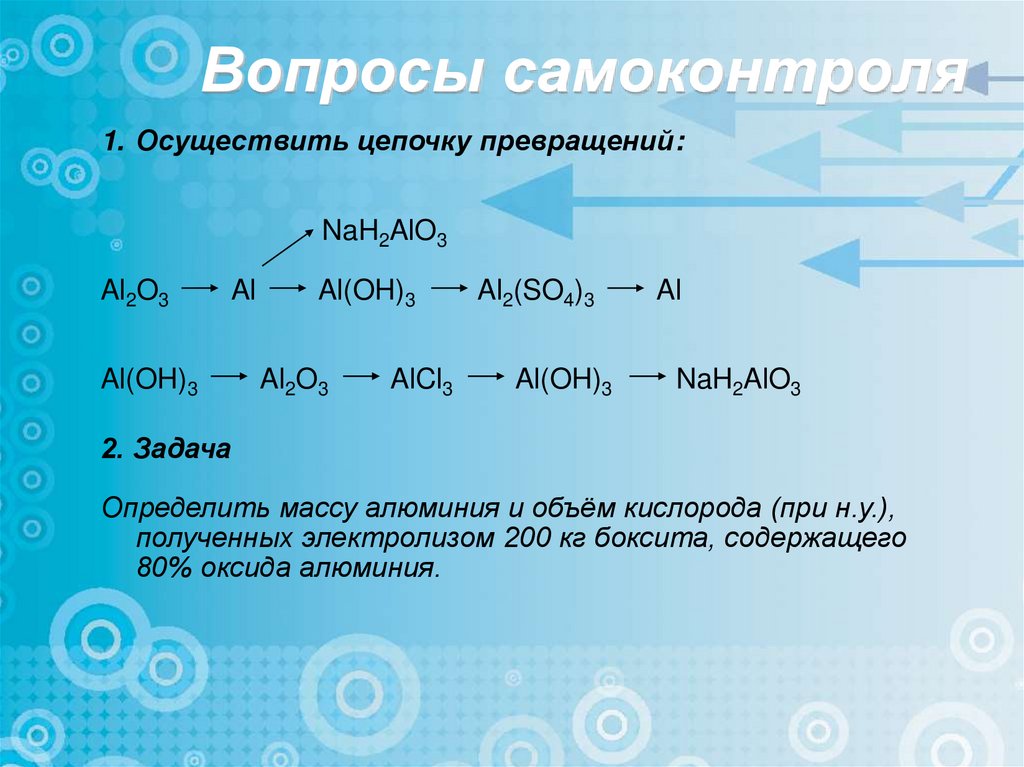
Вопросы самоконтроля1. Осуществить цепочку превращений:
NaH2AlO3
Al2O3
Al
Al(OH)3
Al(OH)3
Al2O3
AlCl3
Al2(SO4)3
Al(OH)3
Al
NaH2AlO3
2. Задача
Определить массу алюминия и объём кислорода (при н.у.),
полученных электролизом 200 кг боксита, содержащего
80% оксида алюминия.


















 chemistry
chemistry








