Similar presentations:
Водород и его изотопы
1.
СВОЙСТВА ЭЛЕМЕНТОВ ПЕРИОДИЧЕКОЙ СИСТЕМЫ.ВОДОРОД И ЕГО ИЗОТОПЫ.
Автор:
Кобылец Ульяна Юрьевна,
студентка группы Х-14(1)
Руководитель:
Дякина Татьяна Александровна,
к.х.н., профессор
2. изучение элемента периодической системы – водорода, а также его изотопов.
Цель:изучение элемента периодической системы – водорода,
а также его изотопов.
Задачи:
Исследование и обусловленный анализ научно-методической
литературы.
Изучение химического элемента периодической системы
водорода.
Исследование физических и химических свойств данного
элемента.
Выявление источников водорода, способов его получения, а
также областей его применения.
Рассмотрение важнейших соединений химического элемента.
2
Изучение изотопов водорода и их свойств.
3.
Элемент периодической системыВодород – первый элемент в периодической системе,
химический знак – Н. Он объединяет в себе признаки
первой (IA) и предпоследней (VIIА) групп (т.е. признаки
щелочных металлов и галогенов).
3
4.
История открытия1731 - 1810
Первым убедился, что при
действии кислот на некоторые
металлы образуется «горючий
газ», который в смеси с воздухом
при поджигании взрывается
Генри Кандевиш в 1766 г.
4
1743 - 1794
Автором открытия водорода как
элемента
многие
считают
французского ученого Антуана
Лавуазье (1785) г. Лавуазье
получил водород пропуская пары
воды через раскаленное железо:
3Fe + 4H2O = Fe3O4 + 4H2↑ и
назвал
газ
Hydrogenium
(рождающий воду).
5.
Физические свойстваВодород – неметалл, имеет молекулярное
строение. Относительная атомная масса 1,008.
Валентность водорода в соединениях равна
единице, степени окисления +1 и -1. Молекула
водорода состоит из двух атомов, связанных
между собой ковалентной неполярной связью.
Некоторые физические характеристики
Tпл = −259,2 °C
Р = 0,08987 г/л
5
Ткип = −252,76 °C
6.
Химические свойстваВвиду своей низкой активности, молекулярный водород
непосредственно соединяется лишь с наиболее активными
из неметаллов (с фтором, а на свету и с хлором) . Однако
при нагревании он вступает в реакции со многими
элементами.
6
H2 + F2 = 2HF.
2NO + 2H2 = N2 + 2H2O.
2H2 + O2 = 2H2O.
CuO + H2 = Cu + H2O.
H2 + S = H2S
2Na + H2 = 2NaH
3H2 + N2 = 2NH3.
Ca + H2 = CaH2.
7.
Нахождение в природеВодород является одним из наиболее распространённых
элементов - его доля составляет 0,88% от массы всех трёх
оболочек земной коры (атмосферы, гидросферы и
литосферы). Также это самый распространенный элемент
во Вселенной. Он составляет больше половины массы
Солнца и большинства других звезд.
7
8.
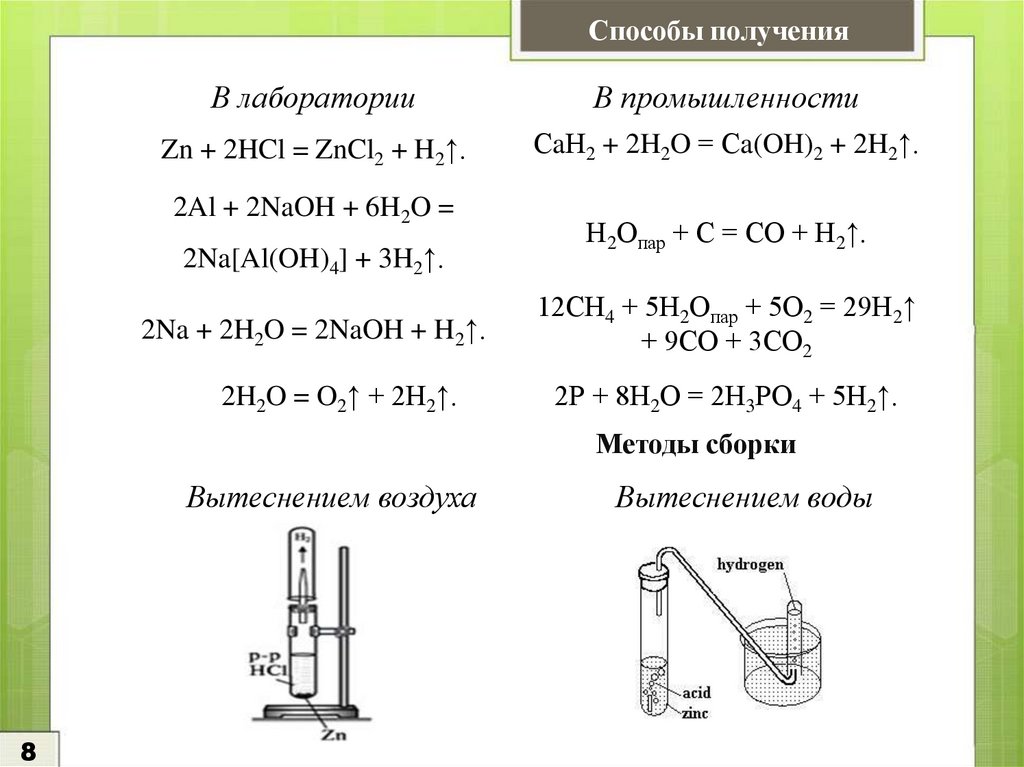
Способы полученияВ лаборатории
В промышленности
Zn + 2HCl = ZnCl2 + H2↑.
СaН2 + 2H2O = Сa(OH)2 + 2H2↑.
2Al + 2NaOH + 6H2O =
2Na[Al(OH)4] + 3H2↑.
2Na + 2H2O = 2NaOH + H2↑.
2H2O = O2↑ + 2H2↑.
Н2Опар + С = СО + Н2↑.
12СН4 + 5Н2Опар + 5О2 = 29Н2↑
+ 9СО + 3СО2
2Р + 8Н2О = 2Н3РО4 + 5Н2↑.
Методы сборки
Вытеснением воздуха
8
Вытеснением воды
9.
Применение9
10.
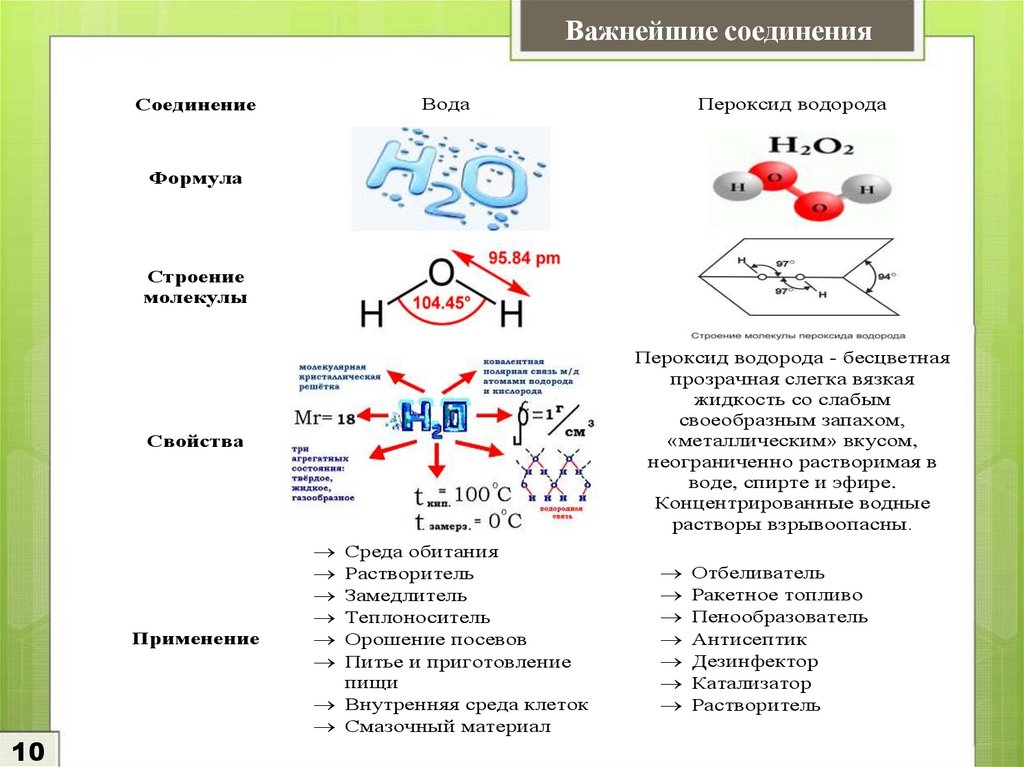
Важнейшие соединенияВода
Соединение
Пероксид водорода
Формула
Строение
молекулы
Пероксид водорода - бесцветная
прозрачная слегка вязкая
жидкость со слабым
своеобразным запахом,
«металлическим» вкусом,
неограниченно растворимая в
воде, спирте и эфире.
Концентрированные водные
растворы взрывоопасны.
Свойства
Применение
10
Среда обитания
Растворитель
Замедлитель
Теплоноситель
Орошение посевов
Питье и приготовление
пищи
Внутренняя среда клеток
Смазочный материал
Отбеливатель
Ракетное топливо
Пенообразователь
Антисептик
Дезинфектор
Катализатор
Растворитель
11.
Изотопы11
Количество
нейтронов
Масса
изотопа
(а.е.м.)
Период
полураспада
Изотоп
Название
Количество
протонов
1Н
Протий
1
0
1,0078250321
стабилен
2Н
Дейтерий
1
1
2,0141017778
стабилен
3Н
Тритий
1
2
3,0160492777
12,32 года
4Н
Квадий
1
3
4,0278100000
1,39×10-22с
5Н
Пентий
1
4
5,0353200000
9,1×10-22с
6Н
Гексий
1
5
6,0449400000
2,9×10-22с
7Н
Септий
1
6
7,0527500000
2,3×10-23с
12.
ЗаключениеВодород – первый элемент в периодической системе. Однако, хоть
он и стоит в начале периодической системы, он не может быть
отнесён к какой-либо определённой её группе. Водород объединяет
признаки первой (IA) и предпоследней (VIIА) групп (т.е. признаки
щелочных металлов и галогенов). Но при этом существуют и
большие различия в его отношении, как к первым, так и к
последним.
Водород существует в четырех состояниях – газообразном при
нормальных условиях, жидком и твердом, а также металлическом
при соблюдении определенных условий.
Молекулярный водород – малоактивное вещество, поэтому для
осуществления реакций с простыми и сложными веществами всегда
требуются дополнительные условия (кроме реакции с F2).
Водород является одним из наиболее распространённых элементов
- его доля составляет 0,88% от массы всех трёх оболочек земной
коры (атмосферы, гидросферы и литосферы). Также это самый
распространенный элемент во Вселенной.
12
13.
Заключение13
Существует большое количество промышленных и лабораторных
способов получения водорода, так как водород практически не
встречается в чистой форме в природе.
Водород применяется в различных отраслях промышленности:
химической,
пищевой,
металлургической,
авиационной,
метеорологической, топливной и т.д.
У водорода существует большое количество изотопов, но хорошо
изучены из них лишь 3. Дейтерий и тритий являются спасением
человечества от энергетического голода, т.к. в управляемых
термоядерных процессах каждый литр природной воды будет давать
столько же энергии, сколько ее дают сейчас 300 л бензина.
Водород – удивительный элемент. После его открытия удалость
понять, как построены кислоты и основания - эти важнейшие классы
химических соединений. Он стал незаменимым лабораторным
реактивом – осаждал металлы из растворов солей, восстанавливал
металлические окислы. Именно от водорода ведут ученые длинную
цепочку превращений атомных ядер. Благодаря изучению водорода
целый спектр наук получил возможность развиваться.












 chemistry
chemistry








