Similar presentations:
Гидроксикарбоновые кислоты
1. Гидроксикарбоновые кислоты
презентацию подготовиластудентка IV курса
группы ХМб-45
Малышева Ангелина
2.
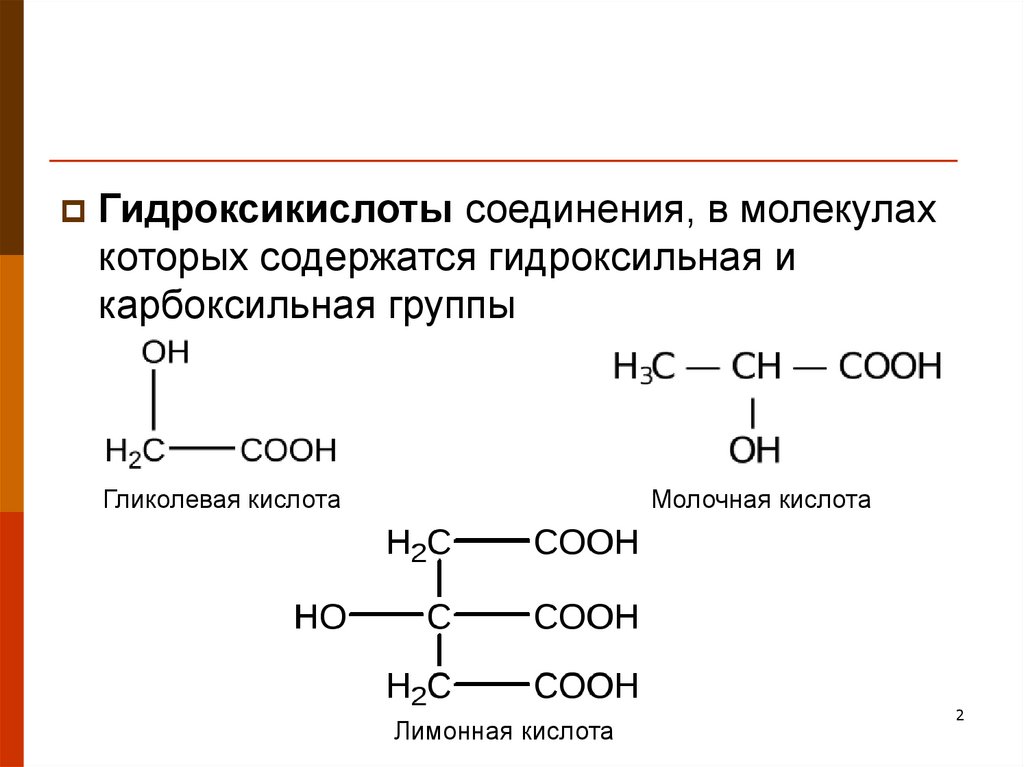
Гидроксикислоты соединения, в молекулахкоторых содержатся гидроксильная и
карбоксильная группы
Гликолевая кислота
Молочная кислота
Лимонная кислота
2
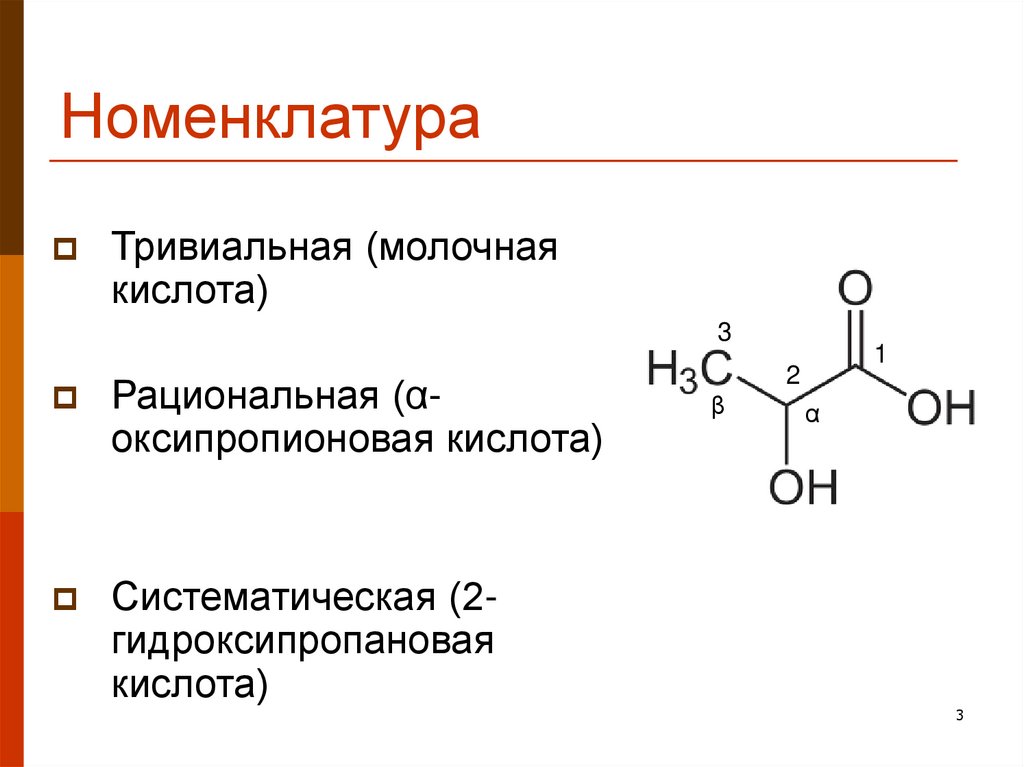
3. Номенклатура
Тривиальная (молочнаякислота)
3
Рациональная (αоксипропионовая кислота)
Систематическая (2гидроксипропановая
кислота)
1
2
β
α
3
4. Изомерия
-Структурная:
изомерия углеродного скелета
изомерия взаимного расположения
функциональных групп
4
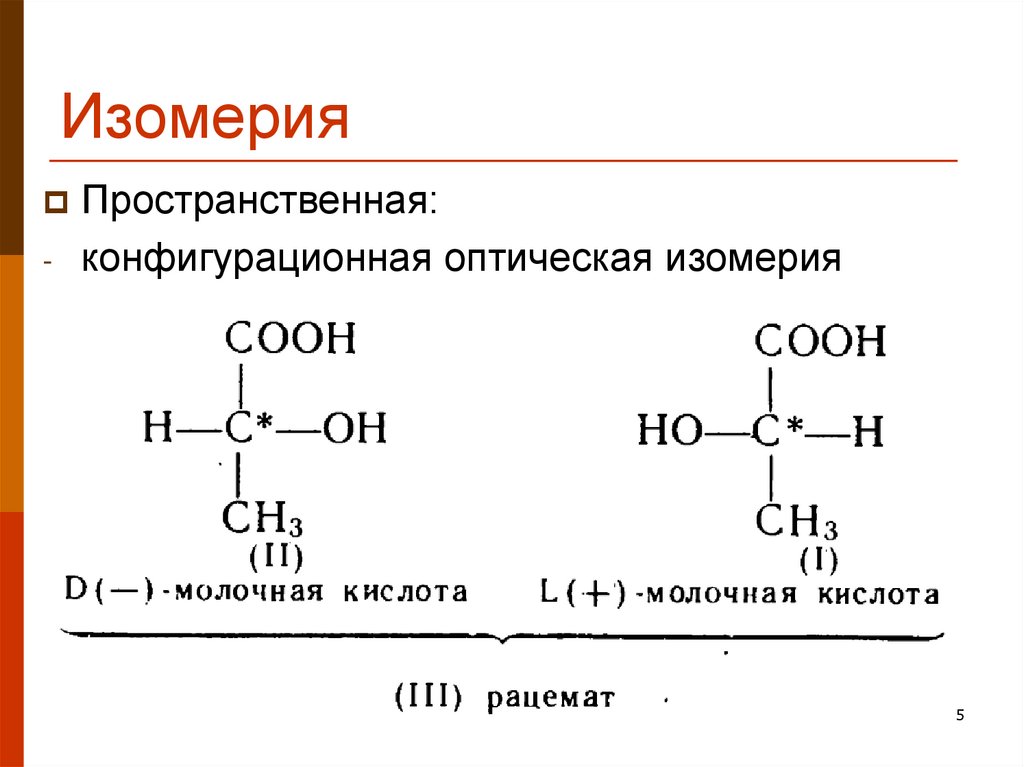
5. Изомерия
-Пространственная:
конфигурационная оптическая изомерия
5
6. Классификация
По радикалу:алифатические
молочная кислота
ароматические
салициловая кислота
По положению гидроксильной группы:
β
γ
β
α
γ
α
6
β-оксимасляная кислота
γ-оксимасляная кислота
7. Классификация
По числу гидроксильных групп: одноатомные,двухатомные и т.д.
По числу карбоксильных групп:
одноосновные, двухосновные и т.д.
Винная кислота:
двухосновная, двухатомная
Лимонная кислота:
трехосновная,одноатомная
7
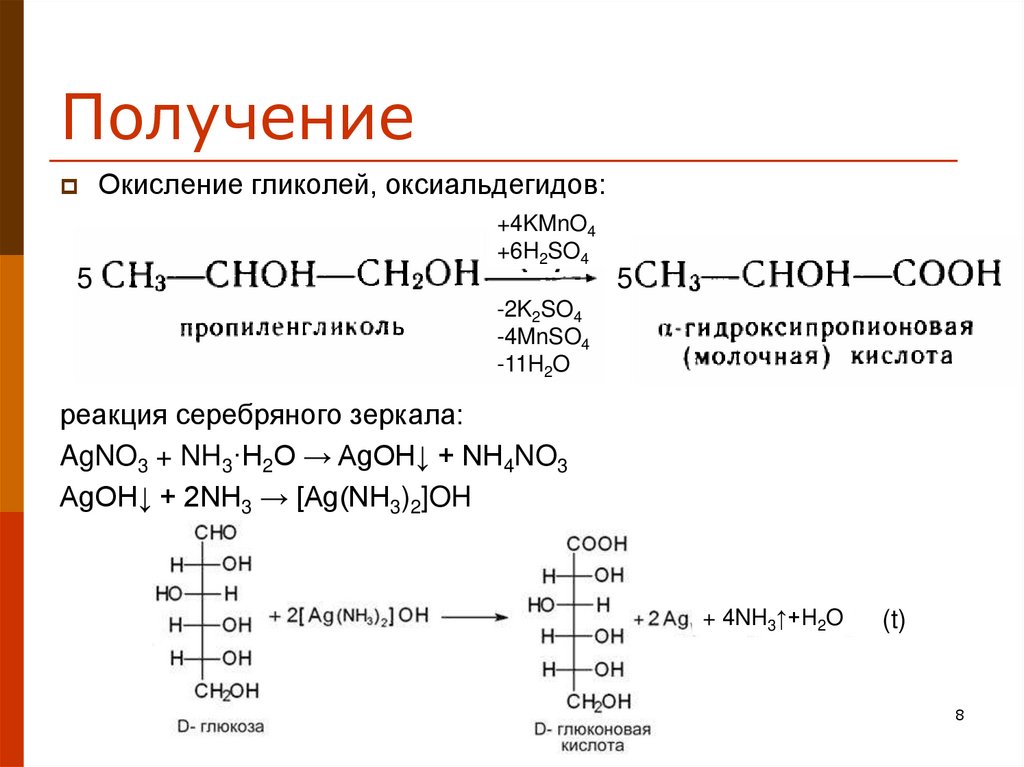
8. Получение
Окисление гликолей, оксиальдегидов:+4KMnO4
+6H2SO4
5
5
-2K2SO4
-4MnSO4
-11H2O
реакция серебряного зеркала:
AgNO3 + NH3·H2O → AgOH↓ + NH4NO3
AgOH↓ + 2NH3 → [Ag(NH3)2]OH
+ 4NH3↑+H2O
(t)
8
9. Получение
Гидролиз галогенпроизводных карбоновыхкислот:
9
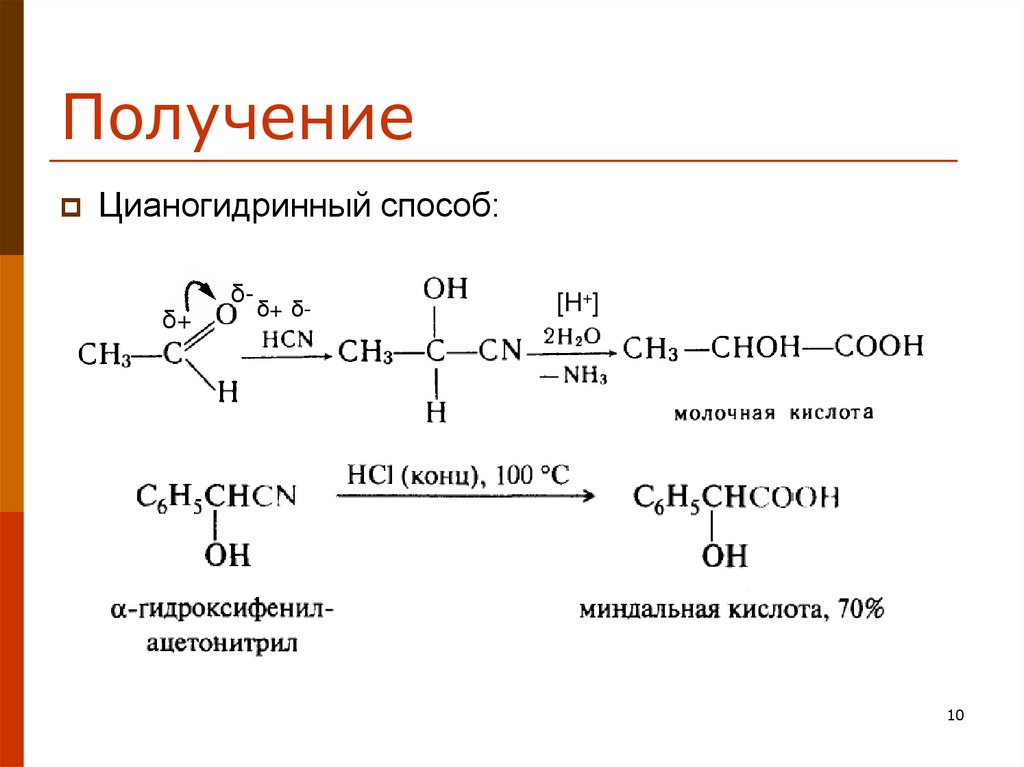
10. Получение
Цианогидринный способ:δ+
δ-
δ+ δ-
[H+]
10
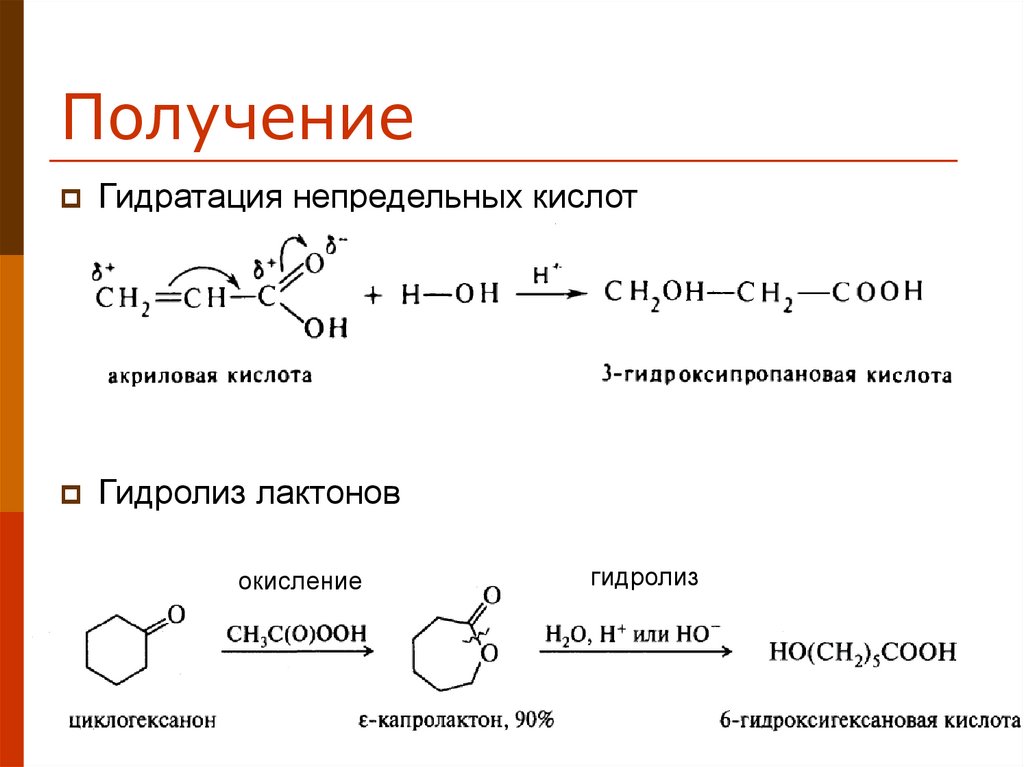
11. Получение
Гидратация непредельных кислотГидролиз лактонов
окисление
гидролиз
11
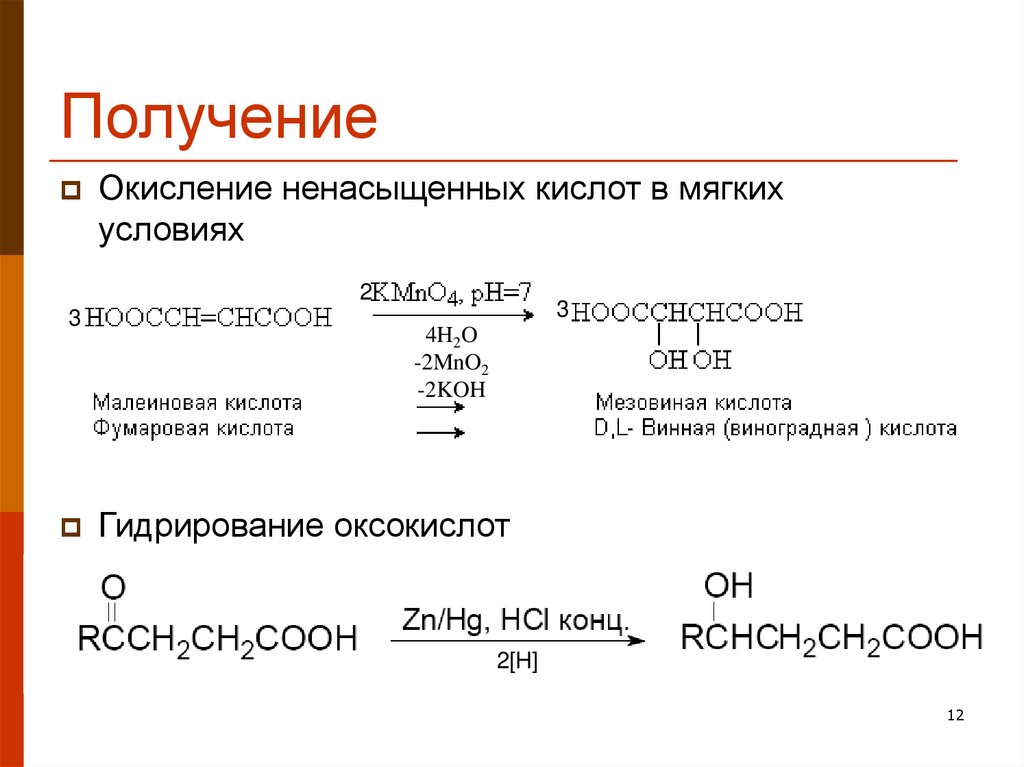
12. Получение
Окисление ненасыщенных кислот в мягкихусловиях
2
3
3
4H2O
-2MnO2
-2KOH
Гидрирование оксокислот
2[H]
12
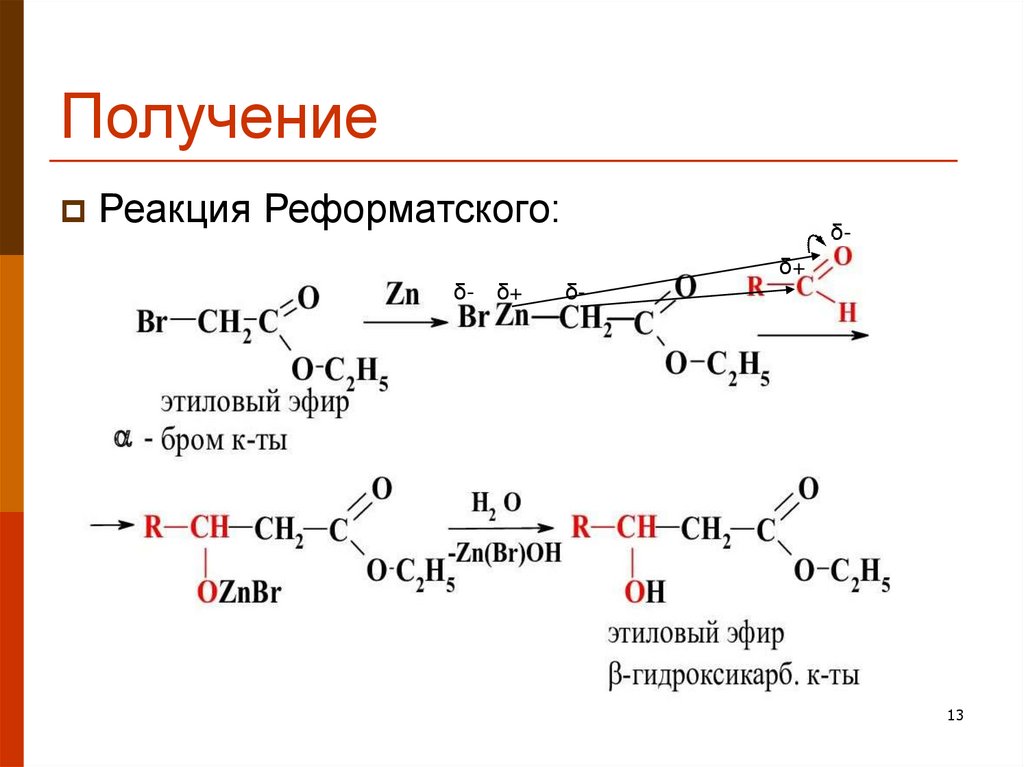
13. Получение
Реакция Реформатского:δδ+
δ- δ+
δ-
13
14. Физические свойства
Одноосновные гидроксикислоты –сиропообразые или твердые вещества
Двухосновные гидроксикислоты –
твердые кристаллические соединения
tпл, tкип выше, чем у соответствующих
карбоновых кислот
14
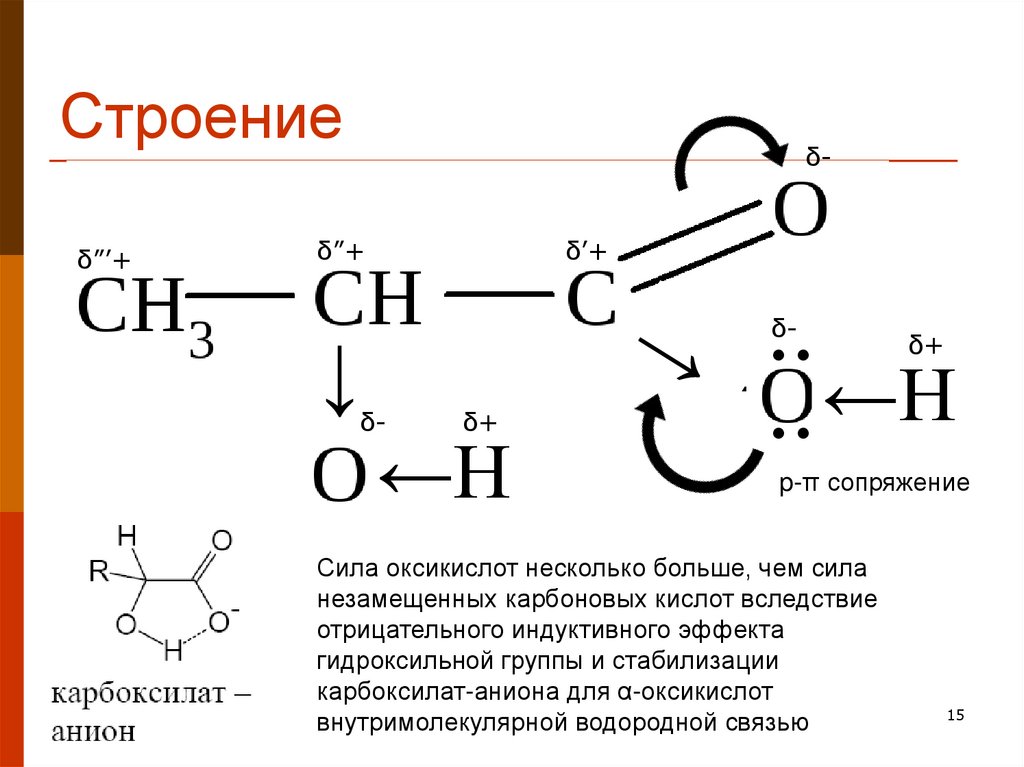
15. Строение
δ”’+δ-
δ”+
δ’+
→
δ-
δ●
δ+
←Н
●
δ+
←Н
p-π сопряжение
Сила оксикислот несколько больше, чем сила
незамещенных карбоновых кислот вследствие
отрицательного индуктивного эффекта
гидроксильной группы и стабилизации
карбоксилат-аниона для α-оксикислот
внутримолекулярной водородной связью
15
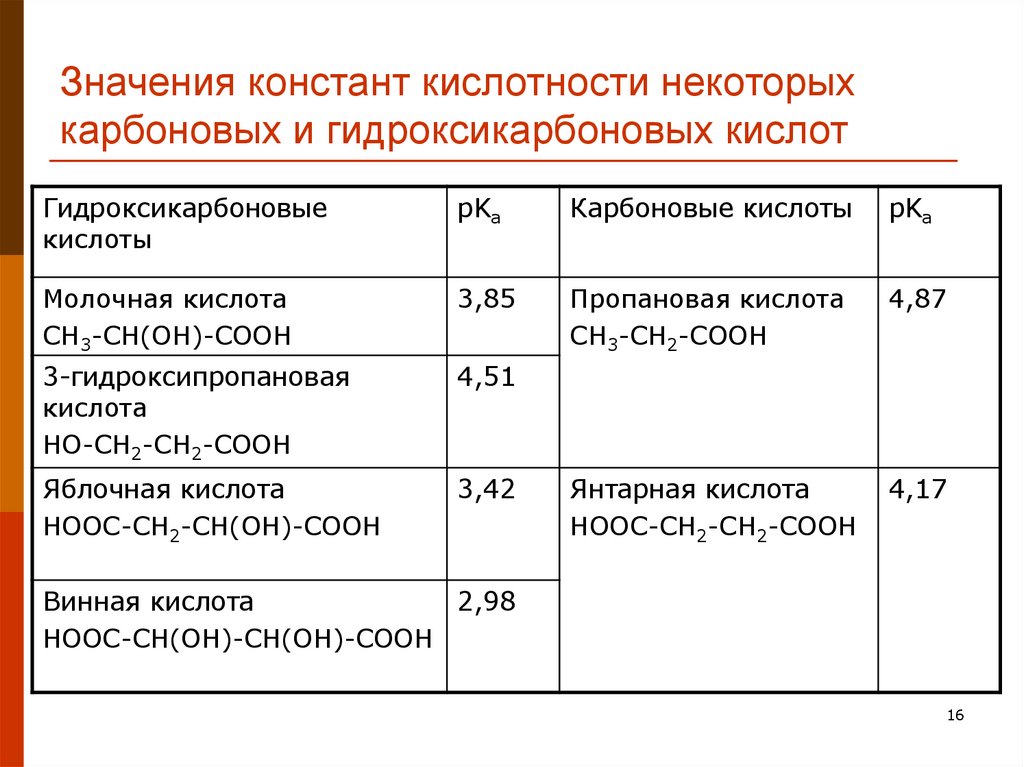
16. Значения констант кислотности некоторых карбоновых и гидроксикарбоновых кислот
Гидроксикарбоновыекислоты
pKa
Карбоновые кислоты
pKa
Молочная кислота
СН3-СН(ОН)-СООН
3,85
Пропановая кислота
СН3-СН2-СООН
4,87
3-гидроксипропановая
кислота
НО-СН2-СН2-СООН
4,51
Яблочная кислота
НООС-СН2-СН(ОН)-СООН
3,42
Янтарная кислота
НООС-СН2-СН2-СООН
4,17
Винная кислота
2,98
НООС-СН(ОН)-СН(ОН)-СООН
16
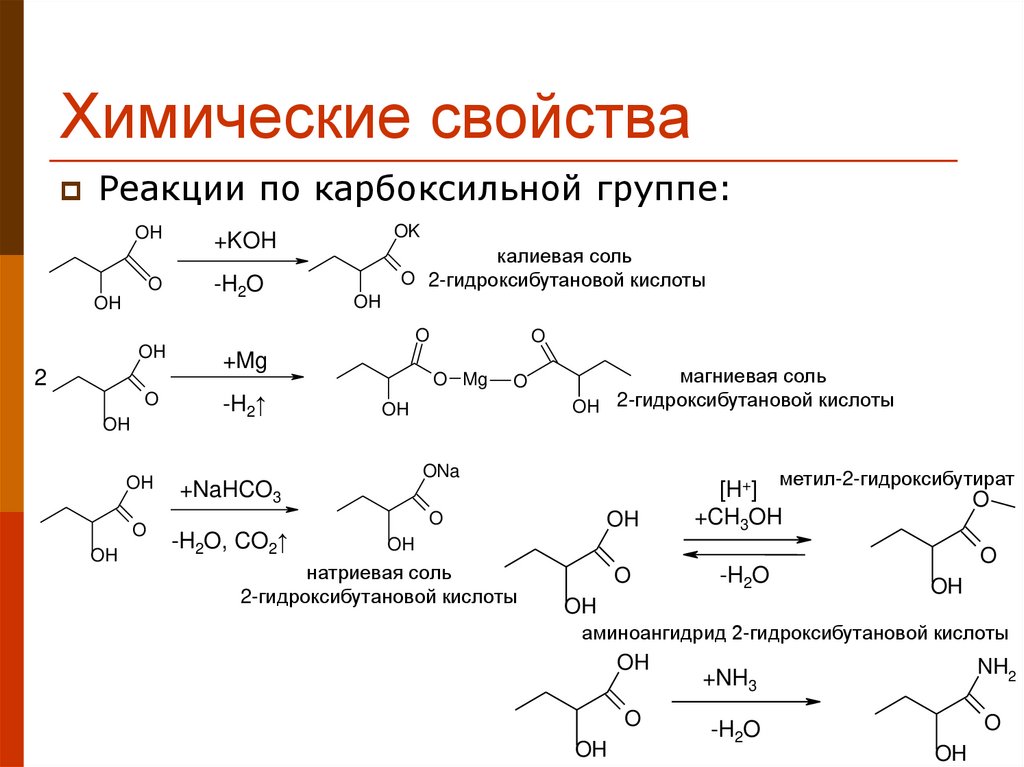
17. Химические свойства
Реакции по карбоксильной группе:OH
O
OH
OH
2
O
OH
OH
O
OH
OK
+KOH
-H2O
калиевая соль
O 2-гидроксибутановой кислоты
OH
O
+Mg
-H2↑
O Mg
O
OH
магниевая соль
OH 2-гидроксибутановой кислоты
ONa
+NaHCO3
-H2O, CO2↑
O
метил-2-гидроксибутират
OH
O
[H+]
+CH3OH
O
OH
натриевая соль
2-гидроксибутановой кислоты
O
-H2O
O
OH
OH
аминоангидрид 2-гидроксибутановой кислоты
OH
O
OH
NH2
+NH3
-H2O
17
OH
O
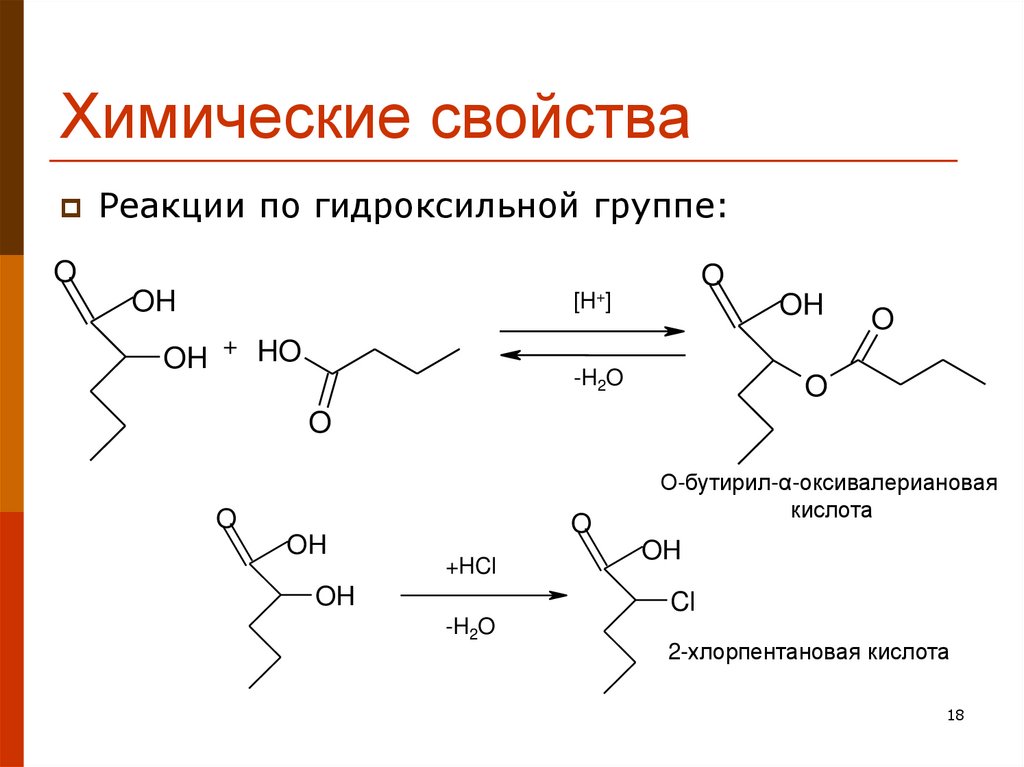
18. Химические свойства
Реакции по гидроксильной группе:O
OH
O
[H+]
OH + HO
OH
-H2O
O
O
O
O
OH
O
+HCl
OH
О-бутирил-α-оксивалериановая
кислота
OH
Cl
-H2O
2-хлорпентановая кислота
18
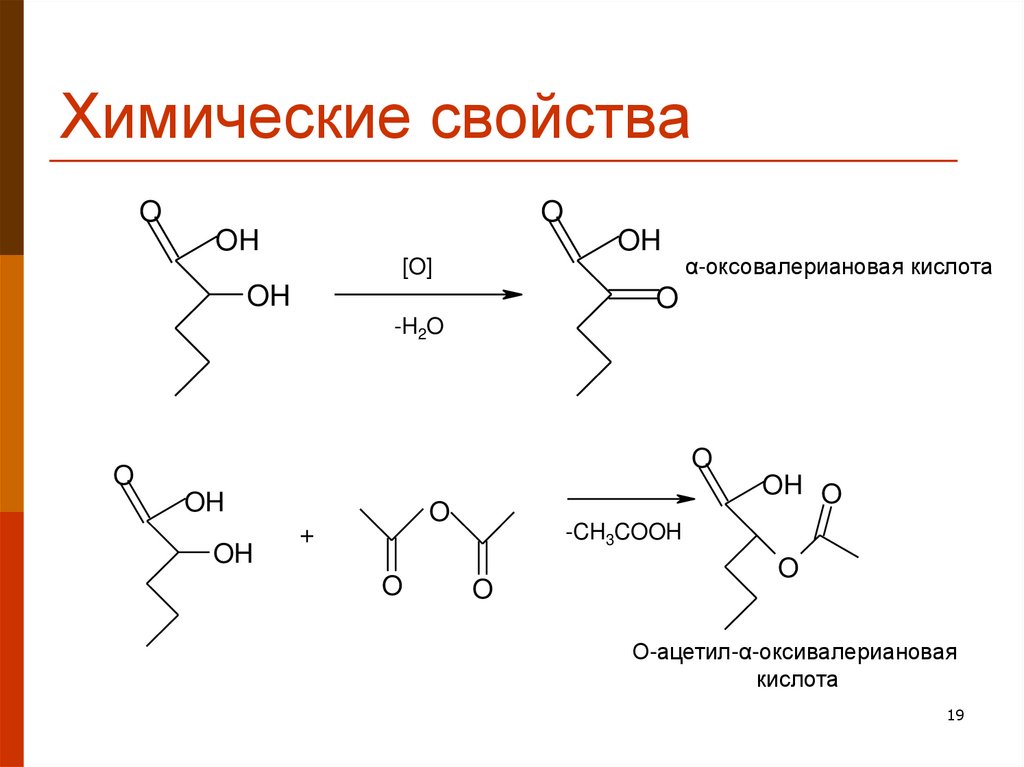
19. Химические свойства
OO
OH
OH
[O]
OH
α-оксовалериановая кислота
O
-H2O
O
O
OH
OH
OH O
O
+
O
-CH3COOH
O
O
О-ацетил-α-оксивалериановая
кислота
19
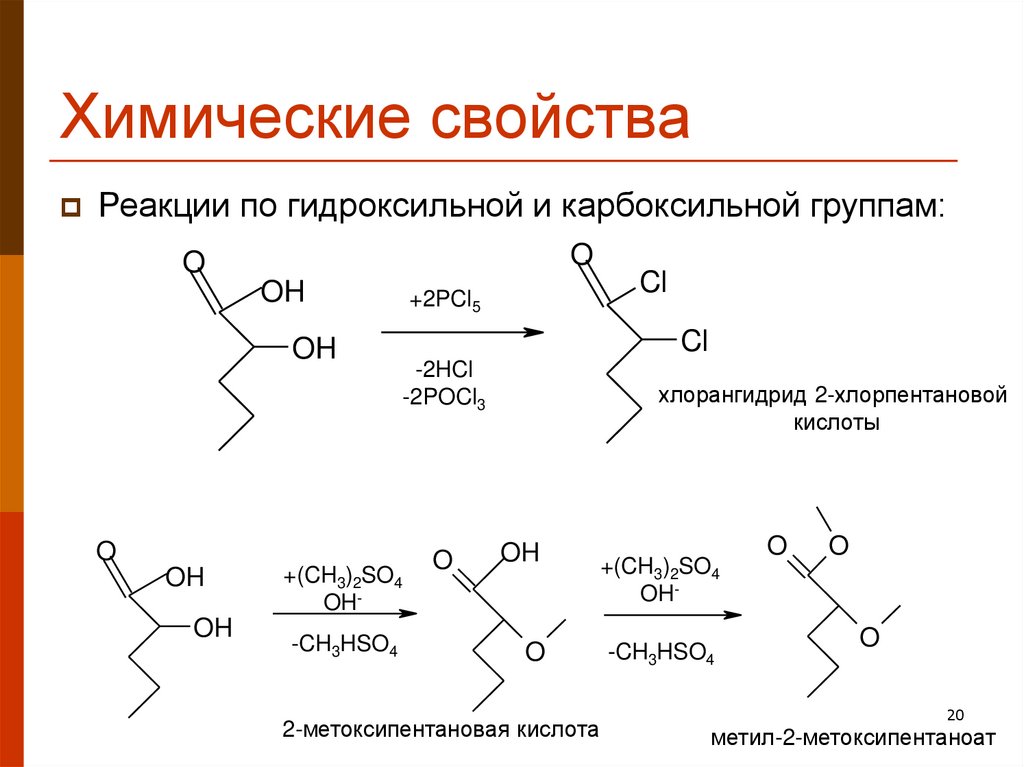
20. Химические свойства
Реакции по гидроксильной и карбоксильной группам:O
O
OH
OH
+2PCl5
Cl
-2HCl
-2POCl3
O
OH
OH
+(CH3)2SO4
OH-CH3HSO4
Cl
O
хлорангидрид 2-хлорпентановой
кислоты
OH
O
2-метоксипентановая кислота
+(CH3)2SO4
OH-
-CH3HSO4
O
O
O
20
метил-2-метоксипентаноат
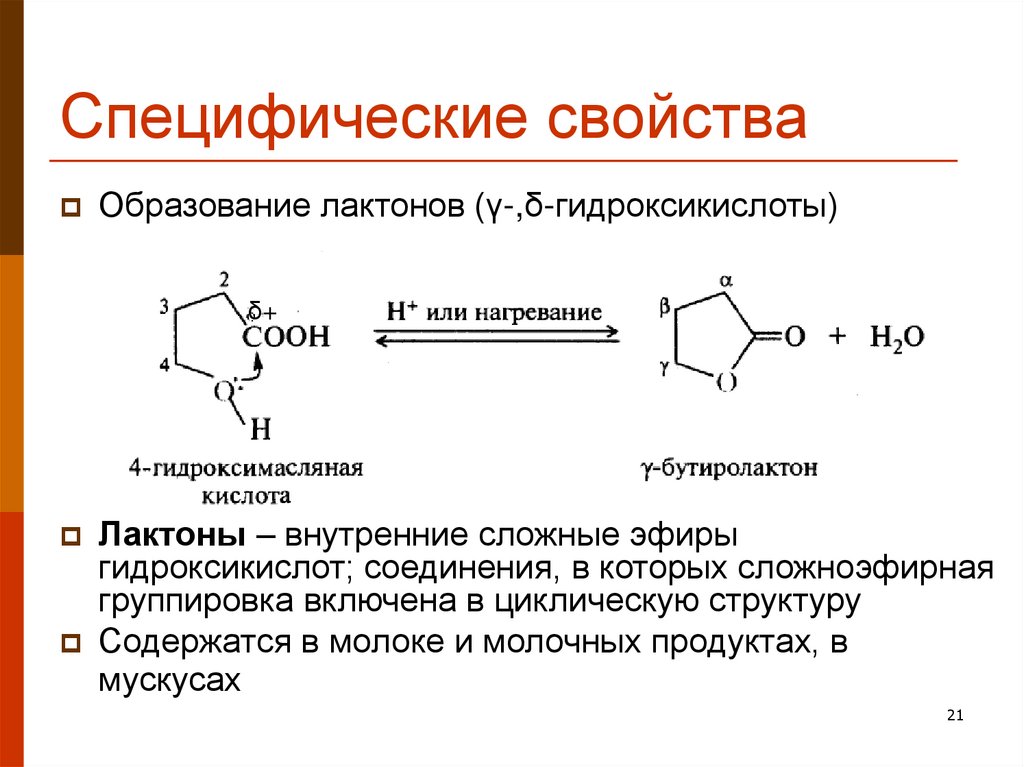
21. Специфические свойства
Образование лактонов (γ-,δ-гидроксикислоты)δ+
Лактоны – внутренние сложные эфиры
гидроксикислот; соединения, в которых сложноэфирная
группировка включена в циклическую структуру
Содержатся в молоке и молочных продуктах, в
мускусах
21
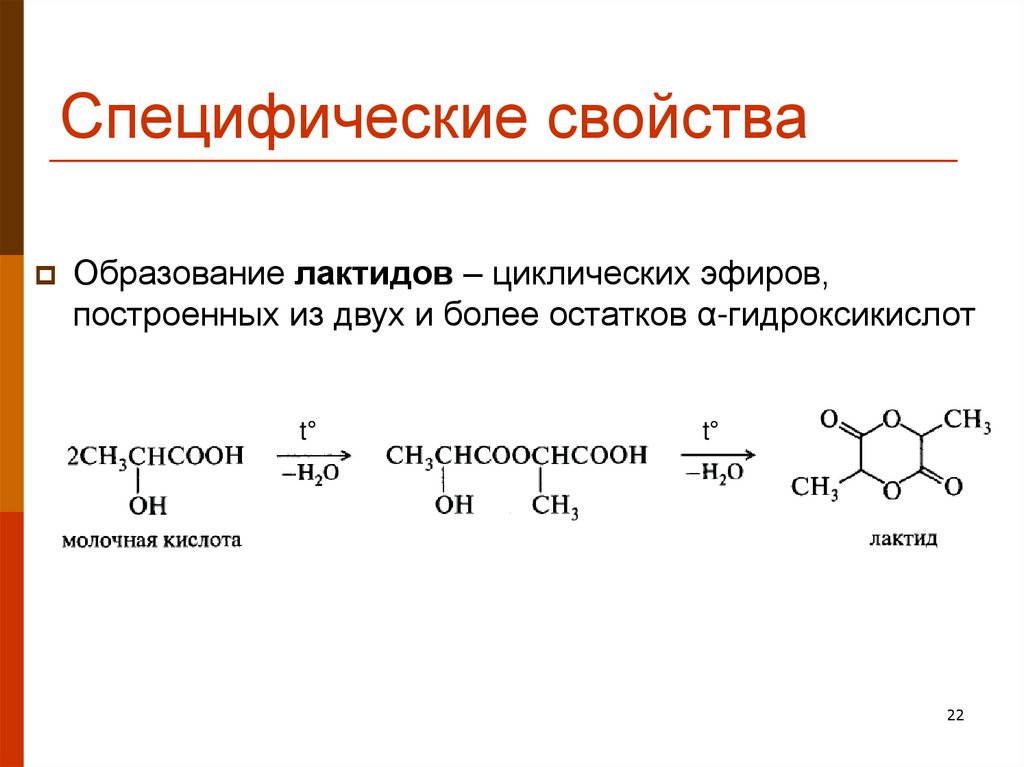
22. Специфические свойства
Образование лактидов – циклических эфиров,построенных из двух и более остатков α-гидроксикислот
t°
t°
22
23. Специфические свойства
Реакции элиминирования (β-гидрокислоты):Кипячение α-гидроксикислот с минеральными
кислотами
t°
23
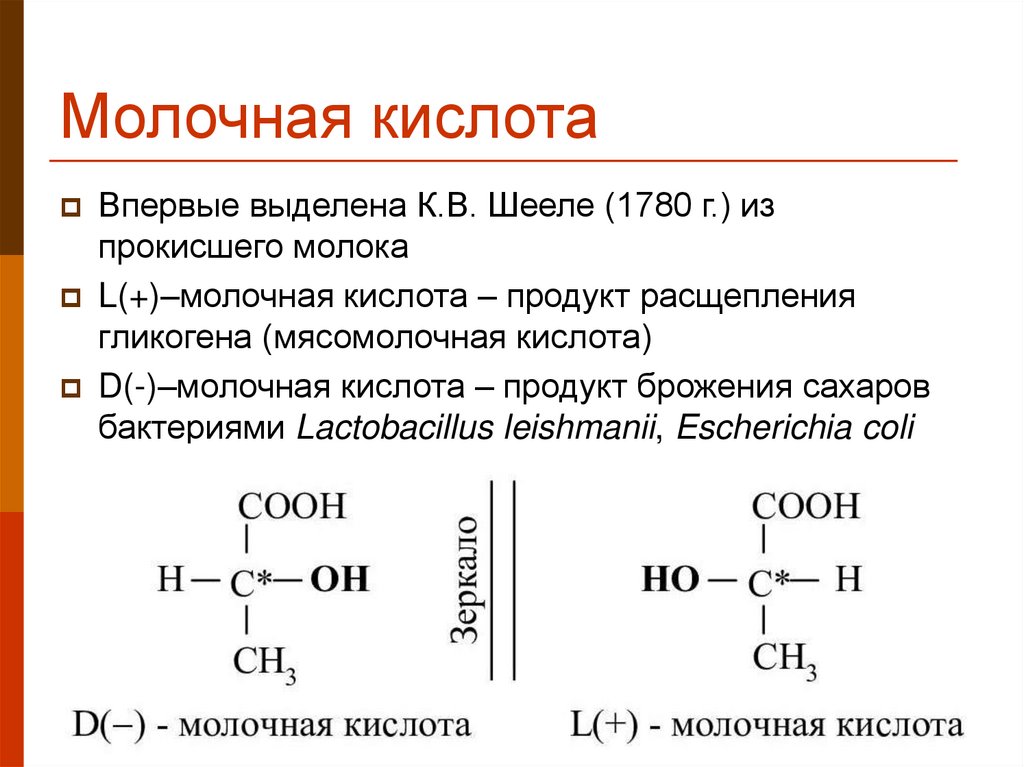
24. Молочная кислота
Впервые выделена К.В. Шееле (1780 г.) изпрокисшего молока
L(+)–молочная кислота – продукт расщепления
гликогена (мясомолочная кислота)
D(-)–молочная кислота – продукт брожения сахаров
бактериями Lactobacillus leishmanii, Escherichia coli
24
25. Применение молочной кислоты
Пищевая добавка для подкисления,консервирования, регулирования рН, улучшения
вкуса, запаха, структуры продуктов
Животноводческая промышленность и
птицеводство: лекарственный препарат,
консервант для кормовых препаратов,
антисептик, подавляющий рост болезнетворных
бактерий
Фармацевтическая промышленность: компонент
лекарственных средств
Косметическая промышленность: входит в
состав лосьонов, скрабов, кремов
В протравном крашении, в кожевенном и
полимерном производстве
25
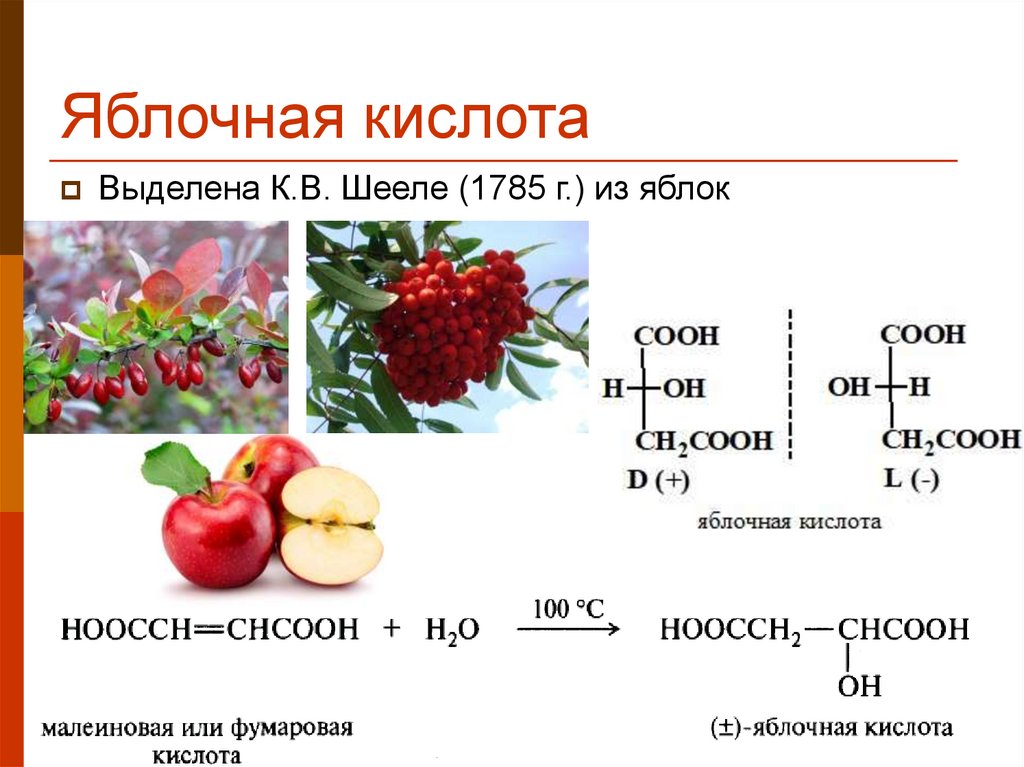
26. Яблочная кислота
Выделена К.В. Шееле (1785 г.) из яблок26
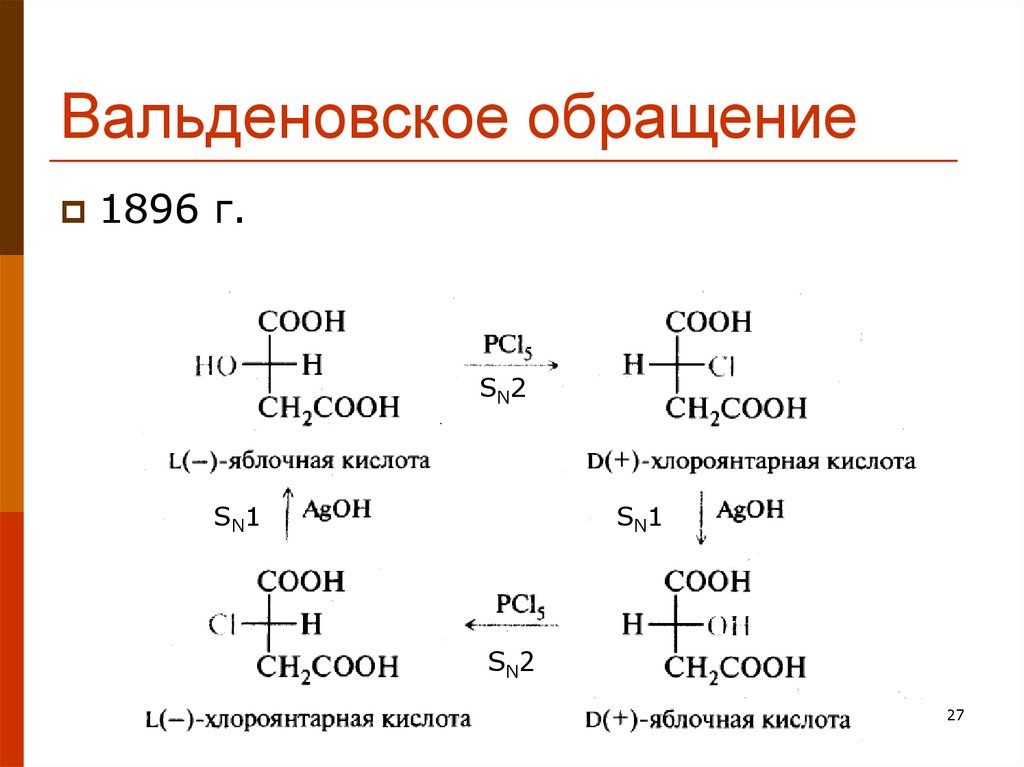
27. Вальденовское обращение
1896 г.S N2
S N1
S N1
S N2
27
28. Применение яблочной кислоты
Пищевая добавка:регулятор кислотности,
стабилизатор, вкусовой
агент при производстве
прохладительных
напитков, мармелада и
пастилы
Косметология: в составе
пилингов
Компонент лекарственных
средств
28
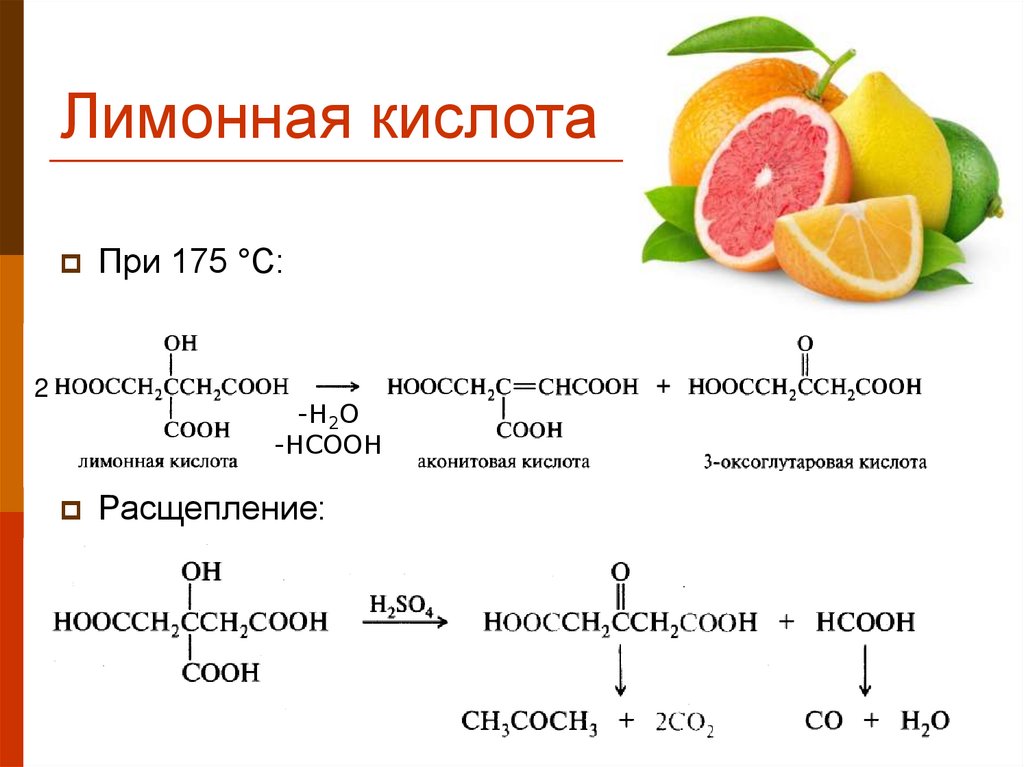
29. Лимонная кислота
2При 175 °С:
-H2O
-HCOOH
Расщепление:
29
30. Применение лимонной кислоты
Пищевая промышленность: вкусоваядобавка, консервант и регулятор
кислотности в
производстве плавленых сыров,
напитков, сухих смесей для
приготовления шипучих напитков
Медицина: в составе средств,
улучшающих энергетический обмен
Косметология:
регулятор кислотности косметических
средств, хелатирующий агент
Входит в состав средств бытовой
химии
Цитрат натрия
30
31. Винная кислота
D(+)-винная (виннокаменная) кислота,встречается в винограде
L(-)-винная кислота образуется при
расщеплении виноградной кислоты
31
32. Применение винной кислоты
Пищевая промышленность:консервант и подкислитель
Косметология: в составе кремов и
лосьонов для лица и тела
Фармацевтическая промышленность:
компонент растворимых
лекарственных средств, шипучих
таблеток
Текстильная промышленность: в
окрашивании тканей для фиксации
цвета
Строительство: замедляет
высыхание строительных
материалов
32
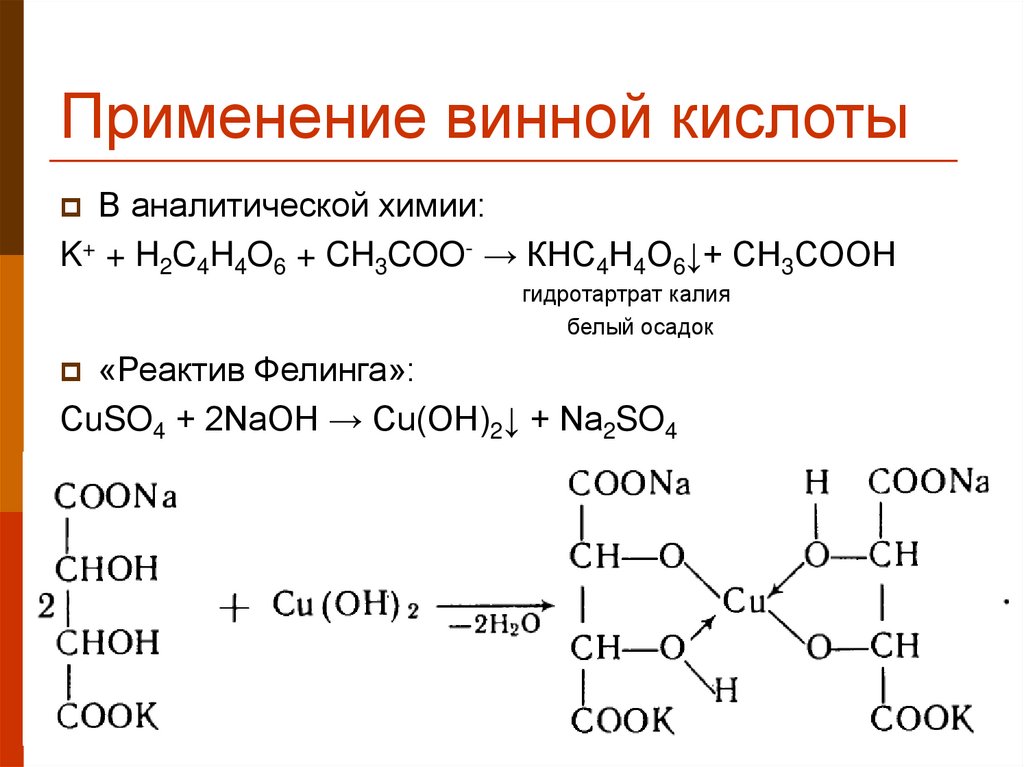
33. Применение винной кислоты
В аналитической химии:K+ + H2C4H4O6 + CH3COO- → КНС4Н4О6↓+ СН3СООН
гидротартрат калия
белый осадок
«Реактив Фелинга»:
СuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
33
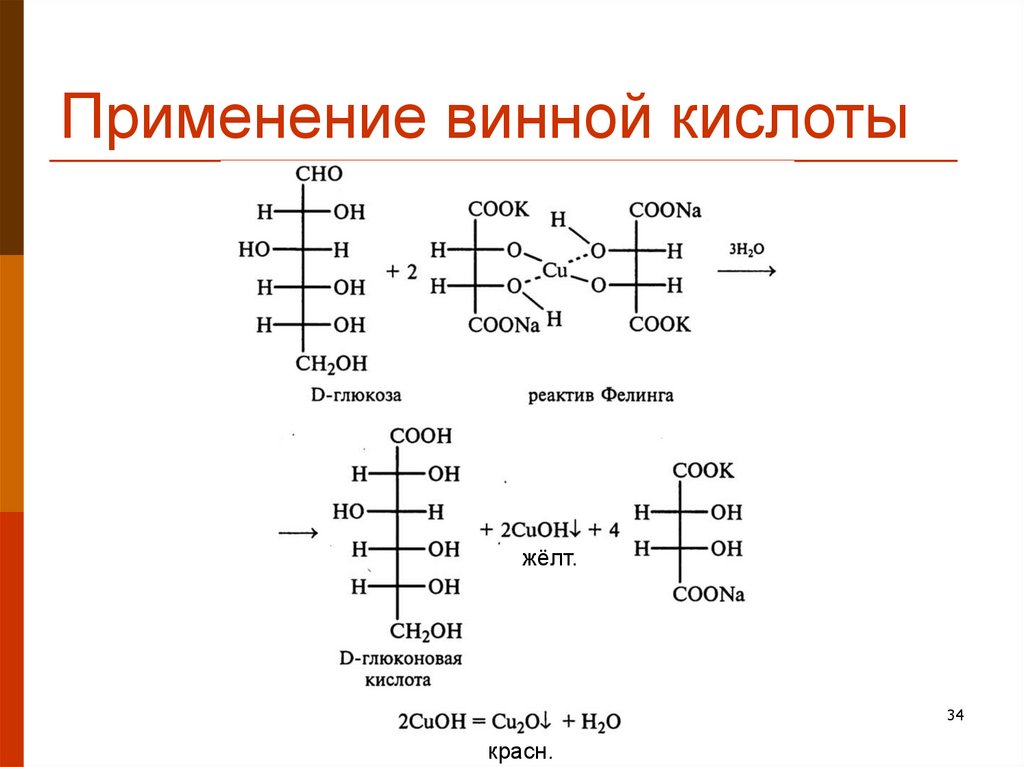
34. Применение винной кислоты
жёлт.34
красн.
35. Разделение рацематов на антиподы
Самопроизвольное расщепление прикристаллизации
кристаллы натрийаммонийных
солей
винных (а, б) и виноградной (в)
кислот
t > 28°C – кристаллы соли виноградной кислоты
t < 28°C – отдельно кристаллы солей D- и L-винных
кислот
35
36. Разделение рацематов на антиподы
Биохимическое расщеплениеСвязано с высокой стереохимической
специфичностью ферментов
микроорганизмов
Плесневелый грибок Penicillium glaucum
потребляет правовращающую винную
кислоту, поэтому в растворах виноградной
кислоты через некоторое время остается
только левовращающая винная кислота
36
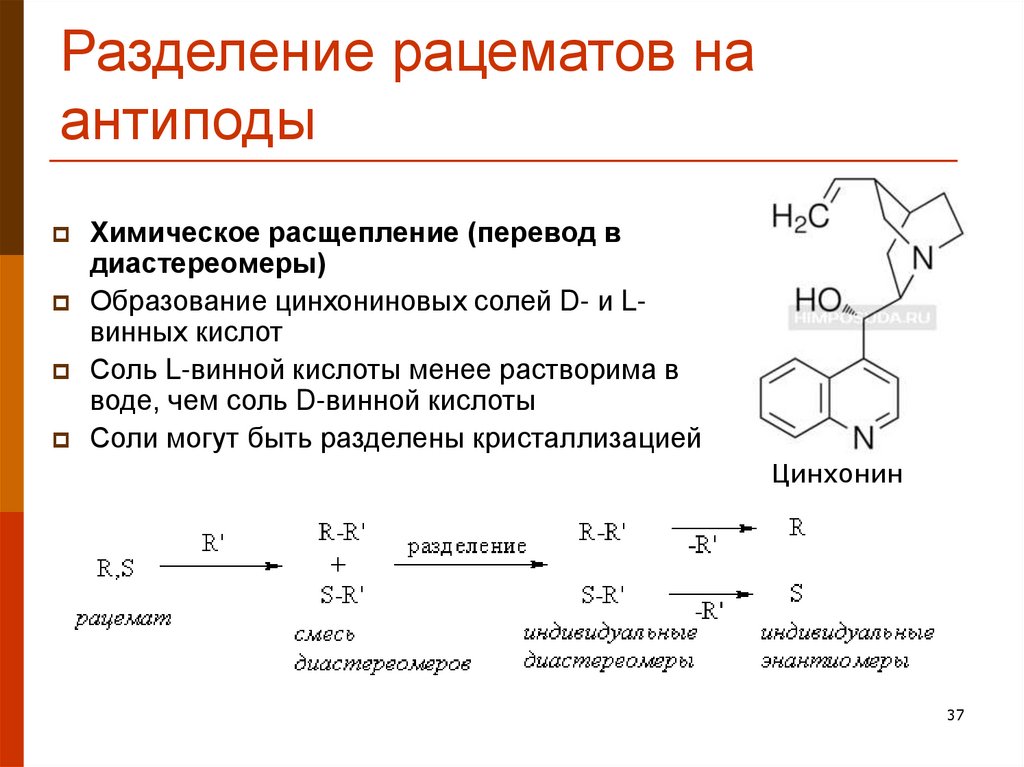
37. Разделение рацематов на антиподы
Химическое расщепление (перевод вдиастереомеры)
Образование цинхониновых солей D- и Lвинных кислот
Соль L-винной кислоты менее растворима в
воде, чем соль D-винной кислоты
Соли могут быть разделены кристаллизацией
Цинхонин
37
38. Разделение рацематов на антиподы
Хроматографическое распределениеВ основе лежит способность хиральных
агентов или селекторов предпочтительно
взаимодействовать с тем или
иным оптическим изомером
38
39.
Спасибо за внимание!39
















 chemistry
chemistry








