Similar presentations:
Окислительно–восстановительные реакции (ОВР)
1. ОКИСЛИТЕЛЬНО–ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
2.
ОВР – это реакции, в которых изменяютсястепени окисления (С.О.) одного или
нескольких элементов, входящих в состав
реагирующих веществ.
При
определении
С.О.
необходимо
учитывать:
1. Любая молекула электронейтральна,
поэтому сумма степеней окисления всех
элементов в молекуле равна 0
(Fe3+Cl-3)0, (K+2Cr+62O-27)0
3.
2. С.О. водорода в большинстве соединений равна +1H+Cl- , H2+S-2,
и только в гидридах - 1
Ca+2H-2, Al+3H-3
3. С.О. кислорода в его соединениях равнa – 2
K+2S+6O-24, Na+3P+5O-24, Mg+2O-2
(исключение пероксиды - H2+O2-, соединения со F
+1,+2).
4. С.О. металлов первой, второй и третьей группы
главной подгруппы соответствует номеру группы
равна номеру +1, +2, +3 соответственно
4.
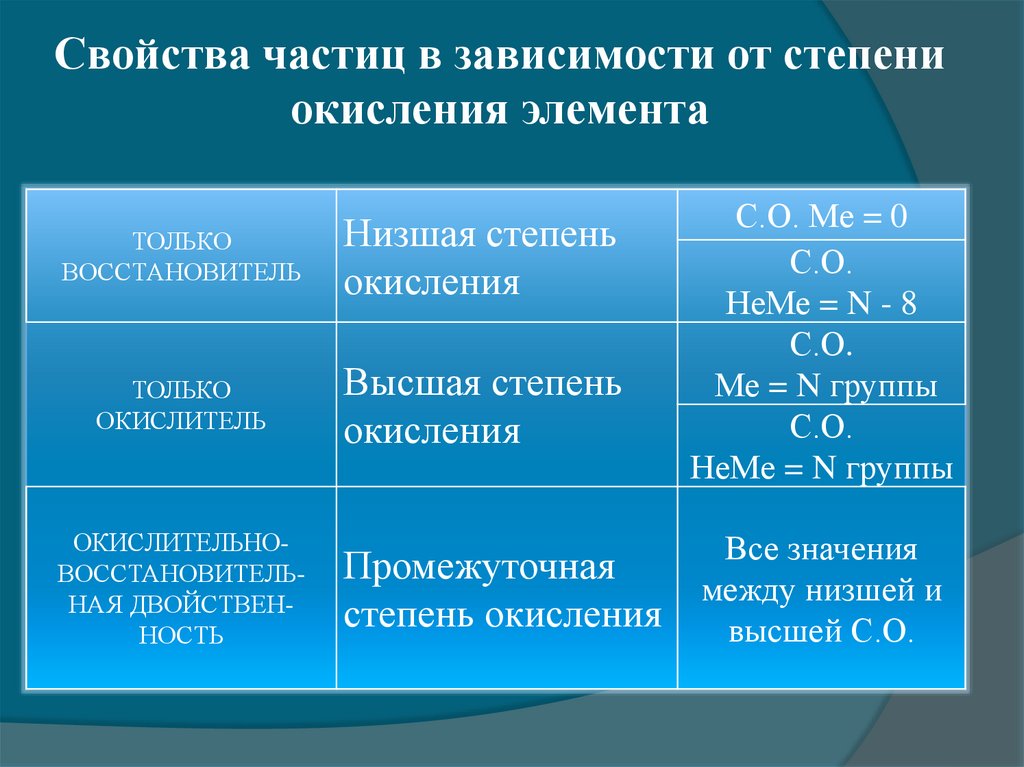
Свойства частиц в зависимости от степениокисления элемента
ТОЛЬКО
ВОССТАНОВИТЕЛЬ
Низшая степень
окисления
ТОЛЬКО
ОКИСЛИТЕЛЬ
Высшая степень
окисления
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНАЯ ДВОЙСТВЕННОСТЬ
С.О. Ме = 0
С.О.
НеМе = N - 8
С.О.
Ме = N группы
С.О.
НеМе = N группы
Все значения
Промежуточная
между низшей и
степень окисления
высшей С.О.
5.
Любая ОВР сопровождается двумя процессами –окисление и восстановление.
Окисление – это процесс отдачи электронов (ē)
восстановителем.
Восстановитель
-
это
химическая частица, в состав которой входит
элемент, отдающий ē и повышающий свою С.О:
S+4 - 2ē → S+6,
восстановитель, процесс окисления
6.
Восстановление – это процесс присоединенияэлектронов (ē) окислителем. Окислитель –
это химическая частица, в состав которой
входит
элемент,
присоединяющий
ē
понижающий свою С.О:
Mn+7 + 5ē → Mn+2
окислитель, процесс восстановления
и





 chemistry
chemistry








