Similar presentations:
Биохимия крови. Лекция № 20
1.
Лекция №20 (№8 весеннего семестра).Тема: «Биохимия крови.»
1. Кровь. Общая характеристика. Функции крови.
Кровь - это жидкая ткань, которая выполняет в организме ряд важных
функций:
1. Основная функция крови - это транспорт веществ и тепловой энергии;
а) Дыхательная функция. Кровь переносит газы: О2 от легких к органам
и тканям, а обратно СО2;
б) Трофическая и выделительная функция. Кровь доставляет органам и
тканям питательные вещества, забирая от них продукты метаболизма;
в) Коммуникативная функция. Кровь переносит гомоны от места их
синтеза к органам-мишеням;
г) Кровь транспортирует по организму воду и ионы;
д) Терморегуляторная функция. Кровь перераспределяет в организме
тепловую энергию;
2. Кровь содержит различные буферные системы, которые участвую в
поддержании кислотно-основного равновесия;
3. Кровь, с помощью неспецифического и специфического иммунитета,
защищает организм от внешних и внутренних вредных факторов.
В результате выполнения перечисленных функций, кровь обеспечивает
поддержание в организме гомеостаза.
Все жидкости организма обладают рядом общих свойств: объемом,
плотностью, вязкостью, рН и осмотическим давлением.
2. Нормальные значения общих и специфических свойств крови
взрослого человека.
Нормальные значения общих свойств крови взрослого человека:
1. Объем в среднем 4,6л или 6—8% от массы тела. У мужчин 5,2л, у
женщин 3,9л.
2. Удельная плотность цельной крови —1050—1060 г/л, плазмы —1025—
1034 г/л, эритроцитов —1080-1097 г/л.
3. Вязкость крови 4-5 относительных единиц (в 4-5 раз выше вязкости
воды). У мужчин – 4,3-5,3 мПа*с, у женщин 3,9-4,9 мПа*с.
4. рН капиллярной крови = 7,37-7,45, рН венозной крови = 7,32-7,42.
5. Осмотическое давление = 7,6 атм. (определяется осмотической
концентрацией – суммой все частиц находящихся в единице объема. Т=37С.).
В основном зависит от NaCl и других низкомолекулярных веществ
При этом у некоторых жидкостей организма могут быть подчеркнуты
специфические свойства, такие как цвет, прозрачность, запах и т.д. К
1
2.
специфическим свойствам крови относятся онкотическое давление, СОЭ,цветовой показатель и гематокрит.
Нормальные значения специфических свойств крови взрослого человека:
1. Онкотическое давление =0,03 атм.
2. СОЭ: мужчины – 1-10 мм/ч, женщины – 2-15 мм/ч.
3. Цветовой показатель – 0,86-1.05
4. Гематокрит – 40—45% (у мужчин 40-48%, у женщин 36-42%).
Отношение форменных элементов крови, в процентах, к общему объему
крови.
3. Состав крови.
Кровь является разновидностью соединительной ткани и, как любая ткань,
состоит из клеток и межклеточного вещества.
1. КЛЕТОЧНЫЙ СОСТАВ КРОВИ
Форменные элементы (клетки) крови составляют 45% от общего объема
крови.
Клетки крови
Концентрация
% от общего объема крови
12
Эритроциты
у ♂ 4,0-5,1*10 /л
44
12
у ♀ 3,7-4,7*10 /л
Тромбоциты
180-320*109/л
≈1
9
Лейкоциты
4,0-8,8*10 /л
<1
Среди лейкоцитов выделяют:
№ Виды лейкоцитов Концентрация, 109/л
1 нейтрофилы
2,0-5,5
сегментоядерные
2 лимфоциты
1,2-3.0
3 моноциты
0,09-0.6
4 нейтрофилы
0,04-0,3
палочкоядерные
5 эозинофилы
0,02-0.3
6 базофилы
0-0,065
% от общ. количества
45-70
18-40
2-9
1-6
0-5
0-1
2. МЕЖКЛЕТОЧНОЕ ВЕЩЕСТВО КРОВИ
Межклеточное вещество крови называется плазмой крови, она составляет
55% от общего объема крови. Для получения плазмы крови, цельную кровь
центрифугируют с антикоагулянтом, например с гепарином.
Существует также понятие сыворотка крови, в отличие от плазмы
сыворотка крови не содержит белок фибриноген. Сыворотку крови получают
при центрифугировании цельной крови без антикоагулянта.
2
3.
ХИМИЧЕСКИЙ СОСТАВ ПЛАЗМЫ КРОВИХимический состав растворимых в плазме крови веществ относительно
постоянен, так как существуют мощные нервные и гуморальные механизмы,
поддерживающие гомеостаз.
Группа
Растворитель
Сухой остаток
Углеводы
Липиды
Вещество
Вода
Органические
и
неорганические
вещества
Глюкоза
капиллярная
кровь
Общие липиды
Общий холестерин
ТГ
Свободные ЖК
ЛПВП
ЛПНП
Коэфф. атерогенности
В плазме
90-91%
9-10%
Общий белок
альбумины
глобулины
α1-глобулины
α2-глобулины
β-глобулины
γ-глобулины
АСТ
АЛТ
Креатинкиназа
Липаза
Кислая фосфатаза
Щелочная фосфатаза
ЛДГ
Лактат
65-85 г/л, 7%
56,5-66,5%
33,5-43,5%
2,5-5,0%
5,1-9,2%
8,1-12,2%
12,8-19,0%
до 40 МЕ
до 30 МЕ
до 6 МЕ (по креатину)
0-28 МЕ
до 10 МЕ
до 120 МЕ
до 460 МЕ
0,99-1,75 ммоль/л
Креатинин
Мочевина
Мочевая кислота
50-115 мкмоль/л
2,5-6,4 ммоль/л
муж 214-458 мкмоль/л
жен 149-404 мкмоль/л
3,3-5,5 ммоль/л
4-8 г/л
<5,0 ммоль/л
0,50-2,10 ммоль/л
400-800 мкмоль/л
0,9-1,9 ммоль/л
<2,2 ммоль/л
До 3 ед.
Белки
Ферменты
Низкомолекулярные
органические
вещества
3
4.
АминокислотыОбщий билирубин
Прямой билирубин
Непрямой билирубин
48-68мг/л
8,5-20,5 мкмоль/л
0-5,1 мкмоль/л
До 16,5 мкмоль/л
0,9%
Натрий
Калий
Кальций
Магний
Хлориды
Неорганич. Фосфаты
Общая углекислота
Железо
135-152 ммоль/л
3,6-6,3 ммоль/л
2,2-2,75 ммоль/л
0,7-1,2 ммоль/л
95-110 ммоль/л
0,81-1,55 ммоль/л
22,2-27,9 ммоль/л
муж 8,95-28,65 мкмоль/л
жен 7,16-26,85 мкмоль/л
муж 11-22 мкмоль/л
жен 11-24,4 мкмоль/л
Минеральные
вещества
Медь
Гормоны
и Гормоны и медиаторы
медиаторы
Капиллярная кровь
Растворенные газы
рСО2
Венозная кровь рСО2
Капиллярная кровь рО2
Венозная кровь рО2
БЕЛКИ ПЛАЗМЫ КРОВИ
В плазме крови открыто более 200 видов белков, которые составляют 7%
объема плазмы. Белки плазмы крови синтезируются в основном в печени и
макрофагах, а также в эндотелии сосудов, в кишечнике, лимфоцитах, почках,
эндокринных железах. Разрушаются белки плазмы крови печенью, почками,
мышцами и др. органами. Т½ белков плазмы крови составляет от нескольких
часов до несколько недель.
В плазме крови белки выполняют следующие функции:
1. Создают онкотическое давление. Оно необходимо для удержания воды
в кровяном русле.
2. Участвуют в свертывании крови.
3. Образуют буферную систему (белковый буфер).
4. Транспортируют в крови плохорастворимые в воде вещества (липиды,
металлы 2 и более валентности).
5. Участвуют в иммунных процессах.
6. Образуют резерв аминокислот, который используется, например, при
белковом голодании.
7. катализируют некоторые реакции (белки-ферменты).
8. Определяют вязкость крови, влияют на гемодинамику.
4
5.
9. Участвуют в реакциях воспаления.Строение белков плазмы крови
По строению белки плазмы крови являются глобулярными, по составу они
делятся на простые (альбумины) и сложные.
Среди сложных, можно выделить липопротеины (ЛПОНП, ЛППП, ЛПНП,
ЛПВП, ХМ), гликопротеины (почти все белки плазмы) и металлопротеины
(трансферин, церрулоплазмин).
Общее количество белка в плазме крови в норме составляет 70-90 (60-80)
г/л, его определяют с помощью биуретовой реакции. Количество общего
белка в крови имеет диагностическое значение.
Повышение общего количества белка в плазме крови называется
гиперпротеинемия, снижение – гипопротеинемия. Гиперпротеинемия
возникает при дегидратации (относительная), травмах, ожогах, миеломной
болезни (абсолютная). Гипопротеинемия наступает при спаде отеков
(относительная), голодании, патологии печени, почек, кровопотере
(абсолютная).
Кроме общего содержания белков в плазме крови также определяют
содержание отдельных групп белков или даже индивидуальных белков. Для
этого их разделяют с помощью электроэлектрофореза.
Электрофорез – это метод, при котором вещества с различным зарядом и
массой, разделяются в постоянном электрическом поле. Электрофорез
проводят на различных носителях, при этом получают разное количество
фракций. При электрофорезе на бумаге белки плазмы крови дают 5 фракций:
альбумины, α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины. При
электрофорезе на агаровом геле получается 7-8 фракций, на крахмальном
геле – 16-17 фракций. Больше всего фракций – более 30, дает
иммуноэлектрофорез.
Белки плазмы можно также разделить с помощью высаливания
нейтральными солями щелочных и щелочноземельных металлов (3 фракции:
альбумины, глобулины и фибриноген) или осаждения в спиртовом растворе.
Электрофореграмма белков сыворотки крови (10 пациентов)
5
6.
Целесообразность разделения белков на фракции связана с тем, чтобелковые фракции плазмы крови отличаются между собой преобладанием в
них белков, с определенными функциями, местом синтеза или разрушения.
Нарушение соотношения белковых фракций плазмы крови называется
диспротеинемия. Выявление диспротеинемии имеет диагностическое
значение.
Фракции белков плазмы крови
I. Альбумины
Основным белком этой фракции является альбумин.
Альбумин. Простой белок из 585 АК с массой 66кДа, имеет 17
дисульфидных мостиков, много дикарбоновых АК, обладает высокой
гидрофобностью. У альбумина наблюдается полиморфизм. Синтезируется в
печени (12 г/сут), утилизируется почками, энтероцитами и др. тканями.
Т½=20 дней. 60% альбуминов находиться в межклеточном веществе, 40% - в
кровяном русле. В плазме альбуминов 40-50г/л, они составляют 60% всех
белков плазмы крови.
Функции: поддержание онкотического давления (вклад 80%), транспорт
свободных жирных кислот, билирубина, жѐлчных кислот, стероидных и
тиреоидных гормонов (20% Т4, 11% Т3), ХС, лекарств, неорганических
ионов (Cu2+, Ca2+, Zn2+), является источником аминокислот.
Транстиретин (преальбумин). Тетрамер. Молекулярная масса 54 кДа. В
плазме 0,25г/л. Белок острой фазы (5 группа). Транспортирует в небольших
количествах тироксин (11%), трийодтиронин (9%) и ретинол. Снижается при
голодании.
Диспротеинемия альбуминовой фракции реализуется преимущественно за
счет гипоальбуминемии.
Причиной гипоальбуминемии является снижение синтеза альбуминов при
печеночной недостаточности (цирроз), при повышении проницаемости
капилляров, при активации катаболизма вследствие ожогов, сепсисе,
опухолях, при потере альбуминов с мочой (нефротический синдром), при
голодании.
Гипоальбуминемия вызывает отек тканей, снижение почечного кровотока,
активацию РААС, задержку воды в организме и усиление отека тканей.
Резкий отток жидкости в ткани приводит к снижению АД и может вызвать
шок.
Глобулины. Они содержат липопротеины и гликопротеины.
II. α1-Глобулины
α1-Антитрипсин - гликопротеин, синтезируемый печенью. В плазме
2,5г/л. Белок острой фазы (2 группа). Важный ингибитор протеаз, в том числе
эластаз нейтрофилов, которые разрушают эластин альвеол лѐгких и печени.
α1-Антитрипсин также ингибирует коллагеназу кожи, химотрипсин, протеазы
грибков и лейкоцитов. При дефиците α1-антитрипсина могут возникнуть
эмфизема лѐгких и гепатит, приводящий к циррозу печени.
6
7.
Кислый α1- гликопротеин, синтезируется печенью. В плазме 1 г/л. Белокострой фазы (2 группа). Транспортирует прогестерон и сопутствующие
гормоны.
ЛПВП синтезируются в печени. В плазме 0,35 г/л. Транспортируют
излишки ХС из тканей в печень, обеспечивают обмен других ЛП.
Протромбин - гликопротеид, содержащий около 12% углеводов; белковая
часть молекулы представлена одной полипептидной цепью; молекулярная
масса около 70000Да. В плазме 0,1 г/л. Протромбин - предшественник
фермента тромбина, стимулирующего формирование тромба. Биосинтез
протекает в печени и регулируется витамином К, образуемым кишечной
флорой. При его недостатке витамина К уровень протромбина в крови
падает, что может приводить к кровоточивости (ранняя детская геморрагия,
обтурационная желтуха, некоторые болезни печени).
Транскортин - гликопротеин, синтезируемый в печени, масса 55700Да,
Т½=5 суток. Переносит кортизол, кортикостерон, прогестерон, 17-альфагидроксипрогестерон и, в меньшей степени, тестостерон. В плазме 0,03 г/л.
Концентрация в крови чувствительна к экзогенным эстрогенам и зависит от
их дозы.
Тироксинсвязывающий глобулин (TBG) - синтезируется в печени.
Молекулярная масса 54 кДа. В плазме 0,02 г/л. Т½=5 суток. Он является
главным транспортером тироидных гормонов в крови (транспортирует 68%
тироксина и 80% трийодтиронина).
Диспротеинемия
за
счет α1-глобулиной фракции реализуется
преимущественно за счет: 1). снижения синтеза α1-антитрипсина. 2). Потере
белков этой фракции с мочой при нефротическом синдроме. 3). повышения
белков острой фазы в период воспаления.
III. α2-Глобулины
α2-Макроглобулин очень крупный белок (725 кДа), синтезируется в
печени. Белок острой фазы (4 группа). В плазме 2,6 г/л. Главный ингибитор
множество классов протеиназ плазмы, регулирует свертывание крови,
фибринолиз, кининогенез, иммунные реакции. Уровень α2-макроглобулина в
плазме уменьшается в острой фазе панкреатита и карциномы простаты,
увеличивается - в результате гормонального эффекта (эстрогены).
Гаптоглобин – гликопротеид, синтезируется в печени. В плазме 1 г/л.
Белок острой фазы (2 группа). Связывает гемоглобин с образованием
комплекса, обладающего пероксидазной активностью, препятствует потери
железа из организма. Гаптоглобин эффективно ингибирует катепсины С, В и
L, может участвовать в утилизации некоторых патогенных бактерий.
Витамин Д связывающий белок (БСВ) (масса 70кДа). В плазме 0,4 г/л.
Обеспечивает транспорта витамина Д в плазме и предотвращает его
экскрецию с мочой.
Белок, связывающий витамин D (VDB; молекулярный вес = 51243 Да),
или Gc-глобулин - многофункциональный белок сыворотки крови,
синтезируемый в печени. Белок структурно связан с альбумином и имеет
7
8.
сравнимые размеры. Витамин D превращается в печени, а затем в почках вактивные метаболиты, перенос которых к тканевым рецепторам витамина D
осуществляется Gc-глобулином.
Церулоплазмин - главный медьсодержащий белок плазмы (содержит 95%
меди в плазмы) с массой 150кДа, синтезируется в печени. В плазме 0,35 г/л.
Т½=6 суток. Церулоплазмин обладает выраженной оксидазной активностью;
ограничивает освобождение железа, активирует окисление аскорбиновой
кислоты, норадреналина, серотонина и сульфгидрильных соединений,
инактивирует активные формы кислорода, предотвращая ПОЛ.
Церулоплазмин - белок острой фазы (3 группа). Он повышается у больных
с инфекционными заболеваниями, циррозом печени, гепатитами, инфарктом
миокарда, системными заболеваниями, лимфогранулематозом, при
злокачественных новообразованиях различной локализации (рак легкого,
молочной железы, шейки матки, желудочно-кишечного тракта).
Болезнь Вильсона – Коновалова. Недостаточность церулоплазмина
возникает при нарушении его синтеза в печени. При дефиците
церулоплазмина Cu2+ уходит из крови, выводятся с мочой или накапливается
в тканях (например, в ЦНС, роговице).
Церулоплазмин - это широко распространенный α2-сывороточный
гликопротеин, содержащий 95% меди, присутствующей в плазме
позвоночных. Церулоплазмин является медь-связывающим белком, который
в норме удаляет железо из клеток благодаря своей феррооксидазной
активности. Концентрация церулоплазмина в среднем составляет 14.6 (±4.0)
мг/дл. Низкий уровень церулоплазмина ведет к патологическому накоплению
железа в клетках, включая клетки поджелудочной железы, печени, сетчатки и
базальных ганглиев головного мозга. К заболеваниям, ассоциированным со
сниженным уровнем церулоплазмина, относят болезнь ВильсонаКоновалова, гемохроматоз, болезнь Менкеса и ацерулоплазминемию.
Антитромбин III. В плазме 0,3 г/л. Антитромбин III действует как
ингибитор свертывания крови и является важным индикатором риска
образования тромба. Сообщается о снижении уровня антитромбина III при
нарушениях функций печени у женщин, принимающих оральные
контрацептивы. Низкий уровень антитромбина III также является
наследственным аутосомным доминантным признаком
Ретинолсвязывающий белок синтезируется в печени. В плазме 0,04 г/л.
Связывает ретинол, обеспечивает его транспорт и предотвращает распад.
Функционирует в комплексе с транстиретином. Ретинол связывающий белок
фиксирует излишки витамина А, что предотвращает мембранолитическое
действие высоких доз витамина.
Ретинол-связывающий белок (RBP) – низкомолекулярный (21 кДа)
липокалин, содержащий 8 петель бета-складчатой структуры, специфически
связывающий витамин А (ВА) и являющийся транспортным белком
8
9.
витаминаA,
образующий
в
крови
комплексы
транстиретином/преальбумином, но теряющий свою аффинность
преальбумину после доставки витамина к клеткам-мишеням.
с
к
Диспротеинемия за счет α2-глобулиной фракции может возникать при
воспалении, т.к. в этой фракции содержатся белки острой фазы.
IV. β-Глобулины
ЛПОНП - образуются в печени. Транспорт ТГ, ХС.
ЛППП - образуются в крови из ЛПОНП. Транспорт ТГ, ХС.
ЛПНП – образуются в крови из ЛППП. В плазме 3,5 г/л. Транспортируют
излишки ХС из периферических органов в печень.
Трансферрин – гликопротеин, синтезируется печенью. В плазме 3 г/л.
Т½=8 суток. Главный транспортер железа в плазме, 1 молекула трансферрина
связывает 2 Fe3+, а 1г трансферрина соответственно около 1,25 мг железа.
При снижении концентрации железа синтез трансферрина возрастает. Белок
острой фазы (5 группа). Снижается при печеночной недостаточности.
Белок плазмы крови, гликопротеин - основной переносчик железа. Синтез
трансферрина осуществляется в печени и зависит от ее функционального
состояния, от потребности в железе и резервов железа в организме. При
снижении концентрации железа синтез трансферрина возрастает.
Трансферрин участвует в транспорте железа от места его всасывания (тонкая
кишка) до основных мест его использования или хранения (костный мозг,
печень, селезенка), препятствуя накоплению токсичных ионов железа в
крови.
При разрушении эритроцитов в селезѐнке, печени и костном мозге
Трансферрин транспортирует железо, высвобождаемое из гема, в костный
мозг; где часть железа депонируется, включаясь в состав ферритина и
гемосидерина. Одна молекула трансферрина связывает два иона
трехвалентного железа, а 1 г трансферрина - около 1,25 мг железа, исходя из
чего можно определить общее количество железа, которое может связать
сывороточный трансферрин. Оно приближается к величине общей
железосвязывающей способности сыворотки крови (ОЖСС). В диагностике
используют расчетную величину - % насыщения трансферрина железом
(отношение концентрации сывороточного железа к максимальной
железосвязывающей способности трансферрина сыворотки, выраженное в
процентах).
В норме процент насыщения трансферрина железом составляет около 30%,
при недостаточном поступлении железа в организм этот показатель
снижается. Избыток железа, сопровождающийся значительным увеличением
процента насыщения трансферрина железом, может вызывать патологию
печени и селезенки.
Определение уровня трансферрина используют главным образом в
дифференциальной
диагностике
железодефицитных
анемий,
9
10.
характеризующихся снижением содержания сывороточного железа, ростомуровня трансферрина и, соответственно, снижением процента насыщения
трансферрина железом. Содержание трансферрина у женщин на 10% выше,
чем у мужчин. В третьем триместре беременности концентрация
трансферрина в сыворотке крови может повыситься на 50%. Концентрация
этого белка снижается у пожилых людей. При воспалении трансферрин
проявляется как негативный белок острой фазы (его концентрация при
острофазном ответе на воспаление уменьшается).
Показания к назначению анализа:
1. Дифференциальная диагностика анемий.
2. Тяжелые инфекции, паразитарные инвазии.
3. Опухоли.
4. Подозрение на гемохроматоз.
Фибриноген гликопротеин, синтезируется в печени. Молекулярная масса
340кДа. В плазме 3 г/л. Т½=100часов. Фактор I свѐртывания крови, способен
под действием тромбина превращаться в фибрин. Является источником
фибринопептидов, обладающих противовоспалительной активностью. Белок
острой фазы (2 группа). Содержание фибриногена увеличивается при
воспалительных процессах и некрозе тканей. Снижается при ДВС синдроме,
печеночной недостаточности. Фибриноген основной белок плазмы,
влияющий на величину СОЭ (с повышением концентрации фибриногена
скорость оседания эритроцитов увеличивается).
Фибриноген (FBG) - это гомодимер с молекулярной массой 340 кДа,
состоящий из двух наборов α-, β- и γ-полипептидных цепей, синтезируется в
паренхимальных клетках гепатоцитов и в мегакариоцитах. FBG играет
основную роль в процессе свертывания крови. И повышение, и снижение его
уровня имеют клиническое значение. После расщепления тромбином на
начальной стадии активации коагуляции происходит полимеризация FBG в
фибрин. Фибрин самоорганизуется в матрикс фибриновых сгустков и затем
сшивается поперечными сшивками фактором XIIIa в нерастворимую сеть
волокон фибрина,. FBG также связывается с гликопротеиновым рецептором
IIbIIIa тромбоцитов, таким образом, образуя мостики между тромбоцитами,
что облегчает их агрегацию. Показано, что повышенный уровень FBG в
плазме является независимым фактором риска развития атеросклероза и
ИБС. У лиц с наследственным отсутствием FBG - афибриногенемией время
кровотечения увеличено.
С-реактивный белок синтезируется преимущественно в гепатоцитах, его
синтез инициируется антигенами, иммунными комплексами, бактериями,
грибами, при травме (через 4-6 ч после повреждения). Может
синтезироваться эндотелиоцитами артерий. В плазме <0,01 г/л. Белок острой
фазы (1 группа). Способен связывать микроорганизмы, токсины, частицы
поврежденных тканей, препятствуя тем самым их распространению. Эти
10
11.
комплексы активируют комплемент по классическому пути, стимулируяпроцессы фагоцитоза и элиминации вредных продуктов. С-реактивный белок
может взаимодействовать с Т-лимфоцитами, фагоцитами и тромбоцитами,
регулируя их функции в условиях воспаления. Обладает антигепариновой
активностью, при повышении концентрации ингибирует агрегацию
тромбоцитов. СРБ - это маркер скорости прогрессирования атеросклероза.
Определяют для диагностики миокардитов, воспалительных заболеваний
клапанов сердца, воспалительные заболевания различных органов.
Диспротеинемия за счет β-глобулиной фракции может возникать при 1).
некоторых дислипопротеинемиях; 2). воспалении, т.к. в этой фракции
содержатся белки острой фазы; 3). При нарушении свертывающей системы
крови.
V. γ-Глобулины
Синтезируются
функционально
активными
В-лимфоцитами
7
(плазмоцитами). У взрослого человека 10 клонов В-лимфоцитов которые
синтезируют 107 видов γ-глобулинов. γ-Глобулины гликопротеины, состоят 2
тяжелых (440 АК) и 2 легких (220 АК) полипептидных цепей различной
конфигурации, которые соединяются между собой дисульфидными
мостиками. Антитела гетерогенны, отдельные составные части полипептидов
кодируются разными генами, с различной способностью к мутированию.
Все γ-глобулины разделены на 5 классов G,A,M,D,E. В каждом классе
выделяют несколько подклассов.
Все иммуноглобулины характеризуются общим планом строения,
который мы рассмотрим на примере строения IgG.
Молекула IgG состоит из четырѐх полипептидных цепей: двух
идентичных лѐгких (L - от англ, light), содержащих около 220
аминокислотных остатков, и двух тяжѐлых (Н - от англ. heavy), состоящих из
440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством
нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG
относят к мономерам.
Лѐгкие цепи IgG состоят из 2 доменов: вариабельного (VL),
находящегося в N-концевой области полипептидной цепи, и константного
(CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с βскладчатой структурой, где участки полипептидной цепи лежат
антипараллельно. β-Слои связаны ковалентно дисульфидной связью
примерно в середине домена (рис. 1-45).
Тяжѐлые цепи IgG имеют 4 домена: один вариабельный (VH),
находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены
тяжѐлых цепей IgG имеют гомологичное строение с доменами лѐгких цепей.
Между двумя константными доменами тяжѐлых цепей СH1, и СН2 есть
участок, содержащий большое количество остатков пролина, которые
препятствуют формированию вторичной структуры и взаимодействию
соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной
областью"; он придаѐт молекуле гибкость.
11
12.
Между вариабельными доменами тяжѐлых и лѐгких цепей находятся дваидентичных участка, связывающих два одинаковых специфических антигена;
поэтому такие антитела часто называют "биваленты". В связывании
антигена с антителом участвует не вся аминокислотная последовательность
вариабельных доменов обеих цепей, а всего лишь 20-30 аминокислот,
расположенных в гипервариабельных областях каждой цепи. Именно эти
области определяют уникальные способности каждого клона антител
взаимодействовать с соответствующим (комплементарным) антигеном.
Основные функции антител - обнаружение и связывание чужеродных
антигенов, находящихся в организме вне его клеток (в крови, лимфе,
межклеточной жидкости, в слизистых секретах). Это происходит с помощью
специфических
антигенсвязывающих
участков
разных
клонов
иммуноглобулинов. Кроме, того, благодаря связыванию антигена с
антителом облегчается процесс дальнейшего разрушения чужеродных
веществ. Специфичность пути разрушения комплекса антиген-антитело
зависит от класса антител.
Классы иммуноглобулинов. Существует 5 классов тяжѐлых цепей
иммуноглобулинов, отличающихся по строению константных доменов: α, δ,
ξ, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A,
D, Е, G и М. Особенности строения тяжѐлых цепей придают их "шарнирным
участкам" и С-концевым областям характерную для каждого класса
конформацию. Связывание антигена с антителом изменяет конформацию
константных доменов тяжѐлых цепей, что определяет путь разрушения
комплекса в организме (связывание с белками системы комплемента или
поглощение комплекса фагоцитирующими клетками).
Иммуноглобулины М - первый класс антител, синтезирующийся в
развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М:
мономерная, мембранно-связанная форма и пентамерная, секретируемая Влимфоцитами в кровь.
Мембранно-с вязанная форма иммуноглобулинов М . Созревающие
В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по
12
13.
структуре похожие на рассматриваемые выше IgG, которые встраиваются вплазматическую мембрану клеток и играют роль первых антигенраспознающих рецепторов. Прикрепление IgM к мембране осуществляется с
помощью гидрофобного участка, находящегося в С-концевой ("хвостовой")
области тяжѐлых цепей, содержащей 25 гидрофобных аминокислотных
остатков.
Взаимодействие антигена с рецептором на поверхности В-лимфоцита
вызывает его размножение и образование целого клона лимфоцитов,
происходящих из одной, стимулированной антигеном клетки. Этот клон Влимфоцитов будет вырабатывать иммуноглобулины с одинаковыми
антигенсвязывающими участками. Однако В-лимфоциты способны
переключаться на выработку других классов антител.
Секреторная форма иммуноглобулинов М. Когда В-лимфоциты
впервые встречаются в жидкостях организма с неизвестным ранее антигеном,
они синтезируют и секретируют в кровь IgM, которые содержат пять
мономерных субъединиц, связанных друг с другом дисульфидными связями
и дополнительной полипептидной J-цепью.
В тяжѐлых цепях их мономеров отсутствует гидрофобная "хвостовая"
часть. Пентамерная молекула содержит 10 участков связывания с антигеном,
что облегчает вероятность прикрепления Неизвестного ранее антигена к
иммуноглобулину.
Взаимодействие антигена с IgM изменяет его конформацию и
индуцирует связывание его "хвостовой" области с первым компонентом
системы комплемента. Если антиген расположен на поверхности
микроорганизма, активирование системы комплемента вызывает нарушение
целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G. В количественном отношении IgG доминируют в
крови и составляют около 75% от общего количества этих белков. Строение
IgG подробно описано выше. В крови IgG обнаруживают только в
мономерной форме; он секретируется активированными В-лимфоцитами в
больших количествах при вторичном иммунном ответе, когда антиген
повторно попадает в организм.
У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4.
Порядковый номер указывает на количественное содержание каждого
подкласса в сыворотке (в наибольшем количестве содержится IgGg1 а в
наименьшем - IgGg4). Степень гомологии между этими подклассами очень
высока (около 90-95%).
IgG не только эффективно связывают и инактивируют чужеродные
молекулы и клетки, попавшие в организм, но также облегчают их
дальнейшее уничтожение. Конформационные изменения в "хвостовой"
области IgG после его взаимодействия с антигеном приводят к связыванию и
активации белков системы комплемента. Кроме того, С-концевая область IgG
способна взаимодействовать со специфическими рецепторами макрофагов и
13
14.
нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело иразрушению их в фагосомах.
IgG - единственный класс антител, способный проникать через плацентарный
барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А. Основной класс антител, присутствующий в
секретах желѐз организма (слюны, молока, пищеварительного сока, секретов
дыхательных путей). В сыворотке крови его содержание не превышает 1015% от общего количества иммуноглобулинов. Мономерная форма по
строению напоминает IgG. Однако в секретах IgA находится в основном в
форме димера, где мономеры соединены дополнительной пептидной цепью J.
На базальной поверхности эпителиальных клеток димер IgA
специфически взаимодействует с белками клеточной поверхности,
называемыми секреторным компонентом. Образующийся комплекс
посредством эндоцитоза поглощается внутрь клетки и перемещается к
апикальной части. Здесь комплекс подвергается действию протеолитических
ферментов, и свободный димер высвобождается во внеклеточное
пространство.
Образующийся при взаимодействии IgA с антигеном комплекс не
взаимодействует с белками системы комплемента и фагоцитирующими
клетками, но препятствует прикреплению антигенов к поверхности
эпителиальных клеток и проникновению их в организм.
Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в
крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжѐлые цепи е
содержат не 3, а 4 константных домена. После синтеза и секреции в кровь Влимфоцитами IgE связываются своими С-концевыми участками с
соответствующими рецепторами на поверхности тучных клеток и базофилов.
В результате они становятся рецепторами антигенов на поверхности данных
клеток.
После присоединения антигена хотя бы к двум антигенсвязывающим
участкам двух соседних IgE клетка получает сигнал к секреции биологически
активных веществ (серотонина, гистамина), хранящихся в секреторных
пузырьках. Выброс этих веществ в значительной мере ответственен за
развитие воспалительной реакции, а также таких аллергических реакций, как
бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества
IgE может предшествовать развитию аллергических реакций.
14
15.
Иммуноглобулины D. IgD обнаружены в крови в очень малыхколичествах. Мономерные белки играют роль рецепторов В-лимфоцитов;
других функций у IgD пока не выявлено.
Диспротеинемия за счет γ-глобулиной фракции может возникать при 1).
Иммунодефицитом состоянии; 3). Инфекционных процессах. 2).
Нефротическом синдроме.
Белки острой фазы воспаления
Понятие "белки острой фазы" объединяет до 30 белков плазмы крови,
участвующих в реакции воспалительного ответа организма на повреждение.
Белки острой фазы синтезируются в печени, их концентрация существенно
изменяется и зависит от стадии, течения заболевания и массивности
повреждения.
Синтез белков острой фазы воспаления в печени стимулируют: 1). ИЛ-6,
2); ИЛ-1 и сходные с ним по действию (ИЛ-1 а, ИЛ-1Р, факторы некроза
опухолей ФНО-ОС и ФНО-Р); 3). Глюкокортикоиды; 4). Факторы роста
(инсулин, факторы роста гепатоцитов, фибробластов, тромбоцитов).
Выделяют 5 групп белков острой фазы
1. К «главным» белкам острой фазы у человека относят С-реактивный
белок (СРВ) и амилоидный А белок сыворотки крови. Уровень этих белков
возрастает при повреждении очень быстро (в первые 6-8 часов) и
значительно (в 20-100 раз, в отдельных случаях - в 1000 раз).
2. Белки, концентрация которых при воспалении может увеличиваться в 25 раз в течение 24 часов. Это кислый α1-гликопротеид, α1-антитрипсин,
фибриноген, гаптоглобин.
3. Белки, концентрация которых при воспалении или не изменяется или
повышается незначительно (на 20-60% от исходного). Это церулоплазмин,
С3-компонент комплемента.
4. Белки, участвующие в острой фазе воспаления, концентрация которых,
как правило, остается в пределах нормы. Это α1-макроглобулин, гемопексин,
амилоидный Р белок сыворотки крови, иммуноглобулины.
5. Белки, концентрация которых при воспалении может снижаться на 3060%. Это альбумин, трансферрин, ЛПВП, преальбумин. Уменьшение
концентрации отдельных белков в острой фазе воспаления может быть
обусловлено снижением синтеза, увеличением потребления, либо
изменением их распределения в организме.
Целый ряд белков острой фазы обладает антипротеазной активностью. Это
α1-антитрипсин, антихимотрипсин, α2-макроглобулин. Их важная функция
состоит
в
ингибировании
активности
эластазоподобных
и
химотрипсиноподобных протеиназ, поступающих из гранулоцитов в
воспалительные экссудаты и вызывающих вторичное повреждение тканей.
Снижение уровней ингибиторов протеиназ при септическом шоке или
остром панкреатите является плохим прогностическим признаком.
15
16.
Парапротеинемия – появление в плазме крови нехарактерных белков.Например, во фракции α-глобулинов может появиться α-фетоглобулин,
карциноэмбриональный антиген.
α-Фетоглобулин — один из фетальных антигенов, которые циркулируют
в крови примерно у 70% больных с первичной гепатомой. Этот антиген
выявляется также у пациентов с раком желудка, предстательной железы и
примитивными опухолями яичка.
Карциноэмбриональный антиген (КЭА) — гликопротеид, опухолевый
антиген, характерный в норме для кишечника, печени и поджелудочной
железы плода. Антиген появляется при аденокарциномах органов ЖКТ и
поджелудочной железы, в саркомах и лимфомах, также обнаруживается при
целом ряде неопухолевых состояний: при алкогольном циррозе печени,
панкреатите, холецистите, дивертикулите и язвенном колите.
Фракция
Конц
Функция
г/л
альбумины Транстиретин
0,25 Транспорт
тироксина
и
трийодтиронина
40
Поддержание
осмотического
Альбумин
давления, транспорт жирных кислот,
билирубина,
жѐлчных
кислот,
стероидных гормонов, лекарств,
неорганических
ионов,
резерв
аминокислот
α1α1-антитрипсин
2,5
Ингибитор протеиназ
глобулины Кислый
α1 - 1
Транспорт прогестерона
гликопротеин
Протромбин
0,1
Фактор II свѐртывания крови
Транскортин
0,03 Транспорт
кортизола,
кортикостерона, прогестерона
α2глобулины
Белки
Тироксинсвязыва 0,02
ющий глобулин
Церулоплазмин
0,35
Антитромбин III
Гаптоглобин
α2Макроглобулин
Ретинолсвязыва
ющий белок
Витамин
Д
связывающий
белок
0,04
Транспорт
тироксина
и
трийодтиронина
Транспорт
ионов
меди,
оксидоредуктаза
Ингибитор плазменных протеаз
Связывание гемоглобина
Ингибитор
плазменных
протеиназ, транспорт цинка
Транспорт ретинола
0,4
Транспорт кальциферола
0,3
1
2,6
16
17.
βЛПНПглобулины Трансферрин
Фибриноген
Транскобаламин
Глобулин
связывающий
белок
С-реактивный
белок
γIgG
глобулины IgA
IgM
IgD
IgE
3,5
3
3
25*1
0-9
20*1
0-6
Транспорт холестерола
Транспорт ионов железа
Фактор I свѐртывания крови
Транспорт витамина В12
Транспорт тестостерона и эстрадиола
<0,01 Активация комплемента
Поздние антитела
Антитела,
защищающие
слизистые оболочки
1,3
Ранние антитела
0,03 Рецепторы В-лимфоцитов
<0,01 Реагин
12
3,5
ФЕРМЕНТЫ ПЛАЗМЫ КРОВИ
Ферменты, находящиеся в плазме крови, можно разделить на 3 основные
группы:
1. Секреторные. Они синтезируются в печени, эндотелии
кишечника, сосудов поступают в кровь, где выполняют свои
функции.
Например,
ферменты
свертывающей
и
противосвертывающей системы крови (тромбин, плазмин),
ферменты обмена липопротеинов (ЛХАТ, ЛПЛ).
2. Тканевые. Ферменты клеток органов и тканей. Они
попадают в кровь при увеличении проницаемости клеточных
стенок или при гибели клеток тканей. В норме их содержание в
крови очень низкое. Некоторые тканевые ферменты имеют
диагностическое значение, т.к. по ним можно определить
пораженный орган или ткань, по этому их еще называют
индикаторными. Например, ферменты ЛДГ с 5 изоформами,
креатинкиназа с 3 изоформами, АСТ, АЛТ, кислая и щелочная
фосфатаза и т.д.
3. Экскреторные. Ферменты, синтезируемые железами ЖКТ
(печень, поджелудочная железа, слюнные железы) в просвет ЖК
тракта и участвующие в пищеварении. В крови эти ферменты
появляются при повреждении соответствующих желез. Например,
при панкреатите в крови обнаруживают липазу, амилазу, трипсин,
при воспалении слюнных желез – амилазу, при холестазе –
щелочную фосфатазу (из печени).
17
18.
4. Свободная и связанная форма лекарственного вещества.В крови часть лекарственного вещества циркулирует в свободной форме.
Именно свободная фракция лекарственного вещества, которая растворена в
водной фазе плазмы, способна проникать через сосудистую стенку в ткани.
Часть лекарственного вещества вступает в обратимую связь с белками (в
основном с альбуминами, реже - с глобулинами), образуя комплекс, который
не проникает через сосудистые и тканевые мембраны и не участвует в
фармакологическом эффекте. От связи лекарственных веществ с белками
крови зависит сила и продолжительность их действия, а также быстрота
выведения из организма. Процент связывания лекарственных веществ
белками плазмы крови широко варьирует. Например, диазепам связывается
белками плазмы крови на 97-98%. Некоторые же лекарственные вещества,
такие как аллопуринол, -метилдофа, канамицин вообще не связываются
белками плазмы.
В крови, а в последующем в межклеточной жидкости, лимфе, спинномозговой жидкости имеет место частичная биотрансформация лекарственных
веществ под влиянием протеиназ, эстераз (например, псевдохолинэстеразы и
др.), алькогольдегидрогеназы, аминооксидаз и др.
Свободная форма вещества фармакологически активна и потому факторы,
вызывающие быстрый переход связанной формы в свободную, могут
приводить к интоксикации этим веществом. Так, нестероидные
противовоспалительные
средства
бутадион,
салицилаты
и
низкомолекулярные антидиабетические вещества (бутамид), вытесняя
антикоагулянты непрямого действия из связи с белками плазмы,
увеличивают концентрацию их свободной фракции, а, следовательно, и
эффект, вплоть до возникновения геморрагии.
в первую очередь лекарство достигает органов и тканей с хорошей
васкуляризацией (печень, легкие, почки, сердце, мозг). При этом часть
лекарств может преодолевать гемато-энцефалический, плацентарный и др.
тканевые барьеры, препятствующие проникновению лекарств в ткани (мозг,
плод).
Связанная форма вещества - это своеобразное депо препарата в крови, из
которого вещество постепенно освобождается и переходит в свободную
фракцию. Значительное связывание лекарственных веществ с белками крови
может привести к снижению скорости их метаболизма или к уменьшению
скорости выделения метаболитов почками.
Депонирование лекарственных веществ может происходить в липидах (для
жирорастворимых веществ), а также путем связывания с нуклеиновыми
кислотами и белками.
18
19.
5. Особенности обмена в эритроцитах и лейкоцитах.Эритроциты (erythrosytus) это форменные элементы крови, они
образуются в костном мозге, циркулируют в крови около 120 дней, а потом
разрушаются макрофагами в печени, селезѐнке и костном мозге. В сутки
обновляется 1% эритроцитов, т.е. в течение одной секунды в кровоток
поступает около 2 млн. эритроцитов.
Организм взрослого человека содержит около 25*1012 эритроцитов.
Концентрация эритроцитов у мужчины составляет 3,9*10 12 - 5,5*1012 /л, у
женщины - 3,7*1012 - 4,9*1012/л. Более высокое содержание эритроцитов у
мужчин обусловлено стимулирующим эритропоэз влиянием андрогенов.
Женские половые гормоны, наоборот тормозят эритропоэз.
ФУНКЦИИ ЭРИТРОЦИТОВ
Основными функциями эритроцитов, которые реализуются с участием
гемоглобина, являются транспорт от легких к тканям О2 и обратно СО2, а
также регуляция КОС.
Кроме того эритроциты адсорбируют и транспортируют на своей
клеточной мембране аминокислоты, антитела, токсины, лекарственных
веществ и другие вещества.
СТРОЕНИЕ ЭРИТРОЦИТОВ
Эритроциты у человека и млекопитающих в токе крови обычно (80%)
имеют форму двояковогнутых дисков и называются дискоцитами. Такая
форма эритроцитов создаѐт наибольшую площадь поверхности по
отношению к объѐму, что обеспечивает максимальный газообмен, а также
обеспечивает большую пластичность при прохождении эритроцитами
мелких капилляров.
Диаметр эритроцитов у человека колеблется от 7,1 до 7,9 мкм, толщина
эритроцитов в краевой зоне - 1,9 - 2,5 мкм, в центре - 1 мкм. В нормальной
крови указанные размеры имеют 75% всех эритроцитов - нормоциты;
большие размеры (свыше 8,0 мкм) - 12,5 % - макроциты. У остальных
эритроцитов диаметр может быть 6 мкм и меньше - микроциты.
Поверхность отдельного эритроцита у человека приблизительно равна 125
мкм2, а объѐм (MCV) – 75-96 мкм3.
Эритроциты человека и млекопитающих представляют собой безъядерные
клетки, утратившие в процессе фило- и онтогенеза ядро и большинство
органелл, они имеют только цитоплазму и плазмолемму (клеточную
мембрану), толщиной около 20 нм.
ХИМИЧЕСКИЙ СОСТАВ ЭРИТРОЦИТОВ
1. Плазмолемма эритроцитов
Плазмолемма эритроцитов состоит из примерно равного количества
липидов и белков, а также небольшого количества углеводов.
Липиды
Бислой
плазмолеммы
образован
глицерофосфолипидами,
сфингофосфолипидами, гликолипидами и холестерином. Внешний слой
19
20.
содержит много фосфатидилхолина, сфингомиелина и около 5% (от общегоколичества липидов) гликолипидов, внутренний - много фосфатидилсерина
и фосфатидилэтаноламина.
Белки
В плазмолемме эритроцита идентифицировано 15 главных белков с
молекулярной массой 15-250 кДа. Большинство этих белков (спектрин,
гликофорин, белок полосы 3, белок полосы 4.1, актин, анкирин) образуют с
цитоплазматической стороны плазмалеммы цитоскелет, который придает
эритроциту двояковогнутую форму и высокую механическую прочность.
Самыми распространенными белками плазмолеммы (более 60% всех
мембранных белков) являются спектрин, гликофорин и белок полосы 3.
Спектрин - основной белок цитоскелета эритроцитов (составляет 25%
массы всех мембранных и примембранных белков), имеет вид фибриллы 100
нм, состоящей из двух антипаралельно перекрученных друг с другом цепей
α-спектрина (240 кДа) и β-спектрина (220 кДа). Молекулы спектрина
образуют сеть, которая фиксируется на цитоплазматической стороне
плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка
полосы 4.1 и гликофорина.
Белок полосы 3 - трансмембранный гликопротеид (100 кДа), его
полипептидная цепь которого много раз пересекает бислой липидов. Белок
полосы 3 является компонентом цитоскелета и анионным каналом, который
обеспечивает трансмембранный антипорт для ионов НСО3- и Сl-.
20
21.
Гликофорин - трансмембранный гликопротеин (30 кДа), которыйпронизывает плазмолемму в виде одиночной спирали.
С наружной
поверхности эритроцита к нему присоединены 20 цепей олигосахаридов,
которые несут отрицательные заряды. Гликофорины формируют цитоскелет
и, через олигосахариды, выполняют рецепторные функции.
Na+,K+-АТФ-аза мембранный фермент, обеспечивает поддержание
градиента концентраций Na+ и К+ по обе стороны мембраны. При снижении
активности Na+K+-АТФ-азы концентрация Na+ в клетке повышается, что
приводит к увеличению осмотического давления, увеличению поступления
воды в эритроцит и к его гибели в результате гемолиза.
Са2+-АТФ-аза — мембранный фермент, осуществляющий выведение из
эритроцитов ионов кальция и поддерживающий градиент концентрации
этого иона по обе стороны мембраны.
Углеводы
Олигосахариды (сиаловая кислота и антигенные олигосахариды)
гликолипидов и гликопротеидов, расположенные на наружной поверхности
плазмолеммы, образуют гликокаликс.
Олигосахариды
гликофорина
определяют
антигенные
свойства
эритроцитов. Они являются агглютиногенами (А и В) и обеспечивают
агглютинацию (склеивание) эритроцитов под влиянием соответствующих
белков плазмы крови – - и -агглютининов, находящихся в составе фракции
-глобулинов. Агглютиногены появляются на мембране на ранних стадиях
развития эритроцита.
На поверхности эритроцитов имеется также агглютиноген - резус-фактор
(Rh-фактор). Он присутствует у 86% людей, у 14% отсутствует. Переливание
резус-положительной крови резус-отрицательному пациенту вызывает
образование резус-антител и гемолиз эритроцитов.
2. Цитоплазма эритроцитов
В цитоплазме эритроцитах содержится около 60% воды и 40% сухого
остатка. 95% сухого остатка составляет гемоглобин, он образует
многочисленные гранулы размером 4-5нм. Оставшиеся 5% сухого остатка
приходятся на органические (глюкоза, промежуточные продукты ее
катаболизма) и неорганические вещества. Из ферментов в цитоплазме
эритроцитов присутствуют ферменты гликолиза, ПФШ, антиоксидантной
защиты и метгемоглобинредуктазной системы, карбоангидраза.
ОСОБЕННОСТЬ
ОБМЕНА
ВЕЩЕСТВ
И
ЭНЕРГИИ
В
ЭРИТРОЦИТЕ
Эритроцит высокоспециализированная клетка, хорошо приспособленная
для транспорта газов. Для эритроцита не характерны анаболические
процессы. Необходимые структурные молекулы и ферменты синтезируются
заранее в процессе дифференцировки и созревания эритроцитов.
21
22.
1. Особенность белкового обмена в эритроцитахВ зрелом эритроците белки не синтезируются, т.к. у него нет рибосом,
ЭПР, аппарата Гольджи и ядра. Однако в цитоплазме синтезируется пептид
глутатион.
Биосинтез глутатиона осуществляется в 2 стадии:
1). АТФ + глутаминовая кислота + цистеин γ глутамилцистеин + АДФ
+ Фн
2). АТФ + γ глутамилцистеин + глицин глутатион + АДФ + Фн
Первая стадия катализируется γ глутамилцистеинсинтетазой, вторая
стадия – глутатионсинтетазой.
Катаболизм белков в эритроците неферментативный. Белки разрушаются и
инактивируются в эритроците под действием неблагоприятных факторов:
СРО, гликозилирования, взаимодействия с тяжелыми металлами и
токсинами.
2. Особенность обмена нуклеотидов в эритроцитах
В зрелом эритроците:
1. из ФРПФ (из рибозо-5ф) и аденина может синтезироваться АМФ.
2. АМФ с участием АТФ превращается в АДФ.
3. В реакциях субстратного фосфорилирования (гликолиз) АДФ
превращается в АТФ.
4. В гликолизе НАД+ восстанавливается в НАДН2, который
используется для регенерации гемоглобина из метгемоглобина.
5. В ПФШ НАДФ+ восстанавливается в НАДФН2, который
используется для функционирования антиоксидантной системы.
3. Особенность липидного обмена в эритроцитах
В зрелом эритроците липиды не синтезируются, однако эритроцит может
обмениваться липидами с липопротеинами крови. Катаболизм липидов
неферментативный, повреждение и разрушение липидов происходит в
реакция ПОЛ.
4. Особенность углеводного обмена в эритроцитах
В зрелых эритроцитах углеводы не синтезируются, а только используются.
Основным субстратом для эритроцитов является глюкоза, которая поступает
в клетку путѐм облегчѐнной диффузии с помощью ГЛЮТ-2. Также
эритроцит может использовать фруктозу, маннозу, галактозу, а также инозин,
ксилит и сорбит.
А. Анаэрбный гликолиз
Катаболизм углеводов в эритроцитах на 70-90% происходит в анаэробном
гликолизе, где с участием фосфоглицераткиназы и пируваткиназы
образуется АТФ, а с участием 3-ФГА дегидрогеназы восстанавливается
НАДН2. Конечный продукт лактат выходит в плазму крови и направляется
преимущественно в печень для глюконеогенеза.
Б. ПФШ
22
23.
10% углеводов в эритроцитах подвергаются катаболизму в ПФШ. В егоокислительной стадии с участием глюкозо-6-фосфат дегидрогеназы и 6фосфоглюконат дегидрогеназы восстанавливается НАДФН2.
В. 2,3–дифосфоглицератный шунт
Кроме традиционного ПФШ, у гликолиза эритроцитов многих
млекопитающих есть свой специфический шунт - 2,3–дифосфоглицератный.
В эритроцитах присутствует дифосфоглицератмутаза, которая активируется
дефицитом кислорода и катализирует превращение 1,3–ФГК в 2,3–ФГК в
обход фосфоглицераткиназной реакции гликолиза. В условиях гипоксии до
20% глюкозы идет по этому пути. Образующаяся 2,3–ФГК уменьшает
сродство гемоглобина к кислороду, что способствует переходу кислорода из
гемоглобина в ткани.
Далее 2,3–ФГК под действием 2,3–дифосфоглицератфосфатазы (принято
считать, что этой активностью обладает фосфоглицератмутаза) превращается
в 3–ФГК, которая возвращается в реакции гликолиза.
При 2,3–дифосфоглицератном шунте в гликолизе не синтезируется АТФ, а
свободная энергия 1,3–ФГК, рассеивается в форме теплоты. В этом может
заключаться определѐнное преимущество, поскольку даже в тех случаях,
когда потребности в АТФ минимальны, гликолиз может продолжаться.
АНТИОКСИДАНТНАЯ СИСТЕМА
глюкозо-6ф
ПФШ
рибулозо-5ф
ГЛИКОЛИЗ
глюкозо-6ф
ТРАНСПОРТНЫЕ СИСТЕМЫ
Глутатион- Глутатионредуктаза
пероксидаза
ДГ
глюкоза
+
НАДФ
2GSH
Н2О2
НАДФН2
GS-SG
2Н2О
ДГ
НАДН2
1,3-ФГК
киназа
АТФ
АДФ
О2 + Н2О
3-ФГА МЕТГЕМОГЛОБИНРЕДУКТАЗНАЯ СИСТЕМА
О2
НАД+
Hb(Fe2+)
MetHb(Fe3+)
дифосфоглицератмутаза
2,3-ФГК
ШУНТ
3-ФГК
СОД
О*2
Тельца Хайнца
АДФ
каталаза
2Н+
Н2О2
О2
HbO2
2,3-ФГК
Н2О
O2
Hb
Фн 2,3-дифосфоглицератфосфатаза
киназа
АТФ
лактат
5. Энергетический обмен в эритроцитах
23
24.
Образующаяся в анаэробном гликолизе АТФ используется дляфункционирования транспортных АТФаз, работы цитоскелета и синтеза
некоторых веществ. За 1 час все эритроциты крови потребляют 0,7г глюкозы.
Генетический дефект любого фермента гликолиза приводит к уменьшению
образования АТФ, в результате падает активность Na+,К+-АТФ-азы,
повышается осмотическое давление, может возникнуть осмотический шок и
гемолиз.
Для оценки эффективности работы транспортных систем определяют
осмотическую резистентность эритроцитов. Осмотическая резистентность
эритроцитов в свежей крови в норме составляет 0,20-0,40% NaCl.
6. Обезвреживание активных форм кислорода в эритроцитах
Высокое содержание О2 в эритроцитах является причиной образования
большого количества его активных форм. Постоянным источником активных
форм кислорода в эритроцитах является неферментативное окисление
гемоглобина в метгемоглобин: 1). b Fe2+ et b Fe3+ e2). e- + 2
→ О∙2
Также СРО в эритроците стимулируют различные окислители - нитраты,
сульфаниламиды, противомалярийное лекарство примахин.
Образующиеся активные формы кислорода запускают реакции СРО,
которые приводят к разрушению липидов, белков, углеводов и др.
органических молекул, являются причиной старения и гибели эритроцита.
Для сдерживания СРО в эритроците функционирует ферментативная
антиоксидантная система. Для ее работы необходим глутатион и НАДФН2.
Супероксиддисмутаза (Cu2+ и Zn2+) превращает супероксидные анионы в
перекись водорода: 2О∙2 + 2H+ → H2O2+ O2
Каталаза - геминовый фермент, разрушает перекись водорода до воды и
кислорода: 2Н2О2 → H2O+ O2
Глутатионпероксидаза (селен) при окислении глутатиона разрушает
перекись водорода и гидроперекиси липидов до воды:
Н2О2 + 2 GSH → 2 Н2О + G-S-S-G.
Глутатионредуктаза восстанавливает окисленный глутатион с участием
НАДФН2:
GS-SG + НАДФН2 → 2 GSH + НАДФ+.
Недостаток в эритроцитах восстановленного глутатиона и НАДФН2
приводит к снижению АОА, активации ПОЛ и может стать причиной
гемолитической анемии. Различные окислители - нитраты, сульфаниламиды,
противомалярийное лекарство примахин, усиливают гемолиз эритроцитов.
Дефицит восстановленного глутатиона может быть обусловлен действием
токсических веществ, например ионами тяжелых металлов или
наследственным недостатком глутатионредуктазы.
Дефицит НАДФН2 возникает при наследственной недостаточности
(аутосомно-рецессивный тип) первого фермента ПФШ глюкозо–6–
фосфатдегидрогеназы. Не менее 100 млн человек являются носителями
около 3000 генетических дефектов глюкозо-6-фосфатдегидрогеназы.
24
25.
Для оценки эффективности работы антиоксидантных систем определяютперекисную резистентность эритроцитов.
7. Обмен метгемоглобина
В течение суток до 3% гемоглобина может спонтанно окисляться в
метгемоглобин:
b Fe2+ et b Fe3+ eВосстановление
метгемоглобина
до
гемоглобина
осуществляет
метгемоглобинредуктазная система. Она состоит из цитохрома b5 и
цитохром b5 редуктазы (флавопротеин), донором водорода служит НАДН2,
образующийся в гликолизе.
1). Цитохром b5 восстанавливает Fe3+ метгемоглобина в Fe2+ гемоглобина:
MetHb(Fe3+) + цит b5 восст → Hb(Fe2+) + цит b5 окисл
2). Окисленный Цитохром b5 восстанавливается цитохром b5 редуктазой:
цит b5 окисл + НАДН2 → цит b5 восст + НАД+
Восстановление
метгемоглобина
может
осуществляться
также
неферментативным путѐм, например, за счѐт витамина В12, аскорбиновой
кислоты или глутатиона.
У здорового человека концентрация метгемоглобина в крови не превышает
1%.
Генетический дефект ферментов гликолиза и метгемоглобинредуктазной
системы приводит к накоплению метгемоглобина и увеличению образования
активных форм кислорода. Активные формы кислорода вызывают
образование дисульфидных мостиков между протомерами метгемоглобина,
что приводит к их агрегации с образованием телец Хайнца. Последние
способствуют разрушению эритроцитов при попадании их в мелкие
капилляры. Накопление метгемоглобина в крови из-за нарушения транспорта
кислорода ведет к гипоксии.
СТРОЕНИЕ ГЕМА
Гем - это порфирин, в центре которого находиться
2+
Fe . Fe2+ включается в молекулу порфирина с помощью
2 ковалентных и 2 координационных связей.
В зависимости от заместителей различают несколько
типов порфиринов: протопорфирины, этиопорфирины,
мезопорфирины и копропорфирины.
В основе порфиринов находится порфин, который
представляет собой конденсированную систему из 4
пирролов, соединенных между собой метиленовыми
мостиками (-СН=).
Молекула гема имеет плоское строение. При
окислении железа, гем превращается в гематин (Fe3+).
CH3
HC
CH2
CH2
HC
CH3
N
N
Fe2+
N
N
H3C
CH3
CH2
CH2
CH2
CH2
COOH
COOH
ИСПОЛЬЗОВАНИЕ ГЕМА
25
26.
Гем является простатической группой многих белков: гемоглобина,миоглобина, цитохромов митохондриальной ЦПЭ, цитохрома Р450,
ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы.
Наибольшее количество гема содержат эритроциты, заполненные
гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени,
содержащие цитохром Р450.
Гемы разных белков могут содержать разные типы порфиринов. В геме
гемоглобина находится протопорфирин IX, в состав цитохромоксидазы
входит формилпорфирин и т.д.
СИНТЕЗ ГЕМА
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном
мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в
гепатоцитах — для образования цитохрома Р450.
1). Аминолевулинат-синтаза, пиридоксальзависимый фермент, в
матриксе митохондрий катализирует образование 5-аминолевулиновой
кислоты (5-АЛК) из глицина и суцинил-КоА. Суцинил-КоА поступает из
ЦТК. Реакцию ингибирует и репрессирует гем. В ретикулоцитах реакцию
индуцирует
железо
(через
железосвязывающий
белок
и
железочувствительный элемент (IRE)). Дефицит пиридоксальфосфата
снижает активность аминолевулинатсинтазы. Стероидные гормоны и
некоторые лекарства (барбитураты, диклофенак, сульфаниламиды),
инсектициды,
канцерогенные
вещества
являются
индукторами
аминолевулинатсинтазы. Это связано с возрастанием потребления гема
системой цитохрома Р450, который участвует в метаболизме этих соединений
в печени.
COOH
COOH
NH2
CH2
+
CH2
C
O
SKoA
Сукцинил-КоА
CH2
HSKoA CO2
CH2
CH2
5-Аминолевулинатсинтаза
C
O
COOH
В6
Глицин
H2C
гем
железо
NH
2
5-Аминолевулиновая кислота
5-АЛК
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму.
2).
Порфобилиноген-синтаза
(Аминолевулинатдегидратаза)
цитоплазматический Zn-содержащий фермент, соединяет 2 молекулы 5аминолевулиновой кислоты в молекулу порфобилиногена. Реакцию
ингибирует гем и ионы свинца. Поэтому, при отравлении свинцом в крови и
моче повышается концентрация 5-АЛК.
26
27.
COOHH2N
COOH
CH2
CH2
CH2
CH2
H2
C C
O
+
O
C
CH2
COOH
CH2
HOOC
2Н2О
CH2
CH2
5-Аминолевулинатдегидратаза
H2N
5-Аминолевулиновая 5-Аминолевулиновая
кислота (5-АЛК)
кислота (5-АЛК)
гем
H2N
C
H2
N
H
порфобилиноген
3). Порфобилиногендезаминаза в цитоплазме дезаминирует (-4NH4+) 4
молекулы порфобилиногена в молекулу гидроксиметилбилана.
4). Уропорфириноген III косинтаза в цитоплазме дегидрирует
гидроксиметилбилан
в
молекулу
уропорфириногена
III.
Гидроксиметилбилан может также неферментативно превращаться в
уропорфириноген I, который декарбоксилируется в копропорфириноген I.
5). Уропорфириногендекарбоксилаза декарбоксилирует (-4СО2) в
цитоплазме уропорфириноген III до копропорфириногена III. Из
цитоплазмы копропорфириноген III опять поступает в митохондрии.
6). Копропорфриноген III оксидаза в митохондриях декарбоксилирует
(+ О2, -2СО2) копропорфириноген III в протопорфириноген IX.
7. Протопорфириногеноксидаза в митохондриях окисляет (-6Н+)
протопорфириноген IX в протопорфирин IX.
8). Феррохелатаза в митохондриях встраивает Fe2+ в молекулу
протопорфирина IX с образованием гема. Источником железа для синтеза
гема служит ферритин.
НАРУШЕНИЯ СИНТЕЗА ГЕМА. ПОРФИРИИ
Порфирии - гетерогенная группа заболеваний, вызванная нарушениями
синтеза гема вследствие дефицита одного или нескольких ферментов.
Классификации порфирий
Единой классификации порфирий нет. Порфирии делят по причинам на:
1) Наследственные. Возникают при дефекте гена фермента,
участвующего в синтезе гема;
2) Приобретенные. Возникают при ингибирующем влиянии
токсических соединений (гексохлорбензол, соли тяжелых
металлов - свинец) на ферменты синтеза гема.
В зависимости от преимущественной локализации дефицита фермента (в
печени или эритроцитах) порфирин делится на:
1) печеночные – наиболее распространенны. К ним относятся
острая
перемежающаяся порфирия (ОПП), поздняя кожная
порфирия, наследственная копропорфирия, мозаичная порфирия;
2) эритропоэтические – врожденная эритропоэтическая
порфирия (болезнь Гюнтера), эритропоэтическая протопорфирия.
В зависимости от клинической картины, порфирии делят на:
27
28.
1) острые.2) хронические.
Негативные последствия порфирий связаны с дефицитом гема и
накоплением в организме промежуточных продуктов синтеза гема –
порфириногенов и продуктов их окисления. При эритропоэтических
порфириях порфирины накапливаются в нормобластах и эритроцитах, при
печѐночных — в гепатоцитах.
Для каждого вида порфирии существует определенный уровень
ферментативного дефекта, в результате накапливаются продукты,
синтезирующиеся выше этого уровня. Эти продукты являются основными
диагностическими маркерами заболевания.
Порфириногены ядовиты, при тяжѐлых формах порфирий они вызывают
нейропсихические расстройства, нарушения функций РЭС и повреждения
кожи.
Нейропсихические расстройства при порфириях связаны с тем, что
аминолевулинат и порфириногены являются нейротоксинами.
В коже на солнце порфириногены легко превращаются в порфирины.
Кислород при взаимодействии с порфиринами переходит в синглетное
состояние. Синглетный кислород стимулирует ПОЛ клеточных мембран и
разрушение
клеток,
поэтому
порфирии
часто
сопровождаются
фотосенсибилизацией и изъязвлением открытых участков кожи.
Порфириногены бесцветны и не флуоресцируют, а порфирины проявляют
интенсивную красную флуоресценцию в ультрафиолетовых лучах. Избыток
порфиринов который выводиться с мочой, придает ей темный цвет
(«порфирин» в переводе с греч. означает пурпурный).
При лѐгких формах наследственных порфирий заболевание может
протекать бессимптомно, но приѐм лекарств, являющихся индукторами
синтеза аминолевулинатсинтазы, может вызвать обострение болезни. В
некоторых случаях симптомы болезни не проявляются до периода полового
созревания, когда повышение образования β-стероидов вызывает индукцию
синтеза аминолевулинатсинтазы. Порфирии наблюдают и при отравлениях
солями свинца, так как свинец ингибирует аминолевулинатдегидратазу и
феррохелатазу. Некоторые галогенсодержащие гербициды и инсектициды
являются индукторами синтеза аминолевулинатсинтазы, поэтому попадание
их в организм сопровождается симптомами порфирии.
Виды порфирий
Острая перемежающая порфирия (ОПП) – причина – дефект гена,
кодирующего ПБГ – дезаминазу. Наследуется по аутосомно-доминатному
типу. Происходит накопление ранних предшественников синтеза гема: 5АЛК (5- ALA) и порфобилиногена (ПБГ).
Бесцветный ПБГ на свету превращается в порфибилин и порфирин, они
предают моче темный цвет. АЛК оказывает нейротоксическое действие,
приводя к вялому параличу конечностей и парезу дыхательной мускулатуры.
Последнее вызывает острую дыхательную недостаточность. Заболевание
28
29.
проявляется в среднем возрасте, провоцируется приемом анальгетиков,сульфаниломидных препаратов, так как они увеличивают синтез АЛК –
синтазы.
Клинической симптоматикой являются острые боли в животе, рвота, запор,
сердечно-сосудистые нарушения, нервно-психические расстройства. Не
наблюдается повышенной чувствительности к свету, так как метаболическое
нарушение проходит на стадии, предшествующей образованию
уропорфириногена.
Для лечения применяют препарат нормосанг – аргинат гема. Действие
основано на том, что гем, по механизму отрицательной обратной связи
блокирует трансляцию АЛК – синтазы, а, следовательно, падает синтез АЛК
и ПБГ, чем и достигается купирование симптоматики.
Врожденная эритропоэтическая порфирия - редкое врожденное
заболевание, наследуемое по аутосомно-рецессивному типу. Для нее
характерна низкая активность уропорфириноген-III-косинтазы и высокая уропорфириноген-I-синтазы. Образование уропорфириногена-I значительно
превосходит синтез уропорфириногена-III (нормального изомера на пути
синтеза гема). Хотя генетическое нарушение распространяется на все клетки,
проявляется оно по неизвестной причине преимущественно в
эритропоэтической ткани. Пациенты экскретируют с мочой большие количества уропорфириногена-I и копропорфириногена-I; которые на воздухе
самопроизвольно окисляются в уропорфирин-I и копропорфирин-I —
красные флуоресцирующие пигменты. Циркулирующие эритроциты
содержат большое количество уропорфирина-I, однако, наивысшая
концентрация этого порфирина отмечена в клетках костного мозга.
Отмечается светочувствительность кожи, обусловленная активацией
ПОЛ при действии света на порфириновые соединения. У пациентов
отмечаются трещины на коже, часто наблюдаются гемолитические явления.
Наследственная копропорфирия — аутосомно-доминантное нарушение,
обусловленное
дефицитом
копропорфириногеноксидазы
—
митохондриального
фермента,
ответственного
за
превращение
копропорфириногена III в протопорфириноген IX. Копропорфириноген III в
больших количествах удаляется из организма в составе фекалий и с мочой.
Копропорфириноген на свету и воздухе быстро окисляется, превращаясь в
красный пигмент копропорфирин.
Ограниченная способность к синтезу гема (особенно в стрессовых
условиях) приводит к дерепрессии АЛК-синтазы. В результате наблюдается
избыточное образование АЛК, порфобилиногена и других интермедиатов
синтеза гема. У пациентов обнаруживаются все признаки и симптомы,
связанные с избытком АЛК и порфобилиногена, которые характерны для
перемежающейся
острой
порфирии,
имеется
повышенная
светочувствительность, обусловленная присутствием избыточных количеств
копропорфириногенов и уропорфириногенов.
29
30.
Мозаичная порфирия, или наследственная фоторопорфирия, являетсяаутосомно-доминантным нарушением, при котором происходит частичное
блокирование ферментативного превращения протопорфириногена в гем. В
норме
это
превращение
осуществляется
двумя
ферментами,
протопорфириногеноксидазой и феррохелатазой, локализованными в
митохондриях. Содержание протопорфириногеноксидазы составляет лишь
половину нормального количества. У пациентов с мозаичной порфирией
наблюдается относительная недостаточность содержания гема в стрессовых
условиях, а также дерепрессированное состояние печеночной АЛК-синтазы.
Что ведет к перепроизводству всех интермедиатов синтеза гема на участках
перед заблокированной стадией. Пациенты с мозаичной порфирией
экскретируют с мочой избыточные количества АЛК, порфобилиногена,
уропорфирина и копропорфирина, а с фекалиями выделяют уропорфирин,
копропорфирин и протопорфирин. Моча больных пигментирована и
флуоресцирует, а кожа чувствительна к свету так же, как и у больных поздней кожной порфирией (см. ниже).
Поздняя кожная порфирия является наиболее распространенной формой
порфирии. Обычно она связана с поражениями печени, особенно при
избыточном потреблении алкоголя или перегрузке ионами железа. Вероятной
причиной
является
частичная
недостаточность
уропорфириногендекарбоксилазы. Нарушение, по-видимому, передается как аутосомнодоминантный признак, но генетическая пенетрантность различна и в
большинстве случаев зависит от наличия нарушений функций печени. Моча
содержит повышенные количества уропорфиринов типа I и III; в то же время
экскреция с мочой АЛК и порфобилиногена наблюдается сравнительно
редко. Иногда моча содержит весьма значительное количество порфиринов,
придающих ей розоватый оттенок; при подкислении она чаще всего дает в
ультрафиолетовой области розовую флуоресценцию.
Печень содержит большие количества порфиринов и поэтому сильно
флуоресцирует, тогда как у эритроцитов и клеток костного мозга
флуоресценция отсутствует. Главным клиническим проявлением при
поздней кожной порфирии является повышенная светочувствительность
кожи. У больных не наблюдается ни повышенной активности АЛК-синтазы,
ни соответственно избыточного содержания в моче порфобилиногена и АЛК;
это коррелирует с отсутствием острых приступов, характерных для
перемежающейся острой порфирии.
Протопорфирия, или эритропоэтическая протопорфирия, по-видимому,
обусловлена доминантно наследуемой недостаточной активностью
феррохелатазы в митохондриях всех тканей; клинически эта болезнь
проявляется как острая крапивница, вызываемая воздействием солнечных
лучей. Эритроциты, плазма и фекалии содержат повышенные количества
протопорфирина IX, а ретикулоциты (незрелые эритроциты) и кожа (при
исследовании с помощью биопсии) часто флуоресцируют красным светом.
Печень, вероятно, тоже вносит вклад в повышение образования
30
31.
протопорфирина IX, однако экскреции с мочой порфиринов и ихпредшественников не наблюдается.
СИНТЕЗ ГЕМОГЛОБИНА
Синтезированный в митохондриях гем индуцируется синтез цепей глобина
на полирибосомах. Гены цепей глобина расположены в 11 и 16 хромосоме.
Цепи глобина формируют глобулы и соединяются с гемом. 4 глобулы
нековалентно соединяются в гемоглобин.
Гемоглобин начинает синтезироваться на стадии базофильного
эритробласта, а заканчивается у ретикулоцитов. В ретикулоцитах также идет
синтез пуринов, пиримидинов, фосфатидов, липида. Чувствительным
биохимическим индикатором для отличия ретикулоцитов от зрелых клеток
является утрата последними глутаминазы. Глутамин в ретикулоцитах источник углерода для синтеза порфирина и азота для синтеза пурина.
СТРОЕНИЕ ГЕМОГЛОБИНА
Гемоглобин - тетрамерный хромопротеин, имеет массу 64,5кДа, состоит из
4 гемов и 4 глобинов. Глобины представлены полипептидными цепями
различных типов , , , и т.д. -цепь содержит 141 АК, а - цепь – 146
АК. Отдельные участки полипептидных цепей образуют правозакрученные
-спирали, особое расположение в пространстве которых формирует
глобулы. Глобула -субъединицы содержит 8 -спиралей, а -субъединицы –
7. Гем располагается в щелях между Е и F спиралями глобина, прикрепляясь
через гистидин F8 к спирали F с помощью 5 координационной связи железа.
Гидрофобные остатки аминокислот окружающие гем, препятствуют
окислению железа водой. 4 глобулы с участием гидрофобных, ионных и
водородных связей формируют шарообразный тетрамер гемоглобина.
Максимально прочные связи, в основном за счет гидрофобных связей,
образуются между - и -глобулами. В результате образуются 2 димера 1 1
и 2 2. Димеры соединяются между собой в основном полярными (ионными
и водородными) связями, поэтому взаимодействие димеров зависит от рН.
Димеры легко перемещаются друг относительно друга. В центре тетрамера
глобулы прилегают друг к другу неплотно, образуя полость.
ФУНКЦИИ ГЕМОГЛОБИНА
Обеспечивают перенос кислорода от легких к тканям. В
сутки около 600литров;
Участвует в переносе углекислого газа и протонов от
тканей к легким;
Образует гемоглобиновый буфер, регулирует КОС крови.
ПРОИЗВОДНЫЕ ГЕМОГЛОБИНА
Гемоглобин со свободной шестой координационной связью железа в
составе гема называется апогемоглобином.
Шестая координационная связь может связывать различные лиганды, с
образованием следующих производных гемоглобина:
31
32.
1) оксигемоглобин HbО2 (Fe2+) – соединение молекулярного кислорода сгемоглобином. Процесс называется оксигенацией; обратный процесс дезоксигенацией.
2) карбоксигемоглобин HbСО (Fe2+). Связь гема с СО в двести раз
прочнее, чем с О2. В норме в крови содержится 1% HbСО. У курильщиков к
вечеру концентрация HbСО достигает 20%. При отравлении СО, из-за
недостаточного снабжения тканей кислородом может наступить смерть.
3) метгемоглобин HbОН (Fe3+). Образуется при воздействии на
гемоглобин окислителей (оксидов азота, метиленового синего, хлоратов). В
норме в крови содержится <1% HbОН. Накопление метгемоглобина при
некоторых заболеваниях (например, нарушение синтеза ГЛ-6-фосфатДГ),
отравлении окислителями может стать причиной смерти, так как
метгемоглобин не способен к переносу кислорода;
4) цианметгемоглобин HbСN (Fe3+). Образуется при присоединении СNк метгемоглобину. Эта реакция спасает организм от смертельного действия
цианидов. Поэтому для лечения отравлений цианидами применяют
метгемоглобинообразователи (нитрит Na);
Карбгемоглобин образуется, когда гемоглобин связывается с СО2. Однако
СО2 присоединяется не к гему, а к NН2 – группам глобина, с образованием
карбаматов:
HbNH2 + CO2= HbNHCOO- + H+
Карбгемоглобин выводит из организма 10-15% СО2.
Дезоксигемоглобин Hb (Fe2+). Форма гемоглобина не связанная с
кислородом.
Дезоксигемоглобин
связывает
больше
СО2,
чем
оксигемоглобин.
В цитохромах гем присоединяется к белковой части через 5 и 6
координационные связи железа (через гистидин и метионин Е и F спиралей).
Занятость всех координационных связей не позволяет цитохромам
присоединять лиганды, поэтому они могут переносить только по 1 электрону.
Механизм насыщения гемоглобина кислородом
Гемоглобин присоединяет О2 последовательно, по одной молекуле на
каждый гем.
В апогемоглобине, благодаря координационной связи с белковой частью,
атом железа выступает из плоскости гема в направлении гистидина F8.
Присоединение О2 к шестой координационной связи железа вызывает его
перемещение в плоскость гема, за ним перемещаются гистидин F8 и
полипептидная цепь, в состав которой он входит.
Происходит изменение конформации текущего протомера и связанных с
ним оставшихся протомеров. При этом у протомеров возрастает сродство к
кислороду, в результате каждый следующий кислород присоединяется к
гемоглобину лучше предыдущего. Четвертая молекула кислорода
присоединяется к гемоглобину в 300 раз легче, чем первая молекула.
Обратный процесс аналогичен, чем больше О2 отдают протомеры, тем легче
идет отщепление последующих молекул О2.
32
33.
Кривая диссоциации кислорода для гемоглобинаКооперативность в работе протомеров гемоглобина формирует
сигмовидный характер кривой насыщения его кислородом в зависимости от
парциального давления кислорода.
S–образная кривая насыщения гемоглобина кислородом имеет важное
биологическое значение.
Во-первых, пологий участок S–образной кривой (выше 60 мм.рт.ст.)
обеспечивает максимальное насыщение гемоглобина кислородом в легких,
даже если концентрация кислорода в альвеолярном воздухе заметно снижена.
Например, в альвеолярной крови при РО2=95 мм.рт.ст. гемоглобин
насыщается кислородом на 97%, а при РО2=60 мм.рт.ст. - на 90%.
Во-вторых, Крутой наклон среднего участка S–образной кривой (от 10 до
40 мм.рт.ст.) обеспечивает максимальный переход кислорода от гемоглобина
к тканям.
В области венозного конца капилляра при РО2 = 40 мм.рт.ст. гемоглобин
насыщен кислородом на 73%. При снижении РО2 на 5 мм.рт.ст. насыщение
гемоглобина кислородом уменьшается на 7%.
Аллостерическая регуляция насыщения гемоглобина кислородом
Кроме РО2 на насыщение гемоглобина кислородом влияют и другие
факторы, например, рН, температура, давление, концентрация 2,3-ДФГ, РСО2.
Увеличение температуры, присоединение к гемоглобину Н+, 2,3-ДФГ, СО2
уменьшает сродство гемоглобина к кислороду, при этом кривая диссоциации
оксигемоглобина сдвигается вправо и гемоглобин легче отдает кислород
тканям.
Эффект Бора
Влияние рН на характер кривой диссоциации оксигемоглобина называется
эффектом Бора (по имени датского физиолога Христиана Бора, впервые
открывшего этот эффект).
Гемоглобин в дезоксигенерированном состоянии имеет более высокое
сродство к протонам, чем оксигемоглобин. Другими словами R – форма
(оксигенерированная) является более сильной кислотой, чем Т-форма
(дезоксигенерированная). Поэтому когда дезоксигемоглобин в легких
присоединяет кислород, происходит переход в R – форму и разрыв
некоторых связей, в результате чего и высвобождаются протоны,
ответственные за эффект Бора. Наоборот, при высвобождении кислорода
образуется Т-структура и разорванные связи между субъединицами должны
быть восстановлены, и протоны вновь присоединяются к остаткам гистидина
в - цепях. Таким образом, протонирование гемоглобина снижает его
сродство к О2 и увеличивает потребление О2 в ткани.
Эффект Бора имеет важное физиологическое значение. Образующийся в
тканях СО2 должен транспортироваться в легкие. Он поступает в эритроциты
по градиенту напряжения. В них фермент карбоангидраза превращает его в
33
34.
Н2СО3, который диссоциирует на бикарбонат, ион и протон. Последнийсдвигает равновесие влево в уравнении (1).
Hb + 4 O2= Hb (О2)4 + (H+)n
Где n - величина порядка 2; число зависит от целого комплекса
параметров, тем самым заставляя Hb О2 отдавать свой кислород.
НСО3- пассивно продвигается через ионный канал по градиенту
концентрации в сыворотку.
Продвижение НСО3- не сопровождается перемещением Н+, поскольку нет
канала, позволяющего ему пройти через мембрану эритроцитов. Для
сохранения ионного равновесия при выходе НСО3- из клетки, Clперемещаются внутрь еѐ через тот же ионный канал. Такое двойное
перемещение известно как хлоридный сдвиг (сдвиг Хамбургера).
Растворенный НСО3- движется вместе с венозной кровью обратно в легкие.
Здесь высвобождение протона из гемоглобина при оксигениции приводит к
образованию НСО3- (по принципу Ле-Шателье).
НСО3-+ Н+= Н2СО3,
что позволяет карбоангидразе образовать СО2.
Разрушение НСО3- в эритроците обуславливает вхождение в него НСО3- из
сыворотки, так что в легких происходит обратный хлоридный сдвиг,
приводящий к выведению СО2 с выдыхаемым воздухом.
Аллостерическая регуляция сродства гемоглобина к кислороду 2,3ДФГ
2,3-ДФГ снижает сродство гемоглобина к кислороду и, таким образом,
повышает отдачу кислорода тканям. Если кровь израсходовала весь свой
запас ДФГ, гемоглобин остается фактически насыщенным кислородом. При
акклиматизации в условиях высокогорья содержание ДФГ в эритроцитах
резко увеличивается. ДФГ является аллотерическим лигандом, так как
связывается с гемоглобином в другом по сравнению с О2 участком. ДФГ
встраивается в полость тетрамерной молекулы гемоглобина, полость
образована остатками всех 4 протомеров.
В Т – форме (дезоксигенерированной) молекулы Hb имеются
дополнительные связи, и поэтому размер центральной полости больше, чем в
R – форме (дезоксигемоглобине). Поэтому ДФГ взаимодействует только с Т
– формой стабилизируя еѐ, путем образования связи между атомами
кислорода ДФГ и тремя положительно заряженными группами в каждой из
- цепей.
В легких при высоком парциальном давлении кислород взаимодействует с
Hb, изменяется конформация белка, уменьшается центральная полость и
ДФГ вытесняется из гемоглобина.
Виды гемоглобинов
Гемоглобины различаются по белковой части. Бывают физиологические и
аномальные виды гемоглобинов. Физиологические образуются на разных
34
35.
этапах нормального развития организма, а аномальные - вследствиенарушения последовательности аминокислот в глобине физиологических
видов гемоглобина.
Физиологические виды гемоглобина
1) эмбриональные гемоглобины (Gover I, Gover II). На ранних этапах
развития плода в первые недели развития, когда в желточном мешке
возникают очаги кроветворения начинается синтез -цепей (эпсилон). Из
четырѐх цепей образуется гемоглобин Gover I. Затем у эмбриона, длина
которого не превышает 2,5см, начинается синтез -цепей, которые вместе цепями образуют гемоглобин Gover II (2 2 ). Затем синтез -цепей
прекращается и Gover гемоглобины полностью исчезают у трехмесячного
эмбриона. Если они остаются у новорожденного, то это признак врожденной
аномалии развития.
2) фетальный гемоглобин – HbF (от латинского fetus – плод). Фетальный
гемоглобин сменяет эмбриональные гемоглобины, вместо эпсилон – цепей (
- цепей) начинают синтезироваться гамма-цепи ( - цепи). HbF состоит из 2
и 2 цепей. HbF – является главным гемоглобином плода и составляет к
моменту рождения 50-80% всего гемоглобина. HbF имеет более высокое
сродство к кислороду, что позволяет ему забирать кислород от гемоглобина
матери и передавать его тканям плода. Эта особенность связана с низким
сродством HbF к 2,3-ФГК.
Кроме перечисленных основных видов гемоглобинов плода, у здорового
плода выделяются и другие виды гемоглобинов: например, гемоглобин
Bart`s, (4 ), Portland–1 (S2 2).
Схема электрофореза
гемоглобина здорового плода
А1
F
А2
Gower I
+
Bart`s
Portland -1
Gower II
3) гемоглобин А1 – тетрамер (2 2 ) составляет около 98% гемоглобина
эритроцитов взрослого человека. Начинает синтезироваться на 8 месяце
развития плода.
4) гемоглобин А2 – тетрамер (2 2 ). Его содержание в эритроцитах
взрослого человека равно 2%. Гемоглобин А2, также как и гемоглобин F,
обладает более высоким сродством к кислороду по сравнению с
гемоглобином А1.
5) гемоглобин А3 (2 2 ) образуется по мере старения эритроцита, при
присоединении к цистеину -цепи глутатиона.
6) гемоглобин А1С – гликозилированный гемоглобин А.
35
36.
Аномальные виды гемоглобиновАномальные гемоглобины возникают в результате мутации генов,
кодирующих и цепи. Известно несколько сотен мутантных гемоглобинов
человека (в большинстве случаев функционально активных).
Таблица №1 замена аминокислот в и пептидных цепях гемоглобина
тип
нормальный
остаток
и
его
замена
гемоглобина положение в цепи
С
лиз
глу 6 в - цепи
глу
Д
лей 28 в - цепи
Е
лиз
глу 26 в - цепи
G
ала
глу 43 в - цепи
GpH
лиз
асл 68 в - цепи
J
асл
лиз 16 в - цепи
М
глу
вал 67 в - цепи
О
лиз
глу 116 в - цепи
S
вал
глу 6 в - цепи
Болезни гемоглобинов
Болезни гемоглобинов называют гемоглобинозами, их насчитывают более
200.
Гемоглобинозы делятся на гемоглобинопатии и таласемии.
Гемоглобинопатии, возникают в результате точечных мутаций в
структурных генах, кодирующих полипептидные цепи гемоглобина. Поэтому
в крови появляется аномальный гемоглобин.
Серповидноклеточная анемия – классический пример наследственной
гемоглобинопатии. В норме в -субъединицах гемоглобина в шестом
положении находится гидрофильная глутаминовая кислота. В гемоглобине S
глутаминовая кислота заменена на гидрофобный валин. Такая замена
приводит к появлению на поверхности -субъединицы гидрофобного
(«липкого») участка, который соединяется с гидрофобным карманом другой
молекулы гемоглобина S. Происходит полимеризация гемоглобина S и его
осаждение в виде длинных волокон. Длинная волокнистая структура
нарушает нормальную форму эритроцитов, превращая еѐ из двояковогнутого
диска в серповидную, которая имеет тенденцию блокировать капилляры.
Такие эритроциты преждевременно разрушаются, способствуя развитию
анемии. Если поражены обе гомологичные хромосомы, заболевание может
оказаться
смертельным.
Заболевание
широко распространено
в
географических зонах, где наиболее часто встречается злокачественная
форма малярии. Высокий показатель заболеваемости можно объяснить
положительной селекцией генома носителей аномальных генов. Серповидная
красная кровяная клетка «неудобна» для развития малярийного плазмодия.
Существенное ухудшение состояния больных наблюдается в условиях
высокогорья при низких давлениях кислорода. Это связано с тем, что
полимеризоваться способна только дезоксиформа S гемоглобина. Так как в
36
37.
молекуле оксиформы S-гемоглобина нет гидрофобного кармана («липкогоучастка»), и она не способна к полимеризации.
Талассемия – генетическое заболевание, обусловленное отсутствием или
снижением синтеза одной из цепей гемоглобина. При данном заболевании
отсутствуют дефекты в структурных генах, кодирующих , , , -цепи.
Причиной
талассемий
являются
мутации
генов-операторов,
контролирующих транскрипцию структурных генов , , , -цепей
гемоглобина.
В результате несбалансированного образования глобиновых цепей
образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров.
В зависимости от того, формирование какой глобиновой цепи нарушается,
выделяют , , , - талассемии.
Талассемии делятся так же на гомозиготные и гетерозиготные.
Гомозиготная -талассемия – формирование -цепи полностью
подавляется. Симптомы заболевания появляются приблизительно через
полгода после рождения, когда происходит полное переключение синтеза цепи гемоглобина F на -цепь. У ребенка прогрессирует анемия.
Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты
(из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос
приплюснут), при рентгенологическом исследовании черепа наблюдается
феномен «игл ежа» («hair – standing –on –end»). В попытке восполнить
эритроциты, утраченные в результате не эффективного эритропоэза и
увеличении гемолиза, ткани
черепа, чрезмерно разрастаясь и
гипертрофируясь, порождают такое изменение медуллярной пластинки.
α-талассемия - недостаток образования α-глобиновых цепей приводит к
нарушению образования HbF у плода. Избыточные γ-цепи образуют
тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не
проявляет кооперативных взаимодействий между протомерами. В результате
гемоглобин Барта не обеспечивает развивающийся плод необходимым
количеством кислорода, что приводит к тяжѐлой гипоксии. При α-талассемии
отмечают высокий процент внутриутробной гибели плода. Выжившие
новорождѐнные при переключении с γ- на β-ген синтезируют β-тетрамеры или
НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к
кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведѐт к
развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Для всех этих заболеваний характерны некоторые общие закономерности:
1). нарушаются пропорции в составе гемоглобина крови. Например, при талассемии в крови появляется 15% гемоглобина А2, 15 – 60% гемоглобина
F;
2). эритроциты приобретают не нормальную форму (мишеневидную,
каплевидную). Такие эритроциты в пределах 1 дня захватываются
ретикулярной соединительной тканью (например, селезенкой) и
37
38.
подвергаются распаду (по этой причине селезѐнка оказываетсягипертрофированной), что приводит к развитию гемолитической анемии.
Катаболизм гемоглобина
Старые поврежденные эритроциты фагоцитируются клетками РЭС и
перевариваются в лизосомах. При распаде гемоглобина образуется жѐлчный
пигмент билирубин. Дальнейший катаболизм билирубина в печени,
кишечнике и почках приводит к образованию уробилиногенов и уробилина,
которые выходятся с калом и мочой. Железо, освобождающееся при распаде
гема, снова используется для синтеза железосодержащих белков.
Сокращение Параметры
WBC
LYM#
MID#
GRAN#
LYM%
MID%
GRAN%
HGB
RBC
HCT
MCV
RDW
MCH
MCHC
PLT
MPV
PCT
PDW
Нормальные
значения*
4,0¸9,0
1200¸3000
90¸600
2000¸5500
19¸37
3¸11
47¸72
117¸174
3,7¸5,1
36¸48
80¸95
11,5¸14,5
-лейкоциты, 103/мкл
-лимфоциты, в 1мкл
-моноциты, в 1мкл
-гранулоциты, в 1мкл
-лимфоциты, %
-моноциты, %
-гранулоциты, %
-гемоглобин, г/л
-эритроциты, 106 в 1мкл
-гематокрит, %
-средний объем эритроцита, фл.
-однородность эритроцитов
-среднее содержание гемоглобина в
27¸35
эритроците, пг
-средняя концентрация гемоглобина
33¸38
в эритроците, г/дл
-тромбоциты, 103/мкл
180¸320
-средний объем тромбоцитов, фл. 6,2¸10
-тромбокрит, %
0,15¸0,32
-однородность тромбоцитов
15,3¸17,3
*-значения взяты из книги «Клиническая
аналитика» под ред. В.В. Меньшикова, том 2
лабораторная
6. Буферные системы.
Буферные системы – совокупность нескольких веществ в растворе,
сообщающих ему буферные свойства, т.е. способность противостоять
изменению
активной
реакции
среды
(pH)
при
разбавлении,
концентрировании раствора или при добавлении к нему небольших
количеств сильной кислоты или щѐлочи.
38
39.
Буферные системы широко распространены в природе: они находятся вводах мирового океана, почвенных водах и особенно в живых организмах,
где выступают в качестве регуляторов, поддерживающих активную реакцию
среды на определѐнных условиях, необходимых для нормального протекания
жизненных процессов. Буферные системы обеспечивают состояние
кислотно-основного
равновесия,
соответствующего
норме
–
протолитический гомеостаз. Смещение протолитического равновесия в
кислую область вызывает ацидоз, в щелочную – алкалоз. Постоянство pH
биологических жидкостей, тканей и органов обусловлено наличием
нескольких буферных систем, входящих в состав этих биообъектов.
Буферные системы проявляют свои буферные свойства в некотором
диапазоне значений pH (≈2 единицы) – называемом зона буферного действия.
Состав буферных систем.
Буферные системы подразделяются на два основных типа.
1. Слабая кислота и еѐ анион, т.е. комбинация слабой кислоты и еѐ соли с
катионом сильного основания.
2. Слабое основание и его катион. Например, аммонийная буферная
система NH3/NH4+ в растворе NH3 и NH4Cl.
Особый ―подкласс‖ буферных систем представляют буферные системы,
образованные из ионов и молекул амфолитов – аминокислотные и белковые
буферные системы.
Название
Ацетатная
Гидрокарбонатная
Фосфатна
я
Гемоглобиновая
Оксигемоглобиновая
I. Слабая кислота и еѐ анион HA/AСостав
Протолитическое
равновесие
CH3COOH + CH3COONa
Зона
буферного
действия
+
pH=3,8CH3COO + H
5,8
CH3COOH
H2CO3 + NaHCO3
H2CO3
H+ + HCO3-
NaH2PO4 + Na2HPO4
H2PO4-
H+ + HPO42-
HHb + KHb
HHbO2 + KHbO2
Hb- + H+
HHb
HHbO2
HHbO2- + H+
pH=5,47,4
рН=6,28,2
рН=7,29,2
рН=6,08,0
II. Слабое основание и его катион B/BH+
Аммонийн
ая
NH3.H2O + NH4Cl
NH3 + H+
NH4+
pH=8,210,2
39
40.
Механизм действия буферных систем.Системы первого типа можно рассмотреть на примере ацетатной буферной
системы
CH3COOH
CH3COO- + H+
CH3COONa
CH3COO- + Na+
При добавлении сильной кислоты происходит связывание иона Н + в
слабую кислоту
CH3COOH,
CH3COO- + H+
а при добавлении щелочи происходит связывание иона ОН- в слабый
электролит Н2О
CH3COOH + OHCH3COO- + H2O
Таким образом, в указанных процессах донором протона является кислота,
акцептором – ацетат-ион. И в том, и в другом случаях первоначальное
значение рН меняется незначительно, хотя сдвиг в область более низких
значений рН – при добавлении кислоты или в область более высоких
значений – при добавлении щелочи имеет место, т.к. нарушается
C(соль)
C(соль)
первоначальное соотношение
и
(см. уравнения 1-3).
C(кисл)
C(осн)
Механизм буферного действия систем второго типа можно проследить на
примере аммонийной буферной системы
NH3.H2O
NH4+ + OH-
NH4Cl
NH4+ + Cl-
При действии кислоты:
NH3.H2O + H+
NH4+ + H2O;
при действии щѐлочи:
NH4+ + OHNH3.H2O
Донор протонов – ион NH4+ (соль NH4Cl), акцептор протонов – основание
NH3.H2O.
Анализируя вышеописанные процессы, делаем вывод: буферное действие
систем первого и второго типов осуществляется за счет связывания
вводимых ионов Н+ и ОН- в малодиссоциированные соединения в результате
реакций этих ионов с соответствующими компонентами буферных систем.
Особый интерес представляет механизм действия белковых буферных
систем. Белки в изоэлектрическом состоянии практически не проявляют
буферных свойств. Но если к белкам добавить некоторое количество кислоты
или щѐлочи, они начинают проявлять буферное действие. Часть белка
переходит в форму «белок – кислота» или в форму «белок – основание». Эти
процессы можно представить схемой:
40
41.
RCHCOONH3++OHRCHCOO+ H2O
NH2
+H+
RCHCOOH
NH3+
"Белок - кислота"
"Белок - основание"
При действии кислоты реагирует «белок – основание»
RCHCOO+ H+
NH2
RCHCOONH3+
"белок - основание"
соль "белка - основания"
При действии щелочи – «белок – кислота»
RCHCOOH
RCHCOO+ H2O
+ OH
NH3+
NH3+
"белок - кислота"
соль "белка - кислоты"
Акцептор протонов – «белок – основание», донор – «белок – кислота».
Буферные системы крови.
Плазма крови.
Нормальное значение рН крови 7.40 ± 0.05, т.е. а(Н+) ≈ 3.7 . 10-8 – 4 . 108
моль/л. Постоянство этих величин обеспечивается одновременным
действием гидрокарбонатной, фосфатной, белковой и аминокислотной
буферных систем.
Гидрокарбонатная.
Особенность этой системы состоит в том, что один из компонентов
системы – H2CO3 образуется при взаимодействии CO2 с H2O.
H2CO3
CO2(р-р) + H2O
В свою очередь концентрация СО2 определяется равновесием
CO2(газ)
CO2(р-р),
которое описывается законом Генри
CO2(р-р) = s . P(CO2)
моль
s - константа Генри [ .
]
л кПа
Т. о. в крови устанавливается равновесие
CO2(р-р) + H2O
H2CO3
H+ + HCO341
42.
В соответствии с уравнением 1 значение рН гидрокарбонатного буфера вконечном счѐте определяется концентрацией НСО3- и парциальным
давлением СО2:
C(HCO3-)
pH = pKa1 + lg .
s P(CO2)
C(HCO3-)
pKa1 = 6.1
= 101.3 = 20
C(H2CO3)
Очевидно, что ѐмкость гидрокарбонатной системы по кислоте значительно
превышает этот показатель по щѐлочи (таблица 2).
Между СО2 в альвеолах и гидрокарбонатным буфером в плазме крови
устанавливается равновесие:
2
1
Атмосфера
CO2(газ)
CO2(р-р)
+ H2O
H2CO3
3
H+ + HCO3-
- H2O
При поступлении в кровь доноров протонов равновесие 3 смещается в
сторону Н2СО3. При этом концентрация Н2СО3 возрастает, а концентрация
НСО3- снижается. Это приводит к смещению равновесия 2 влево, в
результате чего равновесие 1 смещается в сторону образования
газообразного СО2 , что приводит к повышению давления СО2 в лѐгких и
выведению его за счѐт увеличения лѐгочной вентиляции.
При поступлении акцепторов протонов равновесие смещается в обратном
направлении, что приводит к растворению в плазме крови дополнительного
количества СО2, содержащегося в лѐгких.
В результате описанных процессов гидрокарбонатная буферная система
эффективно обеспечивает постоянство рН плазмы крови. Эта система
содержится также в эритроцитах и почечной ткани.
Фосфатная буферная система.
pH =
pKa(H2PO4-)
C(HPO42-)
+ lg
C(H 2PO4-)
C(HPO 42-)
4:1
C(H2PO4-)
Ёмкость данной системы по кислоте выше ѐмкости по щелочи (таблица 2).
Фосфатная буферная система менее мощная, чем гидрокарбонатная, что
обусловлено малым содержанием фосфатов в плазме крови.
Фосфатная система содержится также в тканях, почках, эритроцитах.
42
43.
Белковая буферная система – представляет собой совокупностьальбуминов и глобулинов.
При
физиологическом
значении
рН = 7.40
белки
находятся
преимущественно в форме «белок – основание» и соль «белка – основания» и
ѐмкость по кислоте буферной системы выше ѐмкости по щелочи (таблица 2).
1.
Аминокислотные буферные системы.
Почти все аминокислоты имеют значения рН заметно отличающиеся от 7.4
и мощность их невелика.
Таким образом, мощность буферных систем плазмы крови убывает в ряду
Н2СО3/НСО3- >белки > Н2РО4-/НРО42- > аминокислоты.
Эритроциты.
рН эритроцитов в норме 7.25 ± 0.05. Действуют гидрокарбонатная и
фосфатная буферные системы. Их мощность невелика по сравнению с
мощностью в плазме крови. Большую роль играет система гемоглобин –
оксигемоглобин, на долю которой приходится около 80% всей буферной
ѐмкости цельной крови.
Гемоглобин – слабая кислота (рКа = 8.2), диссоциирует по схеме:
HHb
H+ + HbC(Hb-)
1 , следовательно
Недиссоциированной части больше, т.е.
9
C(HHb)
буферная ѐмкость системы HHb/Hb- выше по щѐлочи, чем по кислоте
(таблица 2).
В легких HHb реагирует с О2,
HHb + O2
HHbO2
образуя оксигемоглобин, который переносится кровью в капиллярные
сосуды, откуда О2 попадает в ткани. HHbO2 – слабая кислота –рКа (HHbO2) =
6.95. Поэтому при действии доноров протонов их в первую очередь будет
нейтрализовать анион HbHHb,
H+ + Hb+
т.к. имеет большее сродство к Н . Но при действии оснований –
акцепторов протонов – в первую очередь будет реагировать оксигемоглобин
-
HHbO2 + OH
-
HbO2 + H2O
Система HHbO2/HbO2- осуществляет также протонирование HCO3- ионов с
последующим выделением СО2 через легкие:
HCO3- + HHbO2
HbO2- + CO2 + H2O
Необходимо также отметить участие эфиров фосфорных кислот в
поддержании постоянства рН. Фосфолипиды являются слабыми кислотами.
рКа диссоциации полярных фосфатных групп находятся в интервале 6.8-7.2.
Поэтому при физиологическом значении рН=7.25 фосфолипиды мембран
эритроцитов находятся как в виде ионизированной, так и неионизированной
43
44.
формы. При этом соотношение ионизированной и неионизированной формсоставляет примерно 3:1.
Вывод – сама мембрана эритроцитов обладает буферным действием,
поддерживая постоянство рН внутренней среды эритроцитов.
Резюме – совокупное действие нескольких буферных систем обеспечивает
кислотно-основной гомеостаз в организме.
Основные буферные системы организма
Буферная система
Буферная
Функционирование
ѐмкость, ммоль/л
Гидрокарбонатная
Вк = 40
Плазма, эритроциты,
Н2СО3/НСО3
Вщ = 2
межклеточная жидкость,
почечная ткань, слюна
Гемоглобиновая
Основная буферная
HHb/Hb
Вщ > Вк
система эритроцитов
Оксигемоглобиновая
HHbO2/HbO2
Вк > Вщ
Фосфатная
Вк = 2
Плазма, эритроциты,
2Н2РО4 /НРО4
Вщ = 0.5
почечная ткань, слюна
Белковая
Вк = 10
Плазма крови, слюна
HProt/Prot
(альбумины)
Вк = 3
(глобулины)
Вк < 1 (фибрины)
Вк > Вщ
7. Система свертывания крови и фибринолиза.
Это единая система, которая выполняет следующие функции:
1) Поддержание крови в сосудах в жидком состоянии.
2) Осуществление гемостаза (предотвращение больших кровопотерь).
Гемостаз - сложный ферментативный процесс, в результате которого
образуется кровяной сгусток.
Система свертывания крови - это многокомпонентная система, в состав
которой входят белки, фосфолипиды, обломки клеточных мембран и ионы
кальция.
Компоненты системы свертывания крови принято называть "факторами".
Факторы бывают тканевыми, плазменными и тромбоцитарными.
Тканевые и плазменные факторы обозначаются римскими цифрами, а
тромбоцитарные - арабскими. Если фактор является активным, то за цифрой
ставится буква "а". Например, переход неактивного двенадцатого фактора
в активный можно обозначить так:
44
45.
фXII ----------------> фXIIa(неактивный)
(активный)
Большинство белков
системы
свертывания
крови
обладает
ферментативной активностью. Все факторы свертывания крови, кроме фXIII,
являются сериновыми протеиназами, которые катализируют реакции
ограниченного протеолиза.
В ходе реакций свертывания крови все белки-ферменты сначала
выступают в роли субстрата, а затем - в роли фермента. Среди белков,
участвующих в свертывании крови, есть такие, которые не обладают
ферментативной активностью, но специфически ускоряют протекание
ферментативной реакции. Они называются параферментами. Это фV и
фVIII.
Большинство факторов свертывания крови синтезируется в неактивной
форме в виде проферментов. Проферменты активируются и их действие
направлено на протекание прямой реакции свертывания крови - на
превращение фибриногена в фибрин, которой является основой кровяного
сгустка.
Есть 2 механизма свертывания крови - внешний и внутренний.
ВНЕШНИЙ механизм запускается с участием внешних (тканевых)
факторов, ВНУТРЕННИЙ - при участии факторов, источником которых
служит сама кровь, плазма, собственно ферменты и форменные элементы
крови. РАЗЛИЧАЮТСЯ ВНЕШНИЙ И ВНУТРЕННИЙ МЕХАНИЗМЫ
ТОЛЬКО
НАЧАЛЬНЫМИ
СТАДИЯМИ
ДО АКТИВАЦИИ
ПРОТРОМБИНА
(фII). ПОСЛЕДУЮЩИЕ СТАДИИ ПРОТЕКАЮТ
ОДИНАКОВО И В ТОМ, И В ДРУГОМ СЛУЧАЯХ.
СХЕМА СИСТЕМЫ СВЕРТЫВАНИЯ КРОВИ И ФИБРИНОЛИЗА
45
46.
НАЧАЛЬНЫЕ СТАДИИ ВНЕШНЕГО МЕХАНИЗМА.Для пуска внешнего механизма необходим первичный сигнал:
повреждение тканей (клеток), оказавшихся в контакте с кровью, или
эндотелия сосуда. При этом разрушаются клеточные мембраны и из
клеток высвобождается тканевой тромбопластин (фIII). Он активирует
фVII.
Активация фVII, а также все последующие реакции до активации
протромбина протекают на матрице, которая состоит из липопротеиновых
осколков клеточных мембран. В ходе активации фVII происходит
конформационная перестройка его молекулы, в результате формируется
активный центр этого белка-фермента.
Активный фVIIa образует комплекс с тканевыми фосфолипидами и ионом
кальция. Этот комплекс обладает протеолитической активностью и
вызывает активацию фактора X.
ктивный фактор Xа тоже обладает протеолитической активностью и
активирует протромбин.
НАЧАЛЬНЫЕ СТАДИИ ВНУТРЕННЕГО МЕХАНИЗМА.
Начальные стадии внутреннего механизма называются "контактная фаза"
или ―контактная
стадия‖.
Происходит контакт фXII с чужеродной
поверхностью (например, игла шприца, лезвие ножа, стекло). В результате
происходит конформационная перестройка фXII и он активируется переходит в фXIIa.
Активация фXII, а также последующие реакции
внутреннего
механизма, так же, как и при внешнем механизме, протекают на матрице тромбопластине, который освобождается при разрушении тромбоцитов.
XIIa действует на XI, превращая его в XIa.
XIa действует на фIX (обязательно в присутствии ионов кальция!), и
переводит его в фIXa.
фIXa образует комплекс с тромбоцитарными фосфолипидами, ионами
кальция и параферментом - фVIIIa. В составе этого комплекса фIXa
обладает протеолитической активностью и переводит фX в фXa.
Следующие стадии, начиная с активации протромбина (фII), протекают
одинаково для обоих механизмов свертывания крови.
Протромбин - белок, который синтезируется в печени. Для синтеза
протромбина необходим витамин "К". Реакция синтеза
протромбина
катализируется комплексом, состоящим из активного фXa, фосфолипидов,
иона кальция и парафермента Va. В ходе этой реакции резко уменьшается
сродство данного комплекса к матрице и активный тромбин,или фIIa,
освобождается с матрицы и гидролизует пептидные связи между аргинином
и глутаминовой кислотой в молекуле своего субстрата - фибриногена,
превращая его в фибрин-мономер.
46
47.
На следующей стадии мономеры фибрина спонтанно агрегируют собразованием регулярной полимерной структуры "мягкого"
сгустка
растворимого фибрин-полимера. При этом происходит захват фибринполимером компонентов крови - формируется тромб (сгусток).
Сначала сгусток рыхлый и мягкий, связи между молекулами фибринполимера слабые (нековалентные). Но затем под действием активного фXIIIa
(фибриназа) (фXIII активируется фактором IIa - тромбином) происходит
прочная ковалентная ―сшивка‖ молекул фибрин-полимера. Образуются
межмолекулярные связи между карбоксильными группами глутамина и
аминогруппами лизина: так растворимый фибрин-полимер переходит в
нерастворимый фибрин-полимер.
После образования нитей фибрина происходит их сокращение
(ретракция кровяного сгустка), которое происходит с затратой АТФ.
Процесс тромбообразования постоянно контролируется антитромбином III
- ингибитором сериновых протеиназ. Кроме того, протекание большинства
реакций свертывания крови на матрице обеспечивает:
1) высокую эффективность процесса
2) локальность процесса - процесс свертывания протекает только в месте
повреждения (это предотвращает
процесс
диссеминированного
внутрисосудистого свертывания (ДВС-синдром).
Скорость свертывания крови зависит не только от работы системы
свертывания, но и от присутствия естественных антикоагулянтов - веществ,
предотвращающих свертывание крови.
АНТИКОАГУЛЯНТЫ.
Естественные антикоагулянты синтезируются в тканях и поступают в
кровь, где препятствуют активации факторов свертывания крови. К ним
относятся ГЕПАРИН, АНТИТРОМБИН-III и альфа-2-МАКРОГЛОБУЛИН.
ГЕПАРИН предотвращает активацию
некоторых
факторов,
но
непосредственно на них не действует. Гепарин способен активировать
АНТИТРОМБИН-III. Обладая высоким отрицательным зарядом, гепарин
связывается с катионными участками антитромбина- III. В результате
изменяется конформация антитромбина- III и он приобретает способность
инактивировать сериновые протеиназы.
альфа-2-МАКРОГЛОБУЛИН - эндогенный ингибитор протеаз, в том
числе многих ферментов, участвующих в работе системы свертывания крови
и фибринолиза (тромбин, плазмин).
Работа параферментов контролируется СИСТЕМОЙ ПРОТЕИНА ―С‖.
Протеин ―С‖ - это гликопротеин, который содержит карбоксиглутаминовую
кислоту, его синтез зависит от витамина ―К‖. Существует в крови в виде
профермента, активируется тромбином. Активный протеин ―С‖ активирует
фV и фVIII, переводя их в фVa и фVIIIa путем ограниченного протеолиза. В
плазме крови есть эндогенный ингибитор протеина ―С‖.
47
48.
Считается, что система свертывания крови работает всегда: одновременнопроисходит образование и растворение фибриновых сгустков благодаря
тому, что работа системы свертния крови уравновешивается работой
системы фибринолиза. Фибринолиз - это расщепление фибринполимера на
отдельные пептиды, которое катазируется ПЛАЗМИНОМ. Плазмин сериновая протеиназа, способен гидролизовать фибрин, фибриноген и др.
Сам плазмин образуется из плазминогена под действием АКТИВАТОРА
ПЛАЗМИНОГЕНА. Тканевой активатор плазминогена неактивен до тех пор,
пока не вступит в контакт с фибрином. Контактируя с
фибрином, он
приобретает способность активировать плазминоген. Когда фибрин будет
гидролизован плазмином, активатор плазминогена теряет свою активность.
ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ СИСТЕМЫ СВЕРТЫВАНИЯ
КРОВИ И ФИБРИНОЛИЗА:
1. Это многокомпонентная система, в которой продукт предыдущей реакции
служит ферментом для следующей.
2. Система свертывания крови - это разветвленная мультиферментная
система, работающая по принципу каскадности (усиление первично слабого
сигнала).
3. Оба механизма свертывания сливаются на уровне активации протромбина
- это единая система, потому что активация одного механизма приводит к
включению другого. Например: активация фXII на поверхности
коллагеновых волокон приводит к активации фVII.
4. Система сааморегулируется по принципу обратной связи. Наблюдается
положительная обратная связь на начальных стадиях работы системы, что
позволяет многократно усиливать первично слабый сигнал (факторы X и
VII). Отрицательная обратная связь чаще встречается на конечных стадиях
(цель - самоограничение процесса: тромбин и протромбин)
5) На автономную регуляцию процесса накладывается нейрогормональная.
Адреналин вызывает освобождение тромбопластина и тканевого активатора
плазминогена из эндотелия сосудов, а также превращение фXII в фXIIa.
6) Система свертывания крови представляет собой каскад реакций, а
ферменты фибринолиза находятся вне этого каскада. Смысл: система
фибринолиза и система свертывания крови работают у нас в организме
постоянно, но с чрезвычайно низкой скоростью. В норме у человека
уравновешены процессы свертывания и фибринолиза. Это обеспечивает
постоянную готовность организма ответить на действие различных
повреждающих факторов. В случае травмы организм может очень быстро
усилить работу системы свертывания крови. При этом система фибринолиза
не может обеспечить значительного прироста активности плазмина и он не
успевает гидролизовать фибрин. Благодаря этому осуществляется гемостаз.
В период Великой Отечественной войны группой ученых под
руководством Палладина был синтезирован ВИКАСОЛ - водорастворимый
аналог витамина "К".
48
49.
Некоторое время назад был синтезирован АНТИВИТАМИН "К". Ониспользуется для лечения больных со склонностью к тромбообразованию.
Сейчас разработаны препараты фXIII и фIX для лечения больных.
Недавно из мочи выделена УРОКИНАЗА. Этот фермент катализирует
превращение плазминогена в плазмин, который обладает высокой
протеолитической активностью.
СИСТЕМА КОМПЛЕМЕНТА.
Система комплемента
- это сложный комплекс сывороточных
глобулинов.
Это каскадная система протеолитических ферментов
предназначена для гуморальной защиты организма от действия чужеродных
агентов и участвует в реализации иммунного ответа организма. Белки
системы комплемента обеспечивают быстрый и эффективный ответ на на
первично слабый сигнал и доведение его до функциональных последствий.
Компоненты системы комплемента принято
обозначать латинскими
буквами.
Существуют два механизма активации системы комплемента:
1. КЛАССИЧЕСКИЙ
2. АЛЬТЕРНАТИВНЫЙ
Эти механизмы соединяются на уровне 5-го компонента и
протекают одинаково.
затем
КЛАССИЧЕСКИЙ ПУТЬ.
Пусковым механизмом является образование комплекса "антигенантитело" (АГ-АТ) на поверхности клетки-мишени. При этом в молекуле
49
50.
иммуноглобулина(
он
обозначается:
Ig
или
АТ)происходят
конформационные изменения. В результате этих изменений Ig приобретает
способность связывать С1q-компонент комплемента. К ним присоединяются
C1r и C1s, и уже весь этот комплекс подвергается конформационной
перестройке и превращается в С1-эстеразу, которая действует на С4,
отщепляется С4а, а С4b входит в состав комплекса. Затем к комплексу
присоединяется С2, формируя новый субстрат для действия С1s,
отщепляется С2b, а С2a входит в состав комплекса.
Образовавшийся комплекс называется "С3-конвертаза", и под его
действием отщепляется пептид С3a, а С3b входит в состав комплекса,
который теперь называется "С5-конвертаза". С5-конвертаза действует на С5,
отщепляет от него С5а, а С5b входит в состав комплекса.
После этого с С5b последовательно связываются С6, С7 и С8. В
результате образуется комплекс, способный присоединять 2 молекулы С9.
Если этот процесс протекает на поверхности клетки-мишени, то
компоненты комплекса С5b-C9 образуют мембраноатакующий комплекс,
который формирует на поверхности клетки-мишени трансмембранные
каналы, полностью проницаемые для электролитов и воды. Клетка-мишень
погибает.
Побочные (неосновные) продукты процесса С3а и С5а обладают
свойствами анафилотоксинов.
Регуляция классического пути:
Большинство компонентов активны только в составе комплекса. Их
активные формы способны существовать очень короткое время. Если в
течение этого времени они не встретятся со следующим компонентом, то
активные формы теряют связь с комплексом и становятся неактивными. Если
концентрация какого-то компонента ниже пороговой (критической), то
работа системы комплемента не приведет к физиологическим последствиям.
В регуляции работы системы комплемента также принимают участие
эндогенные ингибиторы протеиназ. Самым эффективным из них является
С1-ингибитор.
АЛЬТЕРНАТИВНЫЙ ПУТЬ
Отличие альтернативного пути от классического заключается в том,
что для его запуска не нужно образования иммунных комплексов.
Пусковым механизмом альтернативного пути является образование
С3b из С3 под действием какого-либо пускового фактора: например,
полисахаридов бактериальной клеточной стенки.
С3b образует комплекс с фактором "В" (С3bB), который подвергается
действию протеазы D (всегда активна в плазме крови!). В результате
50
51.
отщепляется "Ва" и образуется комплекс С3bBb, который обладаетпротеолитической активностью в отношении С5 - отщепляет от него С5а.
После этого реакции протекают так же, как и в классическом пути.
Субстратом для С3b является и С3, в результате чего образуется еще
большее количество С3b - наблюдается положительная обратная связь.
Поэтому достаточно даже небольших количеств С3bBb, чтобы получать все
больше и больше его активной формы (усиление первично слабого сигнала).
Альтернативный путь в норме работает всегда и очень активно, что
обеспечивает быстрый неспецифический ответ на внедрение чужеродных
клеток.
В регуляции работы системы комплемента принимают участие
специфические ингибиторы, которые регулируют скорость работы
ферментов ключевых реакций.
СИСТЕМА РЕГУЛЯЦИИ СОСУДИСТОГО ТОНУСА
В нашем
организме
есть
две
взаимосвязанные
протеолитических
ферментов,
в
результате
работы
регулируется сосудистый тонус.
системы
которых
1.
РЕНИН-АНГИОТЕНЗИН-АЛЬДОСТЕРОНОВАЯ
СИСТЕМА
(РААС-система).
Работа этой системы направлена на повышение артериального давления.
2. КИНИНОВАЯ СИСТЕМА.
Направлена на понижение
артериального давления.
Активация обеих систем сводится к
синтезу
биологически
активных низкомолекулярных пептидов из их предшественников путем
реакций ограниченного протеолиза.
Главная роль принадлежит РААС, которая регулирует сосудистый
тонус и водно-солевой обмен.
В почках в клетках юкстагломерулярного
аппарата
(ЮГА)
синтезируется РЕНИН - протеолитический фермент. Ренин участвует в
регуляции сосудистого тонуса, превращая ангиотензиноген в декапептид
ангиотензин-I путем ограниченного протеолиза. Из ангиотензина-I под
действием фермента карбоксикатепсина образуется (тоже путем
ограниченного протеолиза)
октапептид ангиотензин-II. Он обладает
сосудосуживающим эффектом, а также стимулирует выработку гормона
коры надпочечников - альдостерона. Альдостерон усиливает реабсорбцию
натрия и воды в почечных канальцах - это приводит к увеличению объема
крови, циркулирующей в сосудах. В результате повышается артериальное
давление. Когда молекула ангиотензина-II выполнит свою функцию, она
подвергается тотальному протеолизу под действием группы специальных
протеиназ - ангиотензиназ. Так работает РЕНИН-АНГИОТЕНЗИНАЛЬДОСТЕРОНОВАЯ СИСТЕМА.
51
52.
Выработка ренина зависит от кровоснабжения почек. Поэтому приснижении артериального давления выработка ренина увеличивается, а при
повышении - снижается.
При патологии почек иногда наблюдается
повышенная выработка ренина и может развиваться стойкая гипертензия
(повышение артериального давления).
Ренин-ангиотензин-альдостероновая система работает в
тесном
контакте с другой системой регуляции сосудистого тонуса: КАЛЛИКРЕИНКИНИНОВОЙ СИСТЕМОЙ, действие которой приводит к понижению
артериального давления.
В почках синтезируется белок кининоген. Попадая в кровь, кининоген
под действием сериновых протеиназ - калликреинов превращается в
вазоактивные пептиды - кинины: брадикинин и каллидин. Брадикинин и
каллидин обладают сосудорасширяющим эффектом - понижают
артериальное давление. Инактивация кининов происходит при участии
карбоксикатепсина - этот фермент одновременно влияет на обе системы
регуляции сосудистого тонуса, что приводит к повышению атериального
давления. Ингибиторы карбоксикатепсина применяются в лечебных целях
при лечении некоторых форм артериальной гипертензии.
ЛИМФА.
В кровеносные сосуды ежедневно поступает от 1 до 2 литров лимфы.
Состав лимфы зависит от анатомического строения и расположения
лимфатических сосудов и для каждого человека индивидуален. В лимфе, по
сравнению с кровью, эритроцитов очень мало, а лимфоцитов - много.
Содержание белка в лимфе может быть от 0.2 до 6%. Соотношение
альбуминов и глобулинов = 4/1. Это намного выше, чем в плазме крови.
52


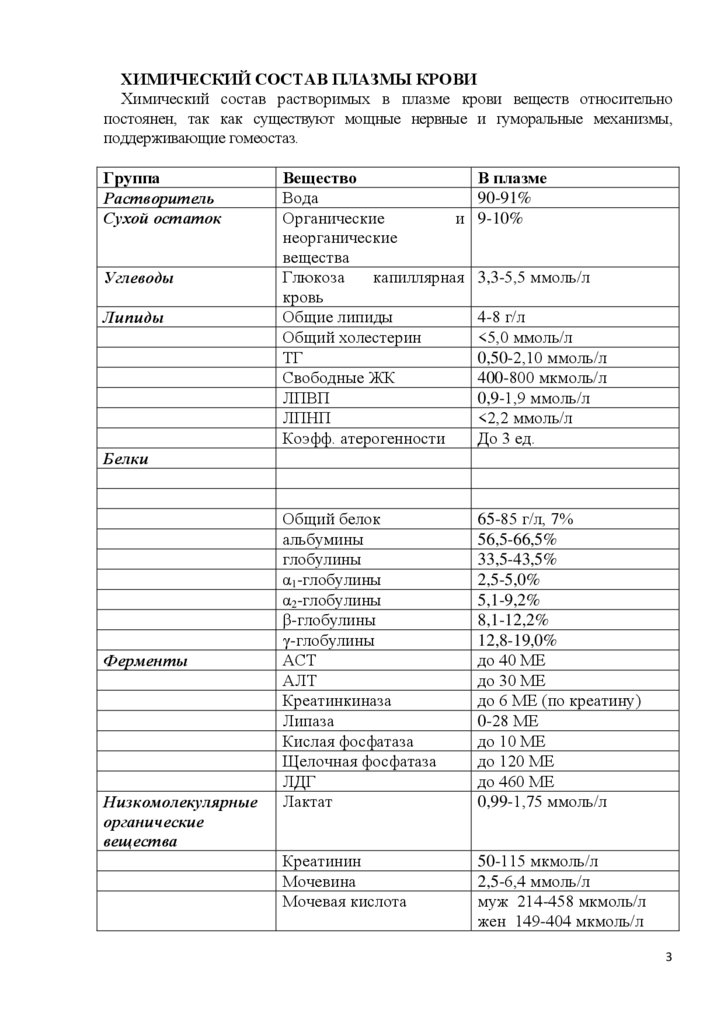























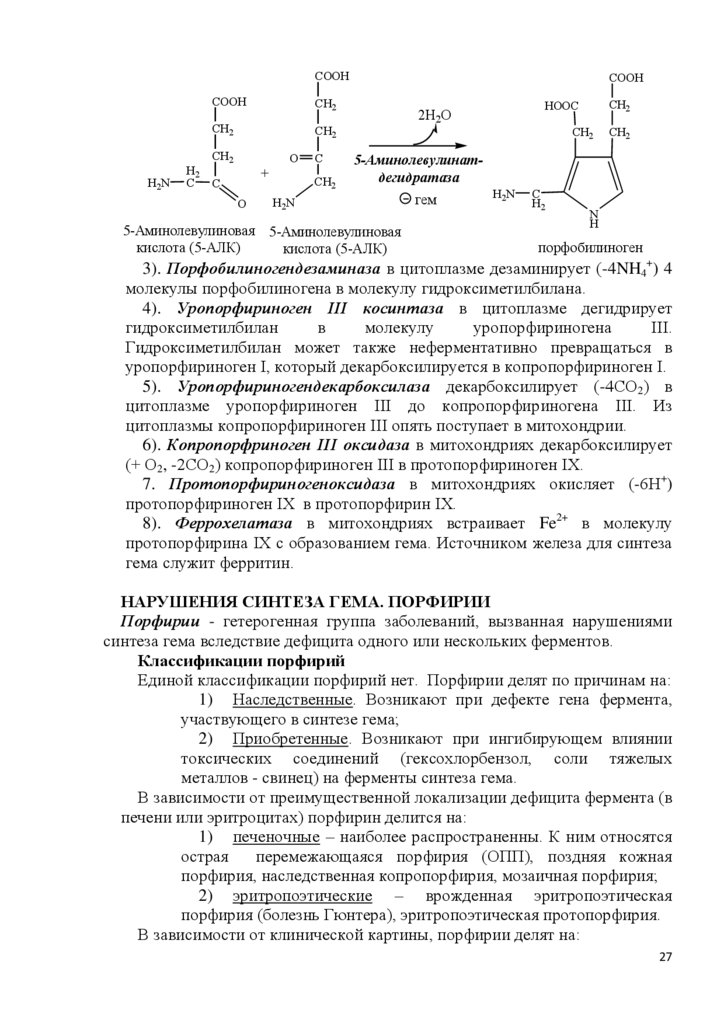








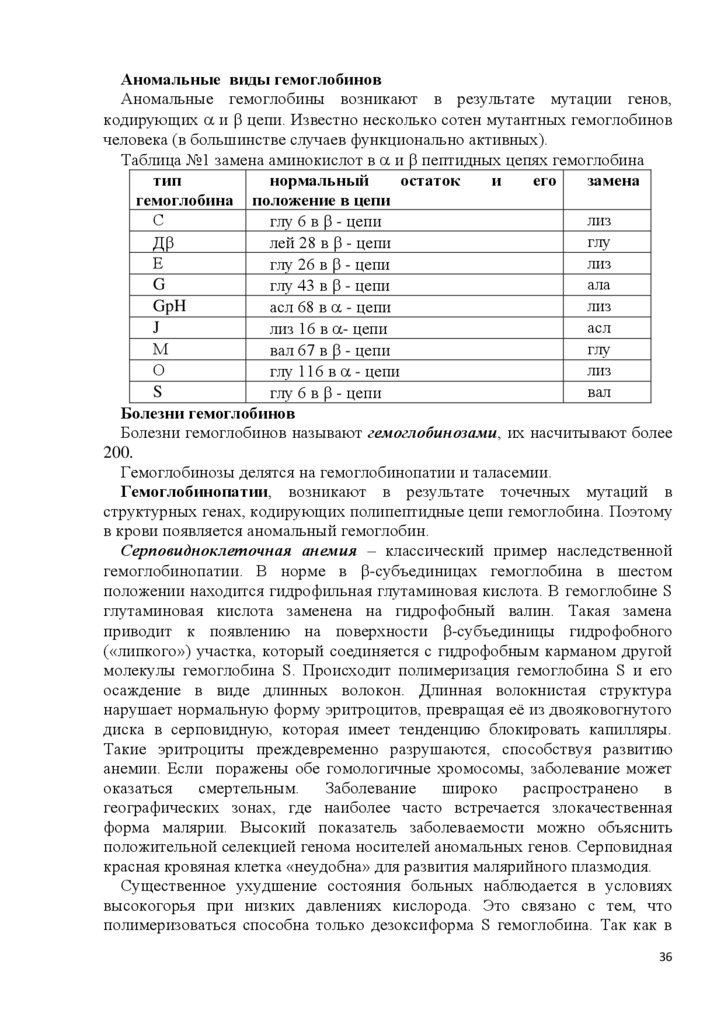
















 biology
biology








