Similar presentations:
Молекулярно-кинетическая теория (МКТ)
1.
Основные положения молекулярнокинетической теории (МКТ)Размеры молекул.
Масса молекул. Количество вещества
Диффузия. Броуновское движение
2.
3.
Молекулярно-кинетическаятеория (МКТ) учение, которое объясняет
строение и свойства тел движением и
взаимодействием частиц, из которых
состоят тела.
4.
Фундаментом МКТ является атомистическаягипотеза:
все тела в природе состоят из мельчайших
структурных единиц – атомов и молекул
5.
Частицымолекулы
атомы
электроны
ядро
нейтроны
протоны
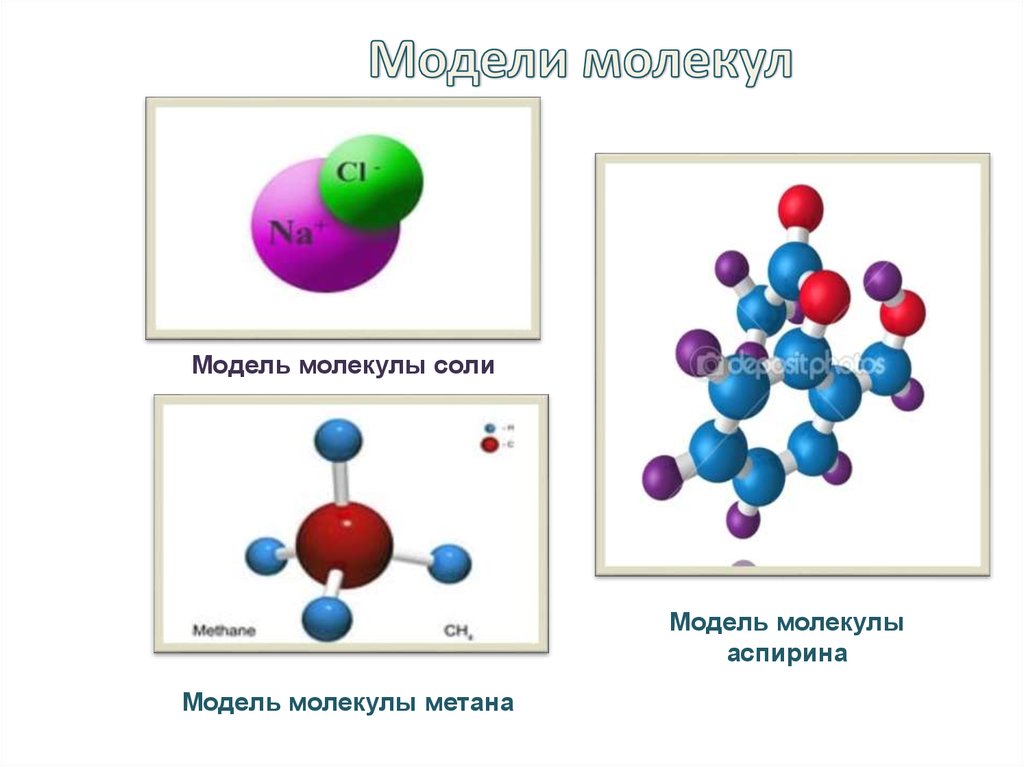
6. Модели молекул
Модель молекулы солиМодель молекулы
аспирина
Модель молекулы метана
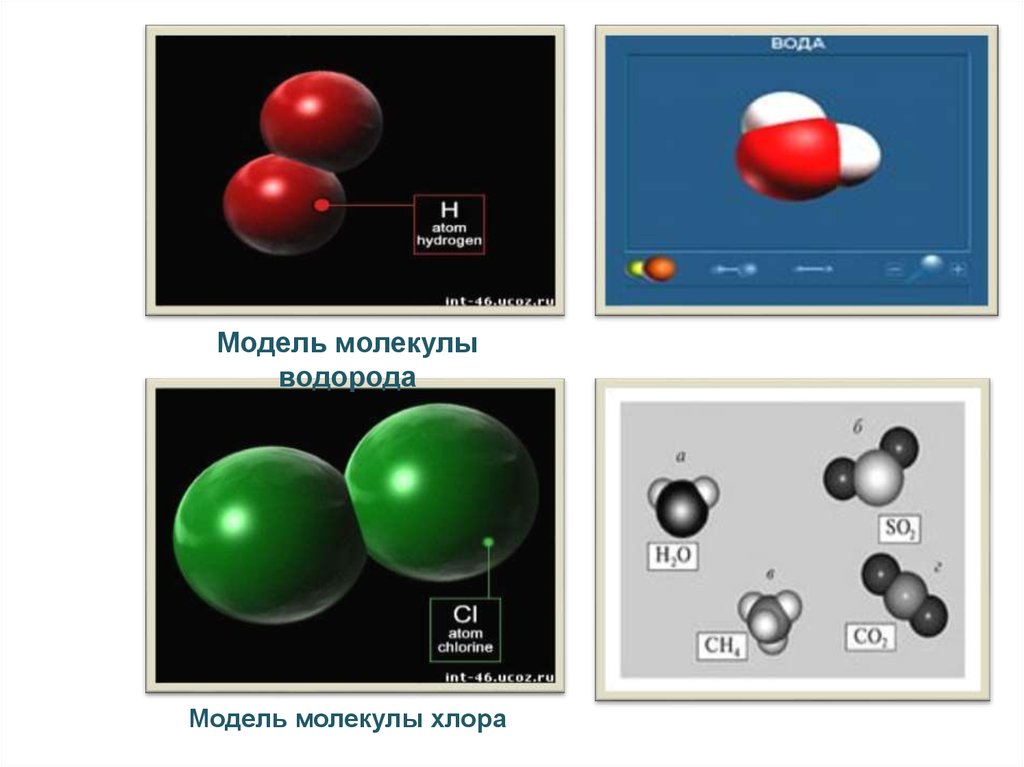
7.
Модель молекулыводорода
Модель молекулы хлора
Модель молекулы воды
8. Основные положения МКТ:
• 1. все тела состоят из молекул, междукоторыми есть промежутки;
• 2. частицы вещества находятся в
непрерывном хаотическом движении;
• 3. частицы вещества взаимодействуют друг
с другом
9.
Косвенные доказательства:• дробление вещества
• Испарение
• расширение и сжатие при изменении
температуры или деформации
• диффузия
Прямые доказательства:
• фотографии отдельных больших молекул
• определение параметров молекул
(d, m, v …)
10.
Диффузия – это проникновение молекул одного вещества вмежмолекулярное пространство другого.
11.
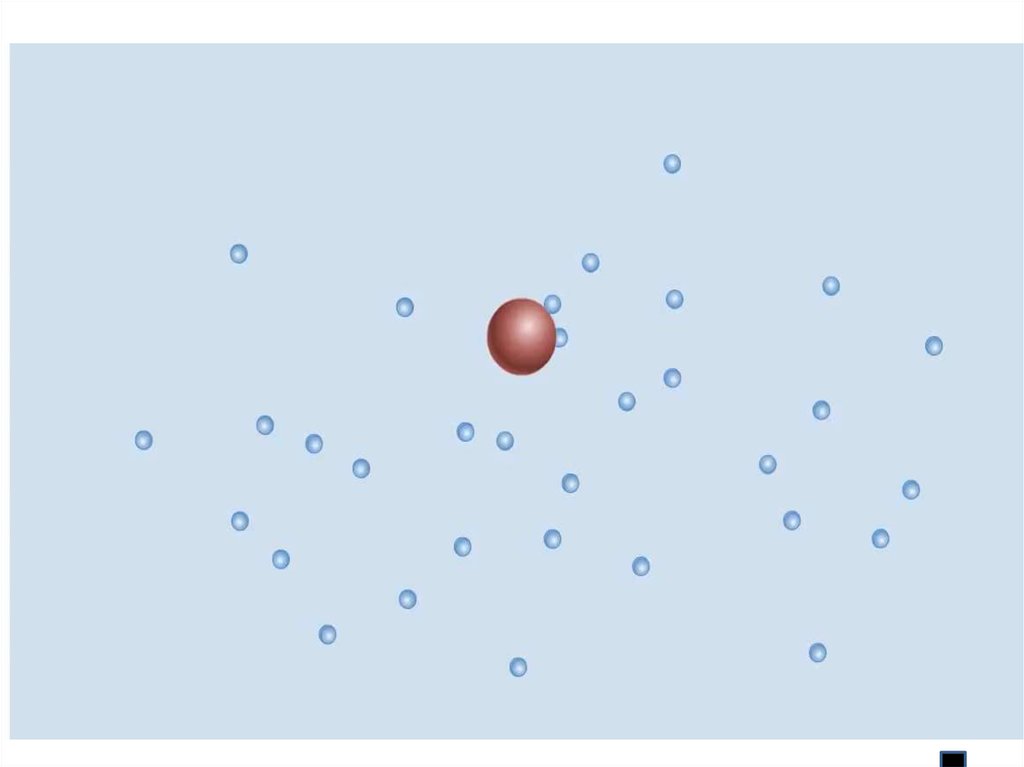
Броуновское движение- это беспорядочное непрерывноедвижение мельчайших, взвешенных в жидкости или газе частиц
твердого тела под ударами молекул жидкости или газа
Характер движения
движения зависит
от
Характер
зависит
Характер движения зависит от
видажидкости,
жидкости,
от вида
вида жидкости, размера и
размера
и формы
частиц,
формы
частиц,
температуры.
размера
и формы
частиц,
температуры.
температуры.
Причина: удары молекул
жидкости
о частицу не
компенсируют
друг друга
Р. Броун 1827 г.
12.
13.
14.
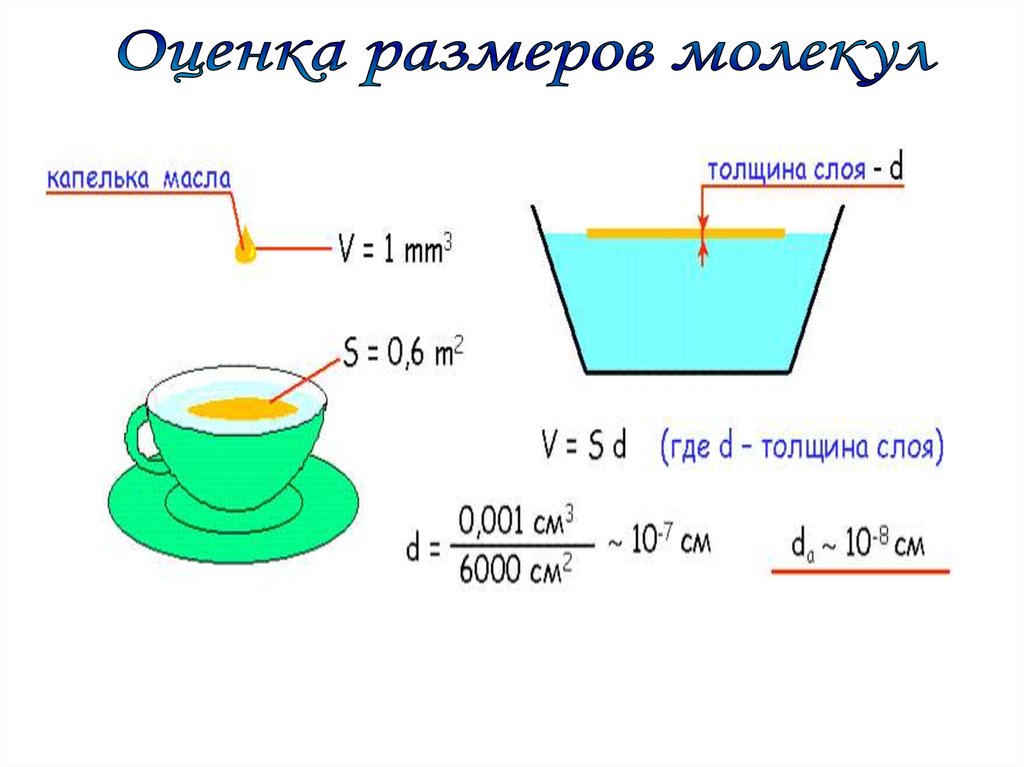
Подсчитаем приблизительное число молекул в капле водымассой 1 г и, следовательно объемом 1 см3.
8 3
d
3
10см VH 2O (3 10 ) cм
H
O
2
8
3
Vкапл и
1 см
22
N
3,7 10
8 3
3
V м ол екул ы (3 10 ) см
3
15.
Вычислим массу одной молекулы воды.В 1 г воды содержится 3,7·1022 молекул.
m
m0
N
mOH O
2
1 г
23
2
,
7
10
г
22
3,7 10
16.
Относительной молекулярной (или атомной) массойвещества Мr называют отношение массы молекулы (или
атома) m0 данного вещества к 1/12 массы атома углерода
m0C
m0
Mr
1
m0C
12
Вычислим Mr воды Н2О (для этого воспользуемся таблицей Менделеева)
Mr (Н2О)= 2·1+16=18 а.е.м.
Атомная единица массы (а.е.м.) ≈ 1,66·10-27 кг
17.
Один моль – это количествовещества,
в
котором
содержится столько же молекул
или атомов, сколько атомов
содержится в углероде массой
12 г.
1 моль любого вещества
же число атомов или
атомов
обозначают
постоянной Авогадро
ученого (XIX в.).
содержится одно и то
молекул. Это число
NA
и
называют
в честь итальянского
NA = 6·1023 моль-1
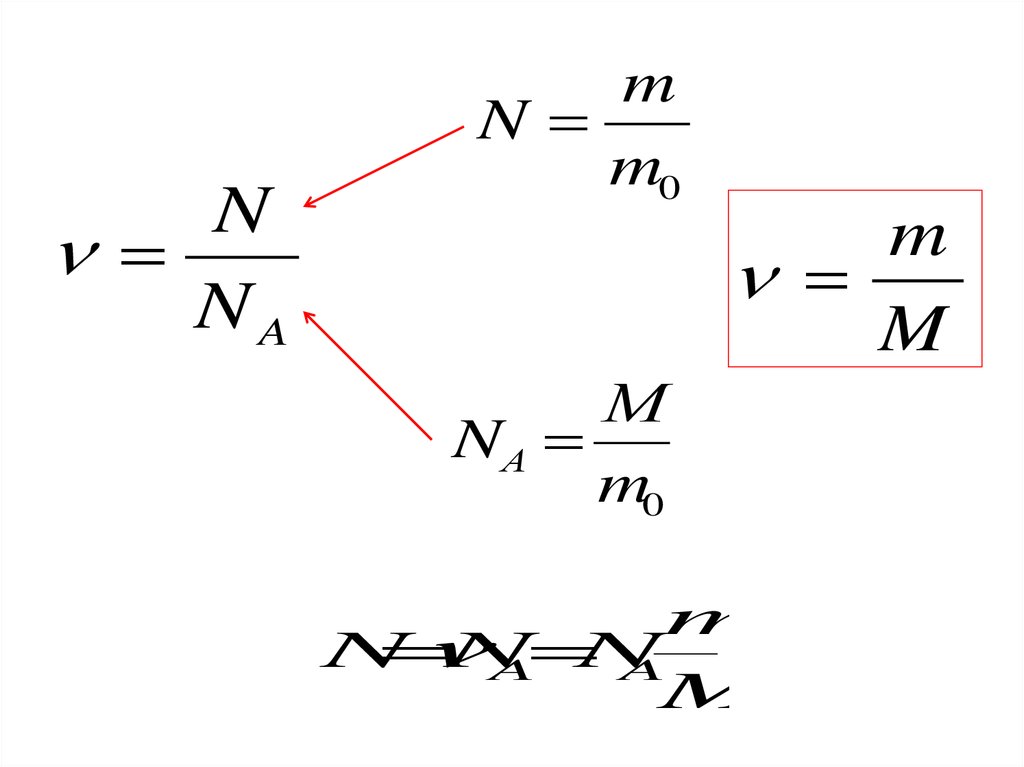
18.
Количество вещества ν равно отношениючисла молекул N в данном теле к постоянной
Авогадро NA, т. е. к числу молекул в 1 моль
вещества:
N
NA
19.
Молярной массой М вещества называют массу вещества,взятого в количестве 1 моль.
M = m0 NA
М
NА
m0
Масса т любого количества вещества равна произведению
массы одной молекулы на число молекул в теле:
m = m0N
m
N
m0
M M r 10 3 кг / моль
20.
NNA
m
N
m0
m
M
М
NА
m0
m
N
N
N
A
A
M















 physics
physics








