Similar presentations:
Cложные реакции. Лекция 3
1. Cложные реакции
Лекция 32. Приближенные методы описания кинетики сложных реакций
• Метод квазистационарных концентраций(МКСК)
• Метод квазиравновесных концентраций –
(МКРК)
• Метод лимитирующей стадии
3. Принцип детального равновесия
• Принцип детального равновесия (принципмикрообратимости)
• Если в сложном процессе устанавливается
химическое равновесие, то скорости
прямой и обратной реакций должны быть
равны для каждой элементарной стадии.
ri = r-i и ki = k-i ; K = ki/ k-i
4. Приближенные методы описания кинетики сложных реакций
• Метод квазиравновесных концентраций –(МКРК) работает при наличии в механизме
реакции равновесных стадий:
A+B=X
KC= CX/CACB ; CX = KC CACB
X + A Пр
r2 = k2CACX
WПр = ?
WПр = r2 = k2CACX
WПр = k2KCCA2CB
Условия для реализации МКРК: k2<<k1,k-1
5. Метод лимитирующей стадии
В любой сложной реакции можно выделитьсамую медленную стадию. Такую стадию
называют скоростьопределяющей стадией
или лимитирующей стадией. Таких стадий
может быть несколько, но преимущественно
это одна стадия.
Следствие: кинетические характеристики
стадий протекающие после лимитирующей
не входят в кинетическое уравнение реакции:
Wi = rлим
6. Пример
1 стадия процесса является лимитирующая:A+B=X
A+B X
r1 = k1CACB
X + A Пр
X A+B
r-1 = k-1CX
WПр = ?
X + A Пр r2 = k2CACX
WПр = rлим = r1 = k1CACB
Вывод: Константа скорости лимитирующей
стадии в явном виде входит в уравнение
скорости (в данном случае k1) (вернутся к МКРК)
7. И кто сказал, что сложно ?
8. Цепные радикальные реакции
• Радикальная реакция, в которой превращение исходных веществ в продуктыосуществляется путем многократного
циклического чередования элементарных
актов с участием активных частиц свободных радикалов или атомов.
• Типичные цепные реакции –
галогенирование, окисление,
полимеризация, ядерные процессы.
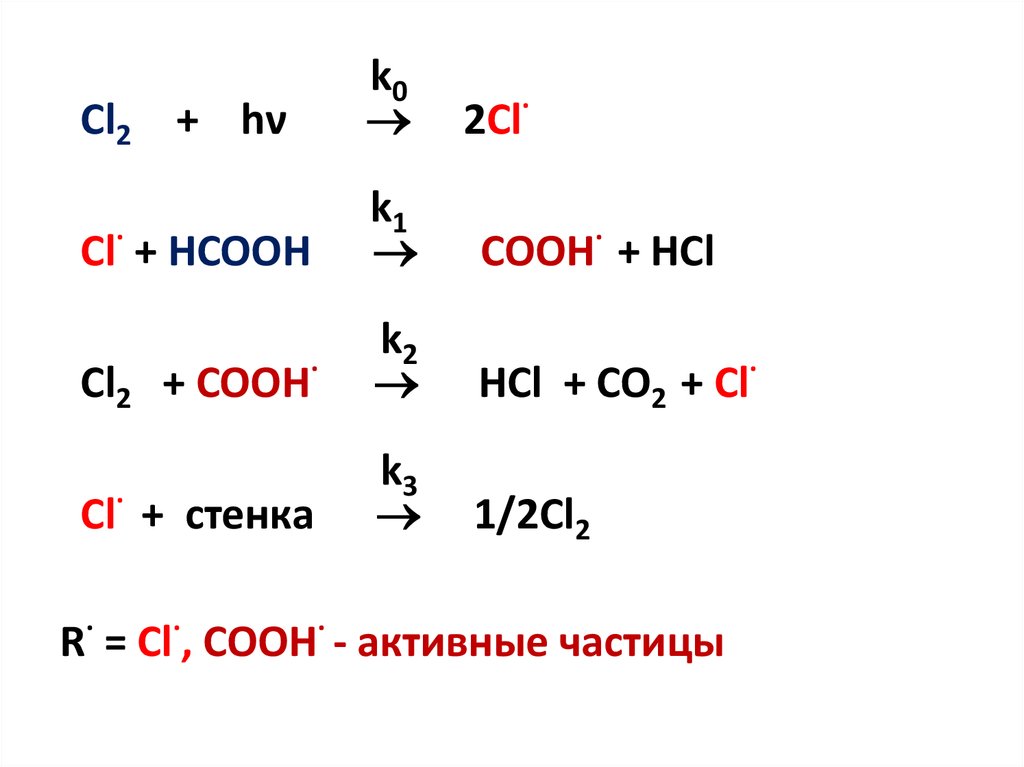
9.
Cl2 + hνk0
Cl· + HCOOH
k1
COOH· + HCl
Cl2 + COOH·
k2
HCl + CO2 + Cl·
Cl· + стенка
k3
1/2Cl2
2Cl·
R· = Cl·, COOH· - активные частицы
10. Цепной характер реакции
• Механизм такого процесса можнопредставить как регулярное чередование
нескольких последовательных реакций,
например:
r1
r2
- Cl· COOH· Cl·
- Количество цепей может быть несколько
- COOH· Cl· COOH·
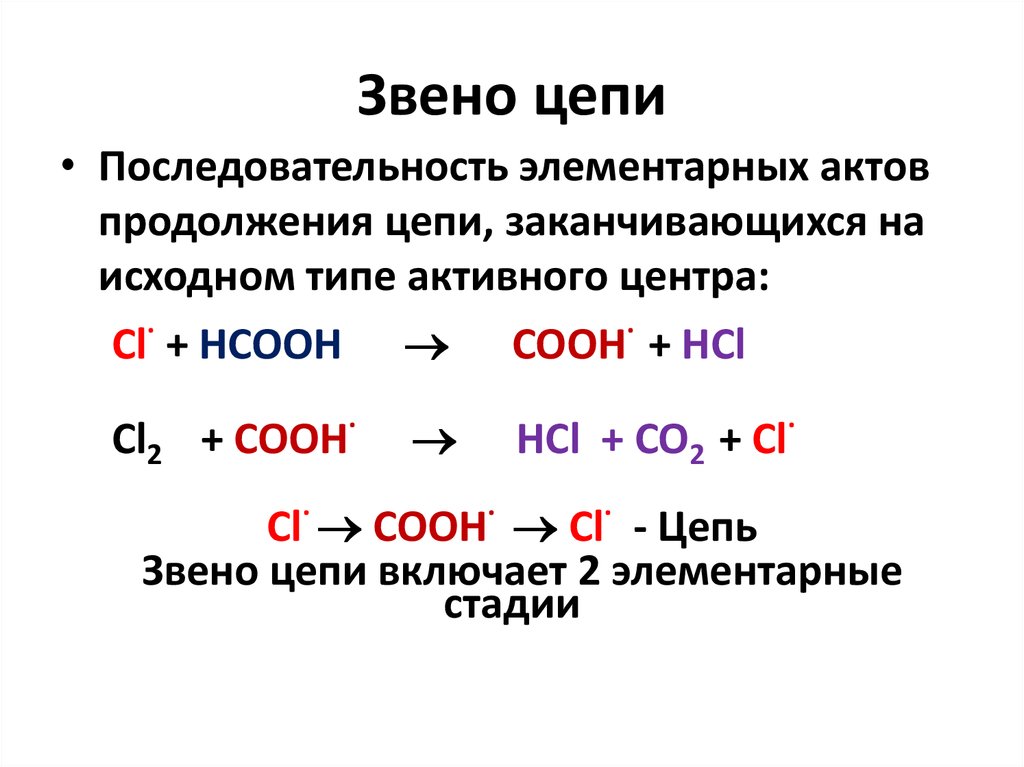
11. Звено цепи
• Последовательность элементарных актовпродолжения цепи, заканчивающихся на
исходном типе активного центра:
Cl· + HCOOH COOH· + HCl
Cl2 + COOH·
HCl + CO2 + Cl·
Cl· COOH· Cl· - Цепь
Звено цепи включает 2 элементарные
стадии
12. Основные стадии цепного процесса
• Стадия зарождения (инициирования) цепи• Стадии продолжения цепи
• Стадии разветвления цепи (для
разветвленных цепных реакции
• Стадии обрыва цепи
В случае процесса полимеризации число
стадий увеличивается
13. Стадии зарождения цепи
Это стадии, в которой образуются исходныеактивные частицы.
Зарождение (инициирования) цепи может быть
вызвано различными причинами:
toC
- распадом молекулы на радикалы СH3-CH3 2CH3.
- гетерогенными условиями протекания реакции;
Cl2 + Стенки сосуда 2Cl·
- инициированием извне, в том числе под
действием света и ионизирующего излучения;
Cl2 + hν
2Cl·
- добавками специальных веществ – инициаторов
образования свободных радикалов ROOR 2RO..
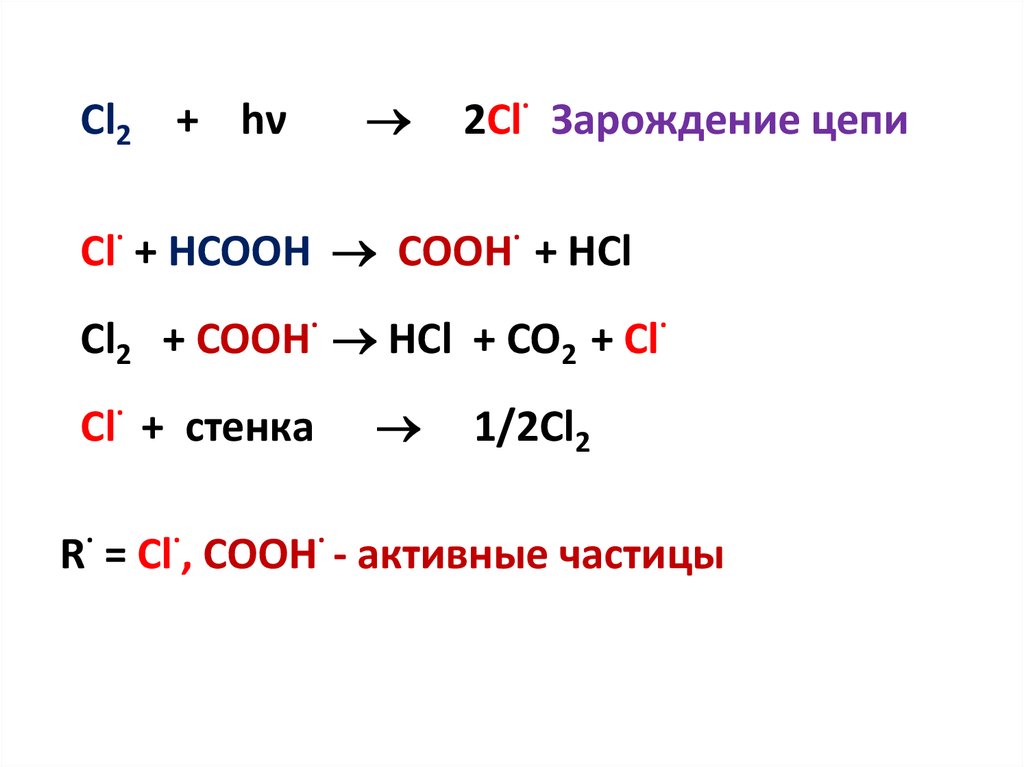
14.
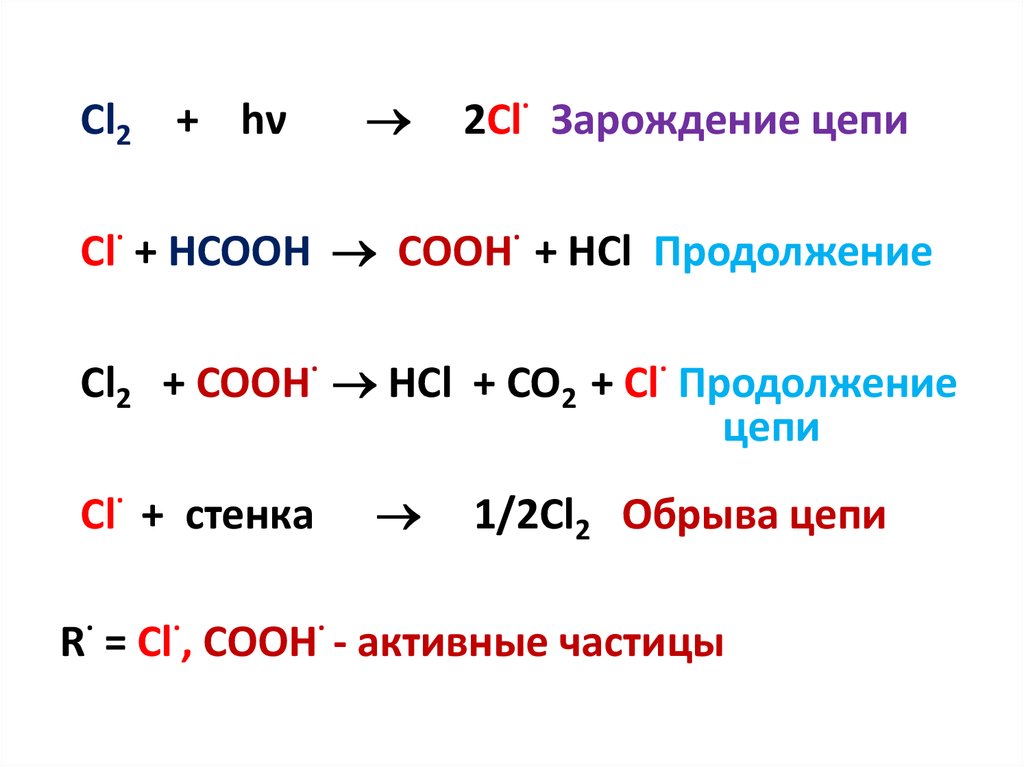
Cl2 + hν2Cl· Зарождение цепи
Cl· + HCOOH COOH· + HCl
Cl2 + COOH· HCl + CO2 + Cl·
Cl· + стенка
1/2Cl2
R· = Cl·, COOH· - активные частицы
15. Cтадии продолжения цепи
• Это стадии, в которых образуются продуктыреакции и новые радикалы (Принцип
неуничтожимости свободной валентности).
Cl· + HCOOH COOH· + HCl
Cl2 + COOH·
HCl + CO2 + Cl·
Данная стадия состоит из большого числа
повторяющихся элементарных реакций
взаимодействия активных частиц с реагентами.
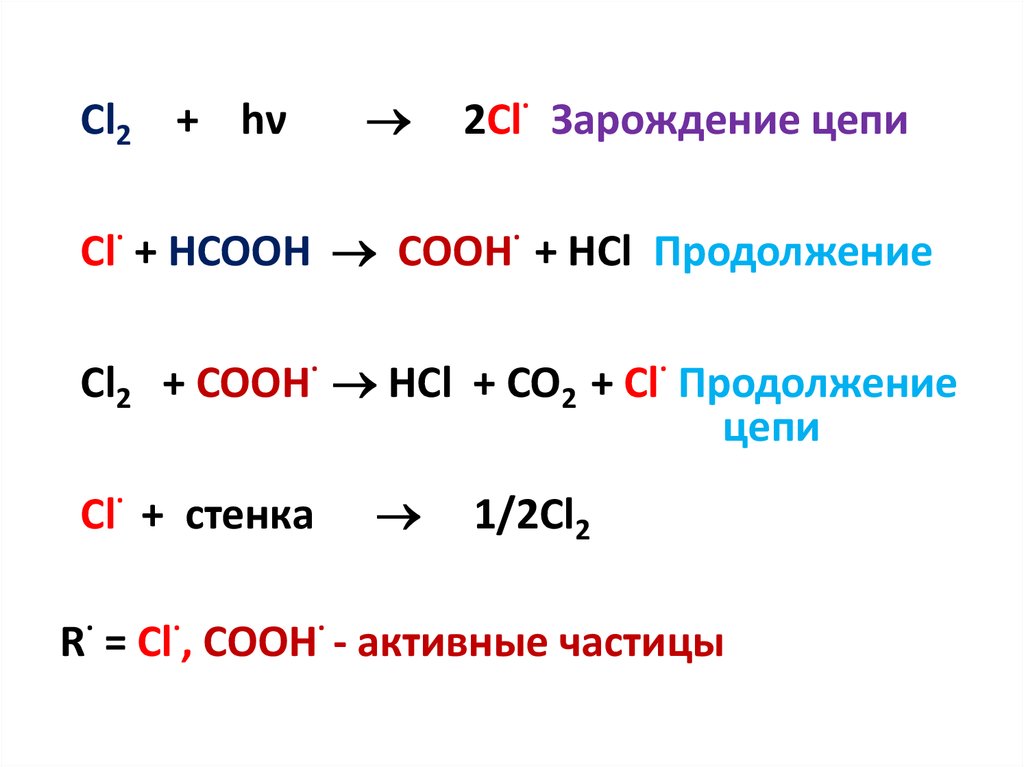
16.
Cl2 + hν2Cl· Зарождение цепи
Cl· + HCOOH COOH· + HCl Продолжение
Cl2 + COOH· HCl + CO2 + Cl· Продолжение
цепи
Cl· + стенка
1/2Cl2
R· = Cl·, COOH· - активные частицы
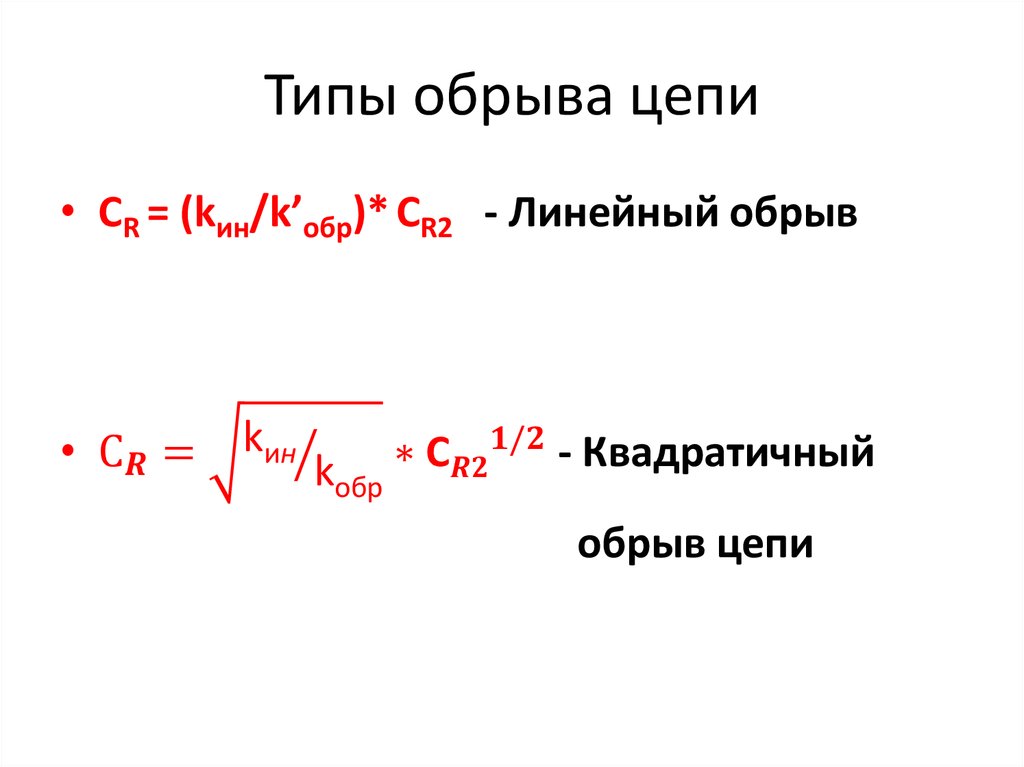
17. Стадия обрыва цепи
Обрыв цепи - гибель активного центра,которая происходит в случае :
1) Реакции между двумя активными
частицами (квадратичный обрыв цепей);
2) Реакции активной частицы с молекулой с
образованием неактивного радикала, который
в данных условиях не может продолжать цепь
(линейный гомогенный обрыв цепей);
3) Реакции активной частицы с поверхностью
(гетерогенный обрыв цепей).
18.
Cl2 + hν2Cl· Зарождение цепи
Cl· + HCOOH COOH· + HCl Продолжение
Cl2 + COOH· HCl + CO2 + Cl· Продолжение
цепи
Cl· + стенка
1/2Cl2 Обрыва цепи
R· = Cl·, COOH· - активные частицы
19. Интересно - Гель-эффект
Ускорение полимеризации с увеличениемвязкости раствора. Гель-эффект проявляется в
том, что начиная с некоторой глубины
происходит ускорение полимеризации и
увеличение степени полимеризации. Вызван
гель-эффект тем, что увеличение вязкости
среды затрудняет обрыв цепей по реакции
между двумя макрорадикалами, а это
приводит к увеличению концентрации
радикалов и ускорению полимеризации.
20. Типы цепных реакций
• Неразветвленная цепная реакция( рассмотренная выше реакция)
• Разветвленная цепная реакция .
Характеризуется появлением новой стадии –
- Стадии разветвления цепи:
Н· + O2 OН· + O: ; O: + Н2 OН· + Н·
Из одного радикала образуются два или
более радикалов
21. Неразветвленные цепные реакции Н2 + Br2 НBr
Неразветвленные цепные реакцииН2 + Br2 НBr
k1
Br2 2Br· ;
Wин = r1= k1*СBr2
k2
Br· + Н2 Н· + НBr ; W’пр = r2 = k2*СBr*СH2
k3
Н· + Br2 Br· + НBr ; W”пр = r3 = k3*СBr2*СH
k4
Н· + НBr Br· + Н2 ; W”’пр = r4 = k4*СH*СHBr
k5
2Br· Br2 ;
Wобр = r5= k5*С2Br
Дж. Христиансен, К. Герцфельд и Поляни (1919 г.)























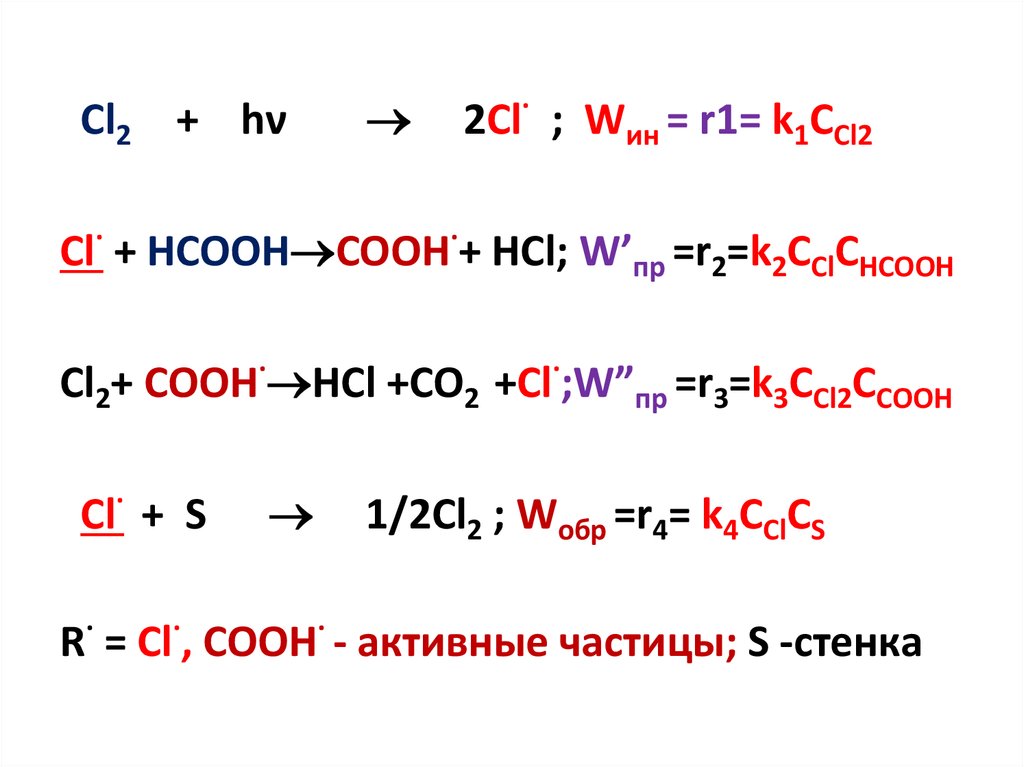















 chemistry
chemistry








