Substancje i ich przemiany
1. Slajd 1
Substancje i ich przemiany2. Slajd 2
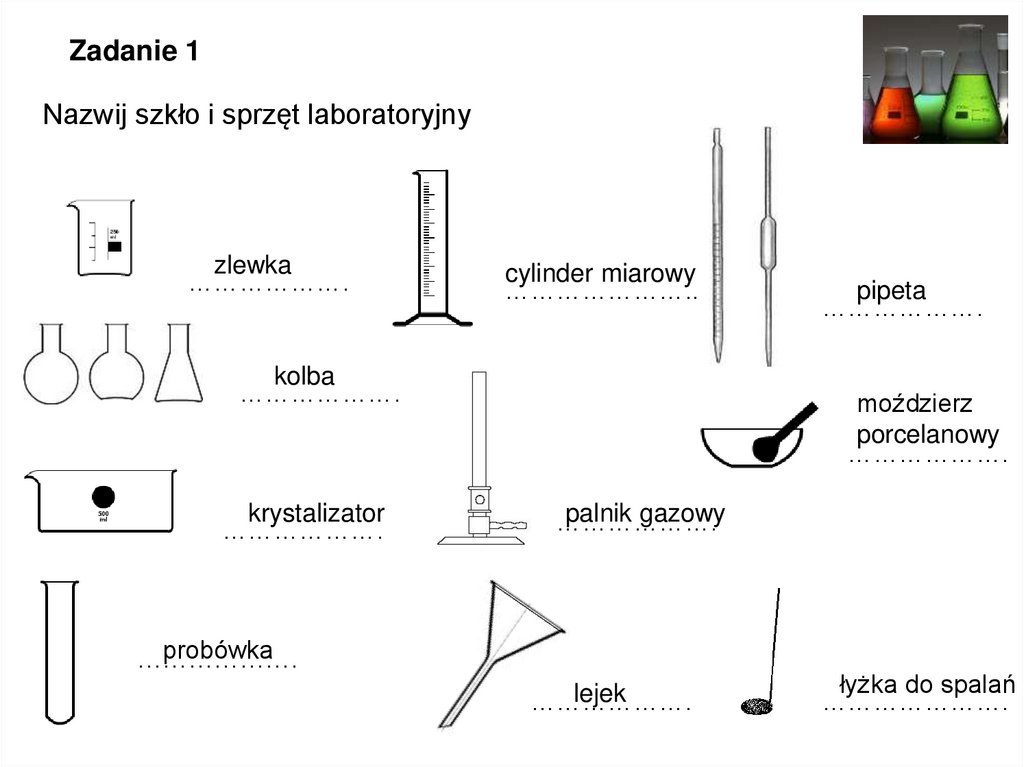
Zadanie 1Nazwij szkło i sprzęt laboratoryjny
zlewka
……………….
cylinder miarowy
…………………..
kolba
……………….
krystalizator
……………….
pipeta
……………….
moździerz
porcelanowy
……………….
palnik gazowy
……………….
probówka
……………….
lejek
……………….
łyżka do spalań
………………….
3. Slajd 3
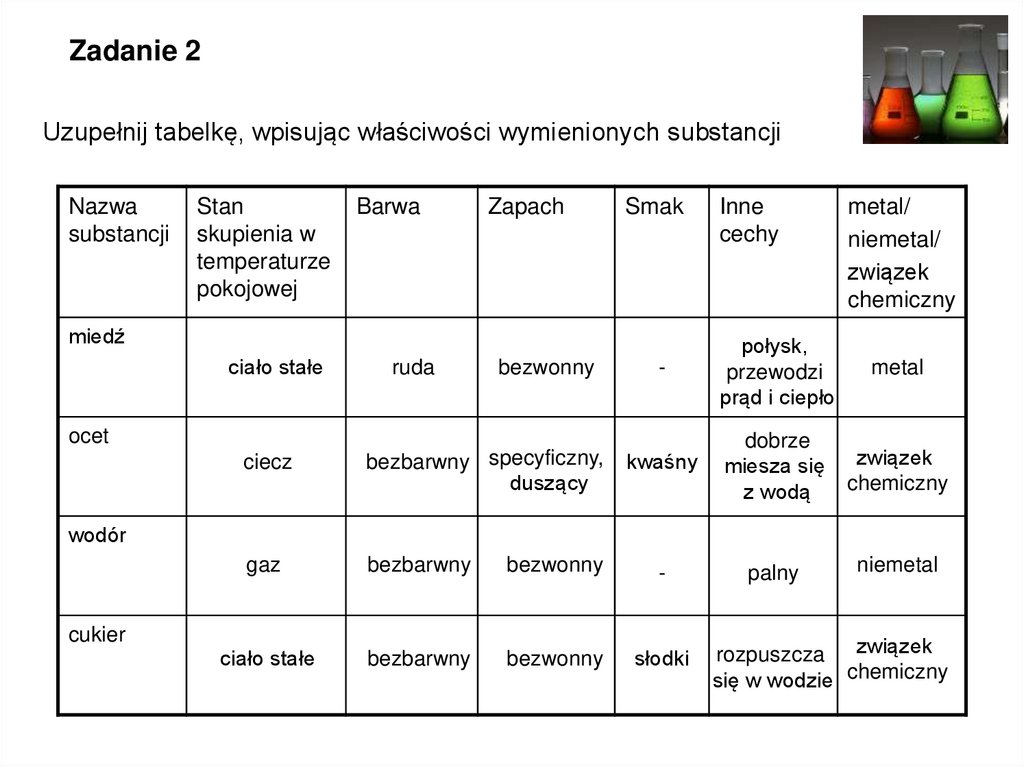
Zadanie 2Uzupełnij tabelkę, wpisując właściwości wymienionych substancji
Nazwa
substancji
Stan
skupienia w
temperaturze
pokojowej
Barwa
Zapach
Smak
miedź
ciało stałe
ruda
bezwonny
Inne
cechy
metal/
niemetal/
związek
chemiczny
-
połysk,
przewodzi
prąd i ciepło
metal
kwaśny
dobrze
miesza się
z wodą
związek
chemiczny
palny
niemetal
ocet
ciecz
bezbarwny specyficzny,
duszący
gaz
bezbarwny
bezwonny
-
ciało stałe
bezbarwny
bezwonny
słodki
wodór
cukier
rozpuszcza związek
się w wodzie chemiczny
4. Slajd 4
Zadanie 3Na podstawie opisów rozpoznaj substancje
A. Ma postać krystaliczną, rozpuszcza się w wodzie.
Jest najpopularniejszą przyprawą kuchenną. Spożywana w nadmiarze
może być przyczyną poważnych schorzeń m.in. nadciśnienia tętniczego.
sól
B. Ma budowę krystaliczną. Dobrze rozpuszcza się w wodzie.
Jest używany do zakwaszania potraw zamiast szkodliwego dla zdrowia octu.
kwasek cytrynowy
C. Ma gazowy stan skupienia, jest żółtozielonej barwy i
ma ostry zapach. Bywa używany do odkażania wody, np.w basenach
chlor
5. Slajd 5
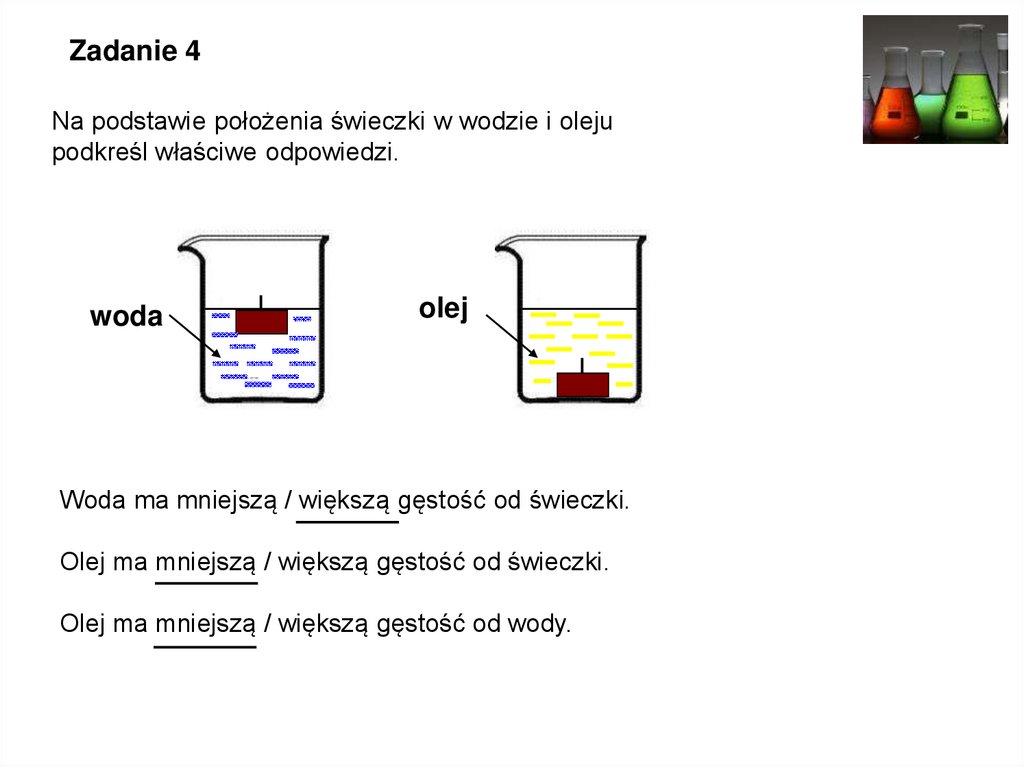
Zadanie 4Na podstawie położenia świeczki w wodzie i oleju
podkreśl właściwe odpowiedzi.
woda
olej
Woda ma mniejszą / większą gęstość od świeczki.
Olej ma mniejszą / większą gęstość od świeczki.
Olej ma mniejszą / większą gęstość od wody.
6. Slajd 6
Zadanie 5W zlewce znajdują się trzy niemieszające się ciecze o gęstościach:
I.
0,785 g/cm3
II.
1,023 g/cm3
III. 1,480 g/cm3
Wpisz na liniach wartości gęstości odpowiadające poszczególnym cieczom.
0,785 g/cm3
1,023 g/cm3
1,480 g/cm3
7. Slajd 7
Zadanie 6Oblicz gęstość kostki wykonanej z glinu o masie 5,4 g i objętości 2 cm3.
I.
Dane:
m = 5,4 g
V = 2 cm3
d=?
II.
Wzór na gęstość
m
d
V
III. Obliczenia
d
5,4 g
g
2
,
7
2cm 3
cm 3
8. Slajd 8
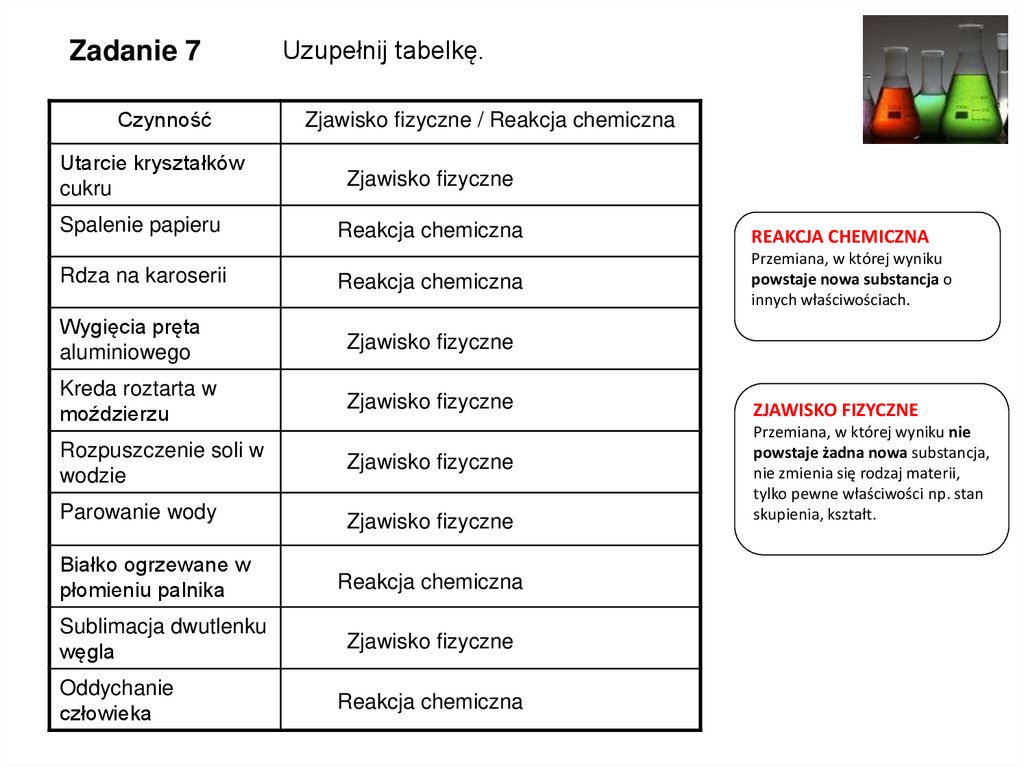
Zadanie 7Czynność
Utarcie kryształków
cukru
Spalenie papieru
Rdza na karoserii
Uzupełnij tabelkę.
Zjawisko fizyczne / Reakcja chemiczna
Zjawisko fizyczne
Reakcja chemiczna
REAKCJA CHEMICZNA
Reakcja chemiczna
Przemiana, w której wyniku
powstaje nowa substancja o
innych właściwościach.
Wygięcia pręta
aluminiowego
Zjawisko fizyczne
Kreda roztarta w
moździerzu
Zjawisko fizyczne
Rozpuszczenie soli w
wodzie
Zjawisko fizyczne
Parowanie wody
Zjawisko fizyczne
Białko ogrzewane w
płomieniu palnika
Sublimacja dwutlenku
węgla
Oddychanie
człowieka
Reakcja chemiczna
Zjawisko fizyczne
Reakcja chemiczna
ZJAWISKO FIZYCZNE
Przemiana, w której wyniku nie
powstaje żadna nowa substancja,
nie zmienia się rodzaj materii,
tylko pewne właściwości np. stan
skupienia, kształt.
9. Slajd 9
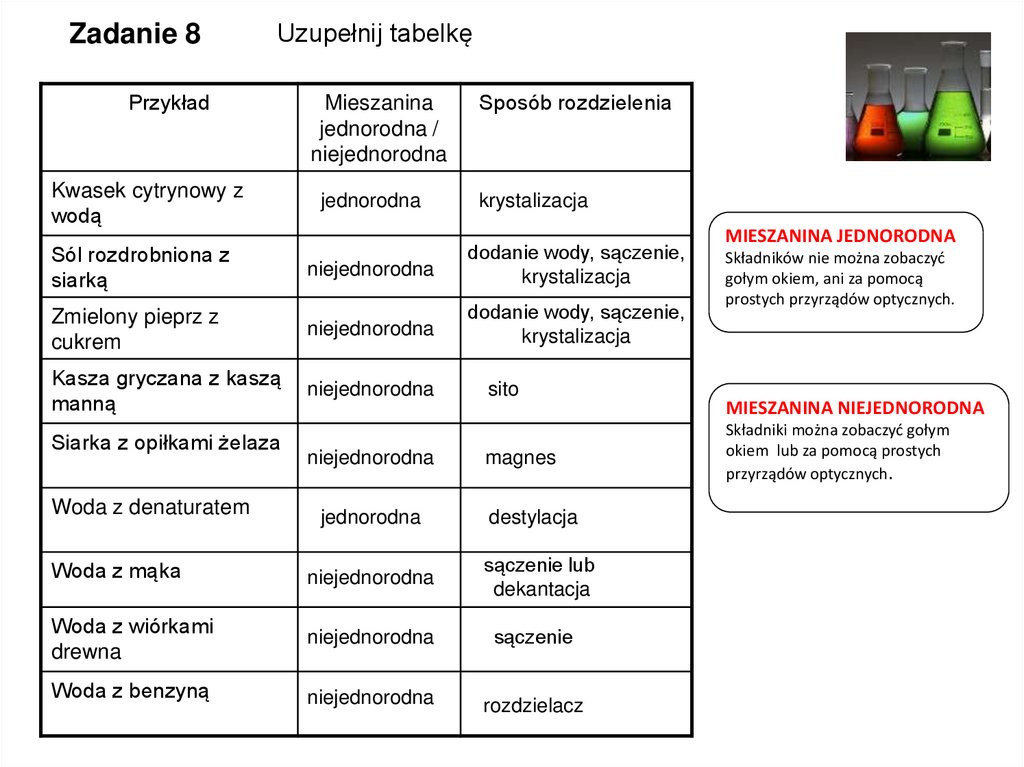
Zadanie 8Uzupełnij tabelkę
Przykład
Kwasek cytrynowy z
wodą
Mieszanina
jednorodna /
niejednorodna
jednorodna
Sposób rozdzielenia
krystalizacja
Sól rozdrobniona z
siarką
niejednorodna
dodanie wody, sączenie,
krystalizacja
Zmielony pieprz z
cukrem
niejednorodna
dodanie wody, sączenie,
krystalizacja
Kasza gryczana z kaszą
manną
niejednorodna
Siarka z opiłkami żelaza
Woda z denaturatem
niejednorodna
sito
magnes
jednorodna
destylacja
Woda z mąka
niejednorodna
sączenie lub
dekantacja
Woda z wiórkami
drewna
niejednorodna
sączenie
Woda z benzyną
niejednorodna
rozdzielacz
MIESZANINA JEDNORODNA
Składników nie można zobaczyć
gołym okiem, ani za pomocą
prostych przyrządów optycznych.
MIESZANINA NIEJEDNORODNA
Składniki można zobaczyć gołym
okiem lub za pomocą prostych
przyrządów optycznych.
10. Slajd 10
Nazwapierwiastka
Symbol
chemiczny
Metal / niemetal
Wodór
H
Na
K
Mg
Ca
Fe
Cu
Ag
Au
Zn
Hg
Al
C
Si
Sn
Pb
N
P
O
S
Cl
niemetal
metal
metal
metal
metal
metal
metal
metal
metal
metal
metal
metal
niemetal
niemetal
metal
metal
niemetal
niemetal
niemetal
niemetal
niemetal
Sód
Potas
Magnez
Wapń
Żelazo
Miedź
Srebro
Złoto
Cynk
Rtęć
Glin
Węgiel
Krzem
Cyna
Ołów
Azot
Fosfor
Tlen
Siarka
Chlor
gaz
gaz
Zadanie 9
Uzupełnij tabelkę.
gaz
gaz
gaz
11. Slajd 11
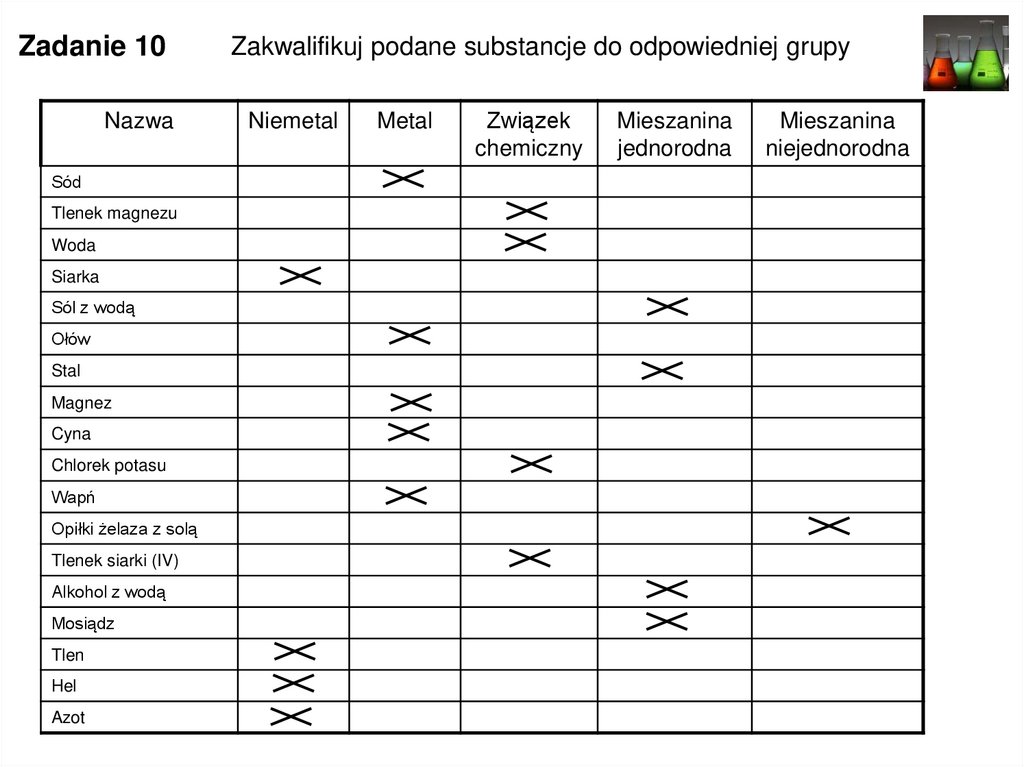
Zadanie 10Nazwa
Sód
Tlenek magnezu
Woda
Siarka
Sól z wodą
Ołów
Stal
Magnez
Cyna
Chlorek potasu
Wapń
Opiłki żelaza z solą
Tlenek siarki (IV)
Alkohol z wodą
Mosiądz
Tlen
Hel
Azot
Zakwalifikuj podane substancje do odpowiedniej grupy
Niemetal
Metal
Związek
chemiczny
Mieszanina
jednorodna
Mieszanina
niejednorodna
12. Slajd 12
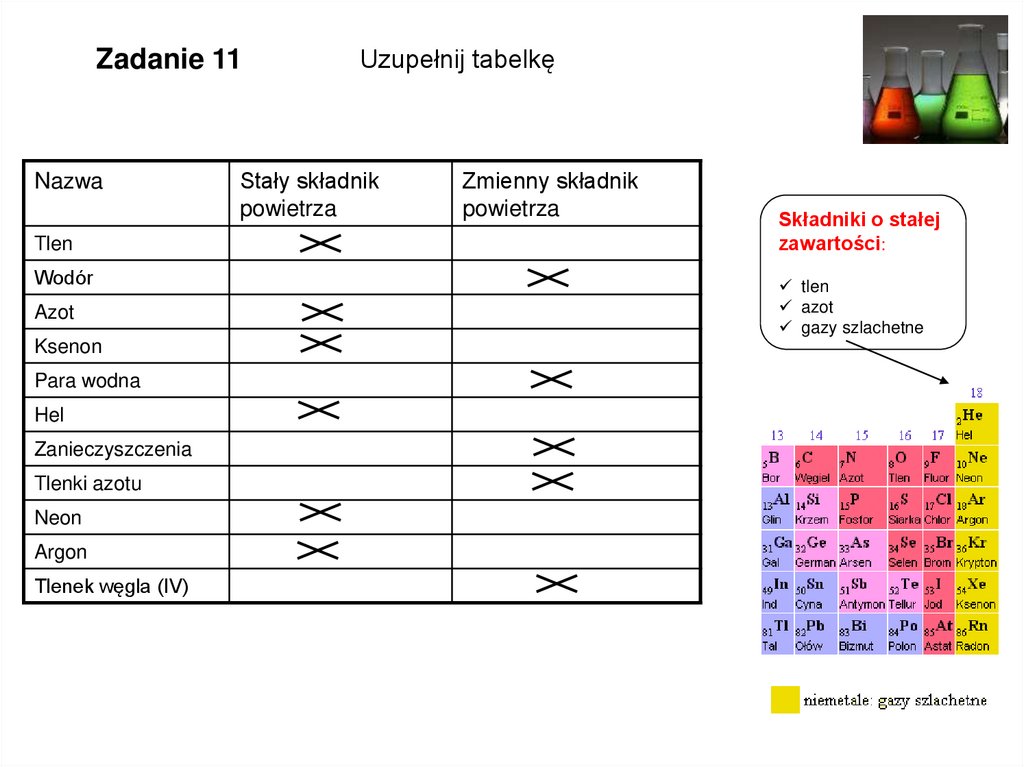
Zadanie 11Nazwa
Tlen
Wodór
Azot
Ksenon
Para wodna
Hel
Zanieczyszczenia
Tlenki azotu
Neon
Argon
Tlenek węgla (IV)
Uzupełnij tabelkę
Stały składnik
powietrza
Zmienny składnik
powietrza
Składniki o stałej
zawartości:
tlen
azot
gazy szlachetne
13. Slajd 13
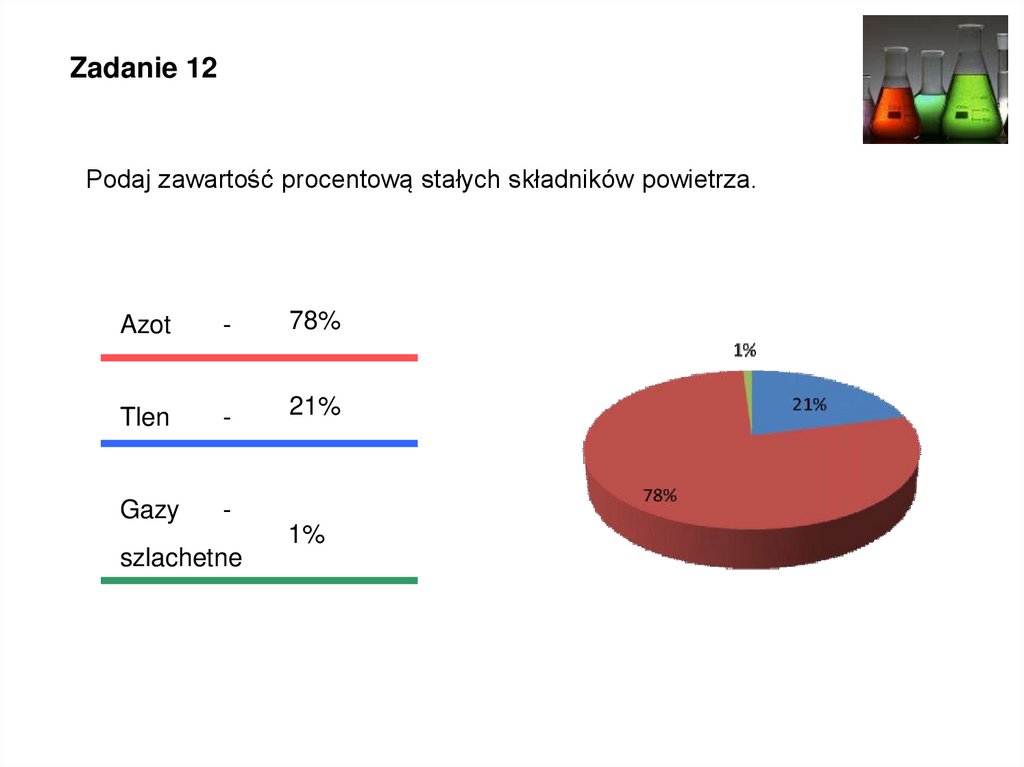
Zadanie 12Podaj zawartość procentową stałych składników powietrza.
Azot
-
78%
Tlen
-
21%
Gazy
-
szlachetne
1%
14. Slajd 14
Zadanie 13Oblicz objętość tlenu i azotu w pokoju o wymiarach: 5 m x 6 m x 3 m
I.
Obliczamy objętość pokoju
V = 5 m x 6 m x 3 m = 90 m3
Zawartość w powietrzu:
II.
Obliczamy objętość tlenu i azotu w pokoju
Tlen
90 m3 x 0,21 = 18,9 m3
Azot
90 m3 x 0,78 = 70,2 m3
Tlenu – 21% = 0,21
Azotu – 78% = 0,78
15. Slajd 15
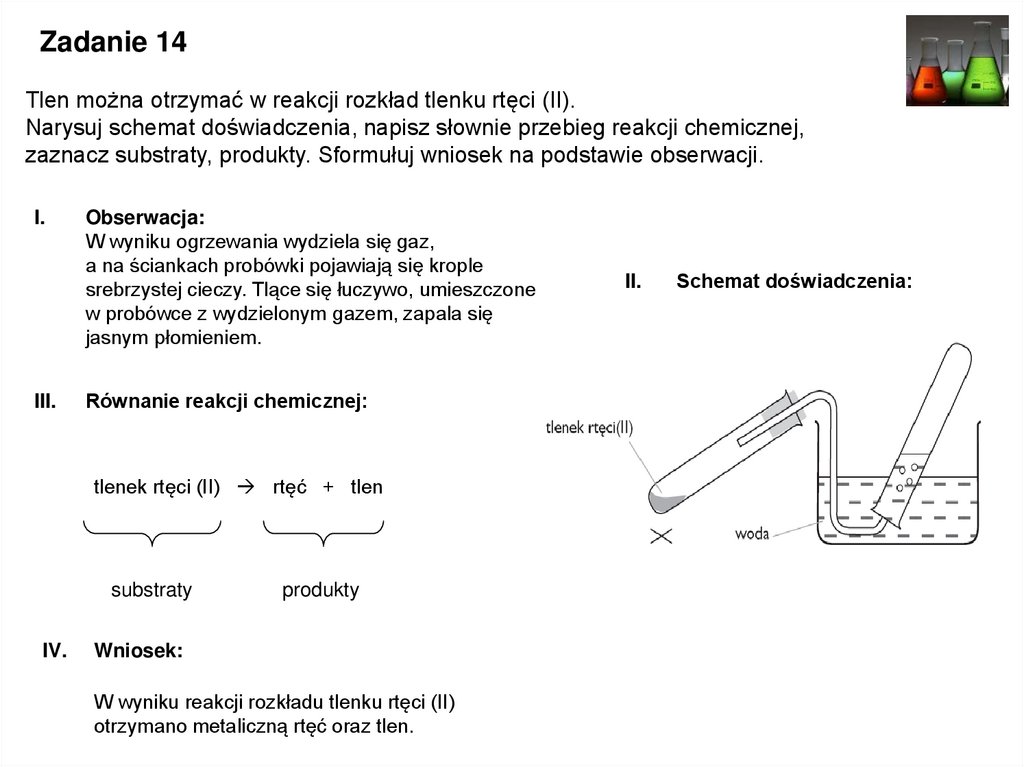
Zadanie 14Tlen można otrzymać w reakcji rozkład tlenku rtęci (II).
Narysuj schemat doświadczenia, napisz słownie przebieg reakcji chemicznej,
zaznacz substraty, produkty. Sformułuj wniosek na podstawie obserwacji.
I.
III.
Obserwacja:
W wyniku ogrzewania wydziela się gaz,
a na ściankach probówki pojawiają się krople
srebrzystej cieczy. Tlące się łuczywo, umieszczone
w probówce z wydzielonym gazem, zapala się
jasnym płomieniem.
Równanie reakcji chemicznej:
tlenek rtęci (II) rtęć + tlen
substraty
IV.
produkty
Wniosek:
W wyniku reakcji rozkładu tlenku rtęci (II)
otrzymano metaliczną rtęć oraz tlen.
II.
Schemat doświadczenia:
16. Slajd 16
Zadanie 15Zaznacz właściwości tlenu w temperaturze pokojowej:
A. ciało stałe, bezwonne, praktycznie nierozpuszczalne w wodzie
B. ciało ciekłe, bezwonne, dobrze rozpuszczalne w wodzie
C. ciało gazowe, zapach specyficzny, słabo rozpuszczalne w wodzie
D. gaz, bezwonny, słabo rozpuszczalny w wodzie
17. Slajd 17
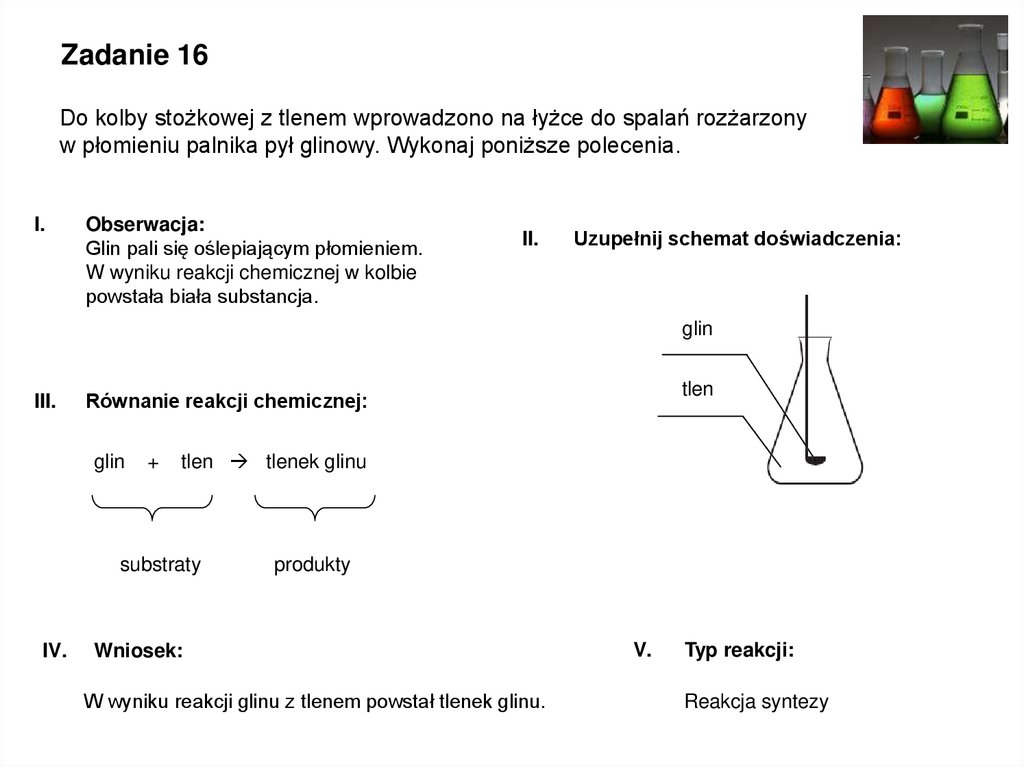
Zadanie 16Do kolby stożkowej z tlenem wprowadzono na łyżce do spalań rozżarzony
w płomieniu palnika pył glinowy. Wykonaj poniższe polecenia.
I.
Obserwacja:
Glin pali się oślepiającym płomieniem.
W wyniku reakcji chemicznej w kolbie
powstała biała substancja.
II.
Uzupełnij schemat doświadczenia:
glin
III.
glin
+
tlen tlenek glinu
substraty
IV.
tlen
Równanie reakcji chemicznej:
produkty
Wniosek:
W wyniku reakcji glinu z tlenem powstał tlenek glinu.
V.
Typ reakcji:
Reakcja syntezy
18. Slajd 18
Uzupełnij luki.Zadanie 17
tlen
A. wapń + ……….
tlenek wapnia
synteza
sód
cynk + chlorek sodu
C. chlorek cynku + ……….
……….
Typ reakcji chemicznej:……………………….
wymiana
Typ reakcji chemicznej:……………………….
wapń, tlen
Substraty:……………………………………….
chlorek cynku, sód
Substraty:……………………………………….
tlenek wapnia
Produkty:…………………………………….….
cynk, chlorek sodu
Produkty:…………………………………….….
wapń, tlen, tlenek wapnia
Reagenty:……………………………………….
chlorek cynku, sód, cynk, chlorek sodu
Reagenty:……………………………………….
wapń, tlen
Pierwiastki:…………………………………..….
Pierwiastki:…………………………………..….
tlenek wapnia
Związki chemiczne:…………………………….
chlorek cynku, chlorek sodu
Związki chemiczne:…………………………….
wodór + ……….
tlen
B. tlenek wodoru …….…
analiza
cynk, sód
magnez
wodór
D. tlenek wodoru + ….…... tlenek magnezu + …...….
wymiana
Typ reakcji chemicznej:……………………….
Typ reakcji chemicznej:……………………….
tlenek wodoru
Substraty:……………………………………….
tlenek wodoru, magnez
Substraty:……………………………………….
wodór, tlen
Produkty:…………………………………….….
Produkty:…………………………………….….
tlenek wodoru, wodór, tlen
Reagenty:……………………………………….
tlenek wodoru, magnez, tlenek magnezu, wodór
Reagenty:……………………………………….
wodór, tlen
Pierwiastki:…………………………………..….
magnez, wodór
Pierwiastki:…………………………………..….
tlenek wodoru
Związki chemiczne:…………………………….
Związki chemiczne:…………………………….
tlenek magnezu, wodór
tlenek wodoru, tlenek magnezu
19. Slajd 19
Zadanie 18Przeczytaj zdania o azocie i wpisz literę P – prawda lub
F – fałsz, zdania z błędami popraw.
Azot jest łatwo palny
F
F
Azot jest gazem niepalnym i nie podtrzymuje palenia.
……………………………………………………………………………..…..
Azot stanowi 50% objętościowych powietrza.
Azot stanowi 78% objętościowych powietrza.
………………………………………………………………………………….
Azot zaliczany jest do stałych składników powietrza.
P
F
F
F
………………………………………………………………………………….
Powietrze jest związkiem chemicznym tlenu i azotu.
Powietrze jest mieszaniną jednorodną tlenu i azotu.
………………………………………………………………………………….
Azot jest używany do produkcji kwasu siarkowodorowego.
Azot jest używany do produkcji kwasu azotowego (V).
………………………………………………………………………………….
Tlen i azot są jedynymi składnikami powietrza.
Tlen i azot nie są jedynymi składnikami powietrza.
………………………………………………………………………………….
P
Ciekły azot służy do szybkiego zamrażania.
………………………………………………………………………………….
20. Slajd 20
Zadanie 19Przekreśl błędne sformułowania w opisie tlenku węgla (IV).
Tlenek węgla (IV) ma wzór CO2 / CO.
Tlenek węgla (IV) jest mieszaniną / związkiem chemicznym węgla i tlenu.
Ulega / nie ulega reakcji spalania.
Jest gazem palnym / niepalnym.
Jest bezbarwny / ma barwę białą.
Ma specyficzny zapach / jest bezwonny.
Powstaje / nie powstaje w procesie fotosyntezy.
Słabo / dobrze rozpuszcza się w wodzie tworząc wodę gazowaną.
Ma gęstość mniejszą / większą od powietrza.
21. Slajd 21
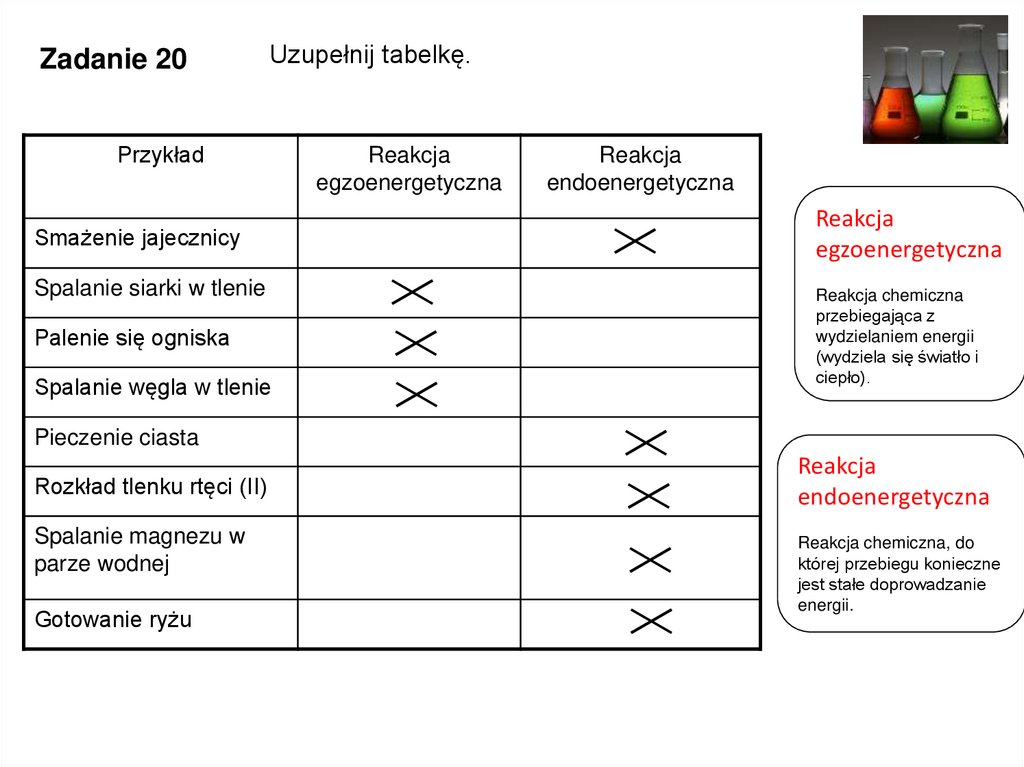
Zadanie 20Uzupełnij tabelkę.
Przykład
Smażenie jajecznicy
Spalanie siarki w tlenie
Palenie się ogniska
Spalanie węgla w tlenie
Reakcja
egzoenergetyczna
Reakcja
endoenergetyczna
Reakcja
egzoenergetyczna
Reakcja chemiczna
przebiegająca z
wydzielaniem energii
(wydziela się światło i
ciepło).
Pieczenie ciasta
Rozkład tlenku rtęci (II)
Spalanie magnezu w
parze wodnej
Gotowanie ryżu
Reakcja
endoenergetyczna
Reakcja chemiczna, do
której przebiegu konieczne
jest stałe doprowadzanie
energii.
22. Slajd 22
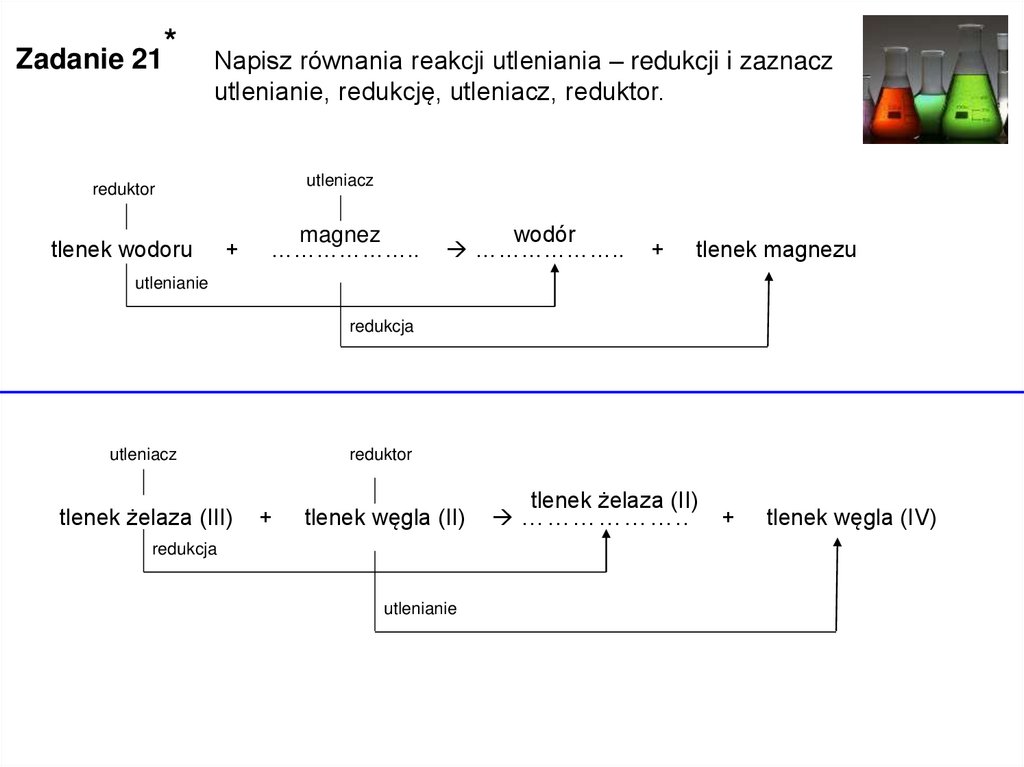
Zadanie 21*
Napisz równania reakcji utleniania – redukcji i zaznacz
utlenianie, redukcję, utleniacz, reduktor.
utleniacz
reduktor
tlenek wodoru
+
magnez
………………..
wodór
………………..
+
tlenek magnezu
utlenianie
redukcja
utleniacz
tlenek żelaza (III)
reduktor
+
tlenek węgla (II)
redukcja
utlenianie
tlenek żelaza (II)
………………..
+
tlenek węgla (IV)
23. Slajd 23
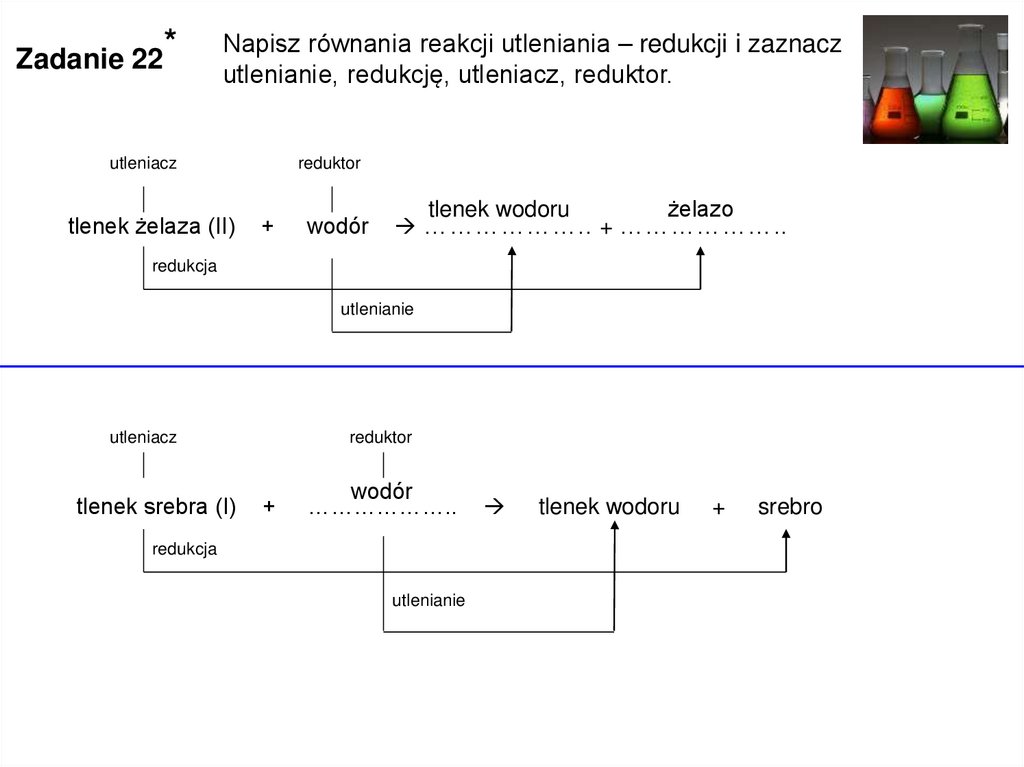
Zadanie 22*
Napisz równania reakcji utleniania – redukcji i zaznacz
utlenianie, redukcję, utleniacz, reduktor.
utleniacz
tlenek żelaza (II)
reduktor
+
wodór
tlenek wodoru
żelazo
……………….. + ………………..
redukcja
utlenianie
utleniacz
tlenek srebra (I)
reduktor
+
wodór
………………..
redukcja
utlenianie
tlenek wodoru
+
srebro










 english
english