Similar presentations:
Металлы в периодической системе химических элементов
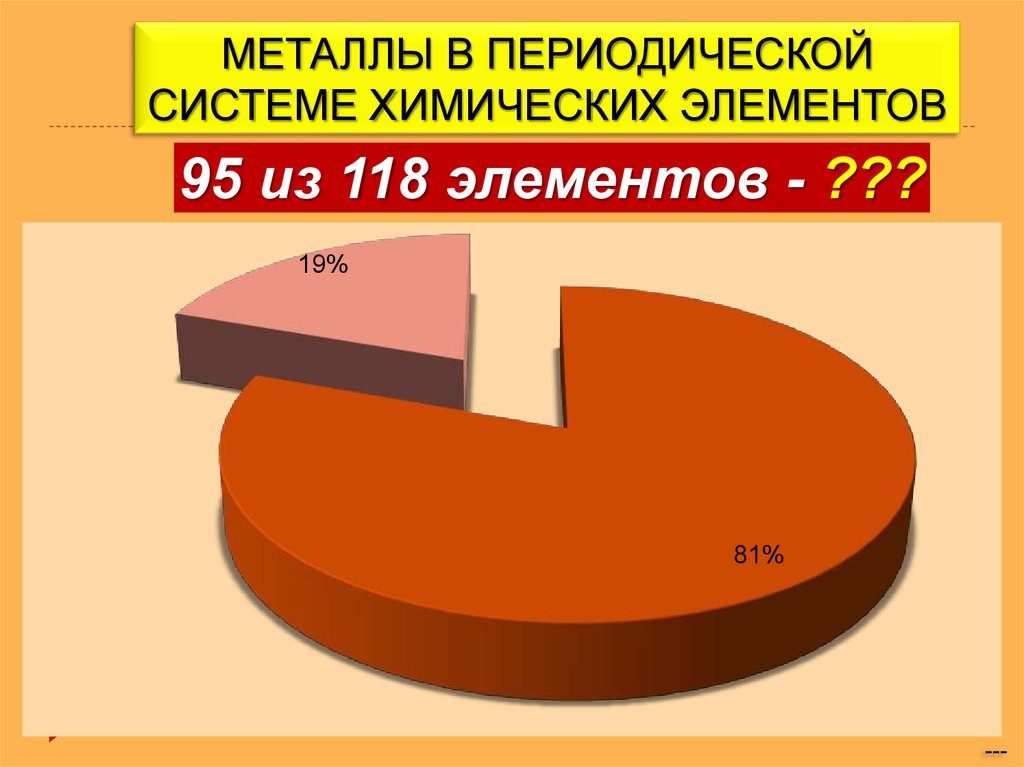
1. МЕТАЛЛЫ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
95 из 118 элементов - ???19%
81%
---
2. История открытия металлов человеком
донашей
эры 8
средние
века
Au, Ag, Hg, Sn, Pb, Cu, Fe, Zn
Bi
1
Co, Pt, Ni, Mn, Ba, Mo, W, Te, U, Zr, Sr, Y,
Ti, Cr, Be
XVIII век
15
3. История открытия металлов человеком
Nb, Ta, Pd, Ce, Ir, Os, Ro, Na,K, Ca, Mg, Cd,Li, Al, Th, V, La, Er, Tb, Ru, Rb, Cs, Tl, In,
XIX век
Ga, Yb, Tm, Sm, Ho, Sc, Pr, Nd, Ge, Gd, Dy,
38
Po, Ra, Ac
Eu, Lu, Pa, Hf, Re, Tc, Fr, Np, Pu, Am, Ku,
XX век
Pm, Bk, Cf, Es, Fm, Md, No, Lr, Rf, Db, Sg,
Bh, Mt, Hs, Ds, Rg, Cn, Fl, Lv
30
XXI век
Uut, Uup, Uus
3
4. Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп
I А II А III А IV В V В VI В VIIВ VIIIВNa Mg
Al
Ti
V
Cr
Mn
Fe
5. Положение элемента в ПС отражает СТРОЕНИЕ ЕГО АТОМОВ
Порядковыйномер
элемента
1. Заряд ядра атома
2. Общее число электронов
Номер
группы
1. Число электронов на внешнем
энергетическом уровне.
2. Высшая валентность элемента,
степень окисления
Номер
периода
1. Число энергетических уровней.
2. Число подуровней на внешнем
энергетическом уровне
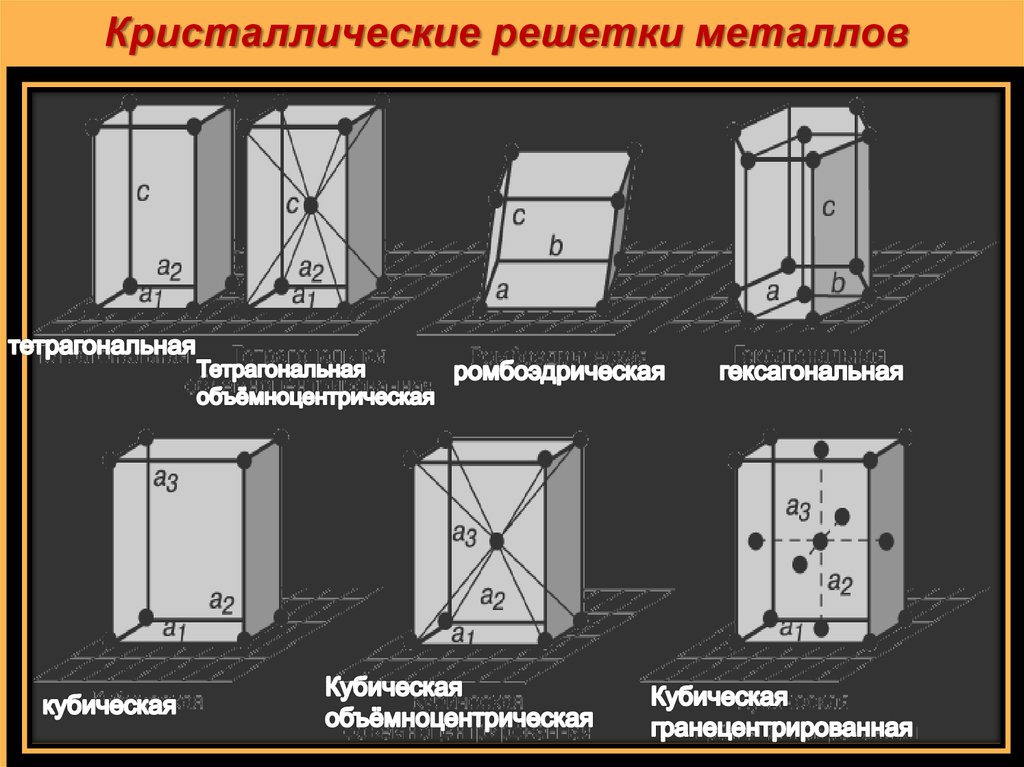
6. Кристаллические решетки металлов
7. Металлическая связь
1.2.
3.
4.
5.
Вспомним сведения о металлической связи
Какая
химическая
связь
называется
определение
металлической?
понятия
Как образуется металлическая химическая
взаимодействие между
связь?
положительными
Какими
свойствами
обладают
вещества
ионами металла и
благодаря
наличию
в
их
строении
общими электронами,
металлической химической связи?
свободно
Что общего и в чём различия
между
перемещающимися
металлической и ионной связью?
по всему объёму
Что общего и в чём различия
между
ковалентной и металлической кристалла
связью? металла
8.
МеталлическаяСВЯЗЬ
Характерна для металлов и сплавов:
+
Na
Na
0
e
e
e
+
Na
Na
Na
Na
8
0
Na
e
0
Na
e
Na
+
+
0
Na
+
0
e
e
e
0
Na
Na
+
0
Na
+
e
0
Na
Na
+
Na
17.07.2019
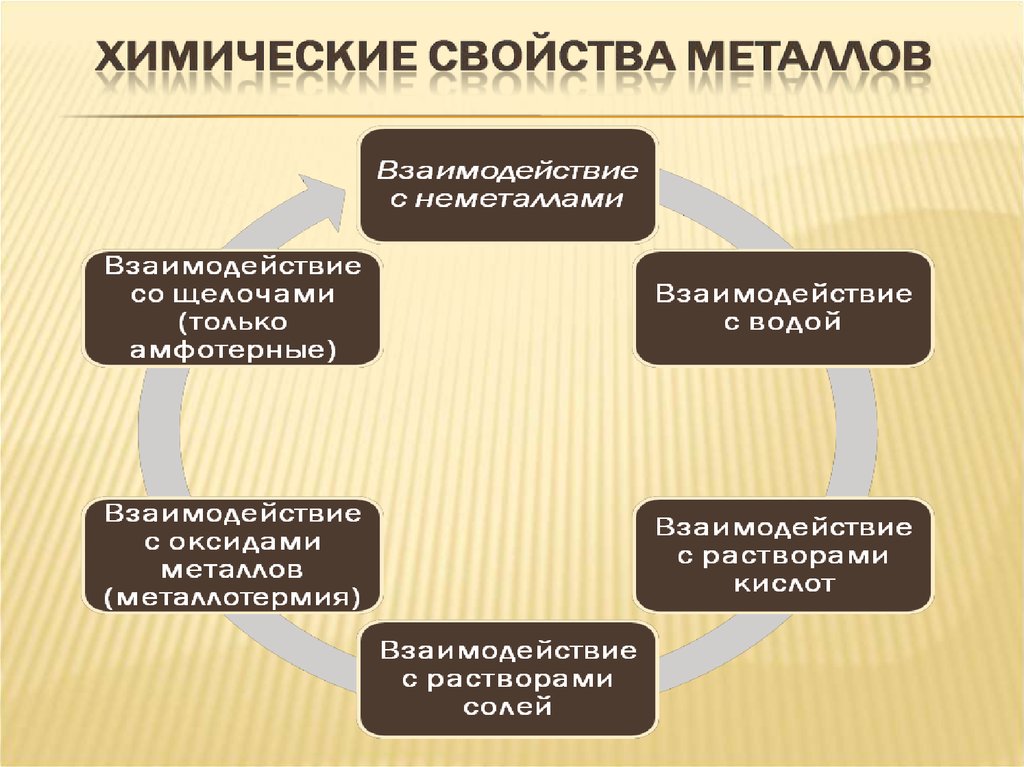
9. Свойства металлов = f (строения их атомов)
ТВЕРДОСТЬВсе, кроме ртути, при обычных условиях твердые
вещества. Самые мягкие – натрий, калий; их можно
резать ножом.
Самый твердый хром – царапает стекло.
ПЛОТНОСТЬ
Лёгкие (плотность 5г/см)
Тяжелые (плотность больше 5г/см).
ПЛАВКОСТЬ
Легкоплавкие и тугоплавкие
ЭЛЕКТРОи ТЕПЛОПРОВОДНОСТЬ
МЕТАЛЛИЧЕСКИЙ
БЛЕСК
ПЛАСТИЧНОСТЬ
Хаотичное движение электронов под действием
электрического напряжения приобретает направление, в
результате чего возникает электрический ток.
Электроны отражают световые лучи
Механическое воздействие на кристалл с металлической
решеткой вызывает только смещение слоев атомов и не
сопровождается разрывом связи, и поэтому металл
характеризуется высокой пластичностью.
10. Металлическая связь
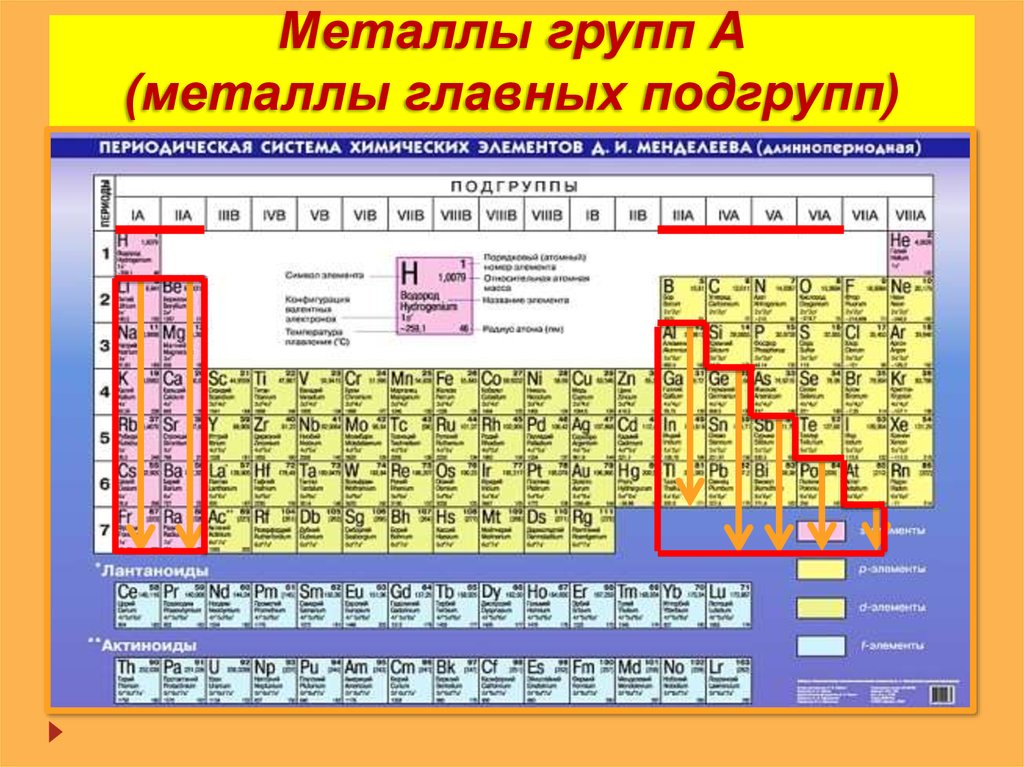
Металлы групп А(металлы главных подгрупп)
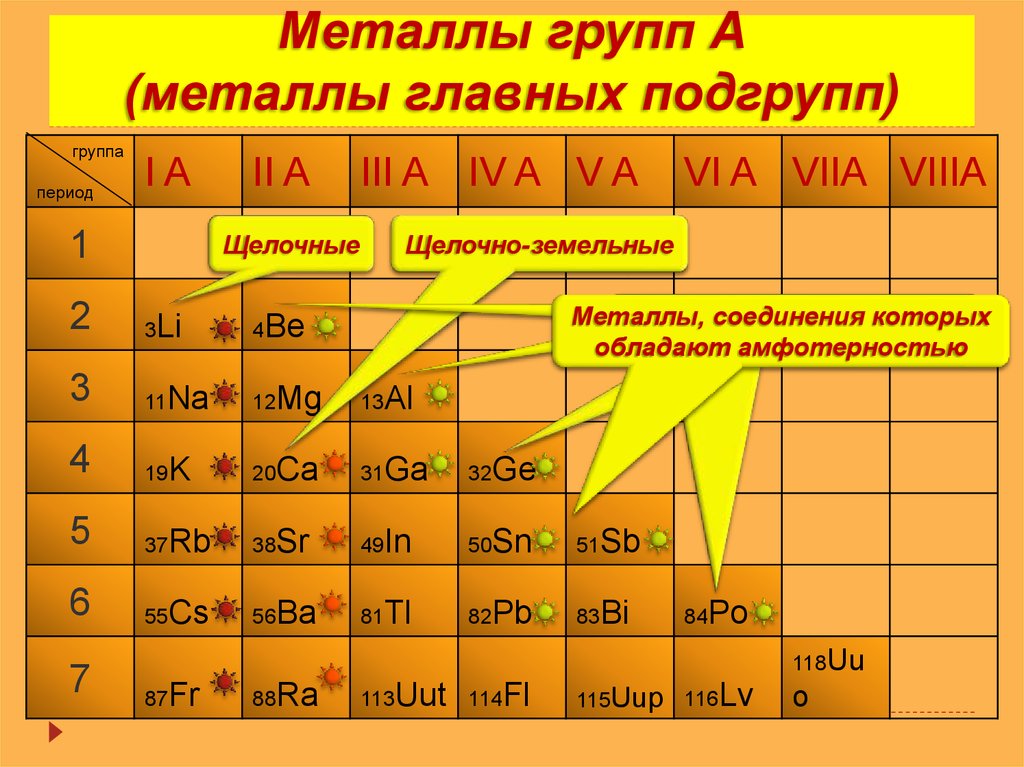
11. Металлы групп А (металлы главных подгрупп)
группапериод
IA
1
II A
Щелочные
III A IV A V A
Щелочно-земельные
2
3Li
4Be
3
11Na
12Mg
13Al
4
19K
20Ca
31Ga
32Ge
5
37Rb
38Sr
49In
50Sn
51Sb
6
55Cs
56Ba
81Tl
82Pb
83Bi
7
VI A VIIA VIIIA
Металлы, соединения которых
обладают амфотерностью
84Po
118Uu
87Fr
88Ra
113Uut
114Fl
115Uup 116Lv
o
12. Металлы групп А (металлы главных подгрупп)
Изменение свойств металловглавных подгрупп в группах
ВОЗРАСТАЕТ
группа
IA
II A
III A
период
2
3
3
11
4
5
Li
4
КОЛИЧЕСТВО
ЭЛЕКТРОННЫХ СЛОЁВ
ОСЛАБЕВАЕТ
Be
Na
12
Mg
13
Al
19
K
20Ca
31
Ga
37
Rb
38
Sr
49
In
6
55
Cs
56
Ba
81
7
87
Fr
88
Ra
113
Tl
Uut
СИЛА ПРИТЯЖЕНИЯ
МЕЖДУ
ПОЛОЖИТЕЛЬНЫМ
ЯДРОМ И
ОТРИЦАТЕЛЬНЫМИ
ЭЛЕКТРОНАМИ НА
ВНЕШНЕМ
ЭЛЕКТРОННОМ СЛОЕ
УСИЛИВАЕТСЯ
СПОСОБНОСТЬ
ОТДАВАТЬ ЭЛЕКТРОНЫ
МЕТАЛЛИЧНОСТЬ
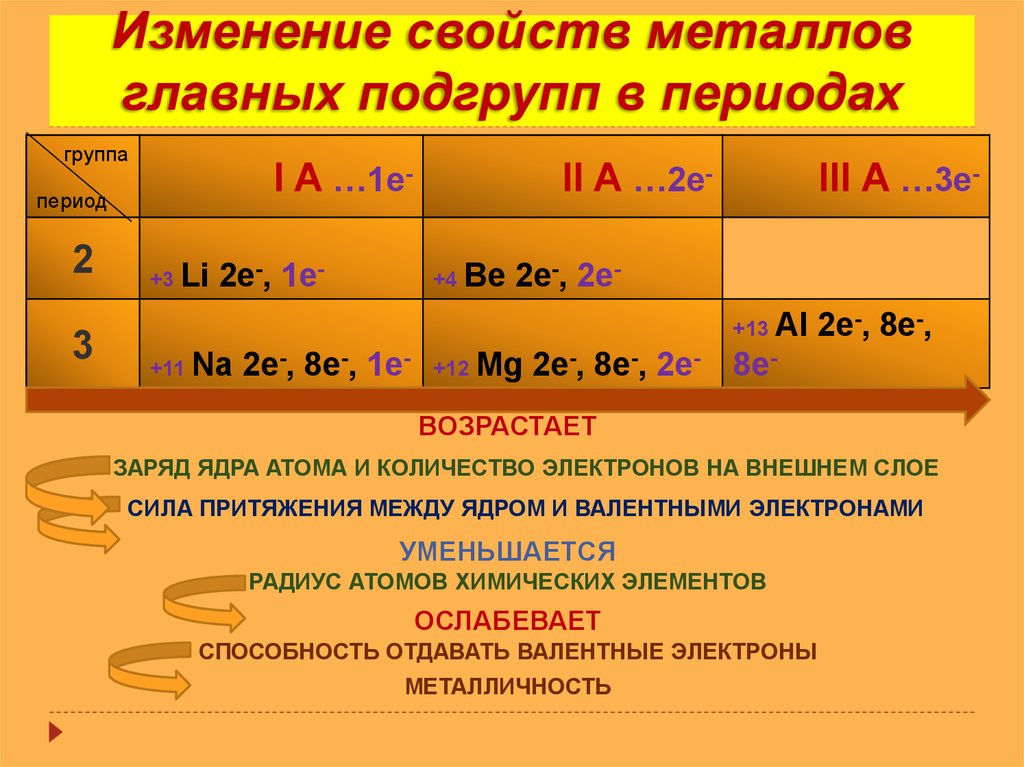
13. Изменение свойств металлов главных подгрупп в группах
Изменение свойств металловглавных подгрупп в периодах
группа
I A …1е-
период
2
3
+3 Li
2е-, 1е-
+11 Na
II A …2е+4 Be
2е-, 8е-, 1е-
III A …3е-
2е-, 2е-
+12 Mg
2е-, 8е-, 2е-
+13 Al
8е-
2е-, 8е-,
ВОЗРАСТАЕТ
ЗАРЯД ЯДРА АТОМА И КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА ВНЕШНЕМ СЛОЕ
СИЛА ПРИТЯЖЕНИЯ МЕЖДУ ЯДРОМ И ВАЛЕНТНЫМИ ЭЛЕКТРОНАМИ
УМЕНЬШАЕТСЯ
РАДИУС АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ОСЛАБЕВАЕТ
СПОСОБНОСТЬ ОТДАВАТЬ ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ
МЕТАЛЛИЧНОСТЬ
14. Изменение свойств металлов главных подгрупп в периодах
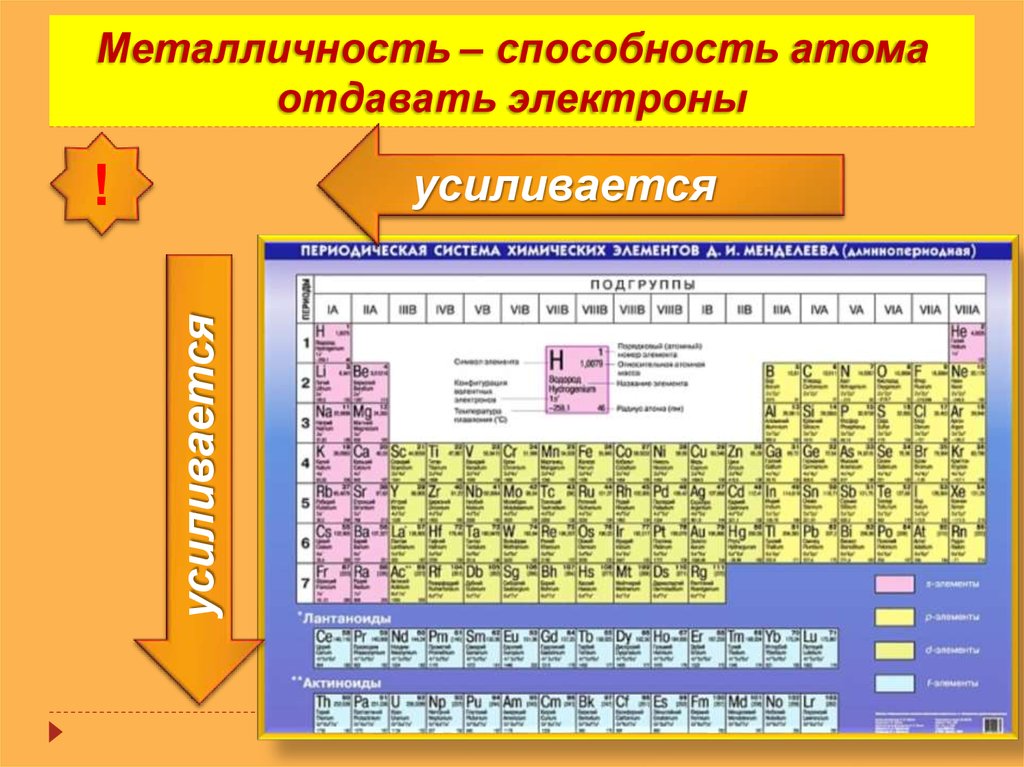
Металличность – способность атомаотдавать электроны
усиливается
усиливается
!
15. Металличность – способность атома отдавать электроны
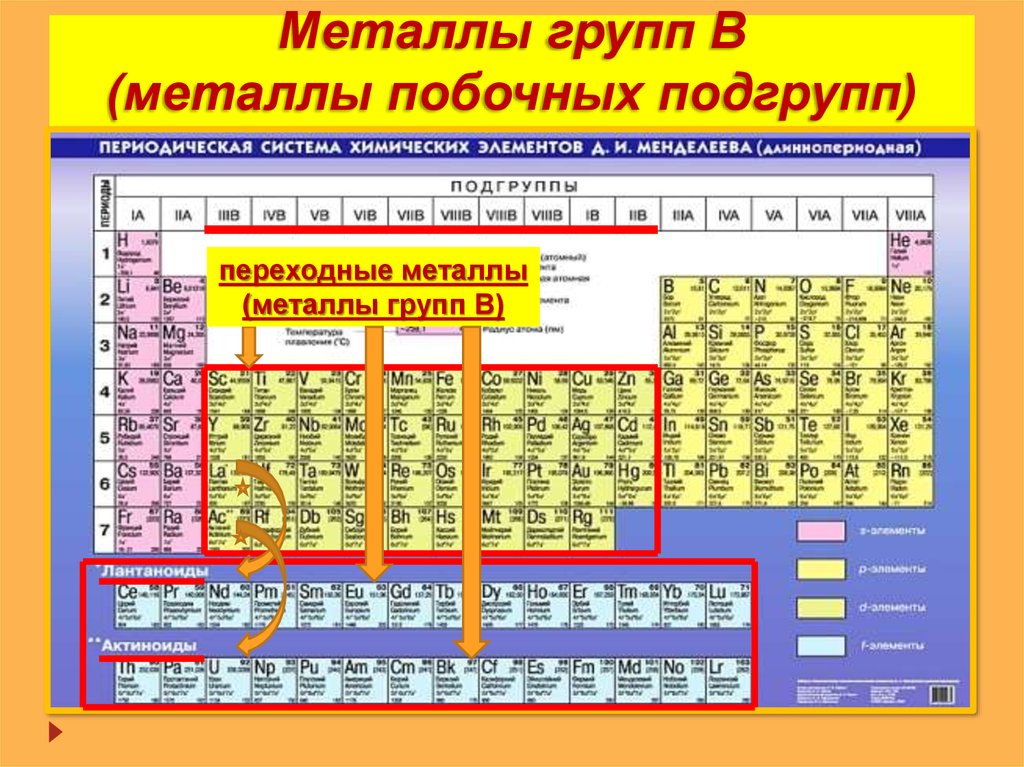
Металлы групп В(металлы побочных подгрупп)
переходные металлы
(металлы групп В)
16. Металлы групп В (металлы побочных подгрупп)
Примерный планхарактеристики металла
химический элемент
простое вещество
-положение в
периодической
системе,
-строение атома,
-электроотрицательность,
-валентность и
степени окисления,
-металличность
-физ. и хим. свойства,
-распространённость,
-получение и
применение,
-кислотно-основный
характер оксидов и
гидроксидов,
-окислительновосстановительная
способность
17. Примерный план характеристики металла
Способы полученияметаллов
18
17.07.2019
18.
Электрометаллургия2
Сu +
2Сl
СuСl2 →
на Катоде (восстановление):
Сu2+ + 2е- = Сu0
на Аноде (окисление):
2Cl - 2е = Сl°2
19.
Пирометаллургияиз
оксидов углем или оксидом
углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
алюминотермия
20
4Аl + ЗМnО2 = 2А12О3 + ЗМn
17.07.2019
20.
ГидрометаллургияCuO + H2SO4 = CuSO4 + H2O,
CuSO4 + Zn = ZnSO4 + Cu.
21
17.07.2019
21.
2217.07.2019













 chemistry
chemistry








