Similar presentations:
Дисперсные системы
1. ДИСПЕРСНЫЕ СИСТЕМЫ Лекция Попова А.С.
2. Дисперсная фаза Дисперсионная среда ΔG = ΔG1 + ΔG2 + GS
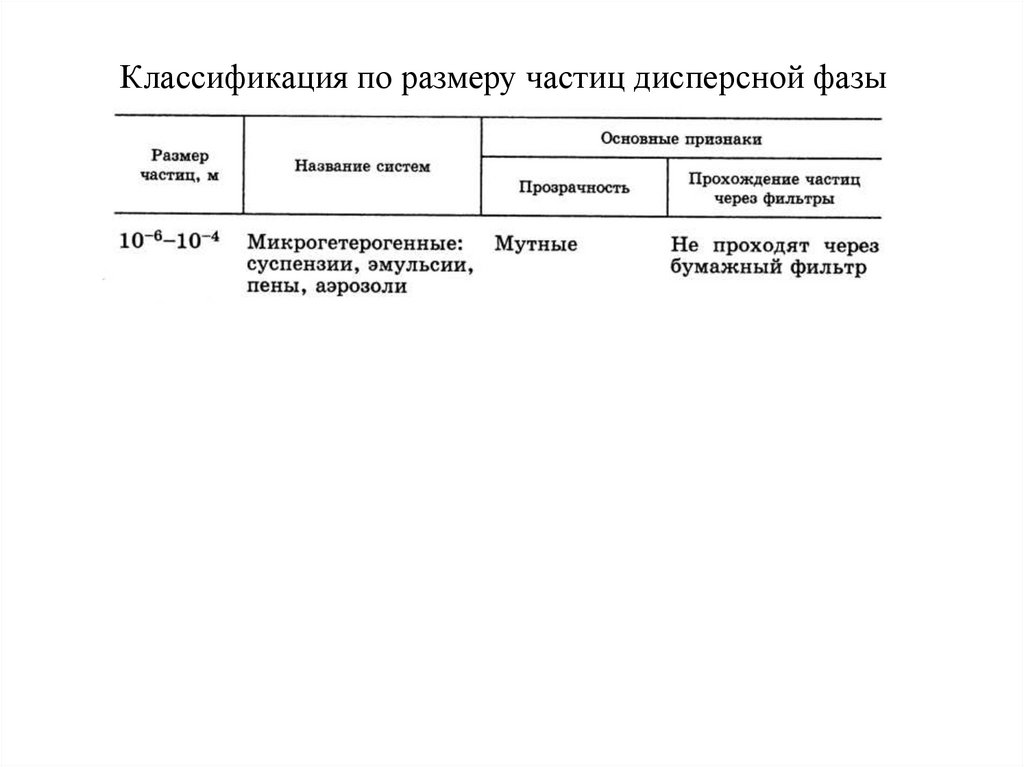
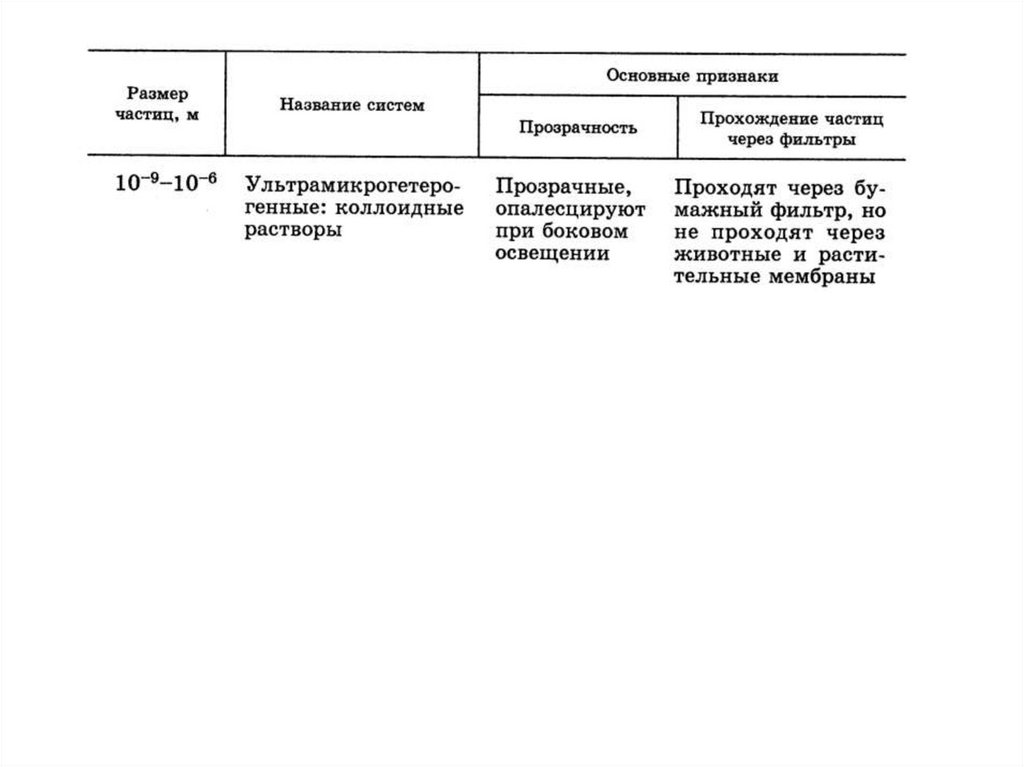
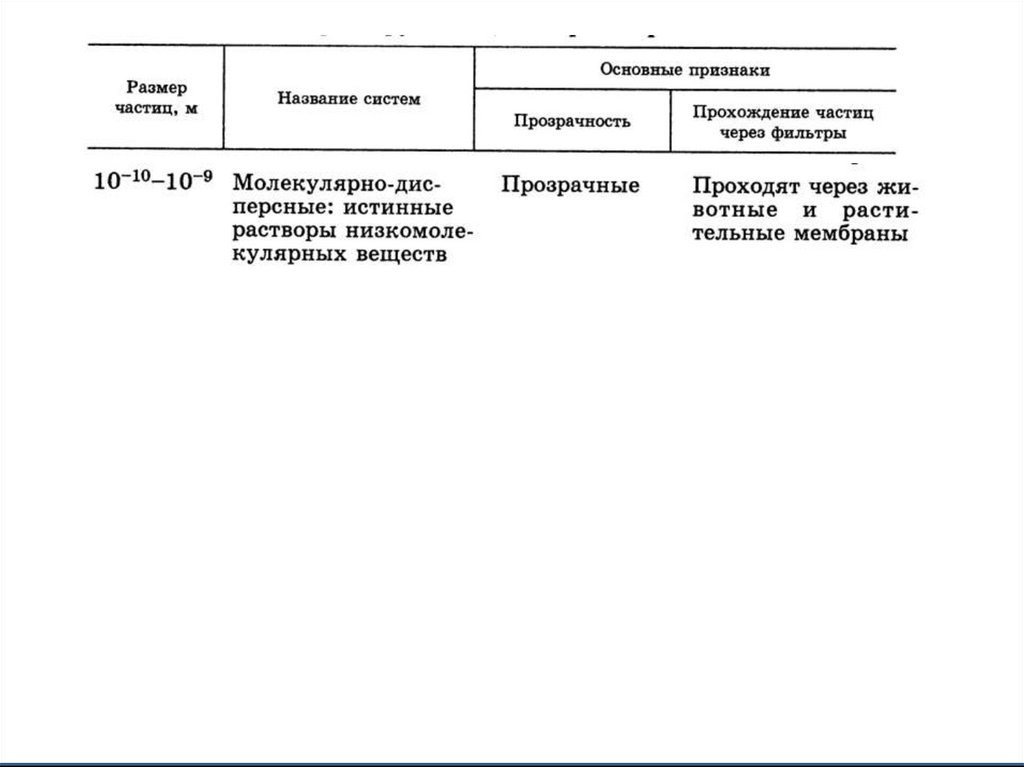
3. Классификация по размеру частиц дисперсной фазы
4.
5.
6.
7. Классификация по характеру взаимодействия
Гидрофильные коллоидыОбъекты:
Макромолекулярные растворы белков (Яичный белок, желатин в воде)
и полисахаридов (крахмал в горячей воде)
Ассоциированные коллоиды
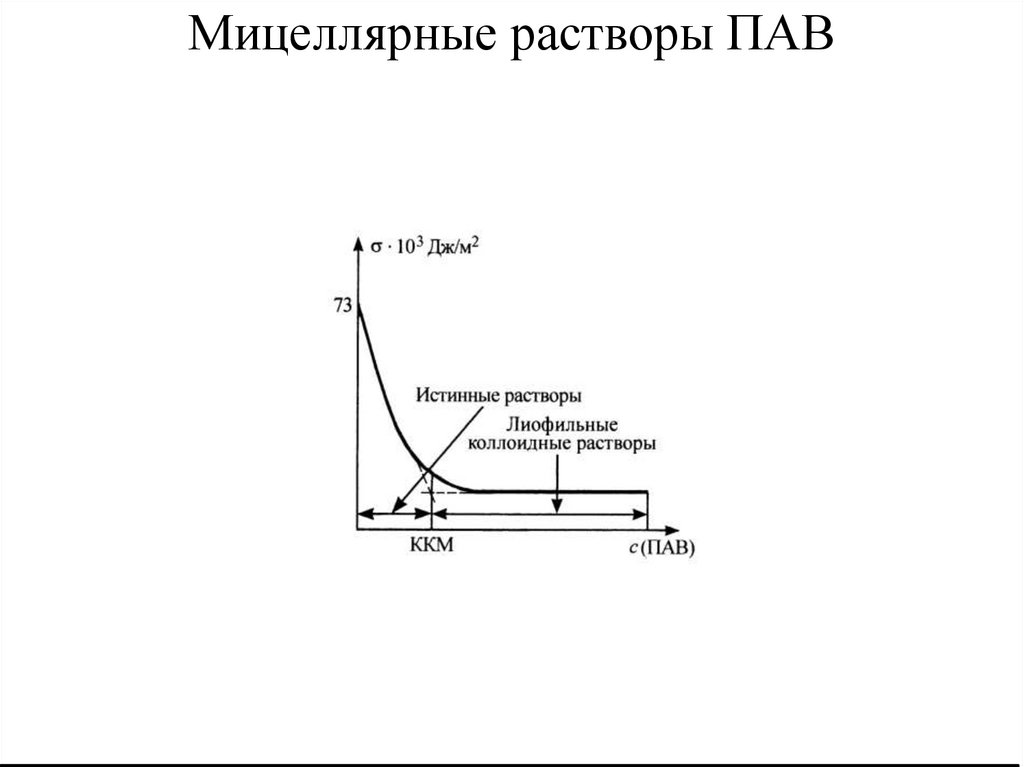
Мицеллярные растворы ПАВ (мыло) в воде
Гидрофобные коллоиды
Объекты:
Нерастворимые в воде вещества:
металлы (ртуть, золото) и неметаллы (сера), оксиды, гидроксиды, соли (оксалаты и
фосфаты кальция в моче), кислоты (мочевая кислота в моче), а также органика
(холестерин в крови)
Сильное взаимодействие:
Частицы сильно гидратированы, имеют мощный гидратный слой, поэтому не
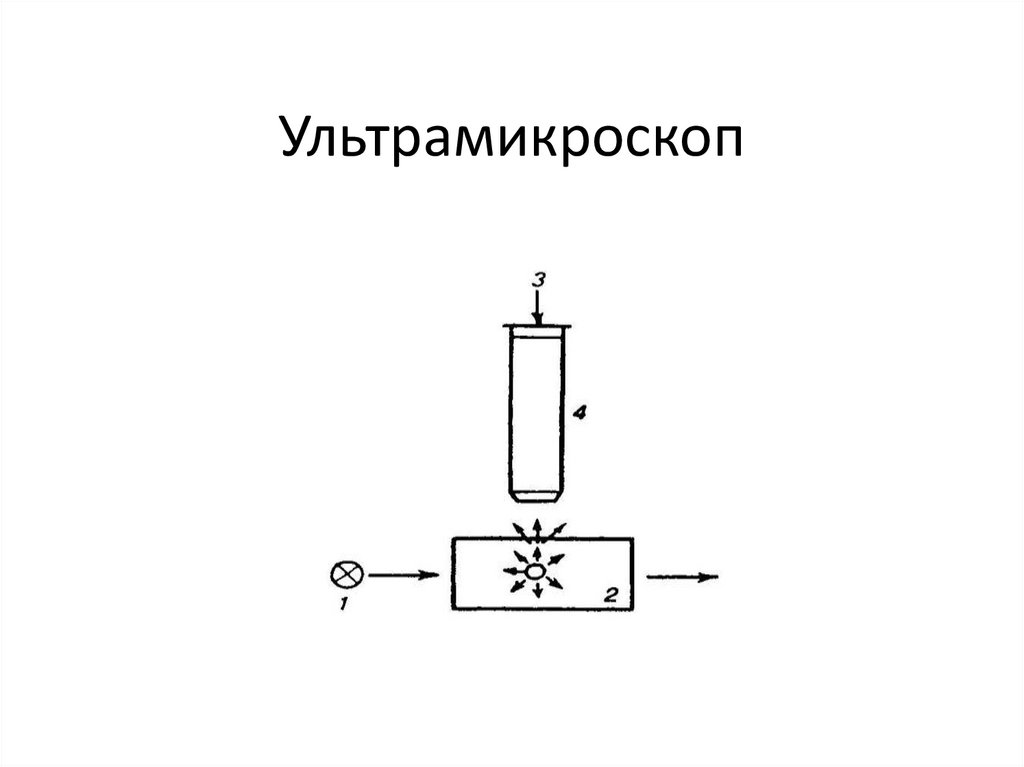
рассматриваются в ультрамикроскоп
Слабое взаимодействие:
Частицы слабо гидратированы, гидратного слоя нет, рассматриваются в
ультрамикроскоп
Получение:
Обычные методы растворения, растворение – самопроизвольный процесс
Получение:
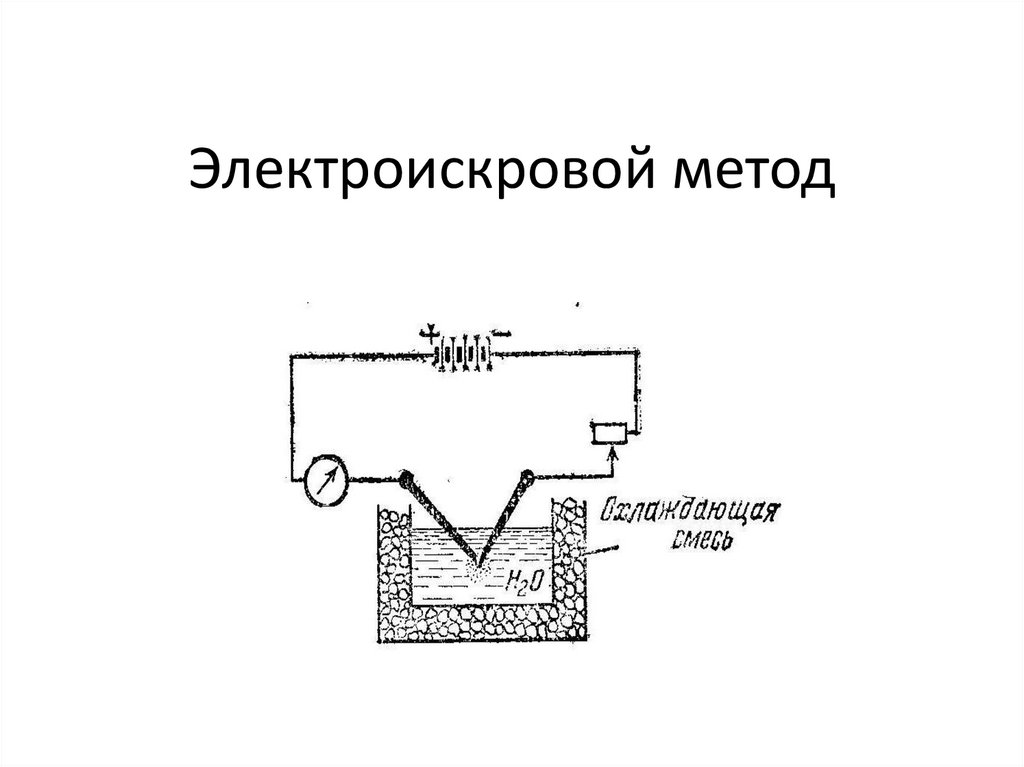
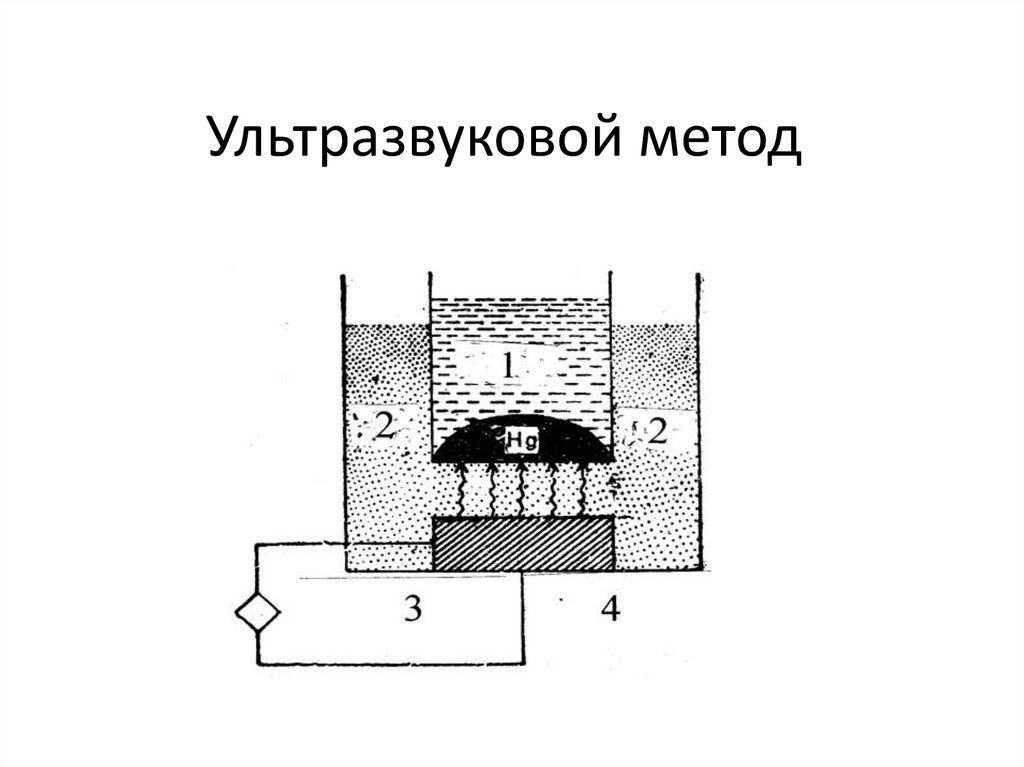
Специальные методы приготовления – методы диспергирования (электроискровой
метод, ультразвук, механическое дробление, пептизация)
- конденсационные методы
(химические реакции осаждения, метод замены растворителя)
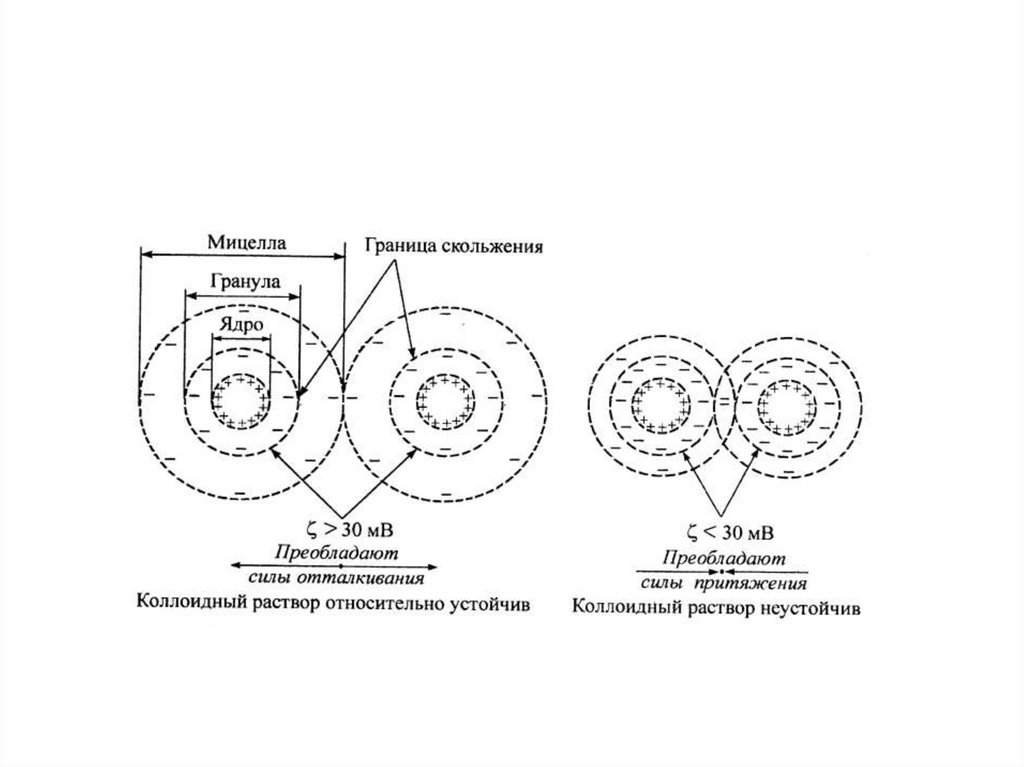
Устойчивость:
Термодинамически устойчивы, не требуют стабилизаторов, сами могут быть
стабилизаторами гидрофобных коллоидов
Устойчивость:
Термодинамически неустойчивы, в пределе подвержены саморазрушению, требуют
наличия стабилизаторов уже на стадии приготовления
Заряд частиц:
Зависит от рН раствора
Заряд частиц:
Определяется методом приготовления и характером стабилизатора
Концентрация:
Любая, при увеличении концентрации образуют гели (тела, подобные твердым)
Концентрация:
Очень разбавленные растворы, не выдерживают повышения концентрации
Механические свойства:
Вязкие жидкости или гели
Поверхностное натяжение:
Намного ниже, чем у воды
Разрушение:
Коагуляция белков и полисахаридов вызывается дегидратирующими веществами,
а растворов ПАВ – крайне затруднена
Механические свойства:
Вязкость жидкости почти как у воды
Поверхностное натяжение:
Практически как у воды
Разрушение:
Коагуляция происходит очень легко, вызывается даже незначительными
воздействиями
Восстановление системы:
Обратимы, то есть после коагуляции возможно систему вернуть к исходному
состоянию раствора
Восстановление системы:
Необратимы, коагуляция приводит к необратимому разрушению системы
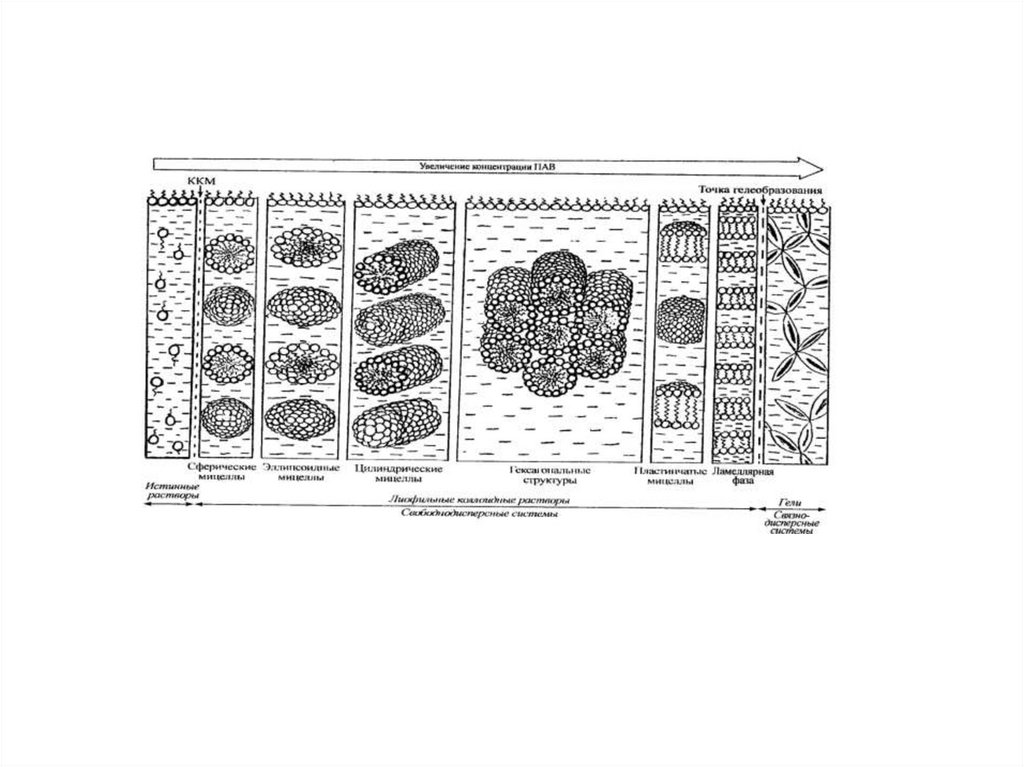
8. Мицеллярные растворы ПАВ
9. Мицелла ПАВ
10.
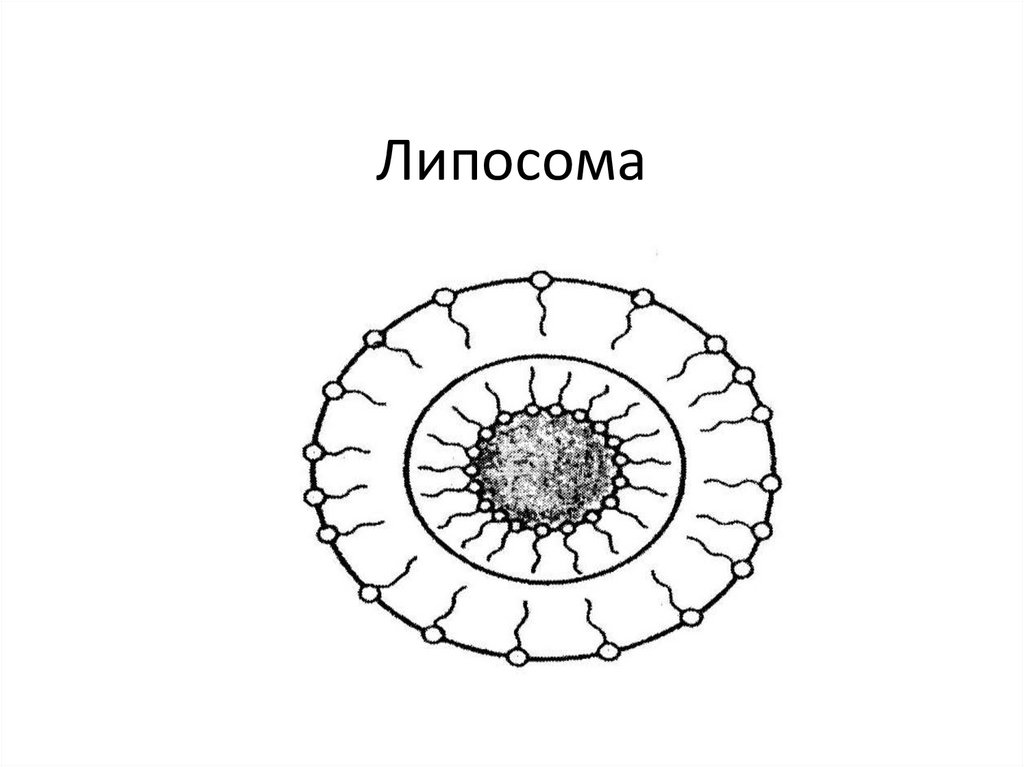
11. Липосома
12.
13. Эффект Тиндаля
14. Ультрамикроскоп
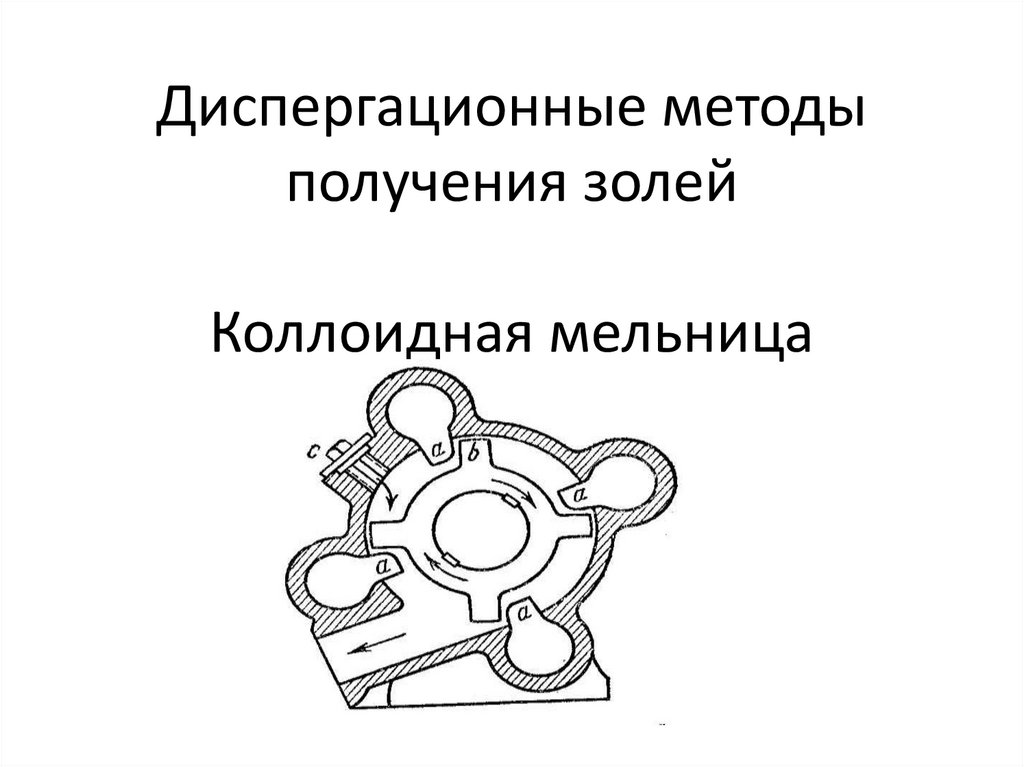
15. Диспергационные методы получения золей Коллоидная мельница
16. Электроискровой метод
17. Ультразвуковой метод
18. Пептизация Fe(OH)3 + H+ → Fe(OH)2+ + H2O Fe(OH)2+ → FeO+ + H2O
19. Конденсационные методы Метод окисления: 2H2S + SO2 → 3S(золь) + 2H2O Метод восстановления: Ag2 + H2 → 2Ag(золь) + H2O
Ионообменный метод:BaCl2 + K2SO4 → BaSO4(золь) + 2KCl
2H3AsO3 + 3H2S → As2S3 + 6H2O
Гидролиз:
FeCl3 + 3H2O → Fe(OH)3(золь) + 3HCl
Fe(OH)3 + HCl → FeOCl + 2H2O
FeOCl → FeO+ + Cl-








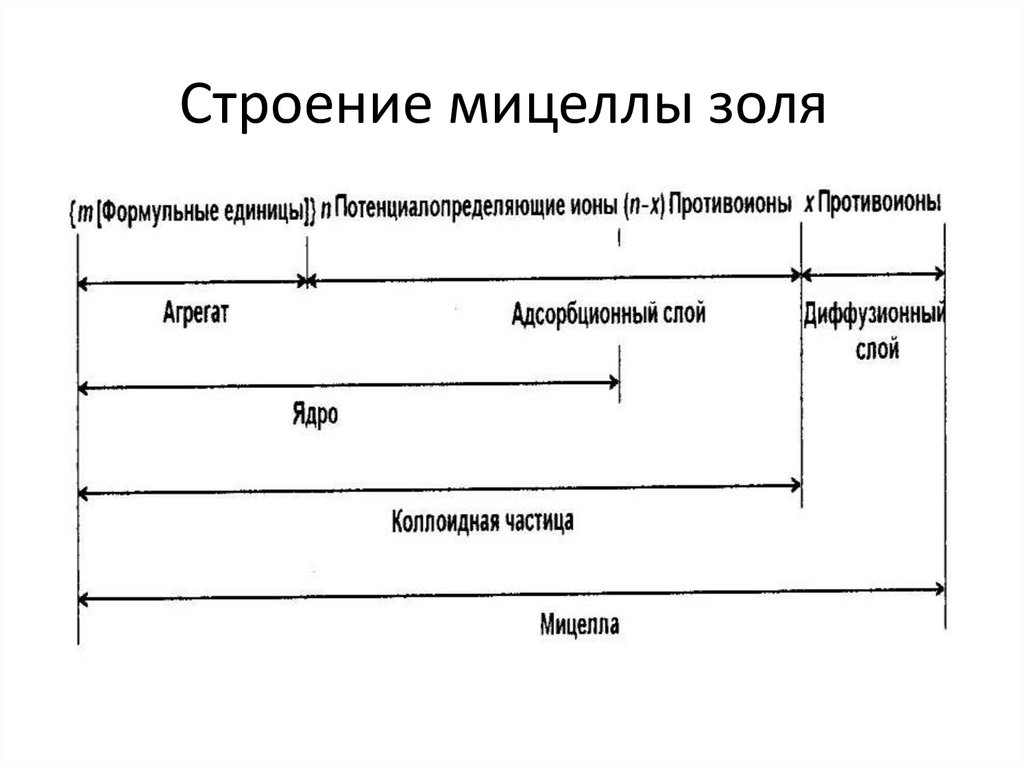
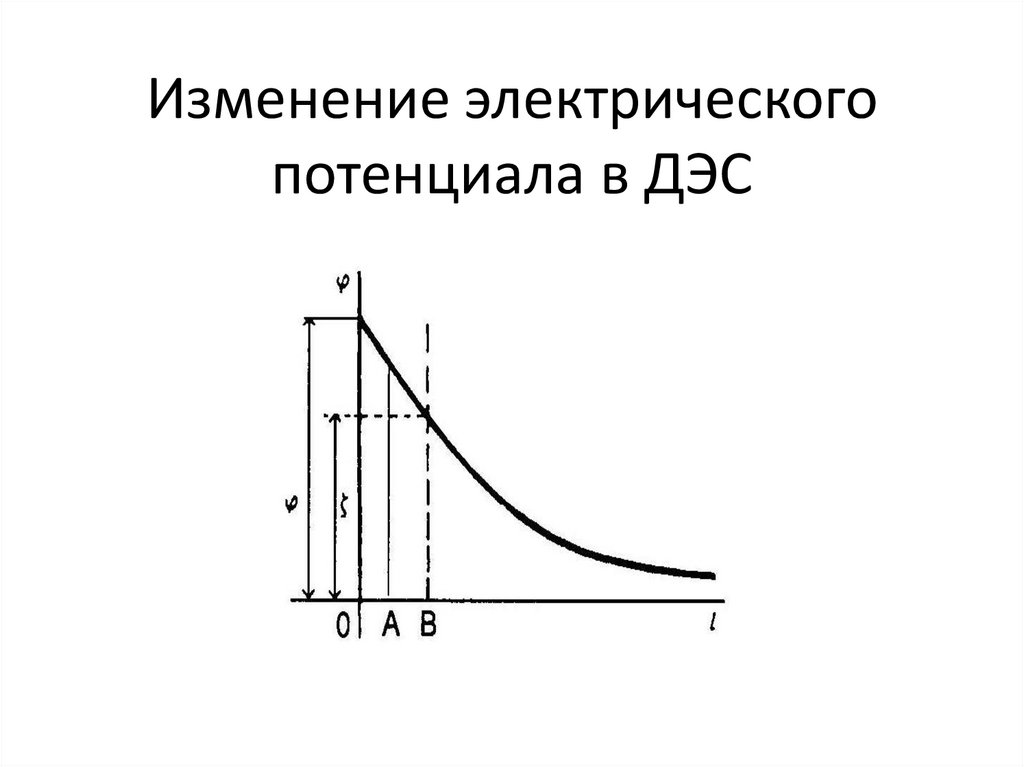
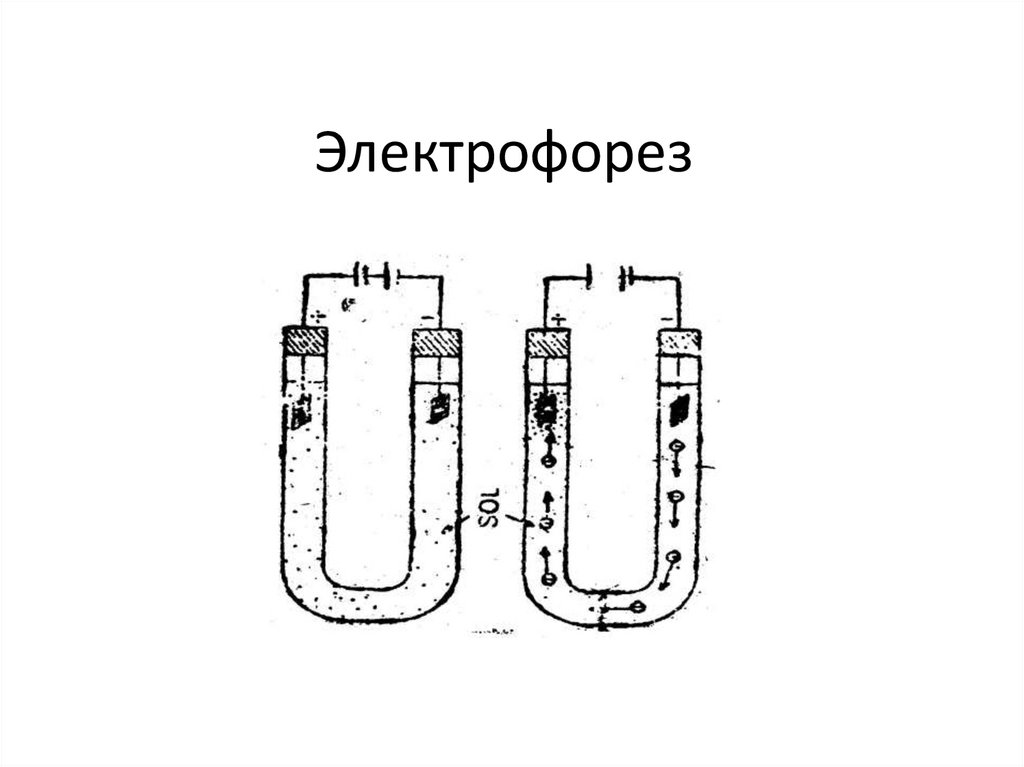
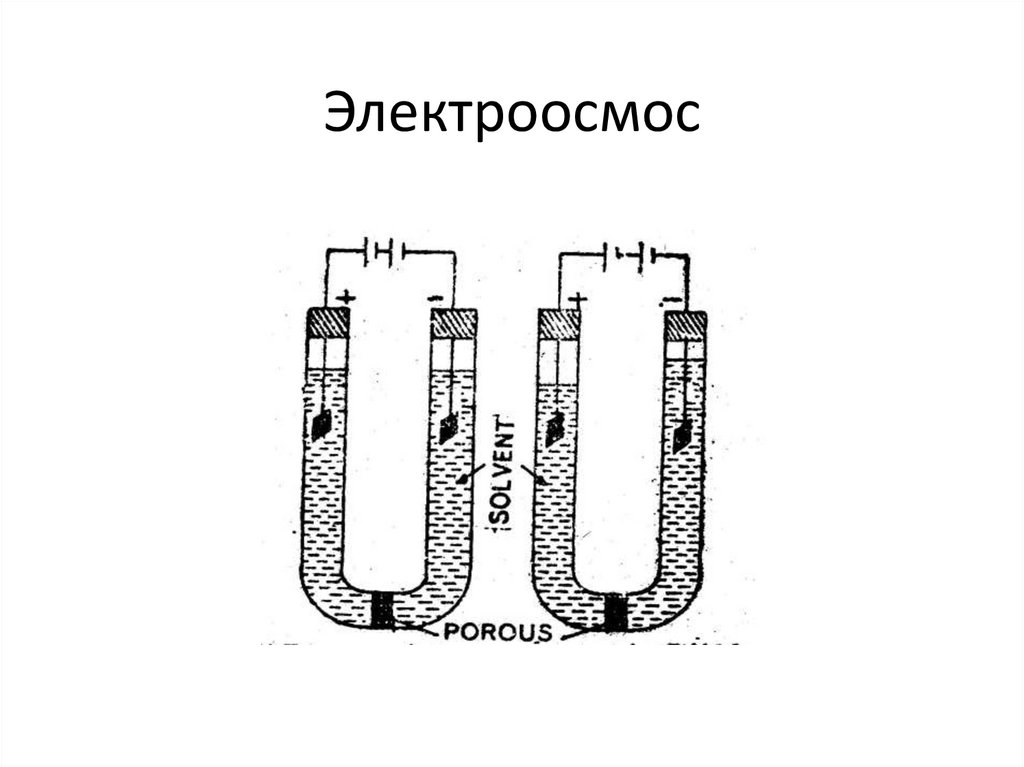
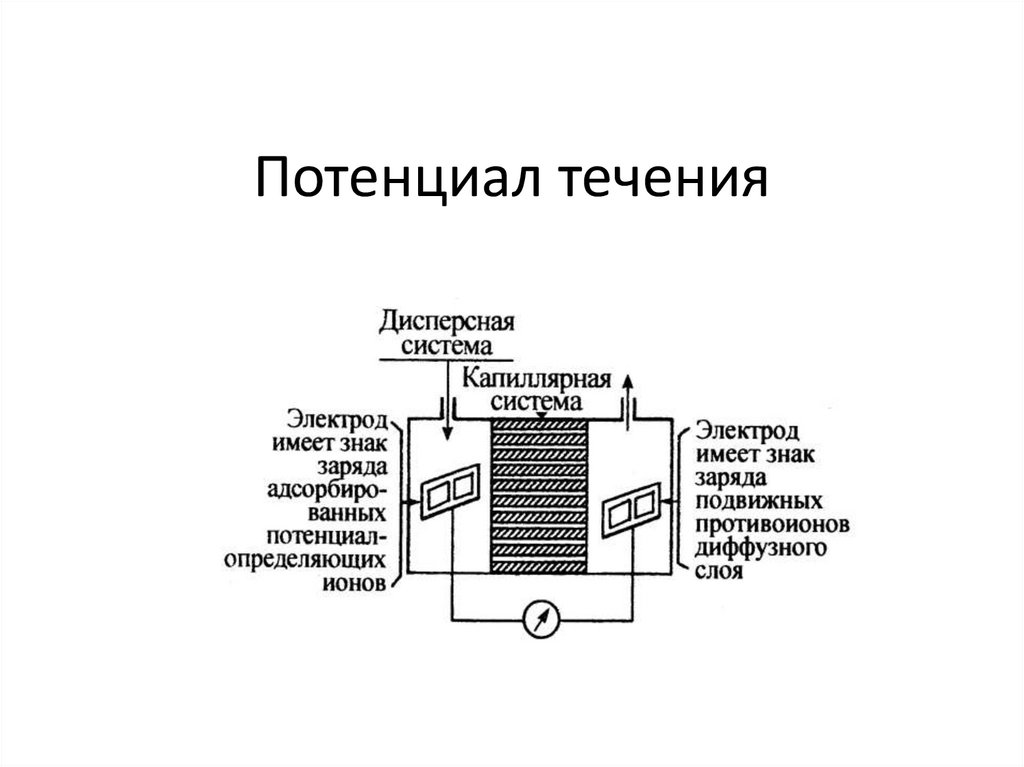
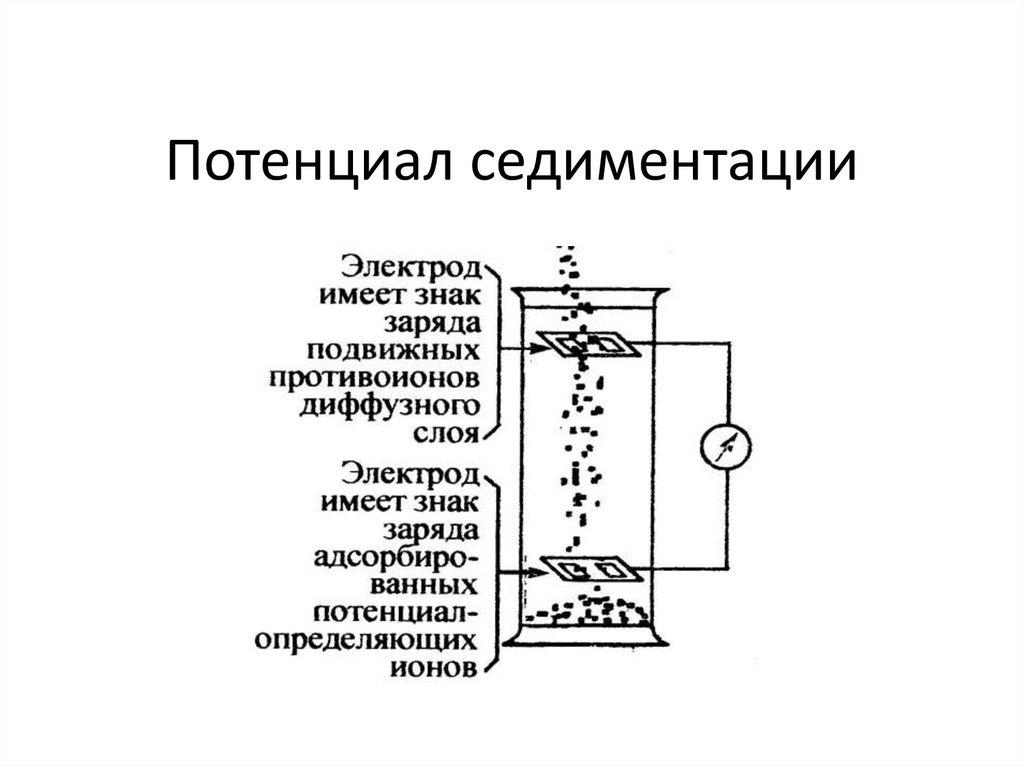
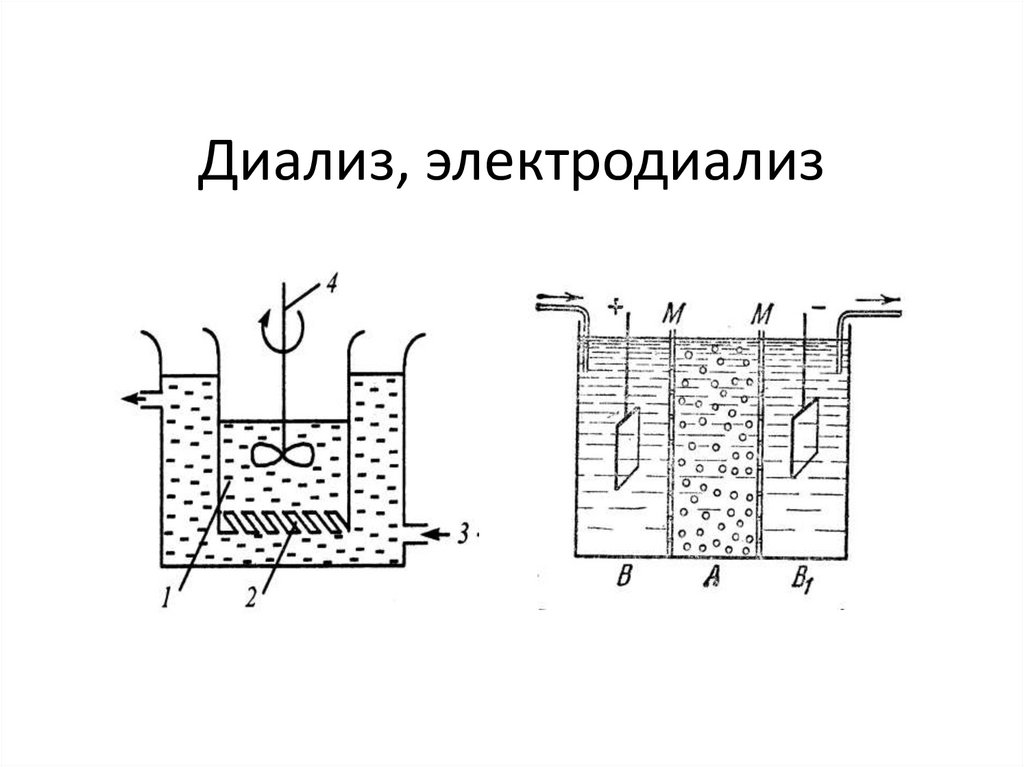
 chemistry
chemistry