Similar presentations:
Есте сақтау қабілетінің биохимиялық механизмі
1. Есте сақтау қабілетінің биохимиялық механизмі
2.
3.
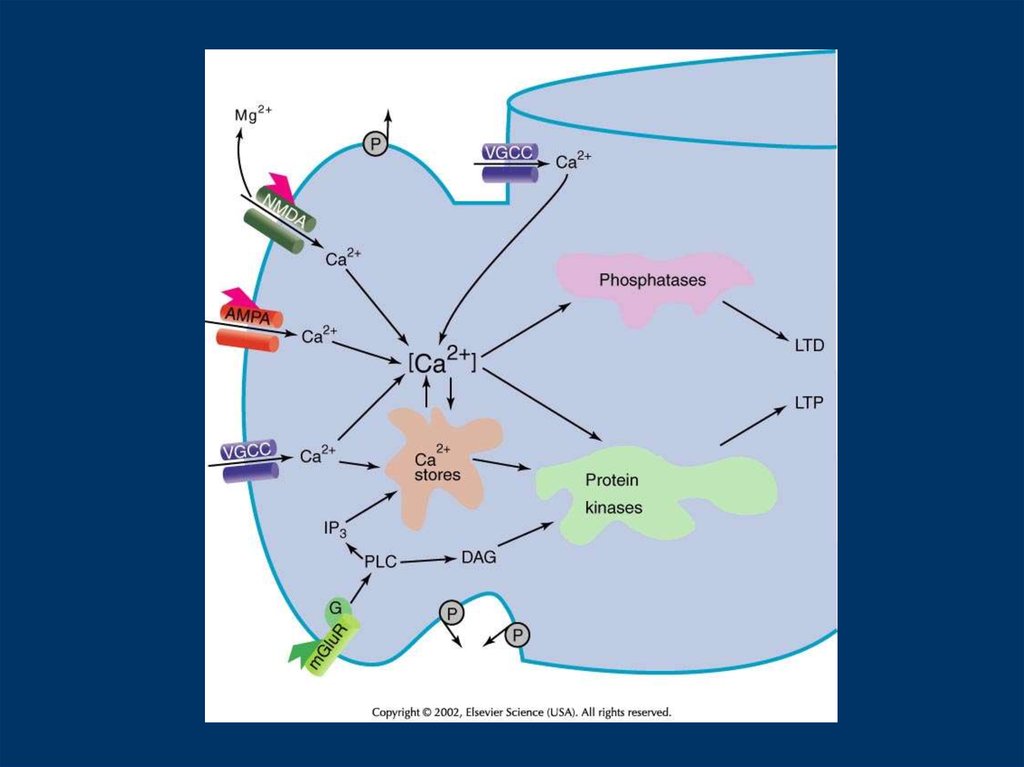
From Sheng and Kim4.
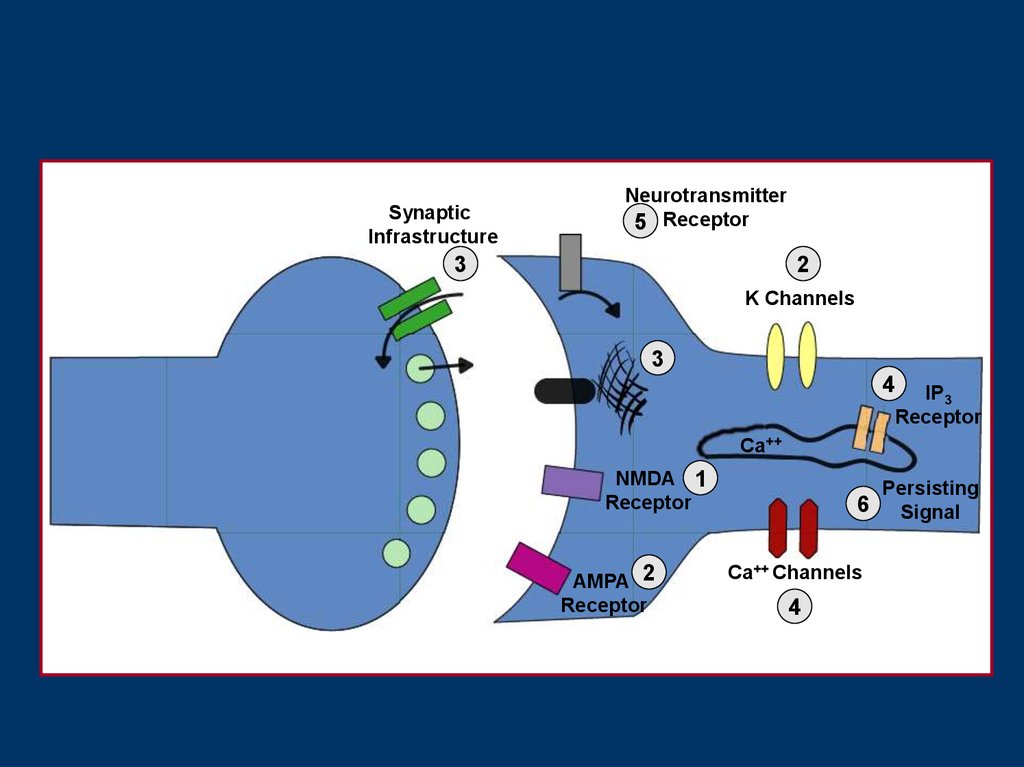
SynapticInfrastructure
Neurotransmitter
5 Receptor
3
2
K Channels
3
4
IP3
Receptor
Ca++
NMDA 1
Receptor
AMPA 2
Receptor
6
Ca++ Channels
4
Persisting
Signal
5.
1. NMDA рецепторының функциясын тікелейреттейтін NMDA рецепторларының үстіндегі
механизмдер.
2. Мембранадағы деполяризацияны басқаратын
NMDA рецепторларының алдында механизмдер.
3. NMDA рецепторының қалыпты жұмыс істеуі және
сигнал беру тетігі үшін қажетті синапc
инфрақұрылымның компоненттері.
4. Кальций деңгейін реттейтін тікелей байланыс және
кері байланыс механизмдері.
5. Кальций ағынына жауапты реттейтін сыртқы
сигналдар.
6. Тиісті тұрақты биохимиялық сигналдарды
генерациялау механизмдері.
6.
7.
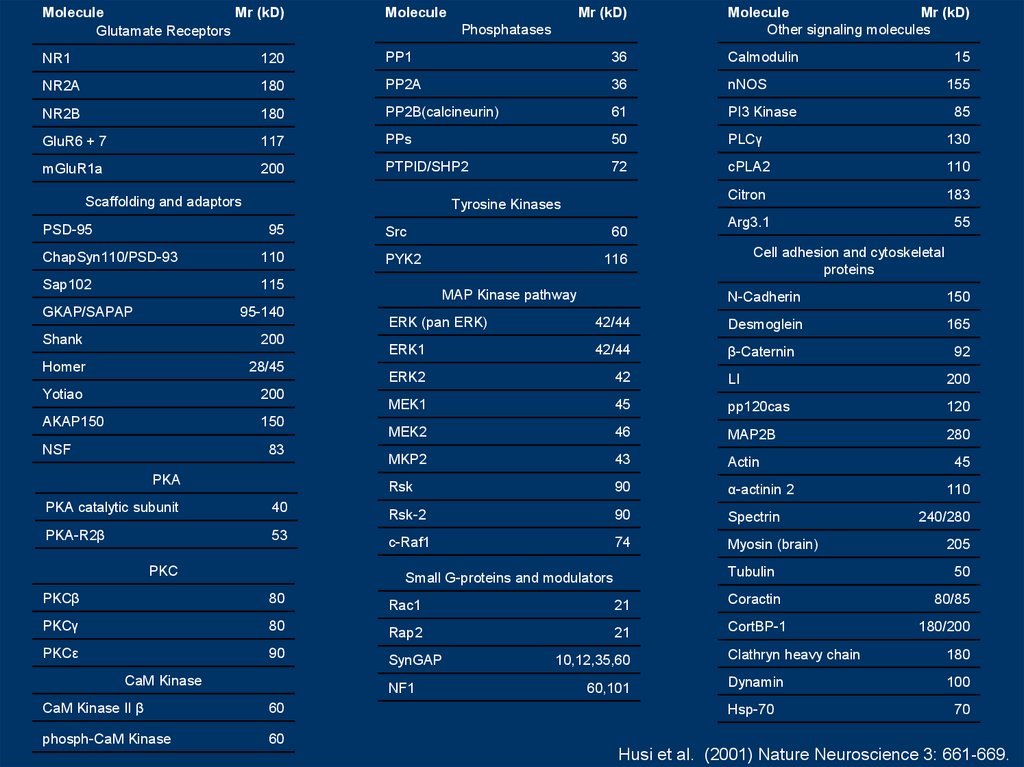
MoleculeMr (kD)
Glutamate Receptors
Molecule
NR1
120
PP1
36
Calmodulin
NR2A
180
PP2A
36
nNOS
NR2B
180
PP2B(calcineurin)
61
PI3 Kinase
GluR6 + 7
117
PPs
50
PLCγ
130
mGluR1a
200
PTPID/SHP2
72
cPLA2
110
Citron
183
Arg3.1
55
Scaffolding and adaptors
PSD-95
Tyrosine Kinases
95
ChapSyn110/PSD-93
110
Sap102
115
GKAP/SAPAP
95-140
Shank
200
Homer
28/45
Yotiao
200
AKAP150
150
NSF
Mr (kD)
Phosphatases
83
PKA
Src
60
PYK2
Molecule
Mr (kD)
Other signaling molecules
150
ERK (pan ERK)
42/44
Desmoglein
165
ERK1
42/44
β-Caternin
92
ERK2
42
LI
200
MEK1
45
pp120cas
120
MEK2
46
MAP2B
280
MKP2
43
Actin
Rsk
90
α-actinin 2
40
Rsk-2
90
Spectrin
PKA-R2β
53
c-Raf1
74
Myosin (brain)
Tubulin
Small G-proteins and modulators
PKCβ
80
Rac1
21
Coractin
PKCγ
80
Rap2
21
CortBP-1
PKCε
90
SynGAP
CaM Kinase
NF1
CaM Kinase II β
60
phosph-CaM Kinase
60
85
N-Cadherin
PKA catalytic subunit
PKC
155
Cell adhesion and cytoskeletal
proteins
116
MAP Kinase pathway
15
10,12,35,60
60,101
45
110
240/280
205
50
80/85
180/200
Clathryn heavy chain
180
Dynamin
100
Hsp-70
70
Husi et al. (2001) Nature Neuroscience 3: 661-669.
8.
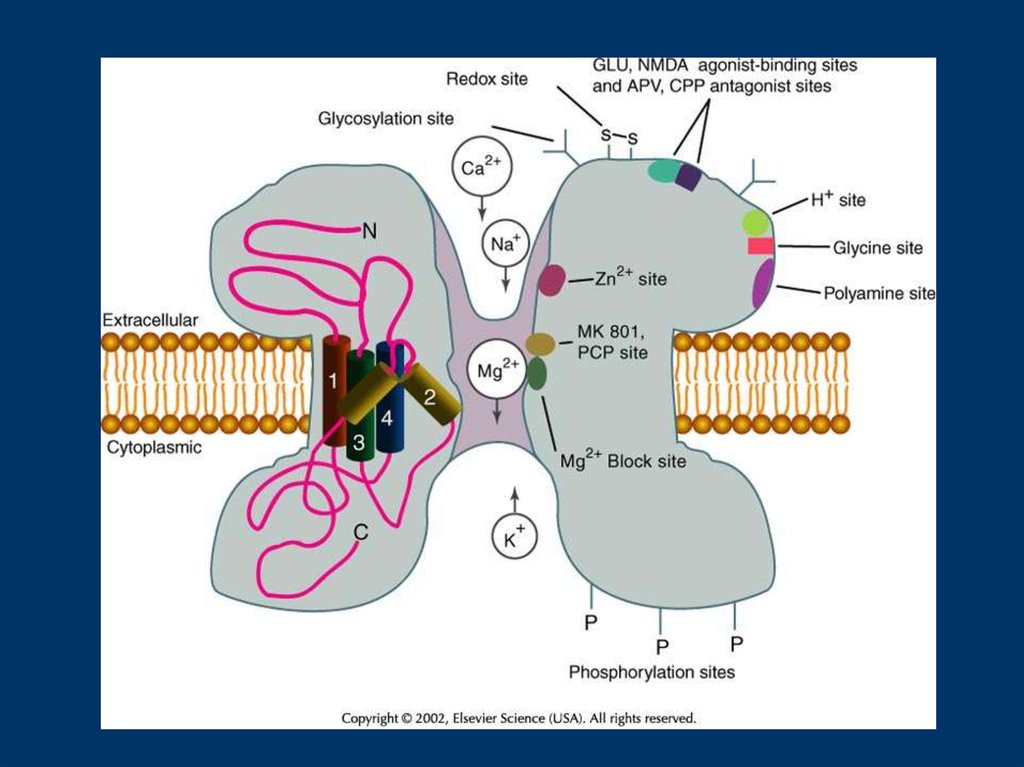
TABLE I – DIRECT MODULATORS OF THE NMDA RECEPTORModulator
Src family tyrosine kinases (src, fyn)
Mechanism
tyrosine phosphorylation
Effect
enhancement
loss of Zn inhibition
Scaffolding proteins
RACK1
binding
inhibitory
PSD-95
scaffolding
modulatory
ser/thr phosphoryation (direct)
enhancement
PKC
src activation (indirect)
PKA/PP1/Yotiao
phosphorylation
enhancement
dephosphorylation
inhibition
Cyclin dependent kinase 5
ser/thr phosphorylation
enhancement
Nitric Oxide/redox
sulfhydryl nitrosylation
inhibition
or oxidation
Polyamines (e.g. spermine,
spermidine)
direct binding to a modulatory
augmentation
site
Caseine kinase II
ser/thr phosphorylation
modulation of polyamine effects
enhancement
9.
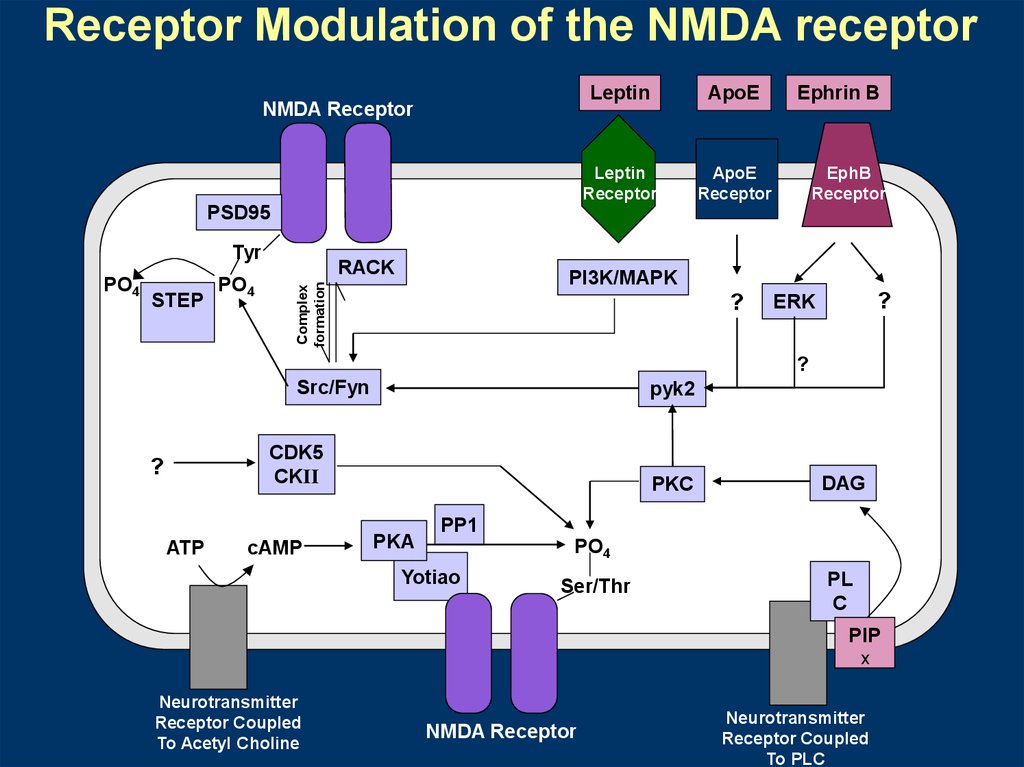
Receptor Modulation of the NMDA receptorNMDA Receptor
Leptin
ApoE
Leptin
Receptor
ApoE
Receptor
Ephrin B
EphB
Receptor
PSD95
Tyr
STEP
PO4
RACK
PI3K/MAPK
Complex
formation
PO4
?
?
ERK
?
Src/Fyn
pyk2
CDK5
CKII
?
ATP
cAMP
PKC
PKA
DAG
PP1
PO4
Yotiao
Ser/Thr
PL
C
PIP
X
Neurotransmitter
Receptor Coupled
To Acetyl Choline
NMDA Receptor
Neurotransmitter
Receptor Coupled
To PLC
10.
TABLE II – MECHANISMS UPSTREAM OF THE NMDA RECEPTORINVOLVED IN MEMBRANE DEPOLARIZATION
Ionic Current
Molecules Involved
Mechanisms of
Modulation
Role
K Currents
Voltage-dependent
Kv4.2 (and Kv4.3)
“A” currents
“H” Currents
limit bpAPs
ERK, PKA, CaMKII
limit EPSP magnitude
regulate excitability
cyclic nucleotides
(direct)
depolarize membrane
PKA, CaMKII, PKC
Na(v)1.6, 1.1,1.2
AP propagation
PKC (decreased
inactivation)
? – likely many
AP propagation
PKA
NCN channels
(HCN)
Na Currents
AMPA Receptors
GluR1, GluR2
Aka GluR-A,B
Voltage-dependent
Na+ currents
Ca Currents
(hypothetical)
Cl Currents
GABA Receptors
all GABA-A
AP firing
receptor subunits
excitability
numerous
11.
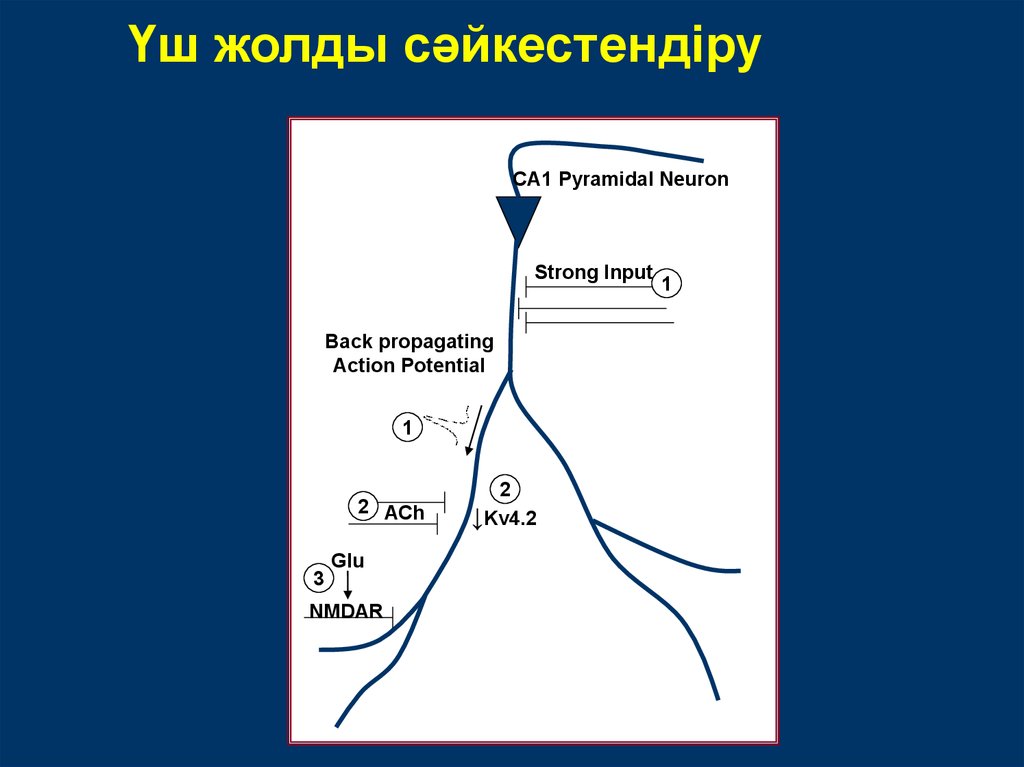
Үш жолды сәйкестендіруCA1 Pyramidal Neuron
Strong Input
Back propagating
Action Potential
1
2 ACh
3
Glu
NMDAR
2
↓Kv4.2
1
12.
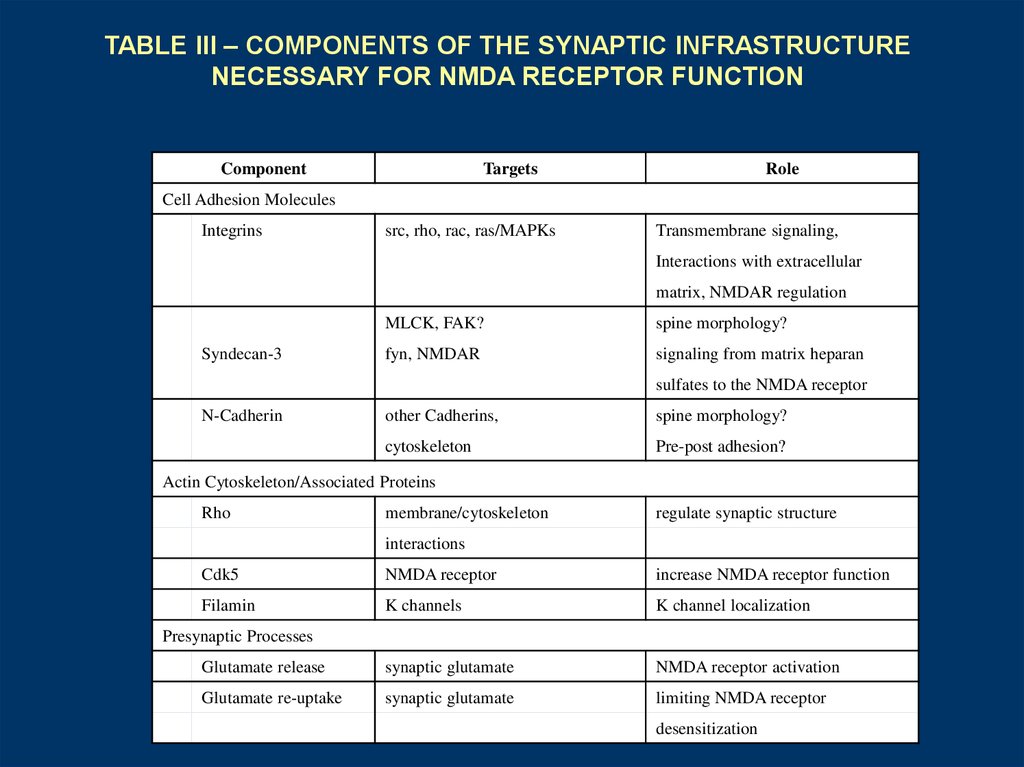
TABLE III – COMPONENTS OF THE SYNAPTIC INFRASTRUCTURENECESSARY FOR NMDA RECEPTOR FUNCTION
Component
Targets
Role
Cell Adhesion Molecules
Integrins
src, rho, rac, ras/MAPKs
Transmembrane signaling,
Interactions with extracellular
matrix, NMDAR regulation
Syndecan-3
MLCK, FAK?
spine morphology?
fyn, NMDAR
signaling from matrix heparan
sulfates to the NMDA receptor
N-Cadherin
other Cadherins,
spine morphology?
cytoskeleton
Pre-post adhesion?
Actin Cytoskeleton/Associated Proteins
Rho
membrane/cytoskeleton
regulate synaptic structure
interactions
Cdk5
NMDA receptor
increase NMDA receptor function
Filamin
K channels
K channel localization
Glutamate release
synaptic glutamate
NMDA receptor activation
Glutamate re-uptake
synaptic glutamate
limiting NMDA receptor
Presynaptic Processes
desensitization
13.
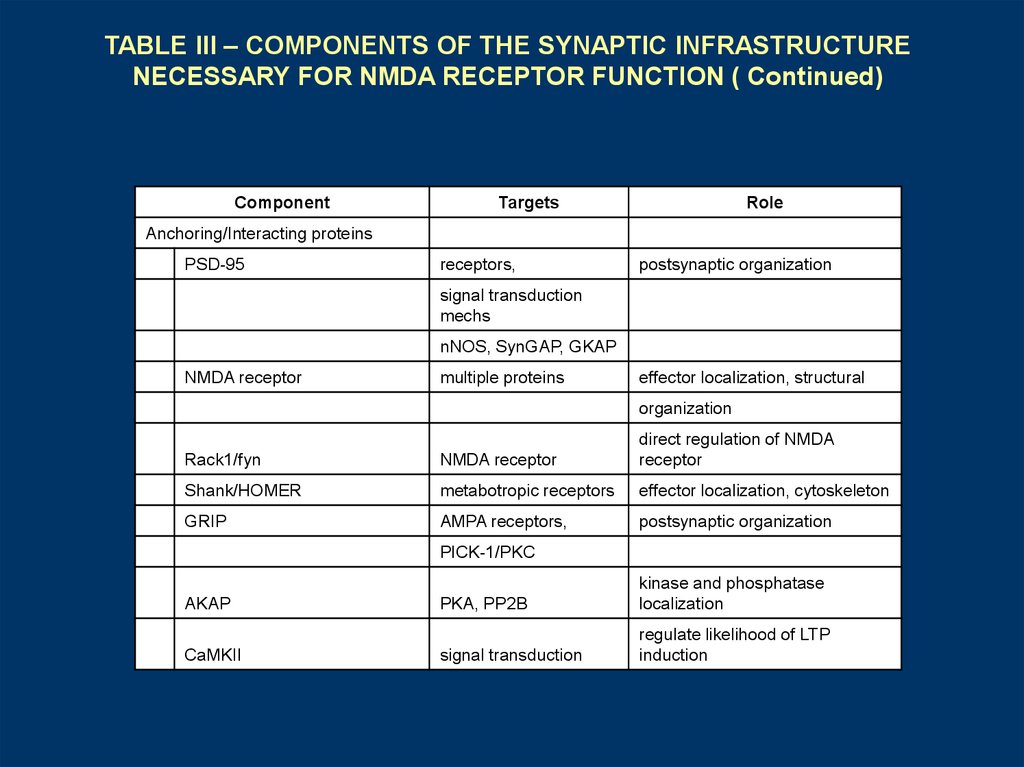
TABLE III – COMPONENTS OF THE SYNAPTIC INFRASTRUCTURENECESSARY FOR NMDA RECEPTOR FUNCTION ( Continued)
Component
Targets
Role
Anchoring/Interacting proteins
PSD-95
receptors,
postsynaptic organization
signal transduction
mechs
nNOS, SynGAP, GKAP
NMDA receptor
multiple proteins
effector localization, structural
organization
Rack1/fyn
NMDA receptor
direct regulation of NMDA
receptor
Shank/HOMER
metabotropic receptors
effector localization, cytoskeleton
GRIP
AMPA receptors,
postsynaptic organization
PICK-1/PKC
AKAP
CaMKII
PKA, PP2B
kinase and phosphatase
localization
signal transduction
regulate likelihood of LTP
induction
14.
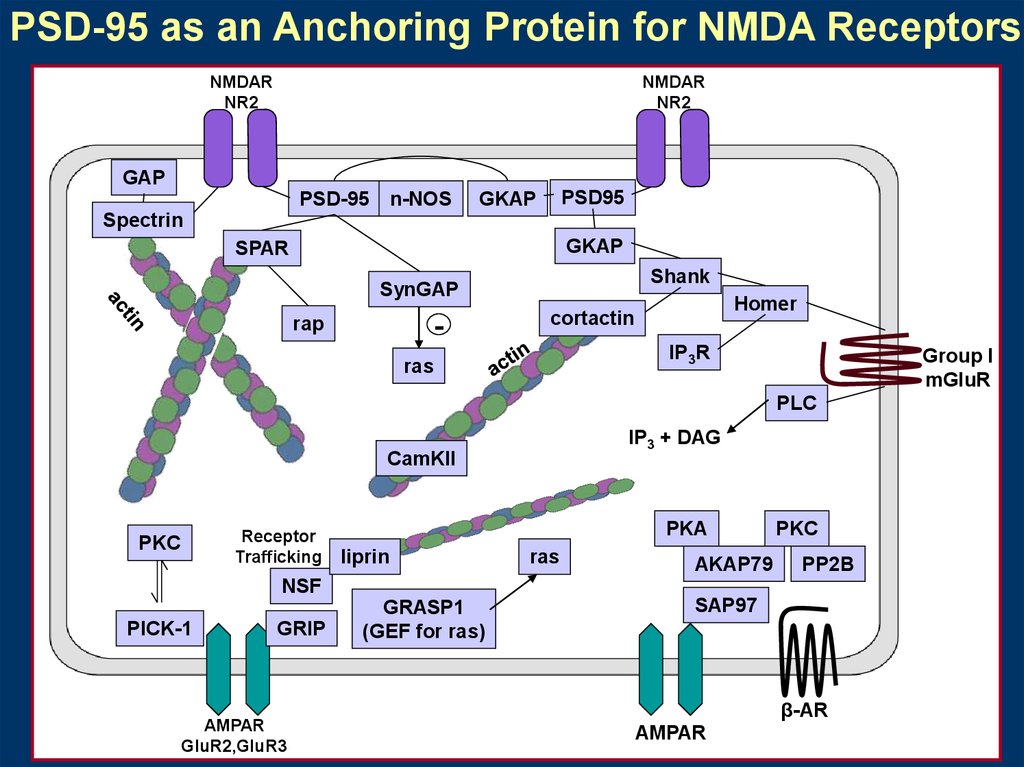
PSD-95 as an Anchoring Protein for NMDA ReceptorsNMDAR
NR2
NMDAR
NR2
GAP
PSD-95
n-NOS
PSD95
GKAP
Spectrin
GKAP
SPAR
Shank
SynGAP
-
rap
Homer
cortactin
IP3R
ras
Group I
mGluR
PLC
IP3 + DAG
CamKII
Receptor
Trafficking
PKC
PKA
liprin
ras
AKAP79
PKC
PP2B
NSF
PICK-1
GRIP
AMPAR
GluR2,GluR3
GRASP1
(GEF for ras)
SAP97
β-AR
AMPAR
15.
From Sheng and Kim16.
17.
18.
19.
20.
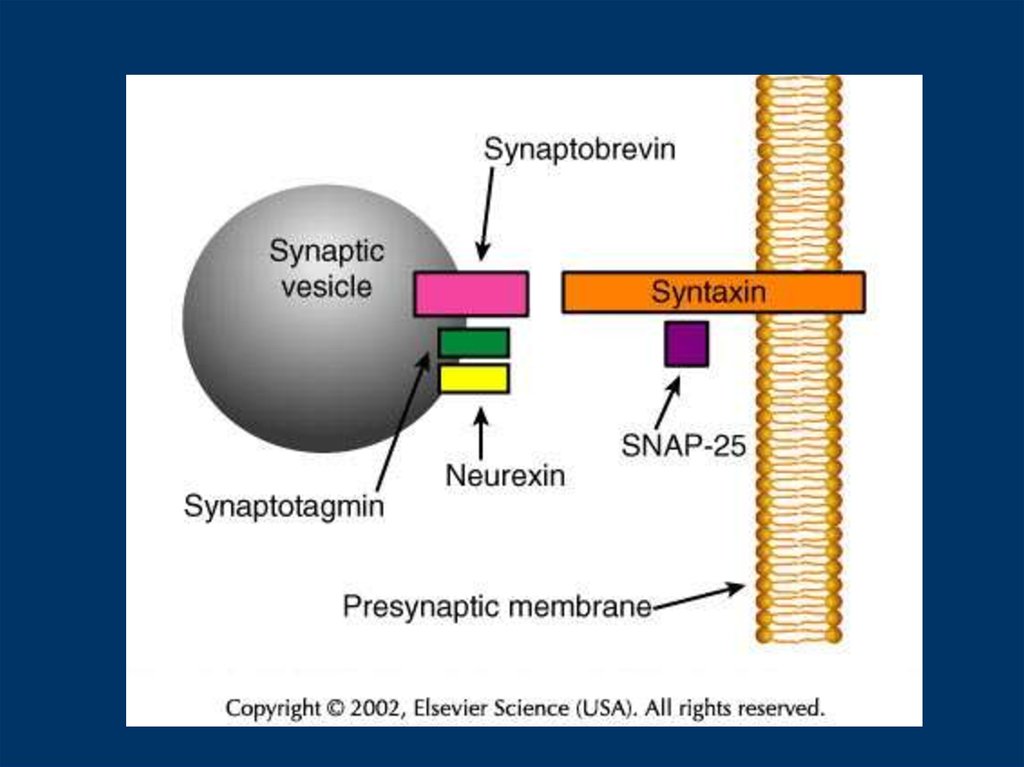
Fig. 1RIM1 және синаптические везикулды біріктіру қабынуы. (а) Қондырылғаннан кейін синапстыквезикул (SV) ядродағы Раб3-ні (N) RIM1-нің (Rab3-интерактивті молекуласы-1) N-терминалына
байланыстырады. Munc-13 фосфолипаза C (PLC) және екінші диацилглицерол (DAG) белсенділігі
арқылы ядросына қабылданады.
Munc-18 синтаксисіне (Syntx) байланыстыру синтаксинді SNAP-25 (синтездеу синтезомасымен
байланысты 25-белок) байланыстыра алмайтын «жабық» конформада сақтайды. (b) қысқа мерзімді
пластикаға ауысу кезінде Ca2 +, аденилат циклді (AC), cAMP және протеин киназ А (ПКА)
қатысуымен болатын екінші хабаршы жолдарын белсендіру RIM1 байланыстырушы серіктестерде
қосқышқа әкеледі. Munc-13-1 N-терминал RIM1-ке байланады, RIM1-ке Раб3-ге байланыстыруды
бәсекеге түсіреді.
21.
22.
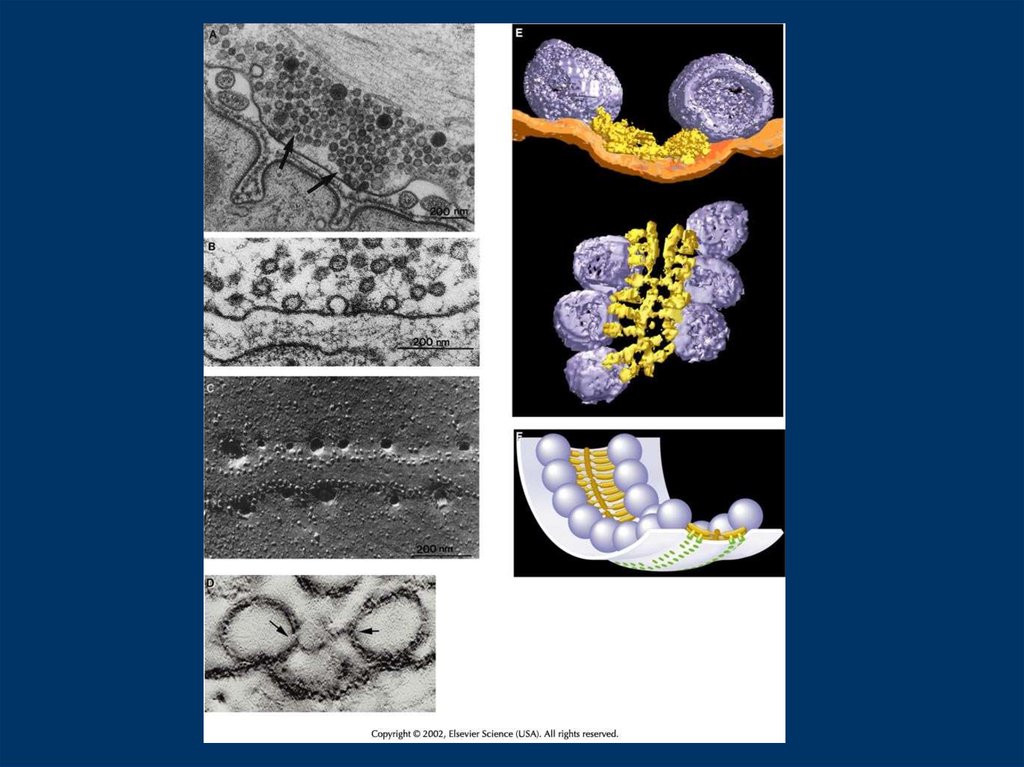
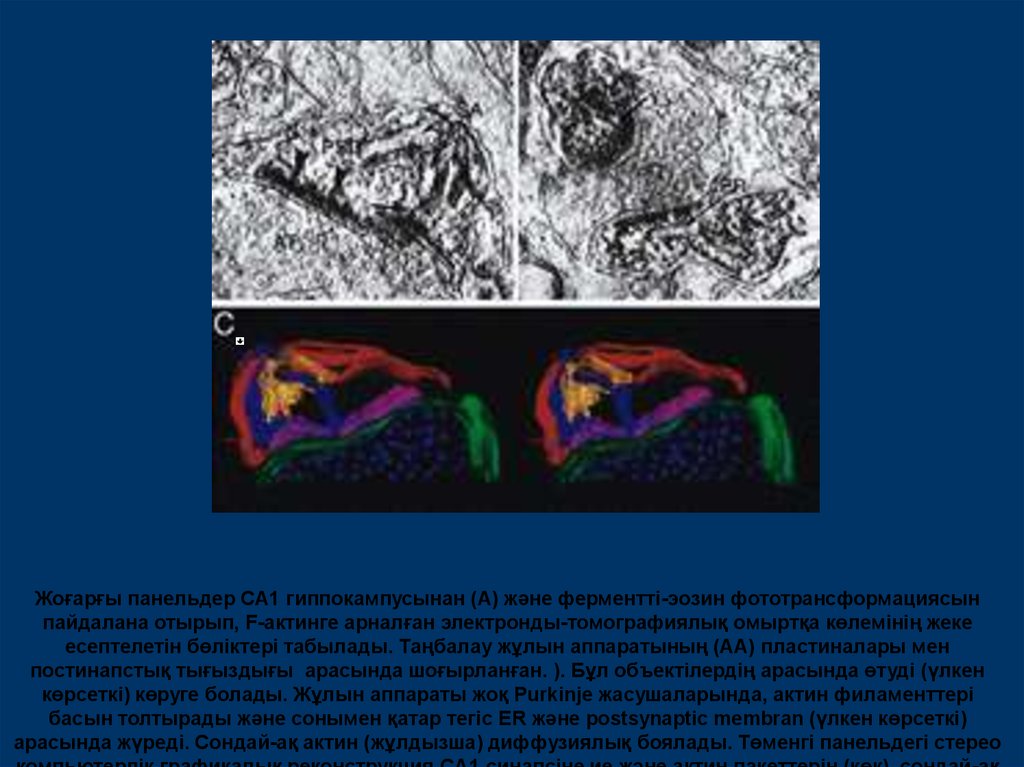
Жоғарғы панельдер CA1 гиппокампусынан (А) және ферментті-эозин фототрансформациясынпайдалана отырып, F-актинге арналған электронды-томографиялық омыртқа көлемінің жеке
есептелетін бөліктері табылады. Таңбалау жұлын аппаратының (АА) пластиналары мен
постинапcтық тығыздығы арасында шоғырланған. ). Бұл объектілердің арасында өтуді (үлкен
көрсеткі) көруге болады. Жұлын аппараты жоқ Purkinje жасушаларында, актин филаменттері
басын толтырады және сонымен қатар тегіс ER және postsynaptic membran (үлкен көрсеткі)
арасында жүреді. Сондай-ақ актин (жұлдызша) диффузиялық боялады. Төменгі панельдегі стерео
23.
Figure 1. LIMK Influences Postsynaptic and Presynaptic Function through Modulation of Actin FilamentsDendritic spines are made up of a head, neck, and postsynaptic density (PSD). Within the PSD, scaffold proteins such as Homer, PSD-95, and Shank,
as well as others not described here, link the actin cytoskeleton to postsynaptic receptors including AMPA and NMDA glutamate receptors. Results in
this issue of Neuron by Meng et al. (2002 ) demonstrate that LIMK-1 is partially responsible for proper dendritic morphology and long-term potentiation
(LTP), presumably via its effect on actin filament dynamics, through phosphorylation and inactivation of ADF/cofilin (AC). In LIMK-1−/− mice, the
morphology of dendritic spines is altered. The spines have a thicker neck and smaller postsynaptic density length and smaller spine area. Results
presented by Meng et al. (2002 ) also reveal that the LIMK-1−/− mice have enhanced basal release of presynaptic vesicles and an enhanced synaptic
depression, suggesting a role for LIMK-1 (and most likely actin dynamics) in neurotransmitter release. Figure by Patrick D. Sarmiere and James R.
Bamburg
24.
Интегриндер мен жасуша ішіндегі эффекторлар арасындағы өзара әрекеттесулерPresynaptic
Retrograde Signaling
Kv4.2 Channel
Integrins
NMDA Receptor
Integrins
?
β subunit
Src/fyn
filamin
rho
ras
α-actinin
talin
vinculin
cdk5
Postsynaptic
ERK
Extracellular
Matrix
rac
FAK ?
MLCK ?
Dynamic
Regulation
25.
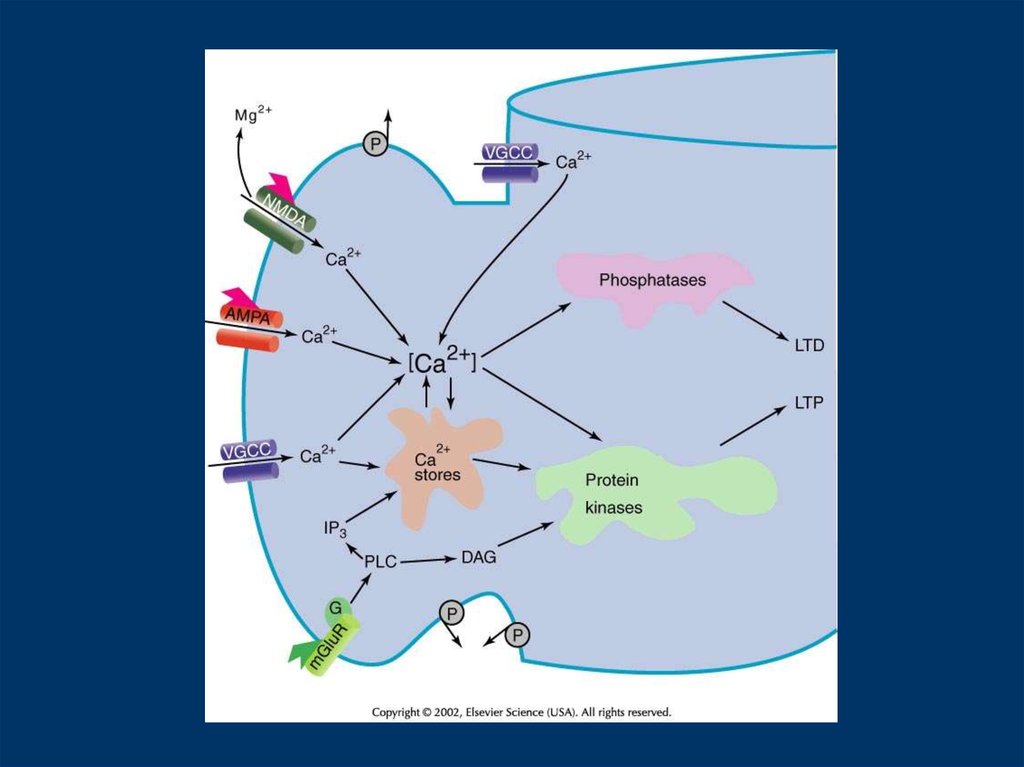
Кальций механизміMolecule/Organelle
Role
Modulator/Regulator
VDCCs
augment NMDAR-dependent
PKA
Ca influx
Ca influx due to bpAPs
regulate ERK activation
Endoplasmic Reticulum
Ca efflux from ER, limit LTP?
PLC-coupled receptors
regulate presynaptic Ca levels
unknown
(Ca ATPase/IP3R/RyR)
Presynaptic Mitochondria
26.
27.
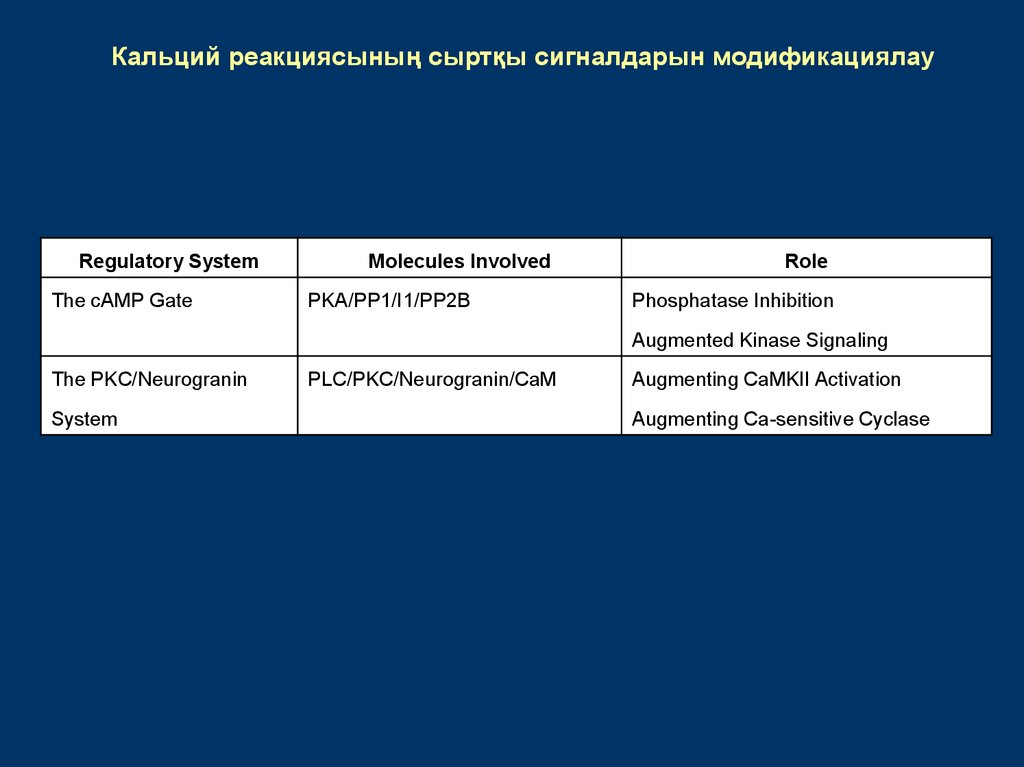
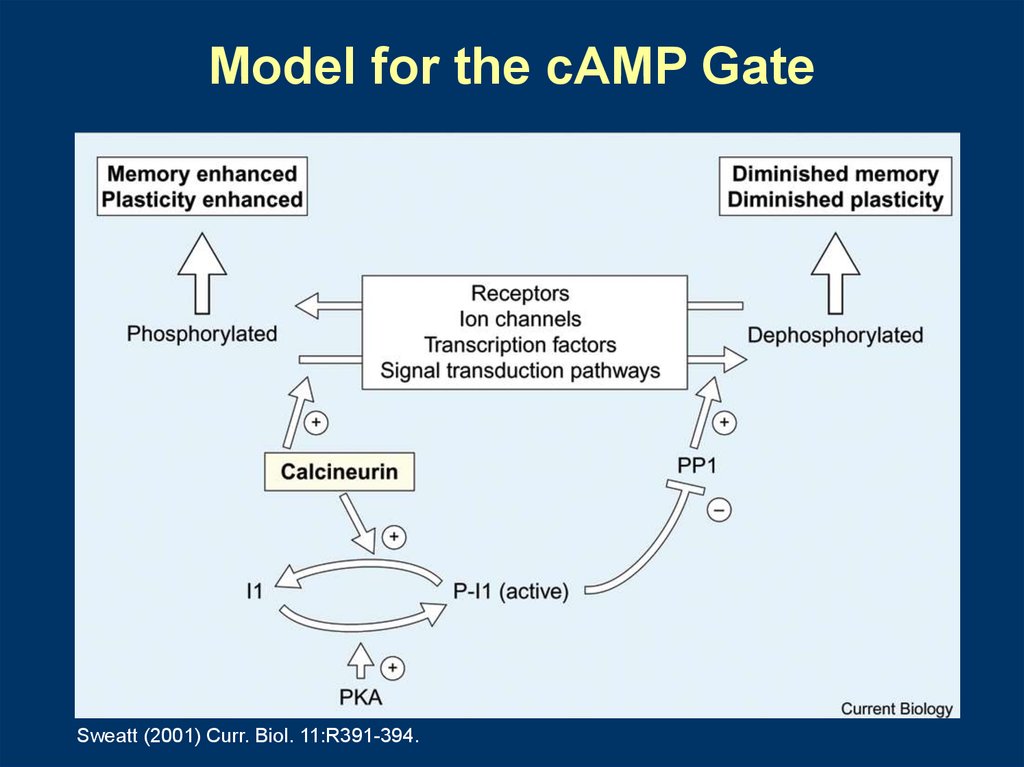
Кальций реакциясының сыртқы сигналдарын модификациялауRegulatory System
The cAMP Gate
Molecules Involved
PKA/PP1/I1/PP2B
Role
Phosphatase Inhibition
Augmented Kinase Signaling
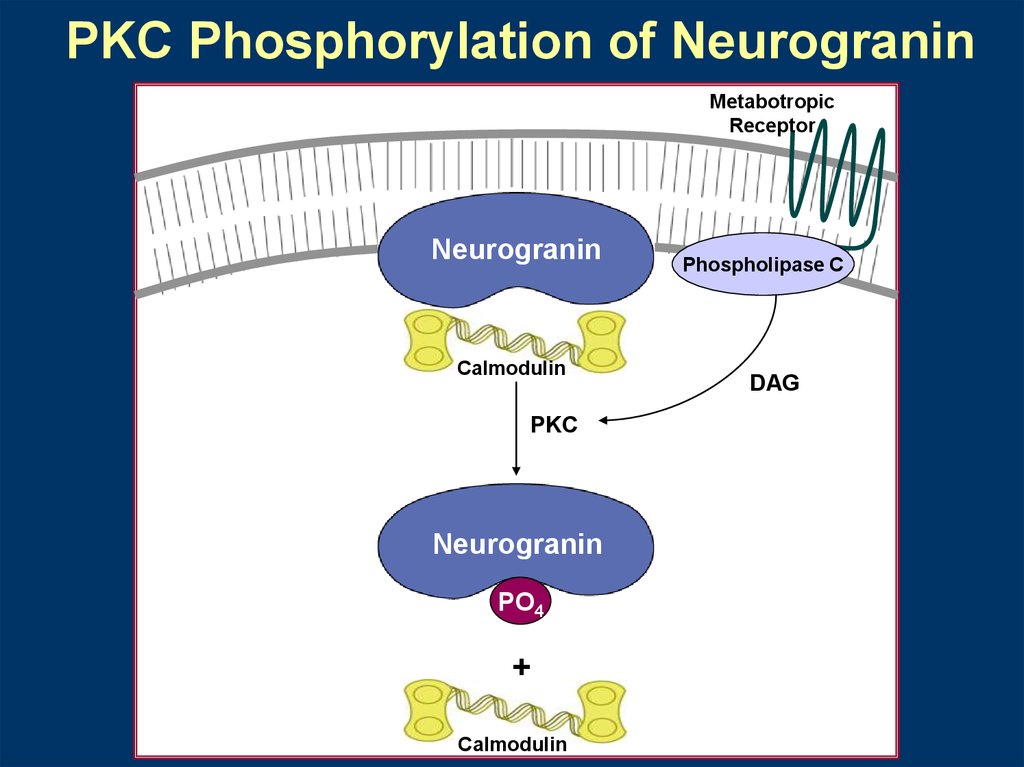
The PKC/Neurogranin
System
PLC/PKC/Neurogranin/CaM
Augmenting CaMKII Activation
Augmenting Ca-sensitive Cyclase
28.
Model for the cAMP GateSweatt (2001) Curr. Biol. 11:R391-394.
29.
PKC Phosphorylation of NeurograninMetabotropic
Receptor
Neurogranin
Calmodulin
PKC
Neurogranin
PO4
+
Calmodulin
Phospholipase C
DAG
30.
The PKC/Neurogranin system and the cAMP GateMetabotropic
Receptors
NMDAR
Initial Ca++
Signal
cAMP
GATE
Augmented
PKC
Neurogranin
DAG
Cyclase Coupled
Receptors
Increased
Ca++/CaM
Adenylyl
Cyclase
Augmented
CaMKII
Activity
31.
Four-way Coincidence DetectionCA1 Pyramidal Neuron
Strong Input
Back propagating
Action Potential
1
2 ACh
3
Glu
NMDAR
2
↓Kv4.2
4
cAMP
GATE
Norepinephrine
4
1













 biology
biology








