Similar presentations:
Металлы. Щелочные металлы
1.
ХИМИЯ9 класс
Металлы
ария Дмитриевна Смирнова
mirnova@sch2101.ru
k.com/masha2101
1
2.
МеталлыЛакмус
Фенолфталеин
3.
МеталлыВсе металлы, кроме бериллия, вступают в реакцию с водородом,
образую гидриды:
2Li + H2 = 2LiH
При реакции с галогенами:
Hal2 + Ca = CaHal2
Так же, образуются сульфиды, нитриды, фосфиды, карбиды, силициды.
4.
МеталлыРеакции с водой приводят к образованию основания
и…
2Li + 2H2O = 2LiOH + H2
Na2O + H2O = 2NaOH или Na2O + H2O = NaOH + H2
Zn + 2HCl = ZnCl2 + H2
Cu + HCl =
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 =
5.
МеталлыZn + 2HCl = ZnCl2 + H2
Cu + HCl =
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 =
Чем левее стоит металл в ряду стандартных электродных
потенциалов, тем более сильным восстановителем он является,
самый сильный восстановитель – металлический литий, золото –
самый слабый, и, наоборот, ион золото (III) – самый сильный
окислитель, литий (I) – самый слабый.
6.
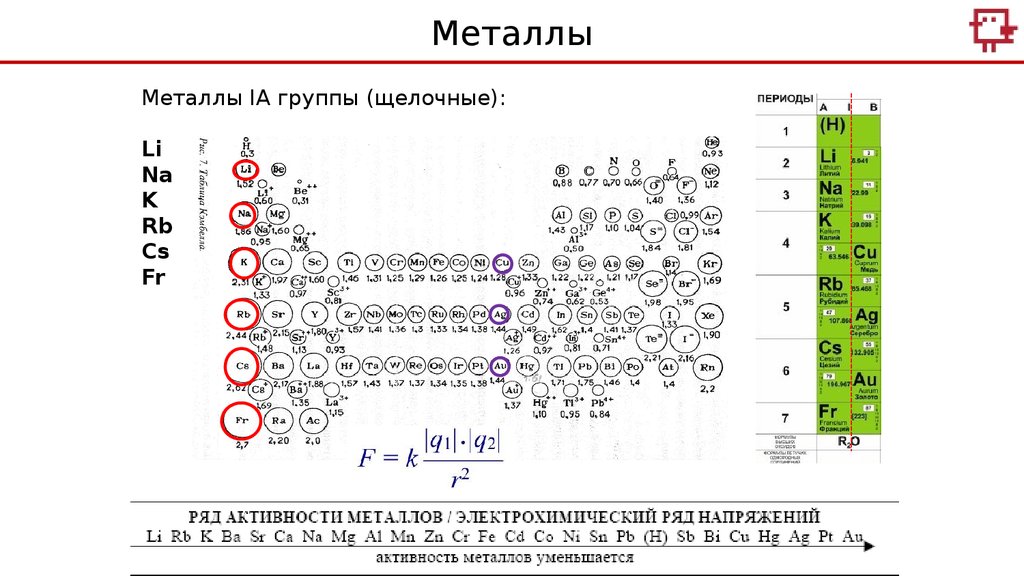
МеталлыМеталлы IA группы (щелочные):
Li
Na
K
Rb
Cs
Fr
7.
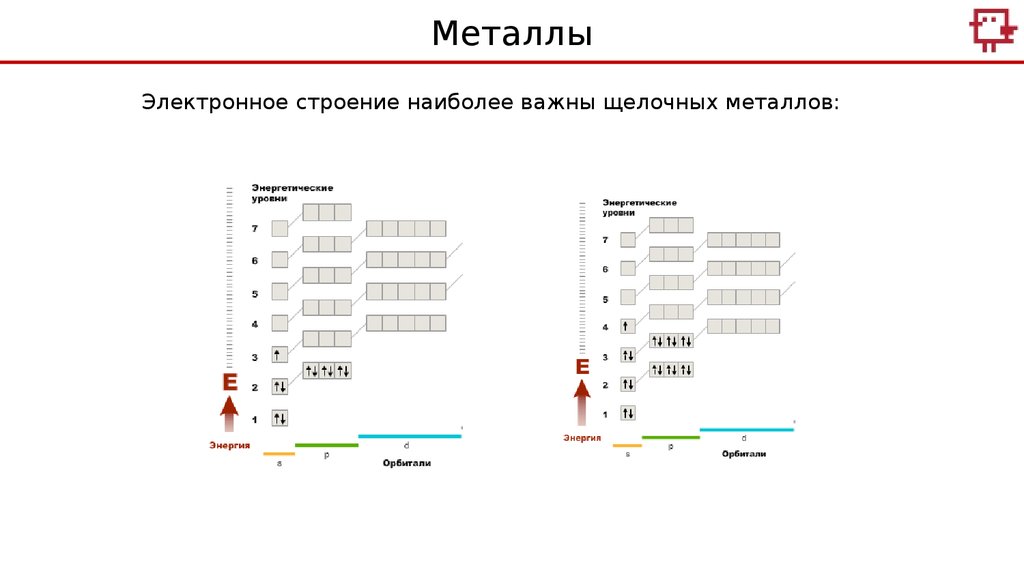
МеталлыЭлектронное строение наиболее важны щелочных металлов:
8.
МеталлыЭлектронное строение наиболее важны щелочных металлов:
Na
K
Me Me+
9.
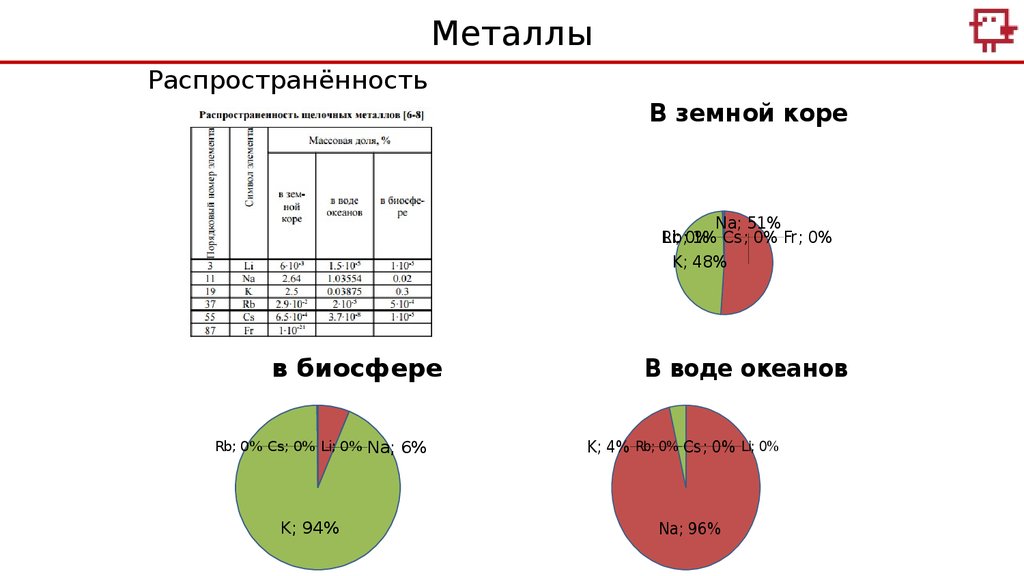
МеталлыРаспространённость
В земной коре
Na; 51%
Rb;
Li; 0%
1% Cs; 0% Fr; 0%
K; 48%
в биосфере
Rb; 0% Cs; 0% Li; 0%
K; 94%
Na; 6%
В воде океанов
K; 4% Rb; 0% Cs; 0% Li; 0%
Na; 96%
10.
МеталлыРаспространённость Li
Литий распространён в земной
коре относительно широко. Он
является
спутником
для
некоторых месторождений К и Na.
А
сам
образует
силикаты,
например,
сподумен,
лепидолит.
KLi2Al[Si4O10](F,OH)2
LiAl[Si2O6]
11.
МеталлыРаспространённость Rb и Cs
В природе рубидий и цезий весьма
распространены, но встречаются в
малых
количествах.
Месторождения этих элементов
рассеяны, причем Rb образует
только один минерал, а Cs – 17.
Но в промышленных масштабах Rb
и Cs спутники калия в воде
минеральных источников, соляных
пластах и минералах.
(Cs, Na)[AlSi2O6]*nH2O
12.
МеталлыРаспространённость Fr
У франция не существует ни
стабильных, ни долго живущих
изотопов.
223
Fr – член уранового ряда
(родоначальник 235U), являющийся
одним из самых долгоживущих,
имеет период полураспада 21,8
мин.
N – число атомов на данный момент; N0 – число атомов в изначальном
состоянии; t – время прошедшее, T – период полураспада.
13.
МеталлыРаспространённость Fr
T – 10
суток
14.
МеталлыРаспространённость K и Na
Очень распространены в земной коре (7 и 6 по
распространённости
соответственно).
Слагают
большое количество минералов, а так же входят в
состав растений.
Добывают, в основном, в виде NaCl и KCl.
15.
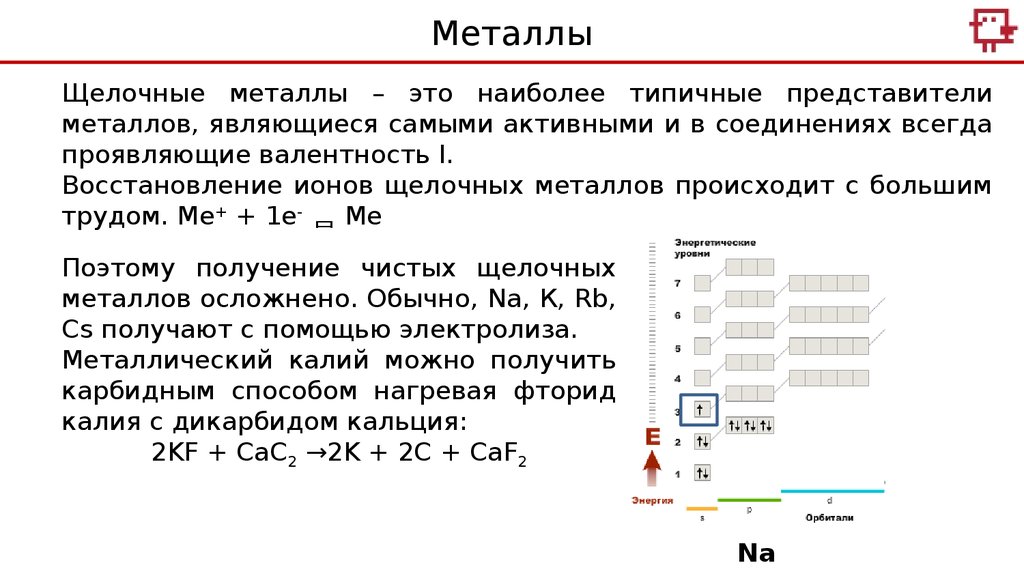
МеталлыЩелочные металлы – это наиболее типичные представители
металлов, являющиеся самыми активными и в соединениях всегда
проявляющие валентность I.
Восстановление ионов щелочных металлов происходит с большим
трудом. Me+ + 1e- Me
Поэтому получение чистых щелочных
металлов осложнено. Обычно, Na, К, Rb,
Cs получают с помощью электролиза.
Металлический калий можно получить
карбидным способом нагревая фторид
калия с дикарбидом кальция:
2KF + CaC2 →2K + 2C + CaF2
Na
16.
МеталлыФизические свойства.
Щелочные металлы – классические металлы, они имеют
металлический блеск, мягкость, легкость, легкоплавкость. Их
твёрдость и температура плавления закономерно снижаются от
лития к цезию.
17.
МеталлыХимические свойства.
Щелочные металлы – сильные восстановители. Они
реагируют со всеми неметаллами.
18.
МеталлыХимические свойства.
Реакции горения протекают до
надпероксидов. Исключение литий.
Давайте напишем эти реакции.
пероксидов
и
19.
МеталлыПрименение.
Li
- Как легирующая добавка к сталям. Так, например,
при добавлении к техническому алюминию всего
только 0,77% лития значительно повышается его
коррозионная
стойкость
и
механическая
прочность.
- Металлический литий предложено использовать
также для создания его парами инертной газовой
атмосферы в обжиговых печах.
- Растворы лития (LiOH) применяются для заливки
щелочных аккумуляторов, увеличивая их емкость,
срок службы и повышая температурный диапазон
действия.
- Важнейшая область применения лития – ядерная
энергетика.
Большое
применение
получили
20.
МеталлыПрименение.
Na
- Как легирующая добавка к сталям, в качестве
модификаторов
алюминиевых
сплавов
типа
силумина (Al + Si), свойства которых при этом
значительно улучшаются.
- В органическом синтезе.
- В лабораториях натрий используют в качестве
восстановителя.
- в осветительной технике в качестве наполнителя
натриевых газоразрядных ламп.
- В качестве исходного продукта при производстве
перекиси натрия (моющее средство).
21.
МеталлыПрименение.
К
Из-за высокой химической активности и высокой
стоимости
применение
металлического
калия
значительно меньше, чем натрия.
- Жидкие (при комнатной температуре) сплавы
калия и натрия, содержащие 40…90% калия, могут
применяться
в
атомной
энергетике
как
теплоносители на АЭС.
- Из
металлического
калия
получают
смесь
пероксида и надпероксида, используемую при
регенерации воздуха.
- Удобрения.
22.
МеталлыПрименение.
Rb и Cs
Одним из замечательных свойств этих металлов
является их высокий фотоэлектрический эффект.
Применение фотоэлементов в современной технике
чрезвычайно широко и разнообразно.


















 chemistry
chemistry








