Similar presentations:
Фосфор
1. ФОСФОР
2.
Р-фосфорАтомдық массасы~31
Реттік нөмірі – 15
Электроны- +15P)2е)8е)5е)
Электронының формуласы:
1S2 2S2 2P6 3S2 3P3
Тотығу дəрежесі:-3,+3,+5
P (15p,16n)15e
3.
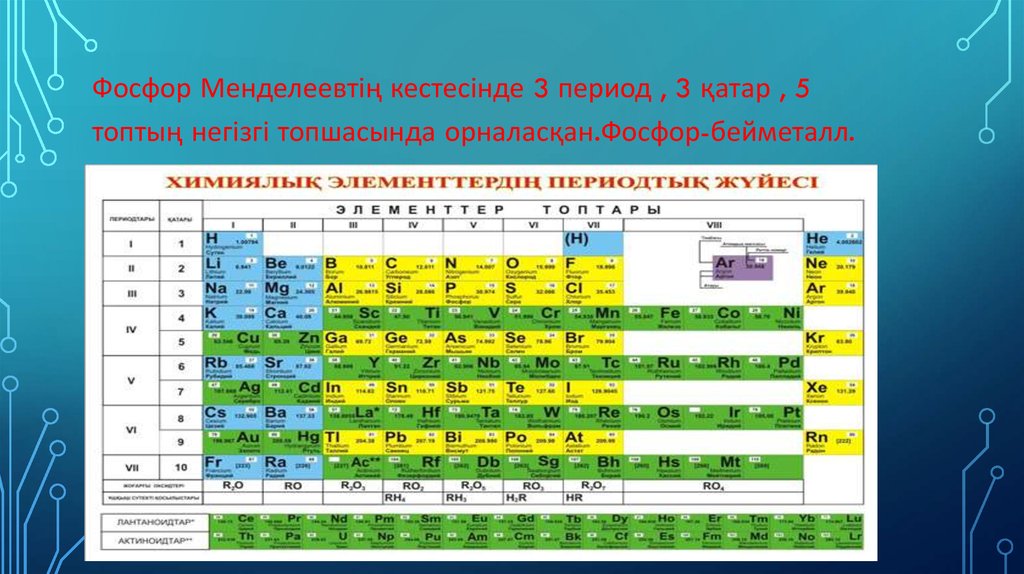
Фосфор Менделеевтің кестесінде 3 период , 3 қатар , 5топтың негізгі топшасында орналасқан.Фосфор-бейметалл.
4.
Фосфорды алғаш ашқан – Гамбургтік алхимик ГеннингБранд(1669 ж). Басқа да алхимиктер тәрізді Бранд қарттарды
жасартып, сырқаттарды жазатын өмір элексирі мен асыл
емес металдарды алтынға айналдыратын философиялық
тасты табуға әрекет жасады. Бір тәжірибенің барысында ол
зәрді буландырып, алынған қалдықты көмір және құм қосып,
буландыруды жалғастырды. Фосфордың алыну құпиясын
сақтау оңай болмағандықтан, ол оны дрездендік химик И.
Крафтқа сатып жіберді. Фосфорды алудың әдістемесі И.
Кункель мен К. Кирхмейерге белгілі болғаннан кейін оны
көрсетушілер саны көбейді. 1680 жылы жаңа элементті,
алдындағыларға тәуелсіз, ағылшын физигі әрі химигі Роберт
Бойль алды. Бірақ көп кешікпей Бойль қайтыс болды, ал оның
шәкірті А. Ганквиц «фосфор спекуляциясын» қайта
жандандырды. Тек 1743 жылы А. Маркграф фосфорды алудың
жетілген әдісін тауып, өз мәліметтерін көпшілік назарына
жариялады.
5. Табиғатта кездесуі
ТАБИҒАТТА КЕЗДЕСУІТау жыныстарында жəне минералдарда болады
6.
Фосфор — күш-қуат көзі. Қаңқаның мықтылығықұрамындағы фосфор мен кальцийдің мөлшеріне
тығыз байланысты. Фосфордың мөлшері кальцийден
бір жарым есе көп болуы керек. Ондай болмаған
жағдайда тепе-теңдік мөлшерін белгілі бір деңгейде
ұстап тұру үшін жеткіліксіз мөлшерін сүйектегі қордан
алады. Бірақ D витамині оның арақатынасын реттеп
отырады. Фосфор жүйке жасушаларының қызметі
үшін де керек. Сондықтан оның мөлшері барлық
уақытта біркелкі болуы керек. Фтор, стронций адам
тісінің мықты болуына әсер етеді.
Фосфор — аралық зат алмасу процесінде маңызды
рөл атқарады. Оның қатысуымен көмірсулардың
фосфорлану процесі жүреді, қанның қышқыл-сілігілік
тепе-теңдігі қамтамасыз етіледі, бұлшық еттің
жиырылуын қуаттандыратын биохимиялық процестер
атқарылады.
Фосфор ақуызы мол ет, сүт өнімдерінде кездеседі.
7.
Қызыл фосфор сіріңке өндірісінде,пиротехникада және фосфор кышкылын алуға
пайдаланылады. Фосфор ауыл- шаруашылык
зиянкестерімен күресу үшін кажет улы
химикаттар алу үшін қолданылады.
Фосфордың ақ және қызыл түрөзгерісі бар. Ақ
фосфор химиялық белсенді болып келеді.
Сондықтан ақ фосфорды қараңғыда су астында
сақтайды. Ақ фосфорды ауасыз ортада
қыздырса, қызыл фосфор алынады. Қызыл
фосфор сіріңке өндіруде, пиротехникада
қолданылады. Фосфор жай және күрделі
заттармен өрекеттеседі.Қазақстанда фосфор
шикізатының қоры Жамбыл (Қаратау) және
Ақтөбе (Шилісай) облыстарында бар.
Фосфор сіріңке және улы химикаттар өндірісінде
пайдаланылады.
Ақ, қызыл фосфор Н3РО4 алуда, жанғыш
қоспалар дайындау үшін қолданылады.
P+5HNО3 = Н3РО4+5NО2↑ +Н2О
8.
Фосфордың алыну формуласы:Са3(РО4)2+ 3SiО2 + 5С = 3CaSiО3+ 5CО↑+2Р
Фосфор оксидін суда еріту арқылы
Р2О5 + ЗН2О = 2Н3РО4 Фосфоритке концентрлі
қышқылмен әркет ету арқылы
Са3(РО4)2 + 3H2SО4= 2Н3РО4+ 3CaSО4Фосфор
қышқылы үш түрлі тұз түзеді: NaH2PО4 - натрий
дигидрофосфаты; Na2HPО4 - натрий
гидрофосфаты; Na3PО4 - натрий фосфаты.








 chemistry
chemistry








