Similar presentations:
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
1. Лекция №3 Тема: «Алкены» План: 1. Общая характеристика ,гомологический ряд, номенклатура ,изомерия. 2. Методы синтеза алкенов.
Лекция №3План:
1. Общая характеристика ,гомологический ряд,
номенклатура ,изомерия.
2. Методы синтеза алкенов.
3. Физические свойства
4. Химические свойства:
а) реакция присоединения;
б)реакция окисления;
в) реакция полимеризации.
5.Отдельные представители алкенов.
2. 1. Общая характеристика, гомологический ряд, номенклатура , изомерия.
Алкенами называются алифатические углеводороды,содержащие в молекуле двойную связь
С═С
Они относятся к группе непредельных углеводородов.
Общая формула гомологического ряда алкенов
(олефинов):
СnН2 n
В молекуле алкена ненасыщенные атомы углерода
находятся в состоянии sp3 – гибридизации, двойная
связь между ними образована 1σ- и 1π-связями.
3.
Строение молекулыалкенов
SP2 - гибридизация
4.
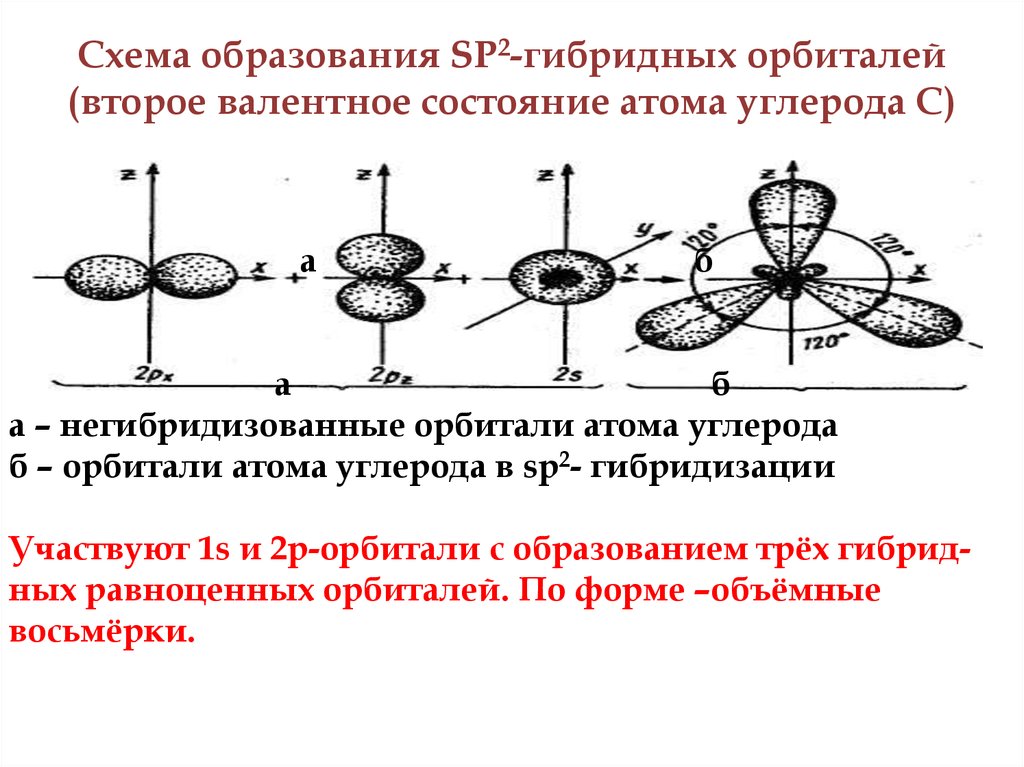
5. Схема образования SP2-гибридных орбиталей (второе валентное состояние атома углерода С)
аб
а
б
а – негибридизованные орбитали атома углерода
б – орбитали атома углерода в sp2- гибридизации
Участвуют 1s и 2р-орбитали с образованием трёх гибридных равноценных орбиталей. По форме –объёмные
восьмёрки.
6. Гомологический ряд алкенов
• ЭтенC2H4
• Пропен C3H6
• н-бутен
C4H8
• н-пентен C5H10
• н-гексен C6H12
• н-гептен
C7H14
• н-октен
C8H16
• н-нонен
C9H18
• н-децен
C10H20
7. Номенклатура
1.Систематическая (международная) номенклатураВыбираем цепочку с двойной связью.
Нумеруем с того конца, где ближе двойная связь.
Цифрой указываем номера углеродных атомов, где есть
радикалы и называем их.
Называем всю цепочку, окончание –ан меняем на –ен.
В конце указываем номер углеродного атома, от
которого начинается двойная связь.
1
2 3
4
СН2 ═ С - СН2 - СН3
│
СН3
2-метилбутен -1
8. 2.Рациональная номенклатура
Выбираем 2 центральных атома, соединенныхдвойной
связью.
Отсекаем все связи, отходящие от центральных
атомов.
Называем радикалы от младшего к старшему.
К названию радикалов добавляем слово «Этилен».
СН3 – С ═ СН – СН - СН3
│
СН3
│
СН3
Диметилизопропилэтилен
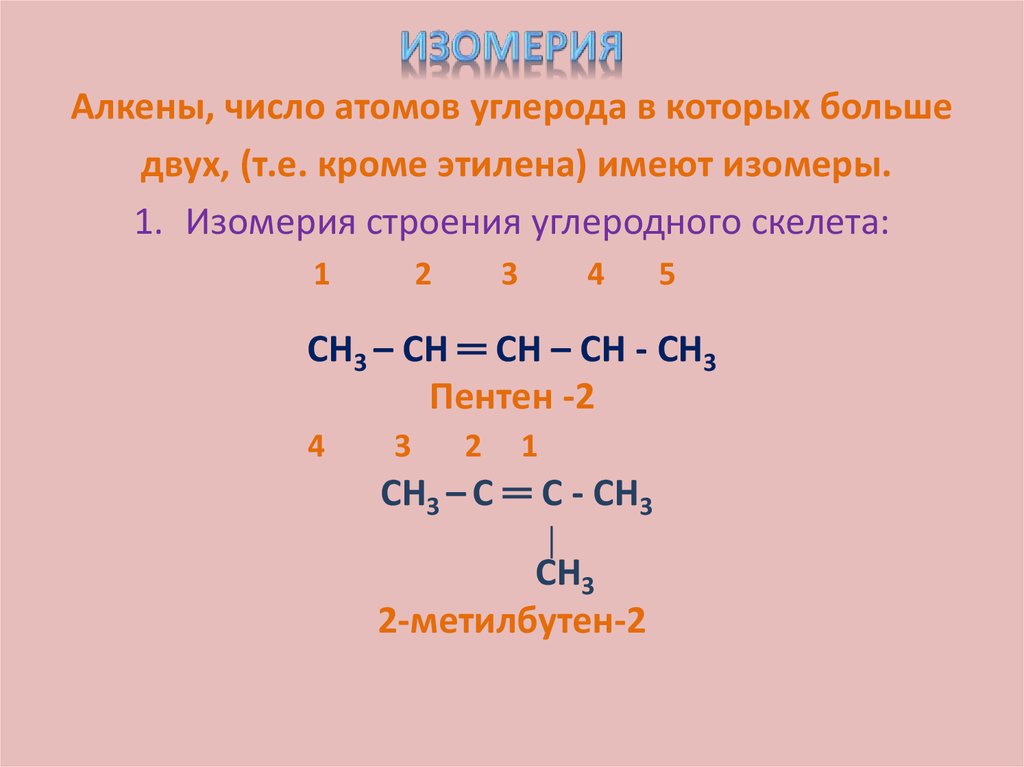
9. Изомерия
Алкены, число атомов углерода в которых большедвух, (т.е. кроме этилена) имеют изомеры.
1. Изомерия строения углеродного скелета:
1
2
3
4
5
СН3 – СН ═ СН – СН - СН3
Пентен -2
4
3
2
1
СН3 – С ═ С - СН3
│
СН3
2-метилбутен-2
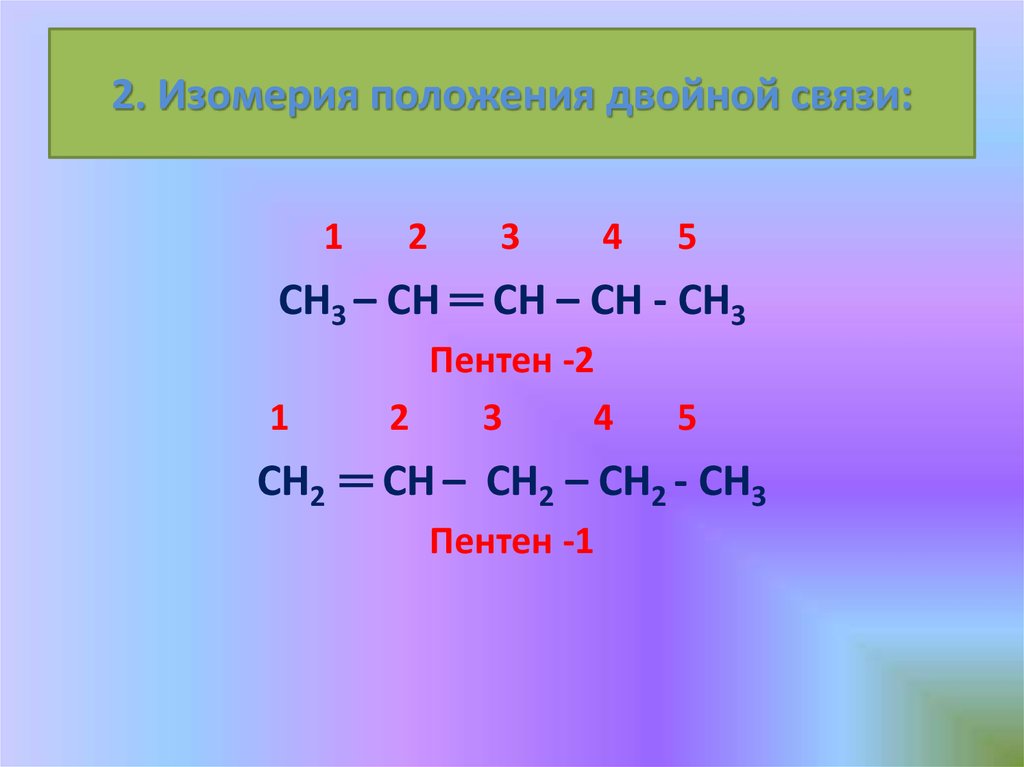
10. 2. Изомерия положения двойной связи:
12
3
4
5
СН3 – СН ═ СН – СН - СН3
1
Пентен -2
2
3
4
5
СН2 ═ СН – СН2 – СН2 - СН3
Пентен -1
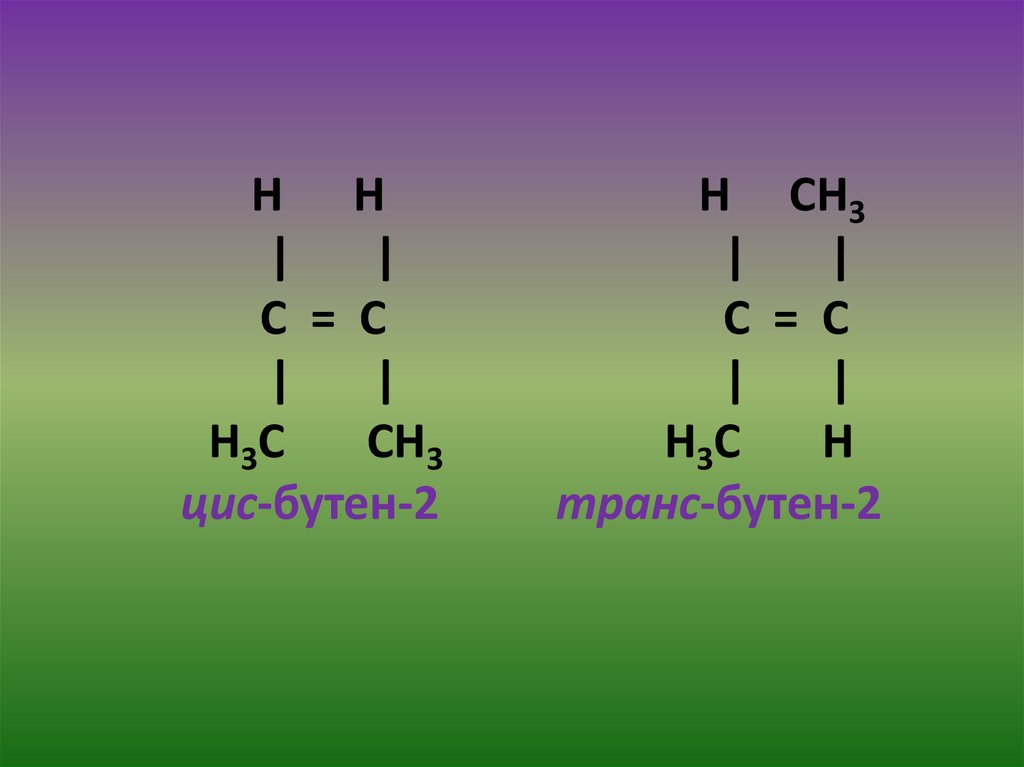
11. 3.Стереоизомерия
Стереоизомерия – изомерия расположения атомовотносительно двойной связи (пространственная).
Цис – и транс – изомеры не являются структурными изомерами,
т.к. они имеют одинаковую последовательность связей атомов,
а различаются только расположением атомов или групп в
пространстве.
Алкены, у которых хотя бы один атом
углерода, связанный двойной связью, имеет два
одинаковых заместителя, например 2-метилбутен – 1
СН2 ═ С - СН2 - СН3, не имеют цис- и транс – изомеров.
СН3
Цис- и транс – изомеры различаются по энергетическому
состоянию, по физико-химическим свойствам. Более устойчивы
– транс-изомеры.
12.
H H|
|
C = C
|
|
H3C
CH3
цис-бутен-2
H CH3
|
|
C = C
|
|
H3C
H
транс-бутен-2
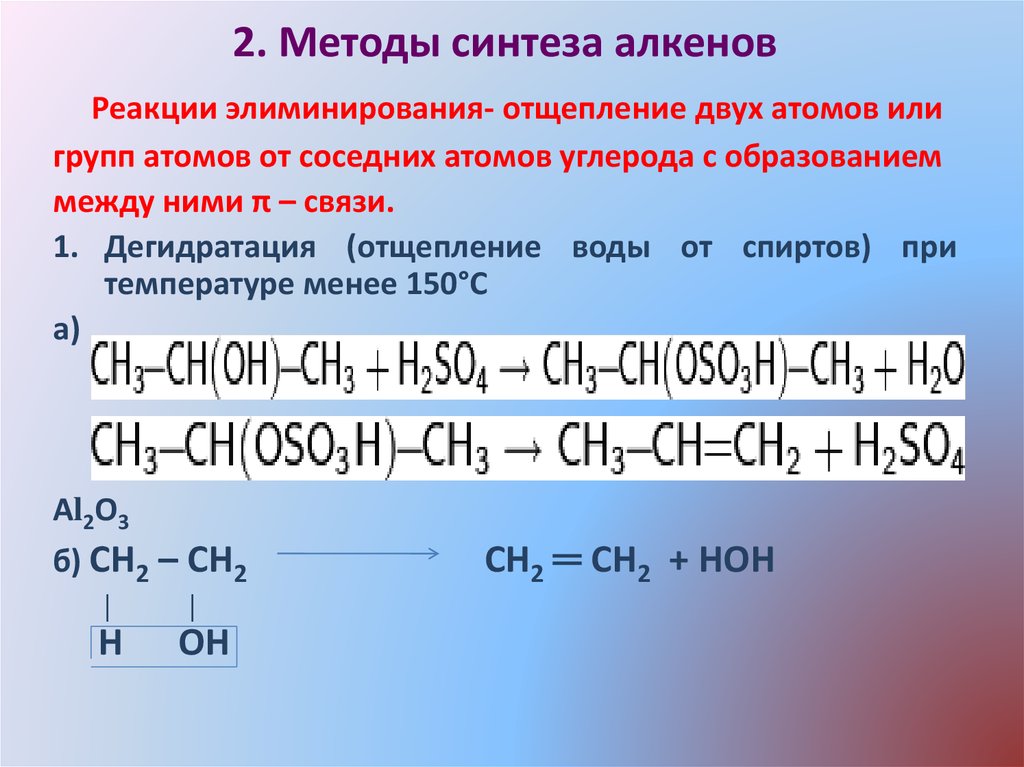
13. 2. Методы синтеза алкенов
Реакции элиминирования- отщепление двух атомов илигрупп атомов от соседних атомов углерода с образованием
между ними π – связи.
1. Дегидратация (отщепление воды от спиртов) при
температуре менее 150°C
а)
Аl2О3
б) СН2 – СН2
│
│
Н
ОН
СН2 ═ СН2 + НОН
14.
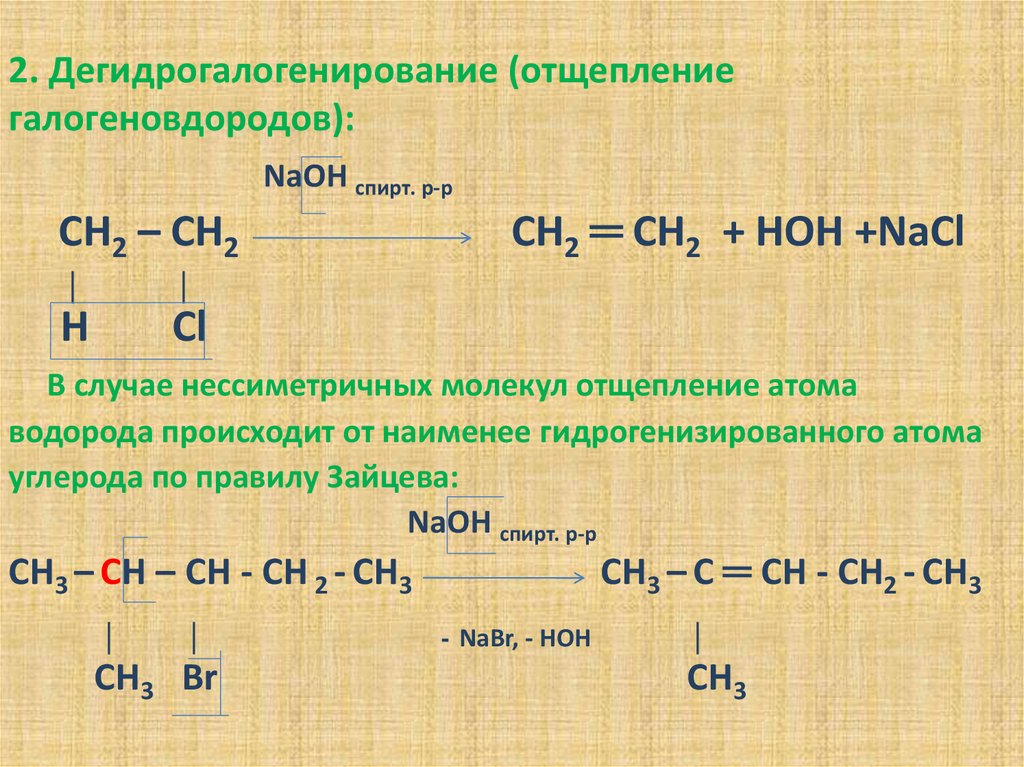
15. 2. Дегидрогалогенирование (отщепление галогеновдородов):
NаОН спирт. р-рСН2 – СН2
│
│
Н
Сl
СН2 ═ СН2 + НОН +NаСl
В случае нессиметричных молекул отщепление атома
водорода происходит от наименее гидрогенизированного атома
углерода по правилу Зайцева:
NаОН спирт. р-р
СН3 – С ═ СН - СН2 - СН3
СН3 – СН – СН - СН 2 - СН3
│
│
СН3 Вr
- NаВr, - НОН
│
СН3
16.
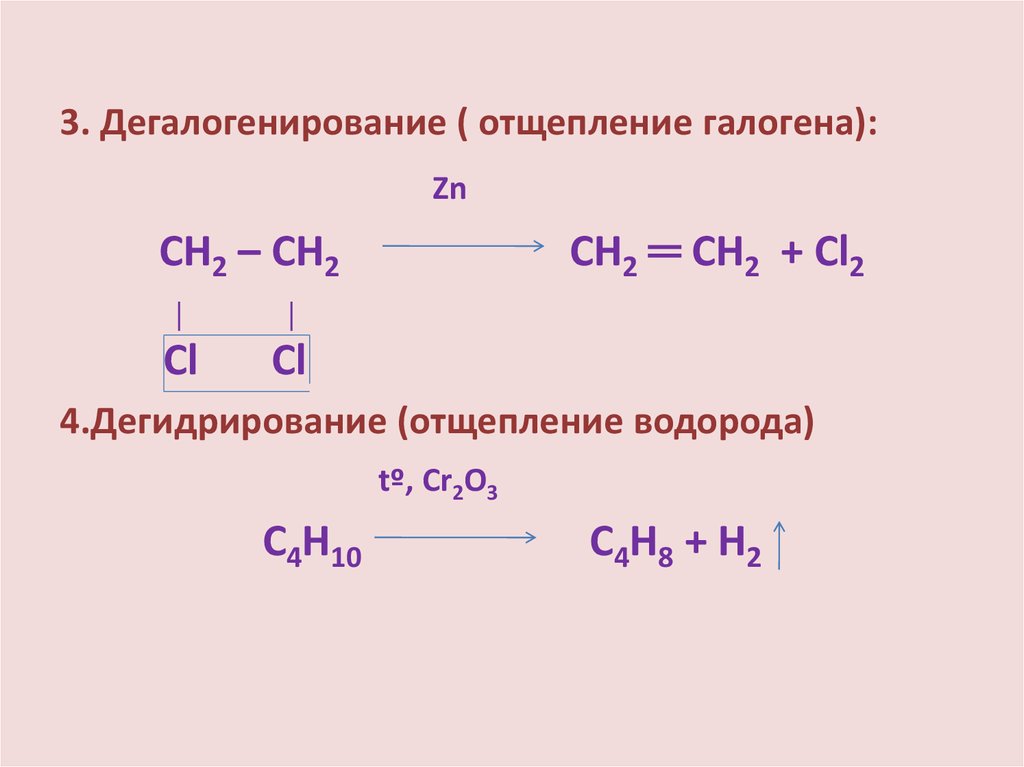
3. Дегалогенирование ( отщепление галогена):Zn
СН2 ═ СН2 + Сl2
СН2 – СН2
│
│
Сl
Сl
4.Дегидрирование (отщепление водорода)
tº, Сr2О3
С4Н10
С4Н8 + Н2
17. 3.Физические свойства
Низшие гомологи С2 –С4 при нормальныхусловиях – газы; С5-С17 – жидкости;
высшие гомологи – твердые вещества.
Алкены нерастворимы в воде, но хорошо
растворяются в органических
растворителях.
18. 4. Химические свойства
Химические свойства алкенов определяютсястроением и свойствами двойной связи С=С,
которая значительно активнее других связей в
молекулах этих соединений. Поэтому для алкено
в наиболее характерны реакции, протекающие за счет
раскрытия менее прочной p -связи. При этом p -связь
(в исходном алкене) преобразуется в s -связь в
продукте реакции.
Исходное ненасыщенное соединение превращается в
насыщенное без образования других продуктов, то
есть происходит реакция присоединения.
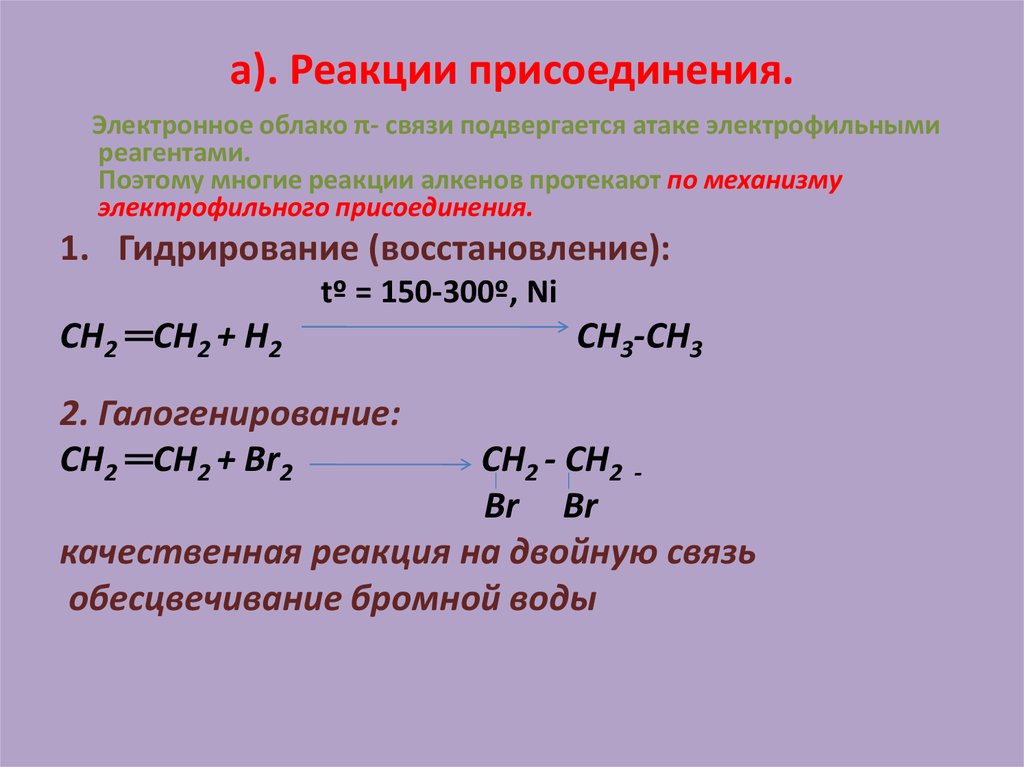
19. а). Реакции присоединения.
Электронное облако π- связи подвергается атаке электрофильнымиреагентами.
Поэтому многие реакции алкенов протекают по механизму
электрофильного присоединения.
1. Гидрирование (восстановление):
tº = 150-300º, Ni
СН2 ═СН2 + Н2
2. Галогенирование:
СН2 ═СН2 + Вr2
СН3-СН3
СН2 - СН2 Вr Вr
качественная реакция на двойную связь
обесцвечивание бромной воды
20. 3. Гидратация: СН2 ═СН2 + Н2 О Н+ СН3 - СН2 - ОН
В реакциях несимметричных алкенов соблюдаетсяправило Марковникова.
Правило Морковникова: при присоединении молекул
типа НХ к несимметричным алкенам атом водорода присоединяется к более гидрогенизировнному
атому углеводорода двойной связи, а остаток к
менее гидрогенизированному атому.
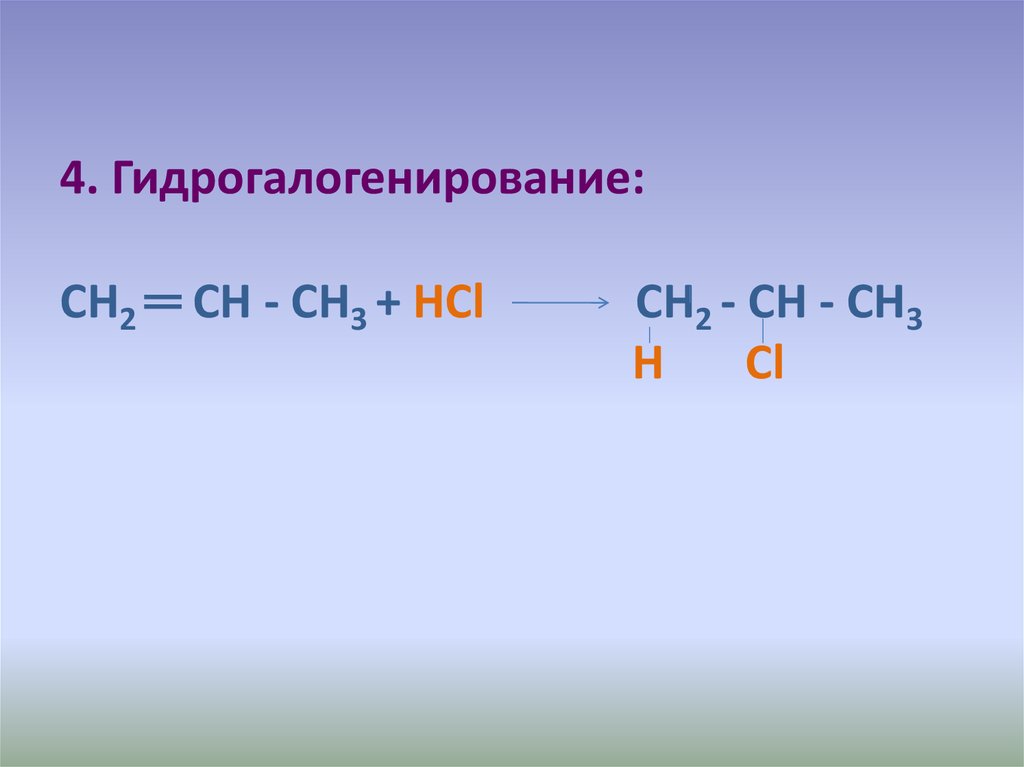
21. 4. Гидрогалогенирование: СН2 ═ СН - СН3 + НСl СН2 - СН - СН3 Н Сl
22.
23. б). Реакции окисления
1. Окисление алкенов в мягких условиях (щелочная илинейтральная среда, холод, окислитель – КМnО4):
3СН2 ═ СН2 + 4Н2О + 2КМnО4 3СН2 - СН2 + 2КОН +2МnО2
коричневый
ОН ОН
2. Окисление алкенов в жестких условиях (кислая среда,
комнатная температура, окислитель - КМnО4 ):
а)СН2 ═ СН2+4Н2SО4+2КМnО4 2СО2+6Н2О+К2SО4+2МnSО4
б)СН3-СН ═ СН-СН3+Н2SО4+2КМnО4 СН3- СООН +3Н2О
+К2SО4+2МnSО4
24.
25.
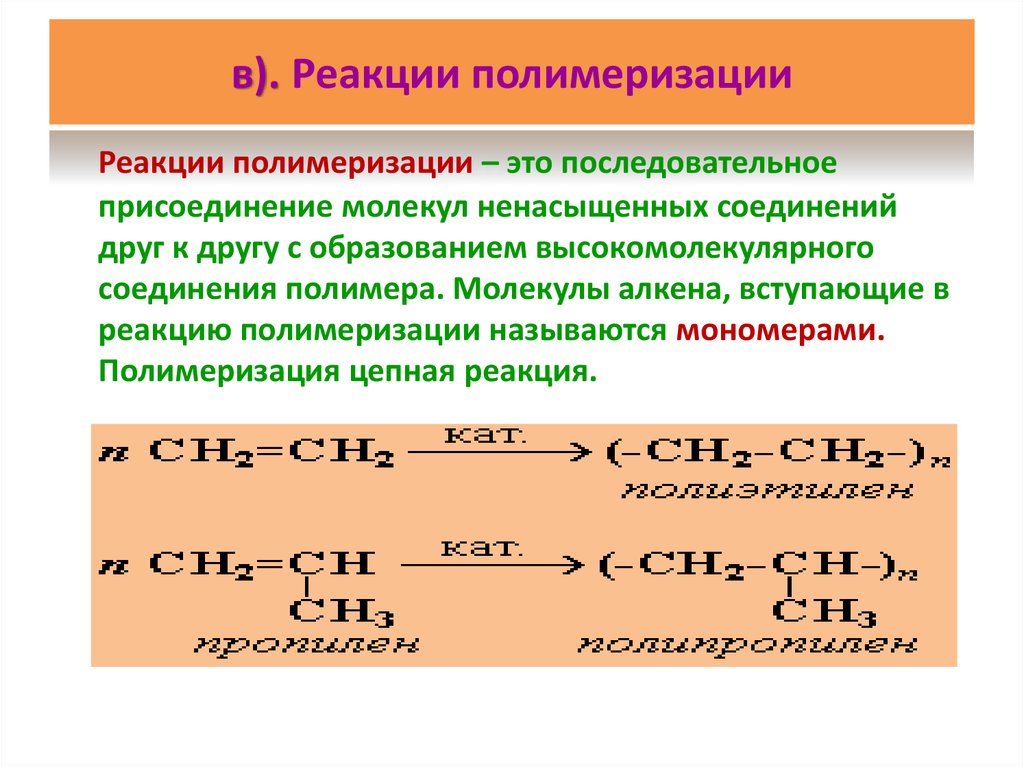
26. в). Реакции полимеризации
Реакции полимеризации – это последовательноеприсоединение молекул ненасыщенных соединений
друг к другу с образованием высокомолекулярного
соединения полимера. Молекулы алкена, вступающие в
реакцию полимеризации называются мономерами.
Полимеризация цепная реакция.
27. 5. Отдельные предствители
1.С2Н4 – этилен- газ со слабымчесночным запахом, горит, образуя
копоть, мало растворим в воде, Смесь
этилена с воздухом используют для
наркоза, обладает раздражающим и
мутагенным действием Используется
для синтеза этилового спирта ,
уксусного альдегида, уксусной
кислоты, плиэтилена.
28. 2.Пропен (пропилен) — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие. 3.Бутен-2 —
2.Пропен (пропилен) — вызываетнаркоз (сильнее, чем этилен),
оказывает общетоксическое и
мутагенное действие.
3.Бутен-2 — вызывает наркоз, обладает
раздражающим действием.
29. 4. Полиэтилен – получают полимеризацией этилена. Представляет собой бесцветный материал, имеющий низкую тепло- и
электропроводность. Широко используется вбыту и технике в виде посуды , плёнок, в
медицинской промышленности.
5. Полипропилен – получают полимеризацией
пропилена . Представляет собой твёрдый
прозрачный материал. Используется для
изготовления труб, деталей аппаратуры, особо
прочной изоляции.
30. С6Н5 6. Полистирол - (-СН2-СН-)n - используется для изготовления игрушек, изоляции труб, предметов домашнего обихода. 7.
Фторопласт - полимеры из фторированногоэтилента. Чрезвычайно химически инертны. На них
не действуют конц. Кислоты, сильные окислители,
органические растворители. Они выдерживают
нагревание до 300ºС . Фторопласты используются
для изготовления коррозионной химической
аппаратуры. Широкое применение получили
покрытия фторопластом (тефлоном) бытовых
изделий.




















 chemistry
chemistry








