Similar presentations:
Современные аспекты генетического анализа
1.
2.
Генетические задачи решаются легкотолько тогда, когда они предварительно
уже
решены
другими.
Поэтому
необходимо предостеречь тех, кто
впервые приступает к генетическому
анализу, от уныния и пессимизма, если их
первые попытки окажутся неудачными.
Александр Сергеевич Серебровский
3.
Методы определения первичной структуры ДНК(секвенирование):
- с использованием модифицированного метода
Максама и Гилберта;
- методом полимерзного копирования (метод
Сэнгера);
- секвенирование по Ротбергу;
- полони-секвенирование;
- секвенирование с помощью нанопор.
4.
5.
Предпосылки возникновения методов секвенированияВ отечественной литературе методы расшифровки нуклеотидной
последовательности нуклеиновых кислот принято называть
методами секвенирования.
Следует обратить внимание на правильность написания
терминов: сЕквенирование нуклеотидной последоватильности но
сИквенс гена.
Еще в 50-е годы прошлого века были разработаны методы,
позволяющие определять последовательность аминокислот в
полипептидной цепи. Теоретически это несложно, поскольку все
аминокислоты, встречающиеся в природных белках, имеют разные
свойства. Поэтому, когда был расшифрован генетический код,
появилась
возможность
восстанавливать
нуклеотидную
последовательность транскрибируемой ДНК по аминокислотной
последовательности
соответствующего
белка.
Однако,
генетический код является вырожденным. Следовательно,
первичная структура ДНК, полученная на основе анализа
последовательности аминокислот, не является однозначной.
Кроме того, для эукариот таким способом можно восстановить
лишь нуклеотидный состав экзонов, тогда как информация о
составе интронов теряется в результате сплайсинга.
6.
7.
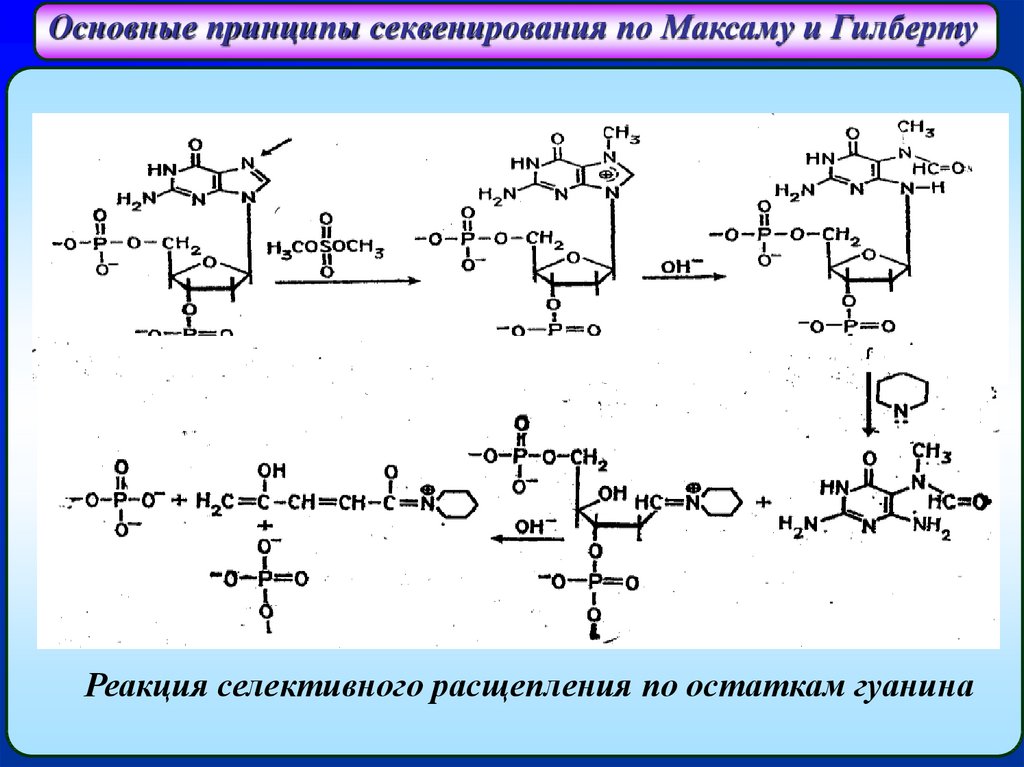
Основные принципы секвенирования по Максаму и ГилбертуВ 1976 г. А. Максамом и У. Гилбертом был разработан метод
секвенирования, основанный на специфической химической
деградации фрагмента ДНК, радиоактивно меченного с одного
конца. В 1977 г. Максамом и Гилбертом был предложен метод
секвенирования,
основанный
на
селективной
химической
модификации различных типов гетероциклических оснований в
составе ДНК с последующим расщеплением межнуклеотидных
связей в модифицированных звеньях. Реакции селективной
модификации по каждому типу гетероциклических оснований
проводятся таким образом, чтобы в каждой молекуле ДНК в
среднем модифицировалось только одно звено данного типа.
Поскольку все звенья данного типа в составе молекулы эквивалентны
и реагируют с модифицирующим агентом с одинаковыми
скоростями, то в сумме каждое звено этого типа окажется
частично модифицированным. Дальнейшая обработка ДНК
вторичным амином или щелочью приводит к отщеплению
модифицированных гетероциклических оснований от цепи ДНК и
разрыву
полинуклеотидной
цепи
в
местах
отщепления
гетероциклов.
Модификации подвергают ДНК, 32Р-меченные по 5'-концевому
нуклеотидному
звену.
Радиоактивная
метка
вводится
фосфорилированием с помощью 32Р-АТР и Т4-полинуклеотидкиназы.
8.
Основные принципы секвенирования по Максаму и ГилбертуФрагмент ДНК
Модификация азотистого
основания
Отщепление или замещение
модифицированного основания
Разрыв сахаро-фосфатной цепи ДНК
Отщепление модифицированных звеньев от цепи ДНК после обработки
вторичным амином или щелочью.
Таким образом, в результате химической деградации получается набор
фрагментов ДНК различной длины. Длины этих фрагментов
соответствуют положению мономерных звеньев того типа, который
подвергался модификации. Концевая радиоактивная метка служит точкой
отсчета при определении длины продуктов химической деградации ДНК.
9.
Основные принципы секвенирования по Максаму и ГилбертуХимическая деградация ДНК
Набор полученных фрагментов фракционируется электрофорезом в ПААГ,
который позволяет разделять олиго (поли) нуклеотиды, отличающиеся по
длине всего на одно мономерное звено. Последовательность нуклеотидов в
ДНК читается непосредственно с радиоавтографа геля.
Метод Максама и Гилберта, разработанный для анализа первичной
структуры достаточно длинных ДНК, применим и для коротких (8 – 16
звенных) олигодезоксирибонуклеотидов. Однако в этом случае реакции
химической модификации проводят в более жестких условиях (увеличивая
время и температуру реакции) с целью повышения степени модификации.
10.
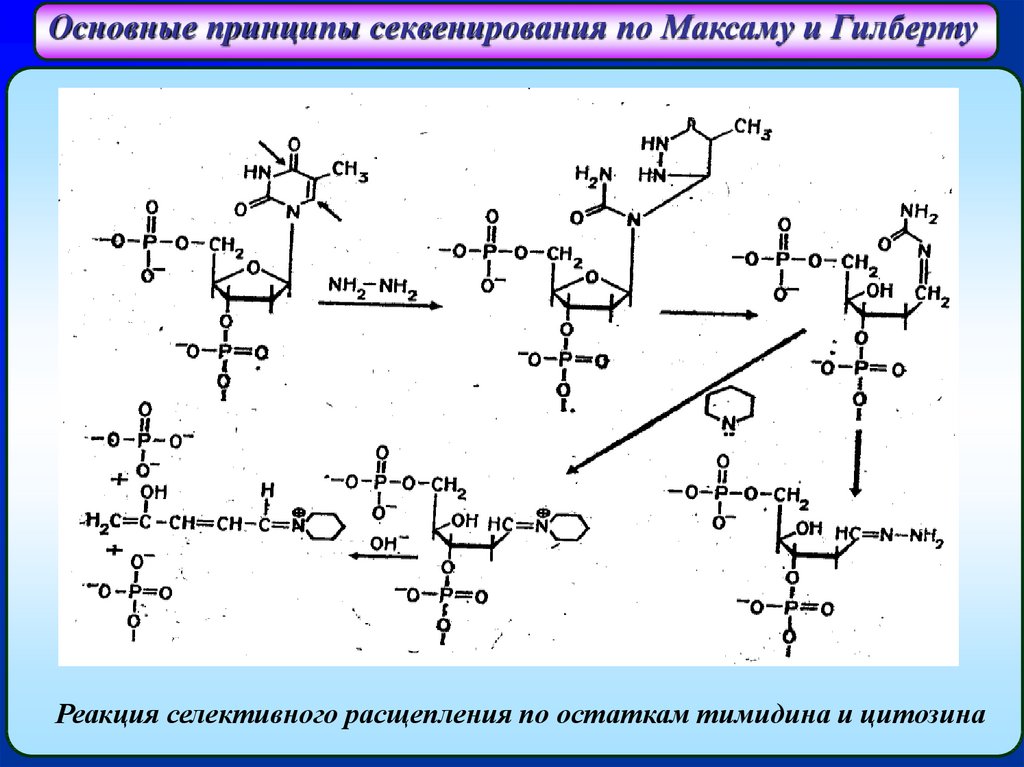
Основные принципы секвенирования по Максаму и ГилбертуНабор реакций, применяемых для расщепления ДНК по
мономерным звеньям определенного типа достаточно велик и
постоянно пополняется:
по остаткам гуанина – обработка диметилсульфатом;
по остаткам аденина и гуанина – апуринизация 50%-ной
муравьиной кислотой (по Бартону);
по
остаткам
аденина
и
цитозина
–
расщепление
гетероциклических оснований под действием 1,2 Н NaOH;
по остаткам тимидина и цитозина – обработка гидразином.
В настоящее время широко используются два основных варианта
секвенирования по Максаму — Гилберту. В первом из них реакции
химической модификации ДНК проводят в растворе, а во втором
ДНК предварительно иммобилизуют на твердой фазе (например,
ДЭАЭ-целлюлозе). Первый метод более традиционен, его
многочисленные модификации с успехом использовались для
секвенирования фрагментов ДНК различных размеров, в том числе
олигонуклеотидов. В то же время второй метод имеет ряд
преимуществ. Он менее трудоемок и занимает меньше времени,
проще в освоении, позволяет обойтись минимальным набором
оборудования. В целом оба метода обеспечивают получение вполне
приемлемых результатов, а выбор одного из них определяется
конкретными условиями лаборатории.
11.
Основные принципы секвенирования по Максаму и ГилбертуРеакция селективного расщепления по остаткам гуанина
12.
Основные принципы секвенирования по Максаму и ГилбертуРеакция селективного расщепления по остаткам тимидина и цитозина
13.
14.
Основные принципы секвенирования по СэнгеруК концу 60-х годов Ф.Сэнгером были разработан метод секвенирования
РНК, получаемой с ДНК-матрицы при помощи РНК-полимеразы. Применив
этот способ, Ш.Вейссман и У.Фирс смогли концу 1976 г. определить
последовательность более половины молекулы ДНК SV40, длина которой
превышает 5200 нуклеотидных пар. Следующим шагом должна была стать
разработка методов прямого секвенирования ДНК.
Ферментативный синтез олиго- и
поли-дезоксирибонуклеотидов с
помощью ДНК-полимераз, заключающийся в копировании матричного
полинуклеотида нашел блестящее применение в качестве эффективных
методов установления первичной структуры ДНК. Метод состоит в
получении блоков-копий полидезоксирибонуклеотида, структура которого
изучается. При этом обязательным является выполнение двух условий.
1) - копирование должно проводиться, начиная с определенного
мономерного звена;
2) - синтез копий следует осуществлять четыре раза, каждый раз
останавливая его поочередно на каком-либо одном из четырех мономерных
звеньев (A, G, С или Т), т.е. стремятся получить полный набор
"комплементационно отраженных" копий исследуемого полинуклеотида,
образование которых прекратилось в каждом из мест расположения одного
из четырех мономерных звеньев нуклеиновой кислоты. Определение длины
каждой копии позволяет установить положение данного мономерного
звена в цепи исследуемого полинуклеотида. Длина копии определяется
фракционированием в полиакриламидном геле. Этот метод, таким
образом, так же как и метод, основанный на модификации оснований
позволяет получать информацию о положении определенного мономерного
звена в цепи полинуклеотида прямо после фракционирования.
15.
Секвенирование ДНК по Сэнгеру: "плюс-минус" методДля получения копии исследуемого полинуклеотида в последнем
выбирают точку отсчета, что достигается введением в систему
ферментативного синтеза в качестве нуклеозидного компонента
олигонуклеотида-затравки. Такой олигонуклеотид во всех копиях,
образующихся в результате достраивания его ферментативным
путем, остается постоянным 5'-концевым фрагментом, т. е.
является точкой отсчета. Копирование с помощью ДНКполимеразы в присутствии всех четырех дезоксирибонуклеозид-5'пирофосфатов (один из них берется 32Р-меченным) проводят в
течение ограниченного времени. Цель этого этапа - проведение
статистически ограниченного синтеза для получения всех
возможных копий, начиная с затравки, достроенной на одно, два и
т. д. звеньев, и включая полную копию изучаемого полинуклеотида. В
идеале смесь должна включать все возможные полинуклеотиды,
синтез которых статистически прекращается где-то в середине
матричного полинуклеотида в районе ATGCTG матричной
последовательности. На практике различные компоненты смеси
присутствуют в разных количествах. Если такую смесь далее
подвергнуть электрофорезу в полиакриламидном геле в определенных
условиях, когда скорость движения пропорциональна длине цепи, на
электрофореграмме обнаруживается серия полос, представляющих
различные олигонуклеотиды. Такое фракционирование обычно не
проводят, хотя оно может использоваться для контроля на
завершающем этапе анализа.
16.
Секвенирование ДНК по Сэнгеру: "плюс-минус" методИнкубационную смесь 32Р-меченных олигонуклеотидов различной
длины в виде комплексов с матричным полинуклеотидом подвергают
гель-фильтрации
для
удаления
дезоксирибонуклеозид-5'трифосфатов и аликвоты реакционной смеси реинкубируют с ДНКполимеразой в различных условиях. В случае "минус-системы"
реинкубацию
проводят
в
присутствии
только
трех
дезоксирибонуклеозид-5'-три-фосфатов. Например, в «- А-системе»
отсутствует dATP и каждая копия в смеси достраивается с
помощью ДНК-полимеразы до места, в котором следующим
мономерным звеном должен быть остаток pdA (т.е. Т в матричном
полинуклеотиде). Образующуюся смесь фракционируют с помощью
электрофореза
и
обнаруживают
(ауторадиографически)
ограниченное количество полос (их количество равно количеству Т в
матричном полинуклеотиде). Аналогично проводят копирование в
отсутствие других субстратов: - dGTP, - dCTP или - dTTP (- G-,- С- и
- Т-системы соответственно). Все четыре ионофореза проводят в
полиакриламидном геле параллельно. Полученные ауторадиограммы
позволяют сразу написать нуклеотидную последовательность,
причем чтение цепи снизу вверх соответствует 5'3'-полярности
цепи
копии.
Например,
положение
самого
короткого
олигонуклеотида (в " - Т-системе") указывает на то, что следующий
за ним по длине олигонуклеотид заканчивается на Т, т.е. что
против полосы, расположенной выше (это полоса в - А-системе),
следует записать букву Т.
17.
Секвенирование ДНК по Сэнгеру: "плюс-минус" методТаким же образом записывают далее в последовательности А (на
основании положения следующего по длине олигонуклеотида, который
оказался в "- А-системе") и т. д. Соответствующий участок цепи в
матрице читается с учетом принципа комплементарности и
антипараллельности цепей в комплексе матрица - затравка. Для проверки
этих данных используют результаты анализа с помощью "плюс-системы".
В этом случае дополнительное копирование (после первого этапа) проводят
в присутствии ДНК-полимеразы, выделенной из бактериофага Т4, которая
в отсутствие субстратов (нуклеозид-5'-трифосфатов) проявляет 3'экзонуклеазную активность, т. е. отщепляет мононуклеотиды один за
другим с 3'-конца. В то же время в присутствии субстратов ее
полимеразная активность во много раз превосходит экзонуклеазную. Так,
если
в
реакционной
смеси
присутствует
хотя
бы
один
дезоксирибонуклеозид-5'-трифосфат (dATP в " +А-системе"), деградация
каждой копии, образовавшейся на первой стадии анализа, будет проходить
вплоть до места положения А (Т в матрице). В этом случае pdA
включается много быстрее, чем удаляется, и, таким образом,
накапливаются фрагменты, содержащие на 3'-конце цепи А. Аналогично
проводят копирование в присутствии только dGTP, dCTP или dTTP. Смеси
параллельно подвергают электрофорезу, как и в предыдущем случае, и
получают
ауторадиограммы,
из
которых
сразу
считывается
последовательность 5'3'-направление, считывается также снизу вверх). Из
сравнения фореграмм "плюс-" и "минус-систем" делается однозначный
вывод о нуклеотидной последовательности в копиях и, следовательно, в
матричном полинуклеотиде.
18.
Секвенирование ДНК по Сэнгеру: "плюс-минус" методИспользование
ферментативного
синтеза олиго- и поли- дезоксирибонуклеотидов
для
определения
первичной структуры ДНК
19.
Секвенирование ДНК по Сэнгеру: метод "терминаторов"В 1977 г. автор "плюс-минус" метода предложил еще один способ
ферментативного
секвенирования,
получивший
название
метода
терминирующих аналогов трифосфатов. Более мощный и более
технологичный, этот способ, несколько модифицированный, применяется до
сих пор. В основе метода так же лежало ферментативное копирование с
помощью фрагмента Кленова ДНК полимеразы I из E.coli. В качестве
праймеров использовали синтетические олигонуклеотиды. Специфическую
терминацию синтеза обеспечивали добавлением в реакционную смесь помимо
четырех типов dNTP (один из которых был радиоактивно мечен по альфа
положению фосфата) еще и одного из 2',3'-дидезокси-нуклеозидтрифосфатов
(ddATP, ddTTP, ddCTP или ddGTP), который способен включаться в растущую
цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за
отсутствия 3'-ОН группы. Отношение концентраций dNTP/ddNTP авторы
подбирали экспериментально, так, чтобы в итоге получить набор копий
ДНК различной длины. Таким образом, для определения первичной
структуры исследуемого фрагмента ДНК требовалось провести четыре
реакции копирования: по одному типу терминаторов в каждой из реакций.
После этого полученные продукты разгонялись в полиакриламидном геле на
соседних
дорожках
и
по
расположению
полос
определялась
последовательность нуклеотидов.
Применимость метода Сэнгера зависила от возможности получения
одноцепочечных копий анализируемых ДНК. Для этой цели можно было
использовать векторы: плазмидные векторы, векторы на основе
бактериофага М13. В настоящее время выделение фрагментов ДНК, создание
рекомбинантных генов, а так же прямое секвенирование ДНК и кДНК
становятся общедоступными методами благодаря внедрению ПЦР.
20.
21.
Автоматическое секвенирование ДНК по м.м. СэнгераВ основе автоматического секвенирования лежит уже упоминавшийся выше
метод ферментативного секвенирования с использованием терминирующих
ddNTP. Как и классический вариант Сэнгера, автоматическое секвенирование
включает две стадии:
1. - проведение терминирующих реакций;
2. - разделение продуктов реакций с помощью электрофореза.
Как правило, автоматизирована лишь вторая стадия, т.е. разделение
меченных фрагментов ДНК в ПААГ или капилярных трубках, получение
спектра эмиссии флуорофоров и последующий обсчет собранных данных.
Таким образом, автоматическое секвенирование идеологически отличается
от современного ему ручного секвенирования только типом используемой
метки.
Флуоресцентную метку включают либо в праймер, либо в терминатор
транскрипции согласно следующим схемам:
I. меченный праймер (четыре разных красителя) и немеченые терминаторы;
II. меченный праймер (один краситель) и немеченые терминаторы;
III. меченные терминаторы (каждый тип терминатора своим красителем)
и немеченый праймер.
Использование меченных праймеров предполагает проведение четырех
независимых реакций (отдельно с каждым из терминаторов) для каждого
секвенируемого образца. Использование меченных терминаторов позволяет
совместить все четыре реакции в одной пробирке. Если используется
единственный краситель, то разделение продуктов сиквенсовой реакции в
геле проводят на четырех разных дорожках. Использование четырех разных
красок позволяет разгонять продукты реакции(й) на одной дорожке.
22.
Сравнение методов секвенированияпо Сэнжеру и Максаму-Гилберту
Метод Максама-Гилберта и метод Сэнгера основаны на одном принципе.
В первом используется специфическое расщепление ДНК, обусловленное
природой оснований, во втором - статистический синтез ДНК,
заканчивающийся на каком-либо одном из 4 нуклеотидов. Таким образом,
основой обоих методов является получение полного (статистического)
набора фрагментов ДНК, оканчивающихся на каждом из четырех
нуклеотидов.
Химический метод (метод Максама-Гилберта) проще использовать в том
случае, когда исследуемая ДНК не слишком велика (200-500 звеньев). В том
случае, если речь идет о секвенировании высокомолекулярной ДНК, лучше
применять метод полимеразного копирования (метод Сэнгера), чтобы не
вводить процедуру рестриктазного расщепления с выделением
индивидуальных фрагментов. При энзиматическом секвенировании
протяженных одноцепочечных ДНК (например, бактериофагов) можно
применять набор олигонуклеотидов-затравок, синтез которых не
требует больших затрат времени и труда. Для двуцепочечных
высокополимерных ДНК наиболее удобен метод слепого энзиматического
секвенирования с применением универсальных праймеров и обработки
данных с помощью ЭВМ либо с использованием методов поэтапного
секвенирования либо «прогулки по хромосоме». Химический метод также
может быть применен, но в этом случае необходимо вырезать из вектора
исследуемые фрагменты ДНК, и это усложняет всю процедуру.
23.
24.
Из истории разработки техники быстрого секвенированияС попыткой создать технику быстрого чтения ДНК познакомил своих
читателей журнал Nature (2005, т. 437, с. 376–380). Новый метод
секвенирования описали несколько десятков авторов под руководством
Марселя Маргулиса и Майкла Эгхольма (Marcel Margoulies, Michael
Egholm) из «454 Life Science Corporation» в Коннектикуте. Кроме этой
компании в работе участвовали Калифорнийский университет,
Рокфеллеровский университет и Ротберговский институт детских
болезней. Имя Джонатана М. Ротберга в списке авторов стоит
последним (как фамилия руководителя работы), тем не менее новый
метод уже называют «секвенированием по Ротбергу». Основатель
корпорации «CuraGen», одной из ведущих компаний в области
фармакогенетики, знаменит не только научными достижениями, но и
тем, что регулярно попадает в списки самых молодых среди богатых и
самых богатых среди молодых жителей планеты — сейчас ему чуть
больше сорока лет. Однако разработка супербыстрого секвенирования
была для него не только перспективным вкладом денежных средств.
Такие трогательные истории чаще происходят в голливудских научнофантастических фильмах, но иногда случаются и в жизни. Когда
у
Ротберга родился сын, он и сразу же попал в отделение интенсивной
терапии: мальчик не мог самостоятельно дышать. Отец не спал ночей
от беспокойства, подозревая у ребенка генетическую болезнь. Молодые
папы вообще склонны к панике, но доходы Ротберга позволяли ему
паниковать с размахом. Он пообещал себе, что расшифрует весь геном
сына.
25.
Из истории разработки техники быстрого секвенированияПосле проекта «Геном человека» всем известно, что это удовольствие
стоит миллиарды долларов и занимает десятки лет. Столько Ротберг не
мог ждать. Он основал «454 Life Science Corp.» и поставил перед ней
задачу: создать такой метод чтения ДНК, какого еще не бывало. Чтобы
немедленно и за реальные деньги — ну хотя бы миллионы, а не
миллиарды...
Немедленно не получилось: понадобились годы. К счастью, здоровье
Ротберга-младшего давно не внушает никаких опасений. Будет ли папа
секвенировать его геном, неизвестно. Но в принципе такая возможность
теперь есть.
Джеймс Уотсон, один из первооткрывателей двойной спирали, обещал
предоставить умельцам из Коннектикута образец своей крови, чтобы они
подарили его генотип мировой науке и истории.
О новом методе одобрительно отозвался и Дж. Крэйг Вентер — еще один
гигант молекулярной генетики, основатель института своего имени,
президент знаменитой «Celera Genomics» (его статья, написанная
совместно с Ю-Ху Роджерс, научным директором технологического
центра при Институте Крэйга Вентера, опубликована в том же номере
«Nature»).
С помощью этого нового метода можно прочесть 25 миллионов пар
оснований (это весь геном низшего гриба) за четыре часа, а три миллиарда
нуклеотидов, составляющих геном человека, — за сто дней, стоимость
же такого проекта, по предварительным оценкам, составит около 10-30
тысяч долларов.
26.
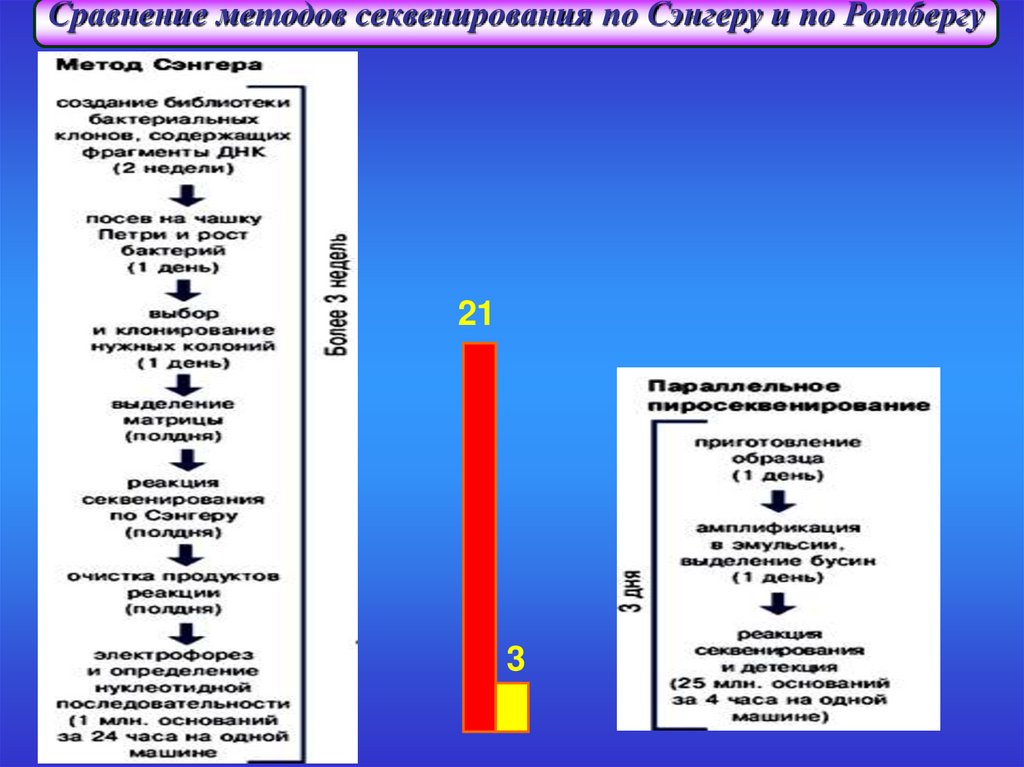
Сравнение методов секвенирования по Сэнгеру и по Ротбергу21
3
27.
Принцип метода пиросеквенированияБерется образец ДНК, которую надо прочитать. Специальные
ферменты нарезают его на кусочки случайным образом, и кусочки
эти изолируют друг от друга предельным разведением. К каждому
кусочку
прикрепляют
адапторную
нуклеотидную
последовательность, которая, в свою очередь, заякоривается на
маленькой бусинке (средний диаметр — 28 микрометров). К одной
бусинке прикрепляется только один фрагмент. Затем бусины
попадают в капельки водной эмульсии в масле. В этих капельках
содержится все необходимое для амплификации ДНК методом
полимеразной цепной реакции (ПЦР): каждая капелька — это
отдельный реакционный сосуд, в котором копируется один и
только один фрагмент ДНК. Как сказал журналистам сам
Ротберг, при традиционном для метода Сэнгера клонировании
фрагменты ДНК изолируют и наращивают в бактериальных
клетках, а здесь роль клеток играют капельки эмульсии. После ПЦР
к каждой бусинке прицепляется около 10 млн. копий
индивидуального фрагмента. Эмульсию разрушают, и бусинки,
обросшие ДНК, центрифугированием загоняют в реакционные
сосуды — открытые сверху микроскопические соты (диаметр
каждой ячейки 44 микрометра, объем — 75 пиколитров). Соты
размещены на волоконно-оптической подложке — квадратике
размером 6 на 6 см, который несет на себе примерно 1,6 миллиона
ячеек. Если бусина попадет не в каждый «колодец», это даже
хорошо: меньше будет вероятность ложных сигналов.
28.
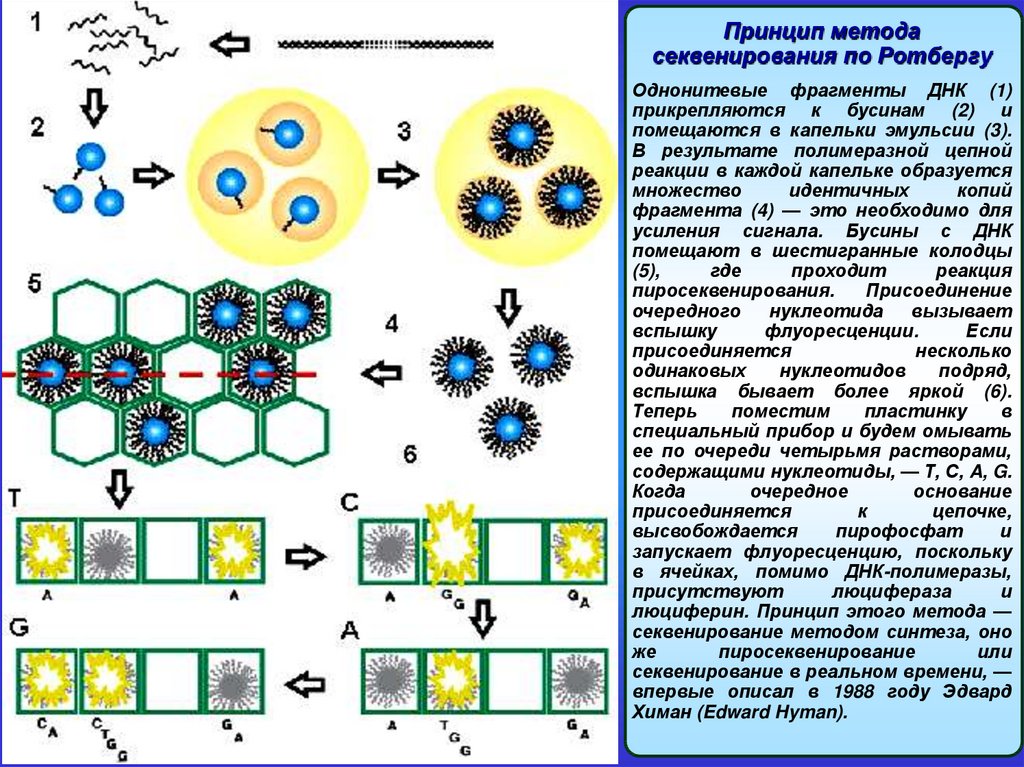
Принцип методасеквенирования по Ротбергу
Однонитевые фрагменты ДНК (1)
прикрепляются к бусинам (2) и
помещаются в капельки эмульсии (3).
В результате полимеразной цепной
реакции в каждой капельке образуется
множество
идентичных
копий
фрагмента (4) — это необходимо для
усиления сигнала. Бусины с ДНК
помещают в шестигранные колодцы
(5),
где
проходит
реакция
пиросеквенирования.
Присоединение
очередного
нуклеотида
вызывает
вспышку
флуоресценции.
Если
присоединяется
несколько
одинаковых
нуклеотидов
подряд,
вспышка бывает более яркой (6).
Теперь
поместим
пластинку
в
специальный прибор и будем омывать
ее по очереди четырьмя растворами,
содержащими нуклеотиды, — Т, С, A, G.
Когда
очередное
основание
присоединяется
к
цепочке,
высвобождается
пирофосфат
и
запускает флуоресценцию, поскольку
в ячейках, помимо ДНК-полимеразы,
присутствуют
люцифераза
и
люциферин. Принцип этого метода —
секвенирование методом синтеза, оно
же
пиросеквенирование
или
секвенирование в реальном времени, —
впервые описал в 1988 году Эдвард
Химан (Edward Hyman).
29.
Принцип метода пиросеквенированияФерменты, как и ДНК, тоже прицеплены к бусинам, которые
не вымываются из ячеек, а остаются на местах, как
камешки на дне ручья, удерживая ферменты и матрицу,
нуклеотиды же сменяют друг дружку. Пришел аденин — во
всех сотах, где к цепочкам присоединяется А, вспыхивают
огоньки, а остальные, ожидающие Т, G или С, остаются
темными, пока не настанет их очередь. А дальше — дело
техники. Оптические волокна передают вспышки на
сенсорное устройство, компьютер записывает букву за буквой
сразу в сотне тысяч последовательностей.
Для публикации в Nature отсеквенировали геном бактерии
Mycoplasma genitalium (580,069 н. п.). ДНК микроорганизма
нарезали на кусочки средней длиной 110 оснований,
автоматизированная реакция (42 цикла по 4 нуклеотида)
заняла всего 4 часа. Исследователи прочитали 96,5% генома
микоплазмы с сорокакратным перекрыванием. Точность
прочтения составила 99,96% (для апробации метода,
естественно, выбрали уже известный геном, чтобы было с
чем сравнивать). Удовлетворительные результаты были
получены и с более крупным геномом Streptococcus pneumoniae
(2,1 млн. н. п.).
30.
Недостатки метода1)
прибор
для
секвенирования
по
Ротбергу
стоит
500 000 долларов. Да и реактивы требуются недешевые, и методика не
самая простая. Хотя, конечно, с затратами на «Геном человека» не
сравнить.
2) - секвенирование по Ротбергу позволяет читать только очень короткие
фрагменты, максимум 120 нуклеотидов. При чтении более длинных кусков
точность стремительно падает. А составлять из мелких кусочков
огромный
текст,
например
последовательность
хромосомы
млекопитающего, — удовольствие ниже среднего, особенно если учесть,
что для высших организмов характерно обилие повторов.
3) - для пиросеквенирования нужны однонитевые кусочки ДНК, а не
двунитевые, как при секвенировании по м.м. Сэнгера, и, значит, можно
забыть о комплементарных «липких концах», которые помогают
состыковывать фрагменты. Придется повторять чтение по нескольку
раз, с различными наборами перекрывающихся небольших кусочков, и
потом собирать этот паззл с помощью хитроумных компьютерных
программ.
4) - у пиросеквенирования есть трудноустранимый дефект, причина
которого лежит в самом принципе метода: когда в последовательности
несколько раз повторяется одна и та же буква, не всегда получается
определить, сколько же там Т подряд: семь или восемь. Об этом
приходится судить по интенсивности вспышки, но здесь легко
ошибиться.
Однако все это, конечно, не отменяет несомненных достоинств метода.
Скорее всего, оптимисты правы, и в самом деле уже настала эпоха
быстрого чтения ДНК. Будущее покажет, победит ли этот метод или
другой.
31.
32.
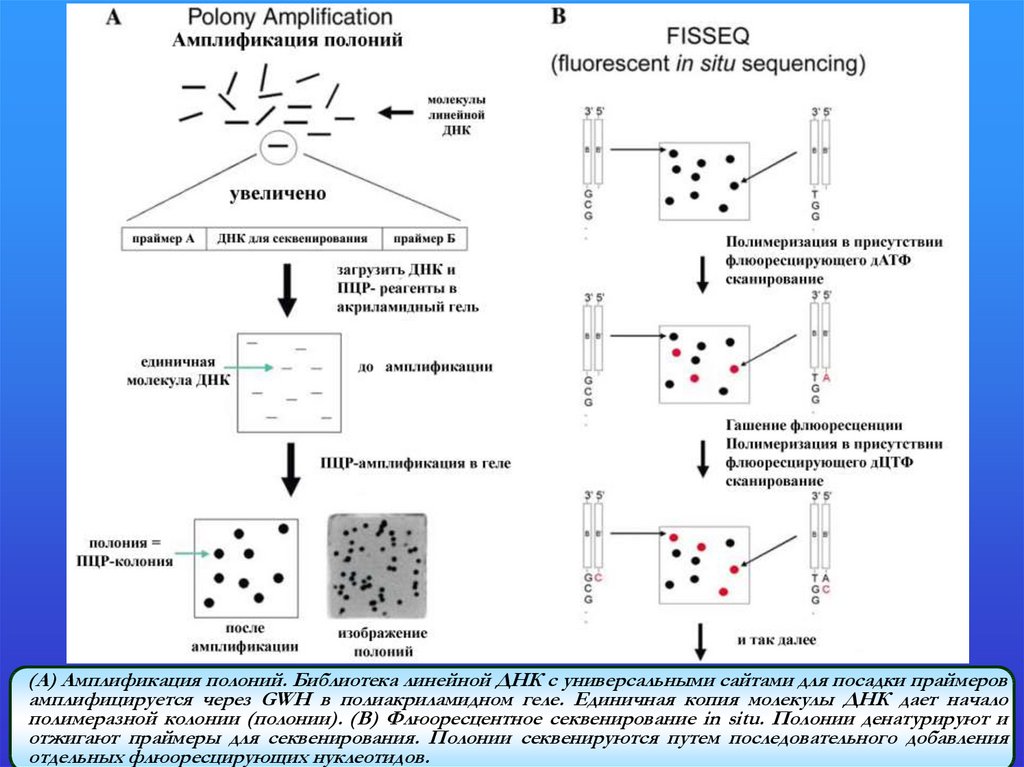
Полони-секвенированиеНаряду с секвенированием по Ротбергу как бумажные, так и электронные
издания регулярно упоминают полони-секвенирование (polony sequencing),
которое придумала группа исследователей Гарвардской медицинской школы
во главе с Джорджем Черчем (George Church). Исследователи обещают
снизить стоимость чтения генома человека до 2,2 миллионов долларов, а в
перспективе — даже до 1000 долларов. Метод использует очень маленькие
фрагменты ДНК, следовательно, лучше подходит для повторного чтения.
Это означает, что метод Черча может быть применен и при
секвенировании ДНК пациентов для медицинских целей (ведь геном человека
уже прочитан), и, например, при изучении новых штаммов микробов.
Кстати, в Гарварде как раз и отсеквенировали геном новой линии кишечной
палочки. Из оборудования потребовался обычный микроскоп с цифровой
камерой. Название метода происходит от слов «polymerase colony» «полимеразная колония». Десятки миллионов индивидуальных ДНКфрагментов амплифицируются в тонком слое полиакриламидного геля.
Поскольку гель ограничивает диффузию, образуются сферические колонии
ДНК - полонии, говоря языком разработчиков. Они действительно
напоминают бактериальные колонии в чашке Петри. Затем двунитевую
ДНК денатурируют, а на оставшихся однонитевых матрицах начинают
сиквенс в реальном времени. Но по-другому, чем у Ротберга: к растущей
цепи присоединяются флуоресцирующие аналоги нуклеотидов. Колония,
присоединившая очередной нуклеотид, начинает светиться. Затем
свечение нового нуклеотида гасят, отрывая и отмывая флуоресцентную
группу. Повторяя циклы, фиксируя картинку камерой и передавая на
компьютер, можно считывать последовательность сразу во всех этих
миллионах точек. Правда, в каждой точке безошибочно прочитывается
лишь очень короткий кусок, но точек-то миллионы! Так что поставленная
задача — много, быстро, и дешево — выполняется неплохо.
33.
(А) Амплификация полоний. Библиотека линейной ДНК с универсальными сайтами для посадки праймеровамплифицируется через GWH в полиакриламидном геле. Единичная копия молекулы ДНК дает начало
полимеразной колонии (полонии). (В) Флюоресцентное секвенирование in situ. Полонии денатурируют и
отжигают праймеры для секвенирования. Полонии секвенируются путем последовательного добавления
отдельных флюоресцирующих нуклеотидов.
34.
35.
Секвенирование с помощью нанопорУченые из Калифорнийского университета, Сан-Диего (UCSD) изобрели
технику быстрого секвенирования ДНК с помощью нанопор.
Наносеквенатор может быть доступен любым здравоохранительным
учреждениям, так как стоимость у готового устройства будет невелика.
Как утверждают ученые, это поможет ускорить появление геномной
медицины, направленной на лечение генетических болезней отдельно
взятого человека, исходя из его дефектов в ДНК.
В статье, опубликованной в Nano Letters, описывается метод секвенации
человеческого генома, занимающий несколько часов. При этом устройство
для секвенации на основе нанопор будет недорогим, его смогут приобрести
практически любые медицинские учреждения. Сам метод состоит в
изменении электрического потенциала при прохождении ДНК через
нанопору.
Секвенирование ДНК отдельно взятого человека с помощью современной
техники займет несколько месяцев и будет стоить миллионы долларов,
что, естественно, не позволяет детально исследовать геном пациентов и
на его основе лечить генетические болезни. Если же появится устройство
быстрого секвенирования, то анализ ДНК может вполне быть обычной
клинической процедурой, как, например, анализ крови. Естественно,
подобная практика совершит революцию в медицине.
«Одно из потенциальных применений ДНК-нанопор – в диагностике
генетических заболеваний. Мы можем оснастить канал различными
протеинами, которые при взаимодействии с ДНК, находящейся в нем,
будут изменять силу протягивания биомолекулы. По величине этой силы
можно говорить о каких-либо отклонениях от нормы в молекуле и,
соответственно, выделять ее поврежденные участки. Возможно, что
таким образом можно будет лечить различные генетические заболевания»,
– говорит Максимилиано Ди Вентра, профессор физики при UCSD.
36.
Секвенирование с помощью нанопорДи Вентра и его коллеги перед началом работы над нано-секвенаторами
провели предварительное математическое моделирование электрических
флюктуаций различных оснований ДНК (аденина, цитозина, гуанина и
тимина). Далее они провели комплексный расчет наноструктуры,
состоящей из окруженной золотыми электродами нанопоры диаметром 1
нанометр, находящейся в подложке из нитрида кремния, и молекулы ДНК,
находящейся непосредственно в канале нанопоры.
Результаты показали, что каждая пара оснований ДНК имеет свою
неповторимую
электрическую
«подпись»,
которую
можно
идентифицировать, приложив напряжение на золотые электроды
нанопоры в то время, как ДНК будет находиться в ней.
Предыдущие попытки создать подобный секвенатор (например, учеными из
Иллинойского университета, которые создали полноценный ДНК-чип) не
увенчались успехом из-за высокого уровня шума сигналов, полученных от
ДНК. Шум, в свою очередь, был вызван изгибом и скручиванием молекулы в
нанопоре из-за высокого приложенного напряжения.
В новом типе секвенатора ученые так скоординировали электроды, что
электрический ток проходит не вдоль ДНК, а поперек, что заметно
снижает электродинамические флюктуации молекулы, что позволяет
свести «паразитный шум» к минимуму.
37.
Модель ДНК, находящейся в наносеквенаторе (А)и проходящей через нанопору (Б)
А , Б –
представлена наноструктура, состоящая из окруженной
золотыми электродами нанопоры диаметром 1 нанометр, находящейся в
подложке из нитрида кремния, и молекулы ДНК, находящейся
непосредственно в канале нанопоры
38.
Секвенирование с помощью нанопор«Мы
разрабатывали
устройство,
способное
записывать
последовательности нуклеотидов ДНК по мере того, как биомолекула
проходит через тонкую пору в специальной мембране из нитрида
кремния, – продолжает объяснять Ди Вентра. – Чем меньше
диаметр нанопоры, тем точнее мы можем управлять положением в
ней молекулы, и, соответственно, наши шансы на прочтение
последовательности нуклеотидов увеличиваются. Однако ДНК не
хочет, чтобы ее секвенировали, поэтому флюктуации будут все время
повторяться по мере того, как молекулу будут протягивать через
нанопору. А измеренный ток не дает полной информации о том, какая
из баз находится на каком месте. Но нам удалось упорядочить
процесс «протаскивания» ДНК через пору, этим мы избавили себя от
необходимости точно идентифицировать базы – мы просто
записываем их точную последовательность».
Конечно, изготовить массово наносеквенаторы пока очень трудно –
нанопоры такого размера и золотые электроды ученые изготавливали
«вручную» долгое время. Но они не сомневаются в том, что вскоре
технология массового производства матриц с нанопорами будет
налажена, и врачи получат бесценный инструмент для лечения
генетических заболеваний. «Быстрый секвенатор» может быть
доступен любым здравоохранительным учреждениям, так как
стоимость у готового устройства будет невелика.
39.
Секвенирование с помощью нанопор«Предложенный нами метод секвенирования ДНК получает
информацию о биомолекуле с гораздо меньшим количеством
ошибок. Например, метод Сэнгера, которым пользуются
сейчас, не дает такой точности». Работа ученых поддержана
Национальным
Научным
обществом,
Национальным
Институтом Геномики и Национальным Институтом
Здоровья США.
Ранее, в 2004 Национальным Научным обществом США была
запущена программа по исследованию альтернативных
недорогих методов секвенирования ДНК, которые позволят
получить полную информацию о геноме человека всего за $1000.
Как говорят коллеги калифорнийских ученых, они сделали
большой шаг навстречу этой цели.
«Мы выбрали новый подход для решения этой проблемы, –
говорит Ди Вентра. – Для нас ДНК – набор атомов, которые
необходимо проанализировать. И у нас это получилось».


































 biology
biology








