Similar presentations:
Алканы. Гомологи
1. АЛКАНЫ
Молчанова Елена РобертовнаМБОУ СОШ 144
Красноярск
2.
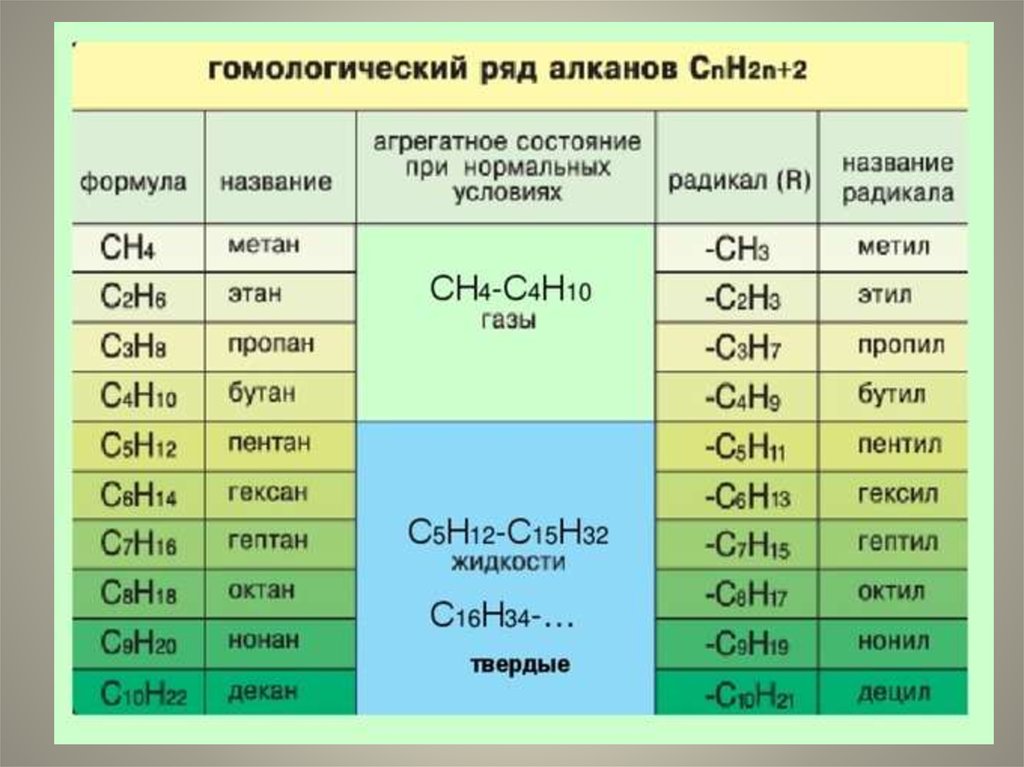
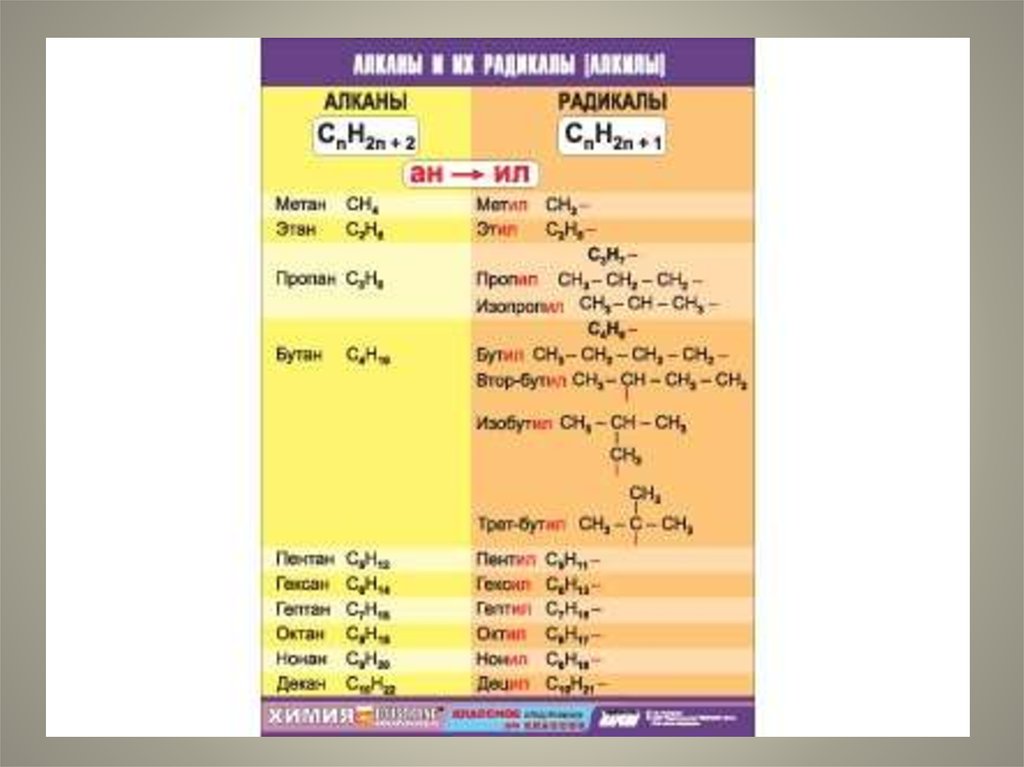
3. Гомологи-
Гомологисоединения, принадлежащие к одномуклассу, но отличающиеся друг от друга по
составу на целое число групп СН2.
Совокупность всех гомологов образует
гомологический ряд.
Группа СН2 называется гомологической
разностью.
4.
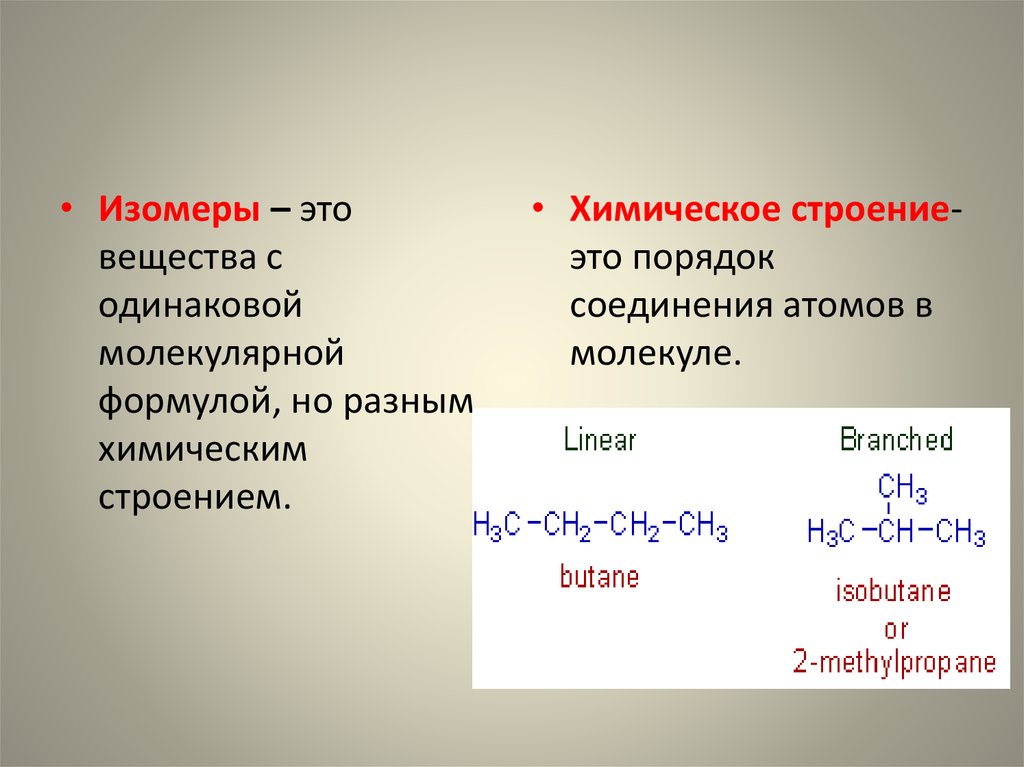
5. Изомерия-
Изомерияявление, заключающееся всуществовании химических соединений
(изомеров), одинаковых по составу и
молекулярной массе, но различающихся
по строению или расположению атомов
в пространстве и, вследствие этого, по
свойствам.
6.
• Изомеры – этовещества с
одинаковой
молекулярной
формулой, но разным
химическим
строением.
• Химическое строениеэто порядок
соединения атомов в
молекуле.
7.
8.
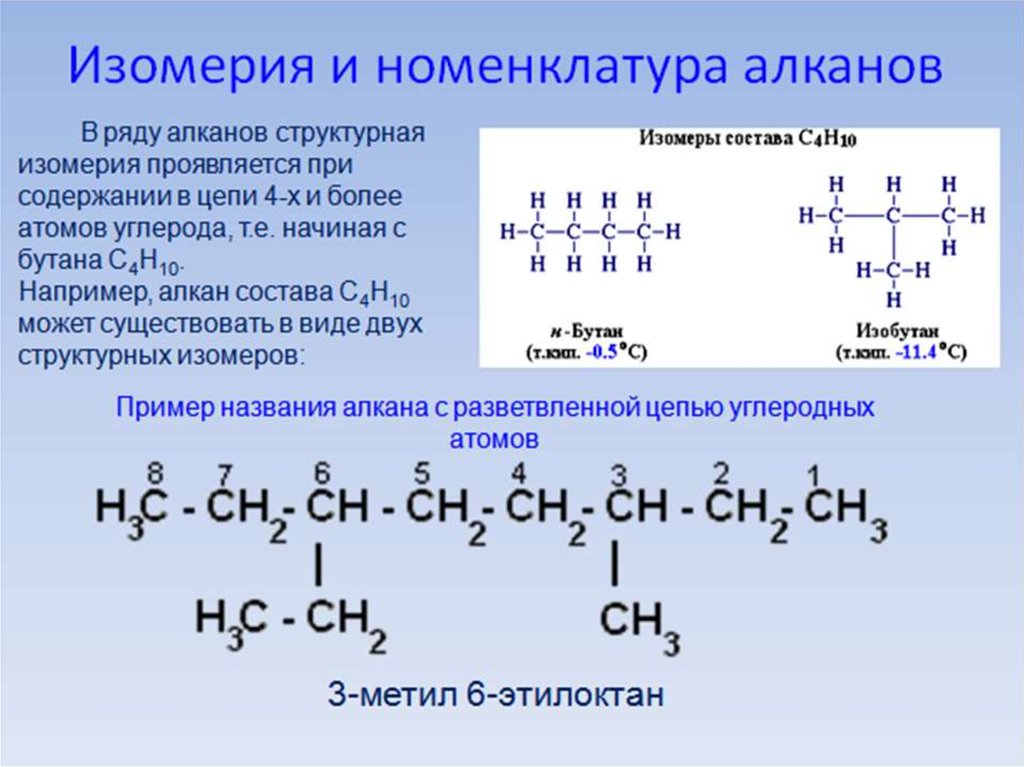
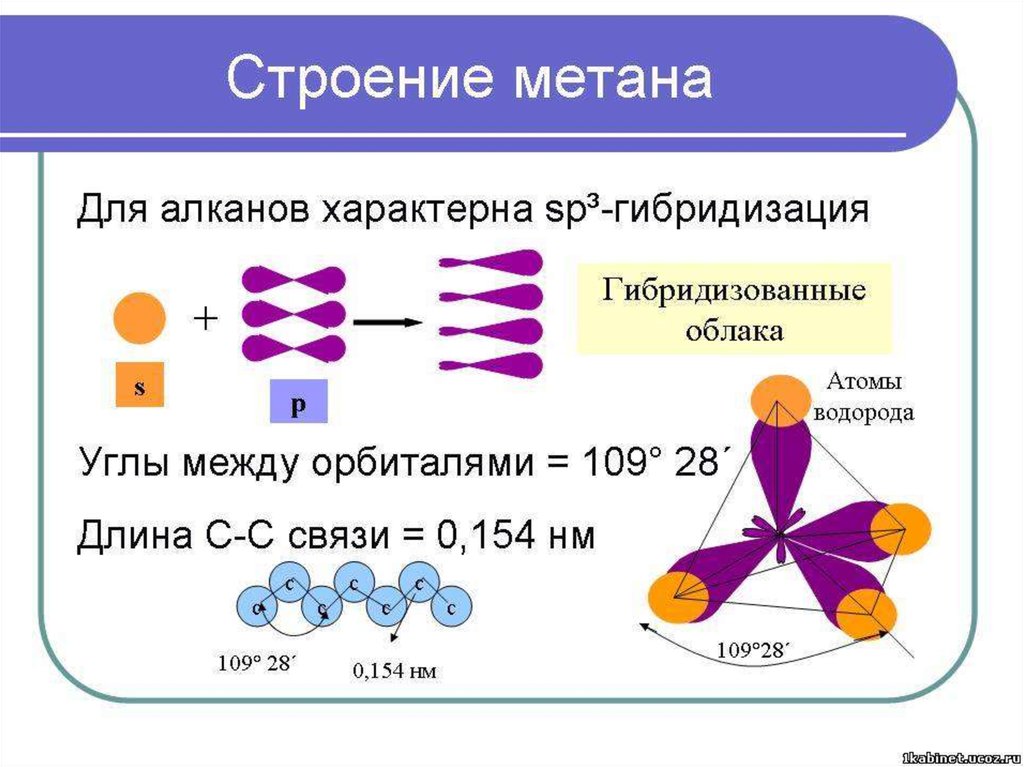
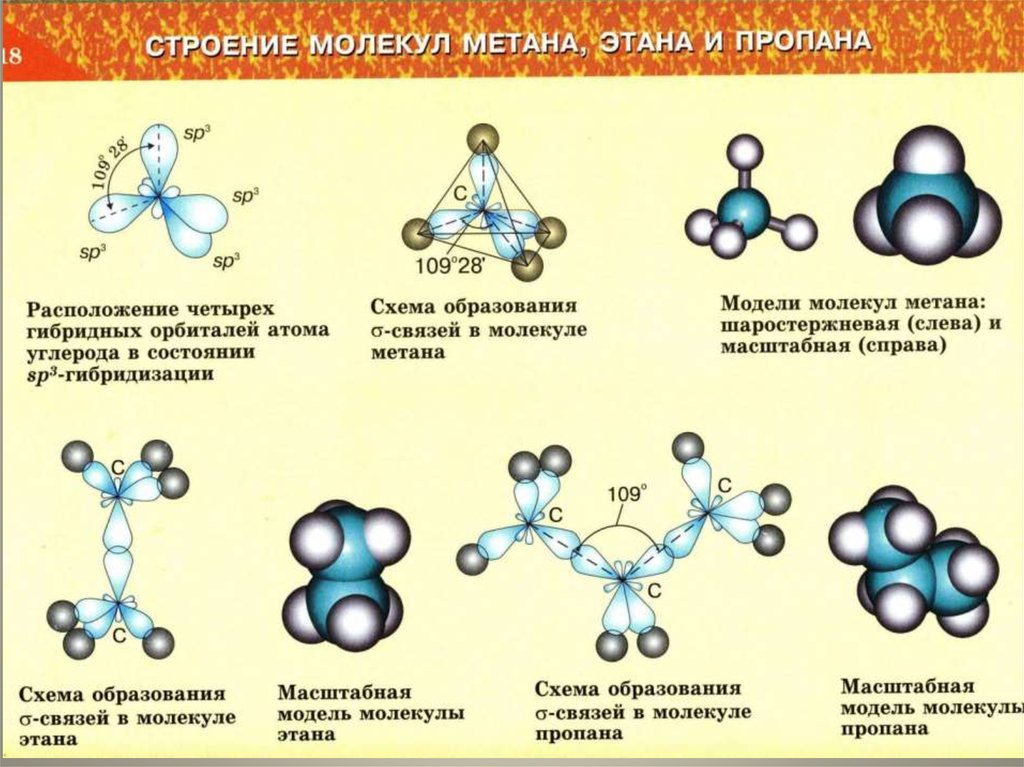
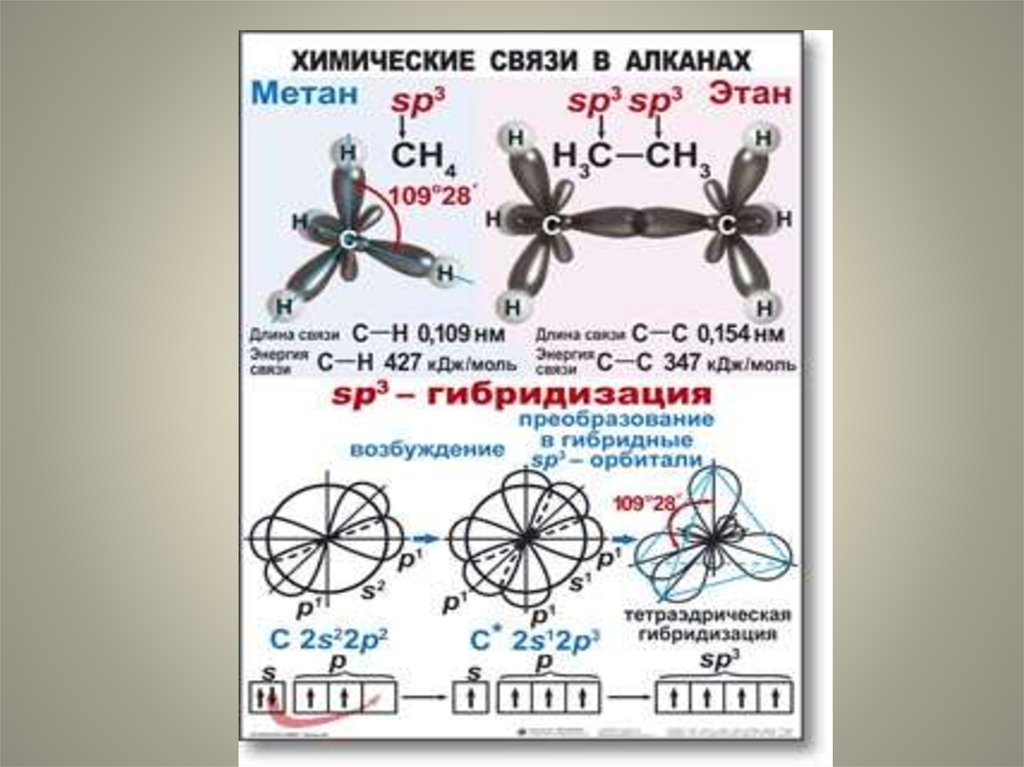
Для алканов с открытой цепьюхарактерен только один вид
изомерии – структурный.
Изомеры с одинаковым числом
атомов углерода в молекуле
различаются только числом,
типом и расположением
заместителей в цепи.
9.
10.
11.
12. Правила составления названий.
• 1. Выбрать вструктурной цепи
наиболее длинную
цепь атомов углерода.
Если какие-то
фрагменты
структурной формулы
свернуты, необходимо
их развернуть.
13.
• 2. Пронумеровать атомыуглерода в выбранной
цепи с того конца, к
которому ближе
находится разветвление.
Если разветвлений два и
они равноудалены от
концов главной цепи, то
нумеровать углеродную
цепь необходимо с того
конца, к которому ближе
стоит более простое (с
меньшим числом атомов
углерода) разветвление.
14.
• 3. Дать названиерадикалу – боковому
разветвлению. Причем
перед ним ставят
номер того атома в
углеродной цепи, от
которого отходит
разветвление, затем
через дефис –
название радикала
(разветвления)
15.
• 4. Если замещающихразветвлений
несколько, то цифрой
отмечают каждое из
них, перечисляя
радикалы в
алфавитном порядке
16.
• 5. Если в формулевстречаются одинаковые
радикалы, то сначала
через запятые
перечисляют цифрами
местоположения
разветвлений, затем их
количество и названия.
Количество одинаковых
радикалов обозначается
греческими
числительными «ди»
(два), «три» (три), «пента»
(пять) и т.д.
17.
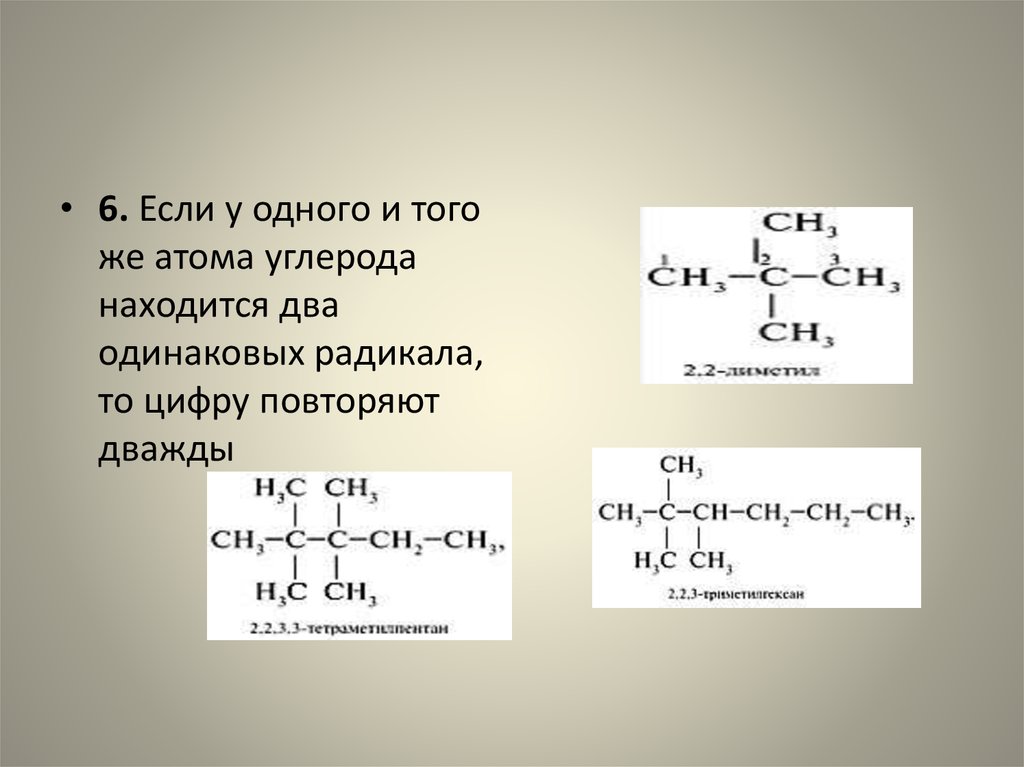
• 6. Если у одного и тогоже атома углерода
находится два
одинаковых радикала,
то цифру повторяют
дважды
18.
• 7. К названиюпоследнего радикала
добавляют название
того алкана, который
содержит такое же
количество атомов
углерода, как и
выбранная главная
цепь.
19.
• 8. При выборе главнойцепи в случае
большого количества
разветвлений
направление
нумерации указывают
так, чтобы цифры,
определяющие
положения
разветвлений, были
наименьшими.
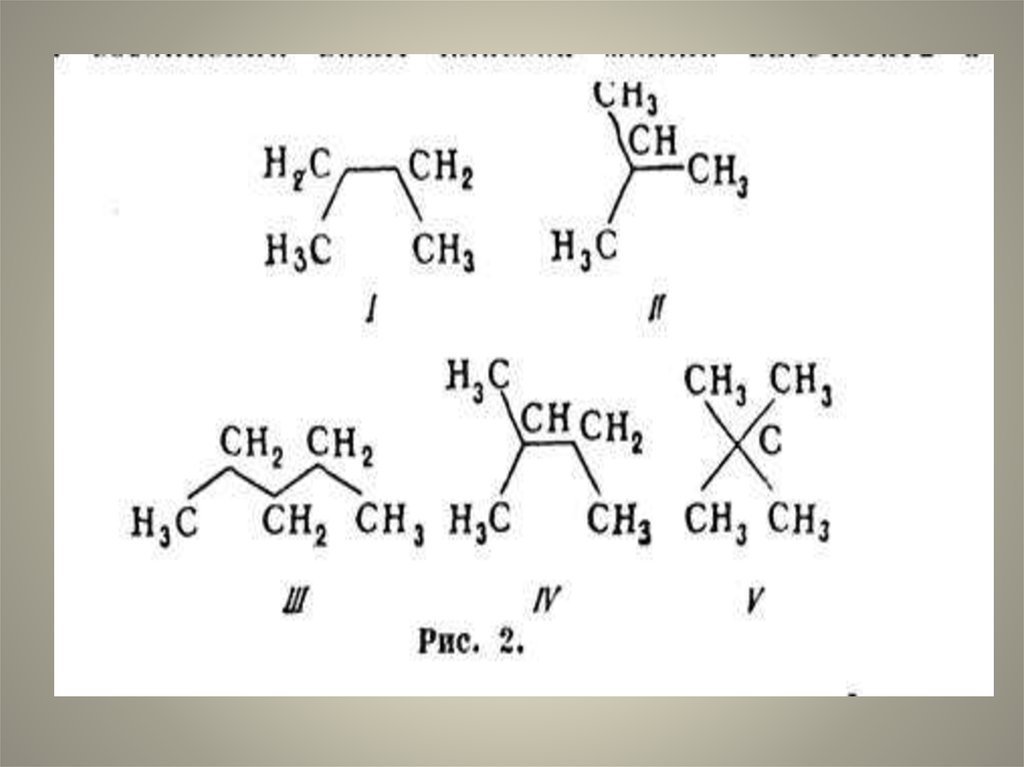
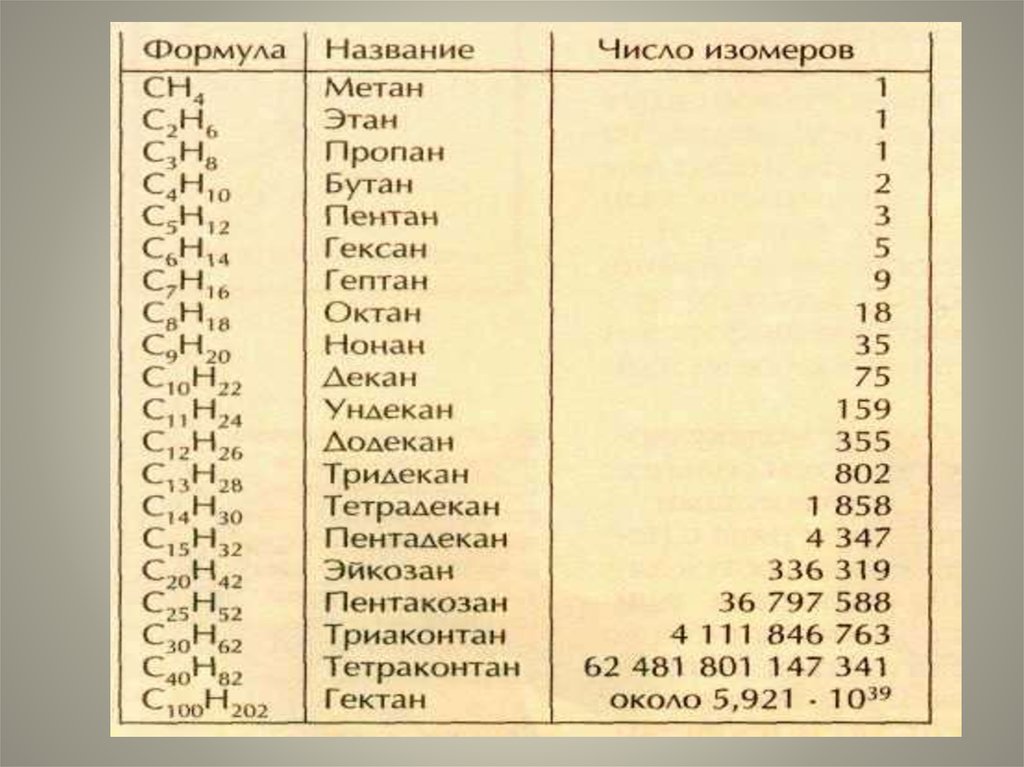
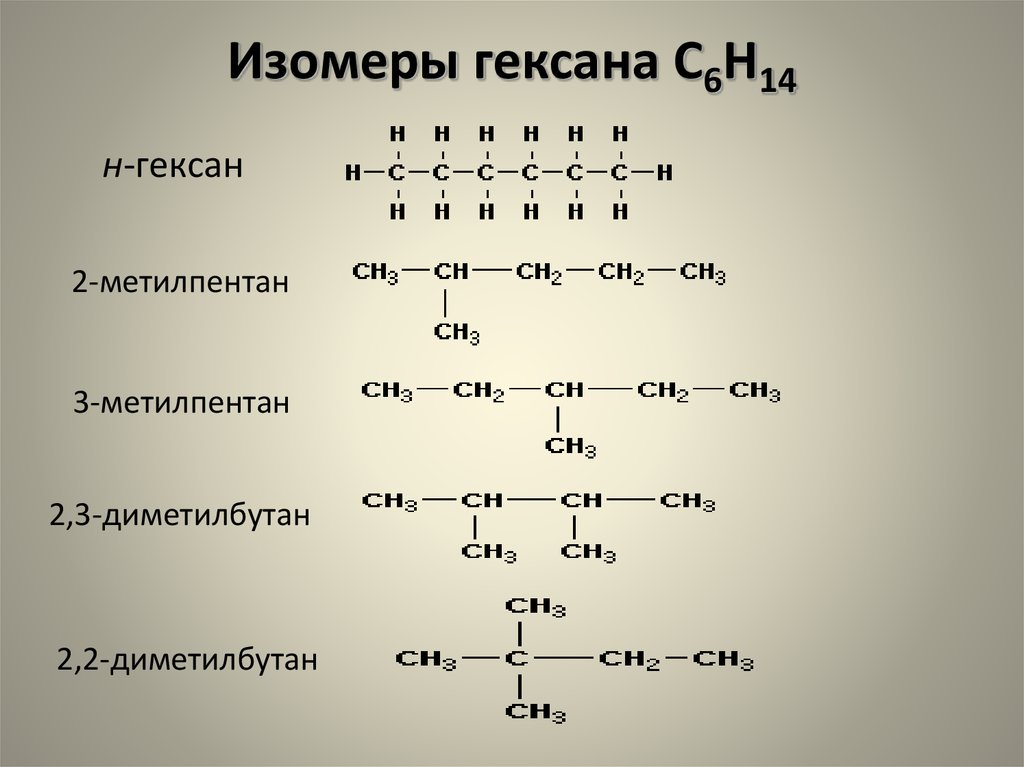
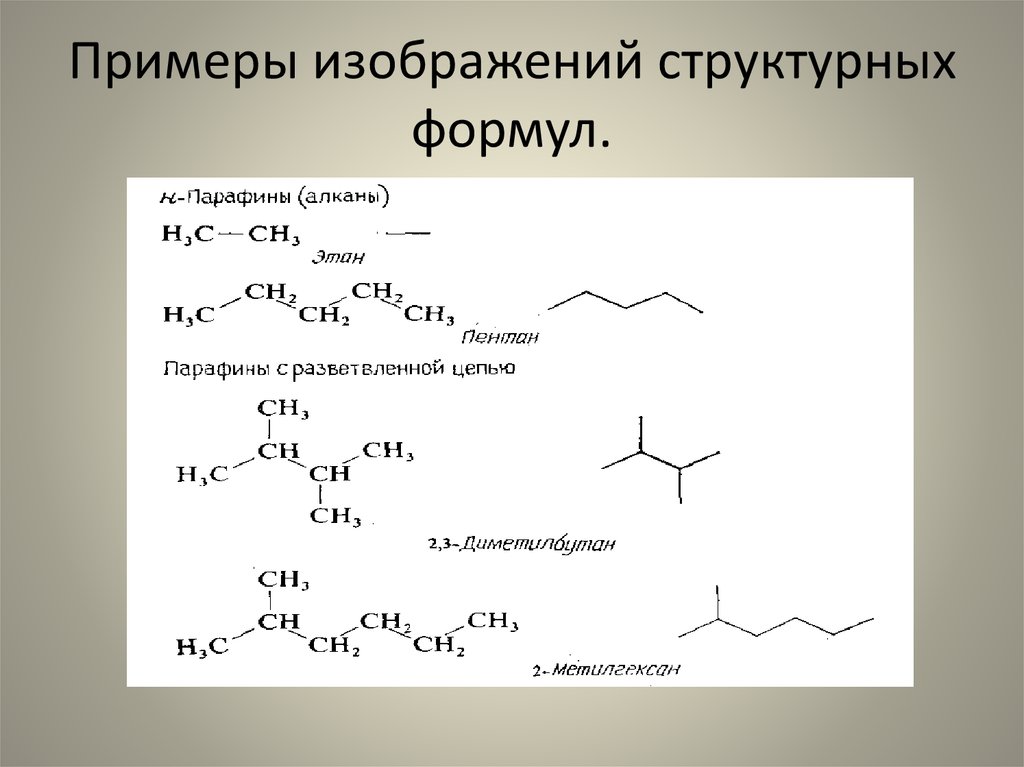
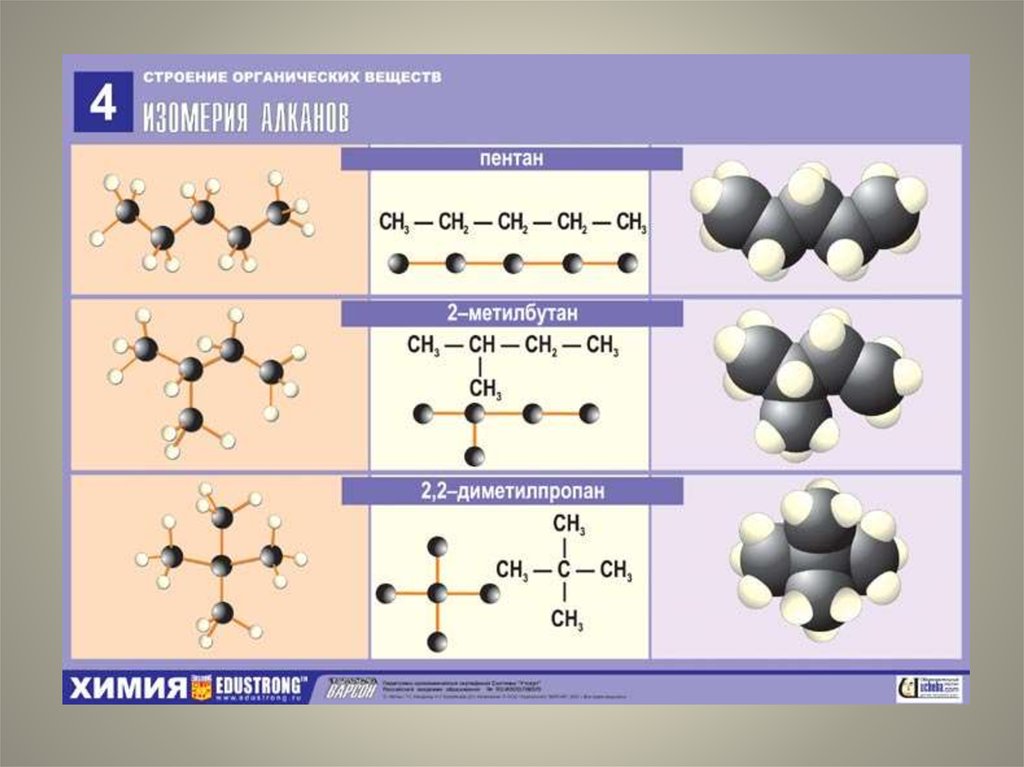
20. Изомеры гексана С6Н14
н-гексан2-метилпентан
3-метилпентан
2,3-диметилбутан
2,2-диметилбутан
21. Примеры изображений структурных формул.
22. Рациональная (заместительная) номенклатура
• По рациональнойноменклатуре
углеводороды
рассматриваются как
производные метана,
у которого один или
несколько атомов
водорода замещены
на радикалы.
23.
24.
• Чем сложнее формулавещества, тем труднее
(а иногда и
невозможно) его
назвать по
рациональной
номенклатуре.
• Поэтому в 1892 г. в
Женеве была принята
женевская
номенклатура, а с 1947
г. выработана
систематическая
международная
номенклатура «ИЮПАК»
(IUPAC – краткое
название
Международного союза
теоретической и
прикладной химии).
25. Дать названия веществам:
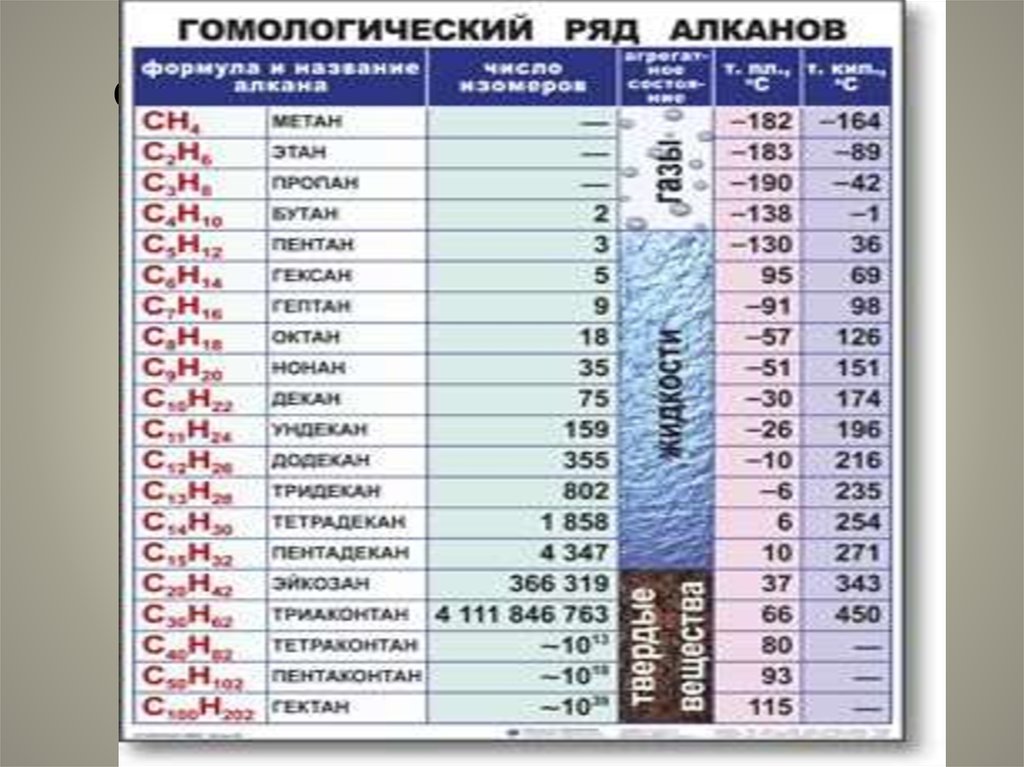
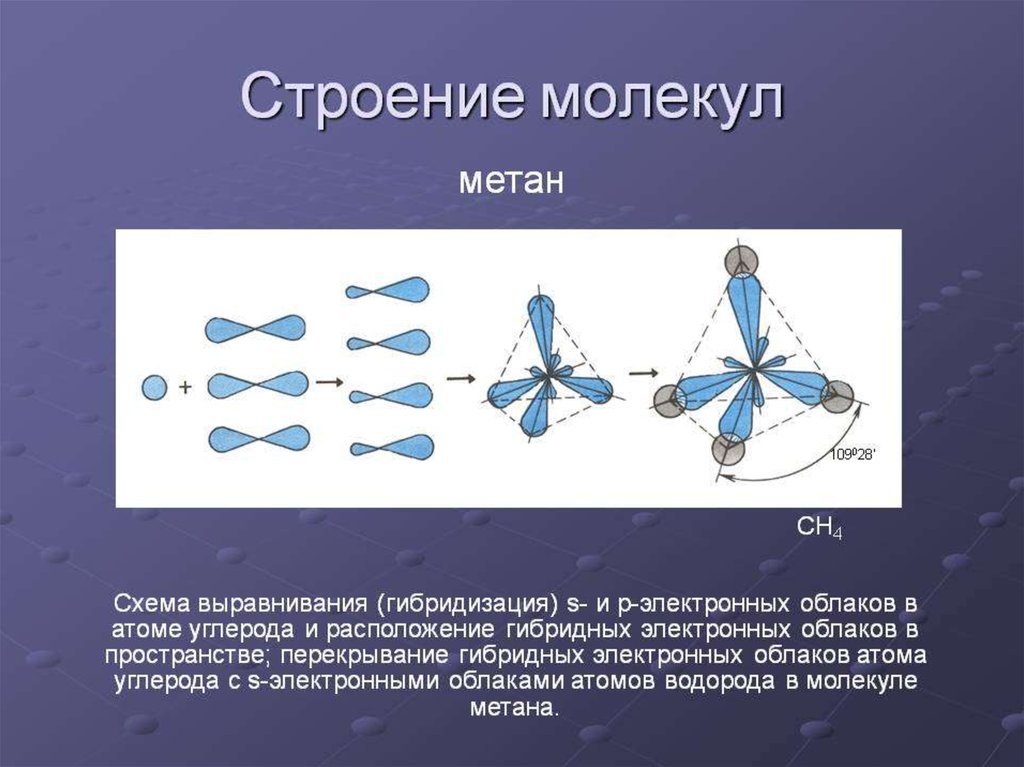
26. Физические свойства алканов.
27. Физические свойства алканов
28.
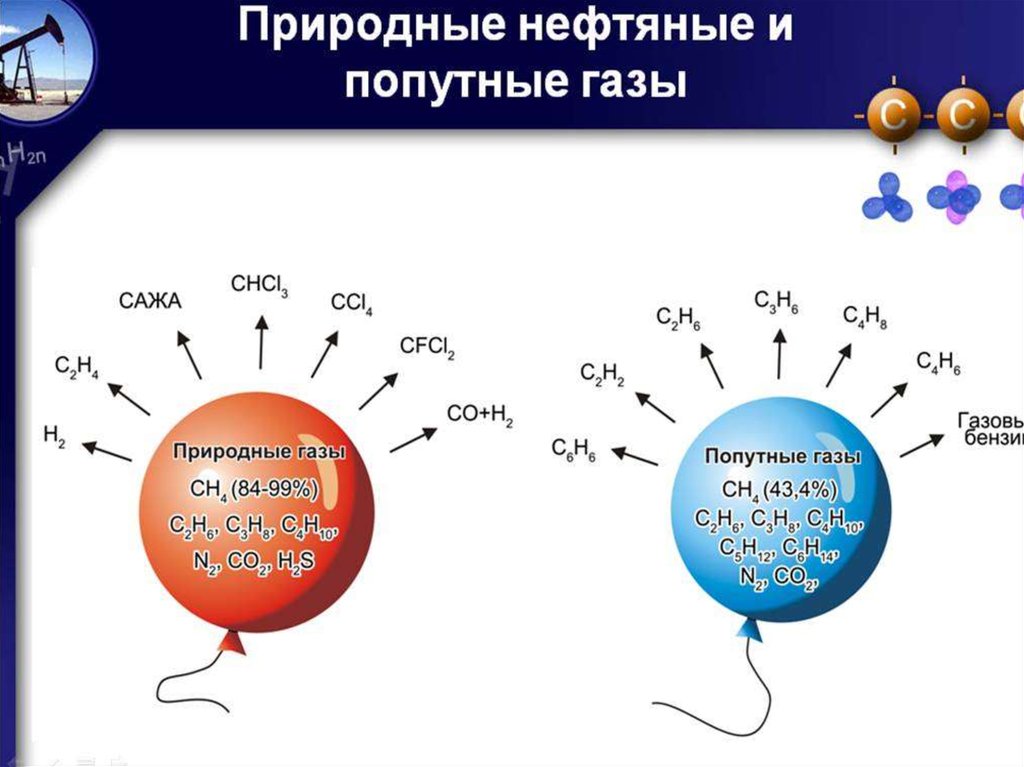
29. Нахождение алканов в природе.
• Основные источники алканов – нефть и природныйгаз. Метан составляет основную массу природного
газа, в нем присутствуют также в небольших
количествах этан, пропан и бутан. Метан
содержится в выделениях болот и угольных
пластов. Наряду с легкими гомологами метан
присутствует в попутных нефтяных газах. Эти газы
растворены в нефти под давлением и находятся
также над ней. Алканы составляют значительную
часть продуктов переработки нефти.
30.
• Простейшийпредставитель
предельных
углеводородов —
метан — образуется в
природе в результате
разложения остатков
растительных и
животных организмов
без доступа воздуха.
• Этим объясняется
появление пузырьков
газа в заболоченных
водоемах. Иногда
метан выделяется из
каменноугольных
пластов и
накапливается в
шахтах.
31.
• Метан составляетосновную массу
природного газа (80 97%). Он содержится и
в газах, выделяющихся
при добыче нефти.
• В состав природного
газа и нефтяных газов
входят также этан
C2H6, пропан C3H8,
бутан C4H10 и
некоторые другие.
Газообразные, жидкие
и твердые предельные
углеводороды
содержаться в нефти.
32.
33.
Твердые алканы встречаются вприроде в виде залежей
горного воска – озокерита, в
восковых покрытиях листьев,
цветов и семян растений,
входят в состав пчелиного
воска.
34.
35.
36.
37.
38.
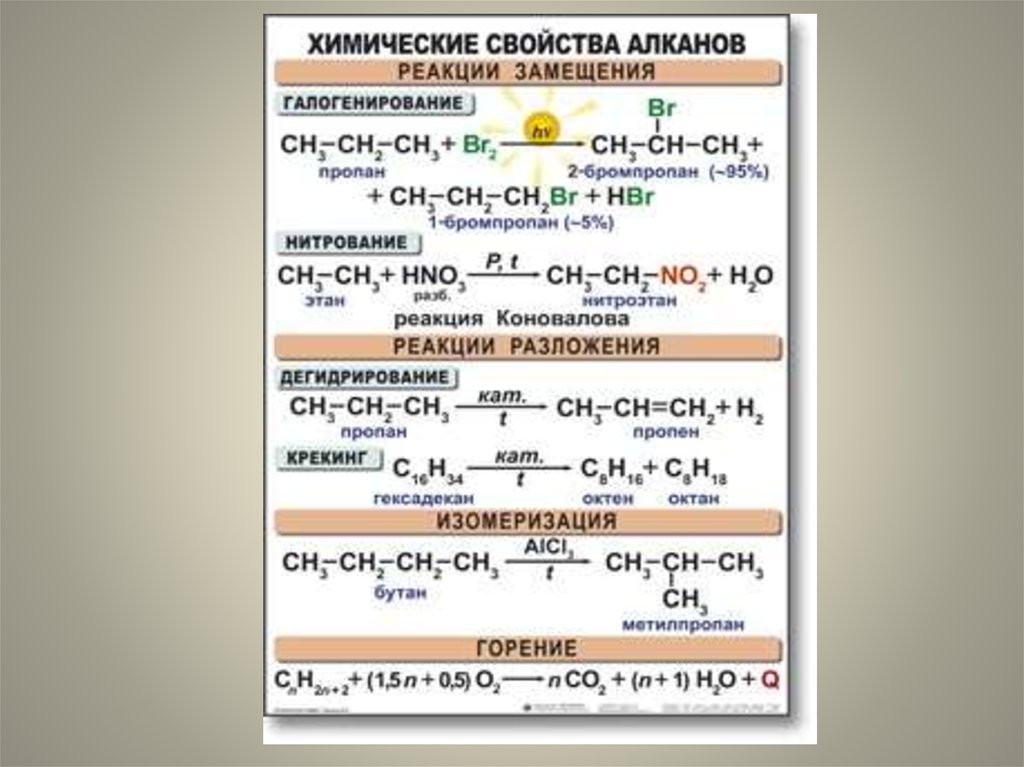
39. Химические свойства алканов.
Для алканов характерны реакции:
I.Замещения.
II.Крекинг.
III.Дегидрирование.
IV.Изомеризация.
V.Окисление.
40.
41. I.Реакции замещения.
• 1.Галогенирование алканов – реакциязамещения одного или более атомов
водорода в молекуле алкана на галоген.
Продукты реакции называют галогеналканами
или галогенопроизводными алканов. Реакция
алканов с хлором и бромом идет на свету или
при нагревании.
42.
Механизм реакции замещения.1 стадия – зарождение цепи - появление в зоне
реакции свободных радикалов. Под действием
световой энергии гомолитически разрушается связь в
молекуле Cl:Cl на два атома хлора с неспаренными
электронами (свободные радикалы) ·Cl. Свободный
радикал- это частица с одним неспаренным
электроном.
43.
• 2 стадия – рост(развитие) цепи.
Свободные
радикалы,
взаимодействуя с
молекулами,
порождают новые
радикалы и
развивают цепь
превращений:
44.
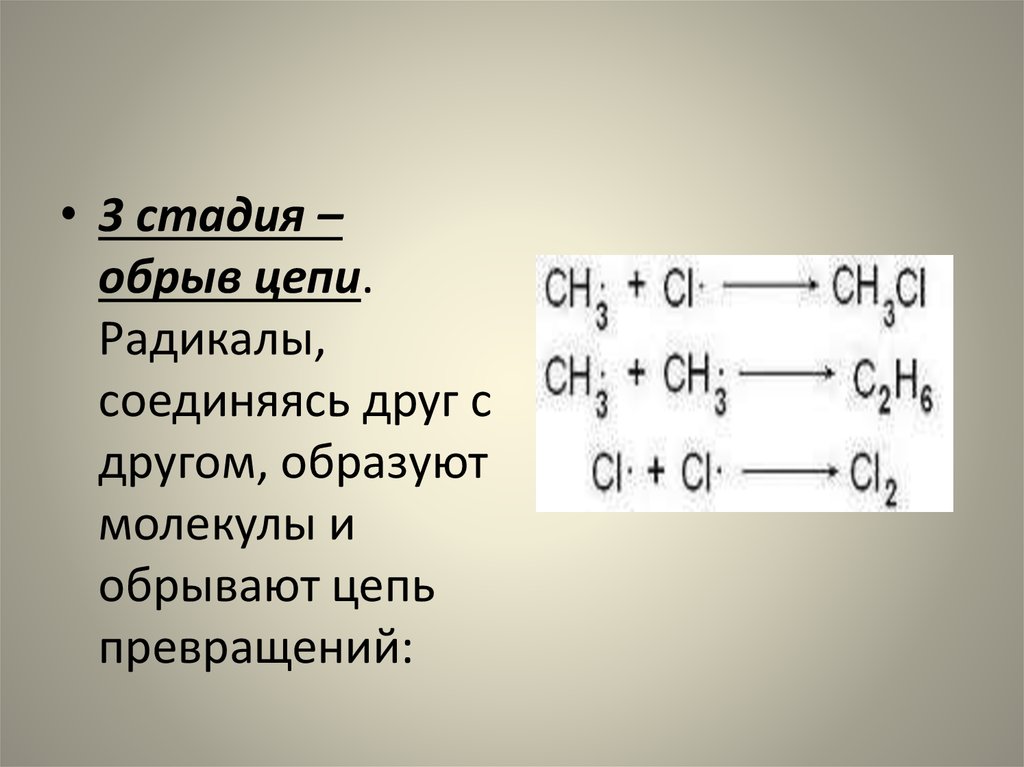
• 3 стадия –обрыв цепи.
Радикалы,
соединяясь друг с
другом, образуют
молекулы и
обрывают цепь
превращений:
45.
• Реакция галогенирования алканов протекаетпо радикальному цепному механизму, т.е. как
цепь последовательных превращений с
участием свободно-радикальных частиц.
В разработке теории цепных реакций большую
роль сыграли труды академика, лауреата
Нобелевской премии Н.Н. Семенова.
• Механизм радикального замещения (символ
SR):
46. СЕМЁНОВ Николай Николаевич
15 апреля 1896 г. – 25
сентября 1986 г.
• Лауреат Нобелевской
премии по химии
за разработку теории
цепных реакций
(совместно с Сирилом
Хиншелвудом),
• 1956 г.
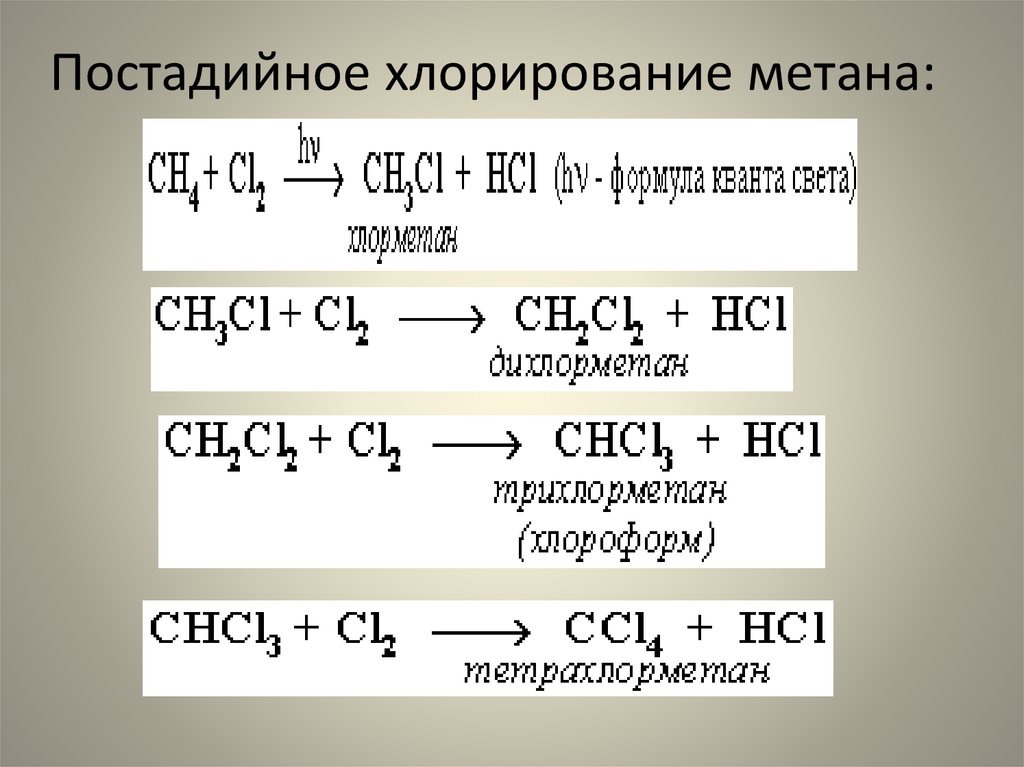
47. Постадийное хлорирование метана:
48.
• Замещение у хлорметана идет легче, чем уметана, так как атом хлора поляризует
связи С-Н и делает их
реакционноспособными.
49. Легче замещается атом водорода: С трет. > С втор. > Cперв.
Легче замещается атом водорода:С трет. > С втор. > Cперв.
• При хлорировании
или бромировании
алкана с вторичными
или третичными
атомами углерода
легче всего идет
замещение водорода
у третичного атома,
труднее у вторичного
и еще труднее у
первичного.
• Это объясняется
большей
устойчивостью
третичных и
вторичных
углеводородных
радикалов по
сравнению с
первичными.
50.
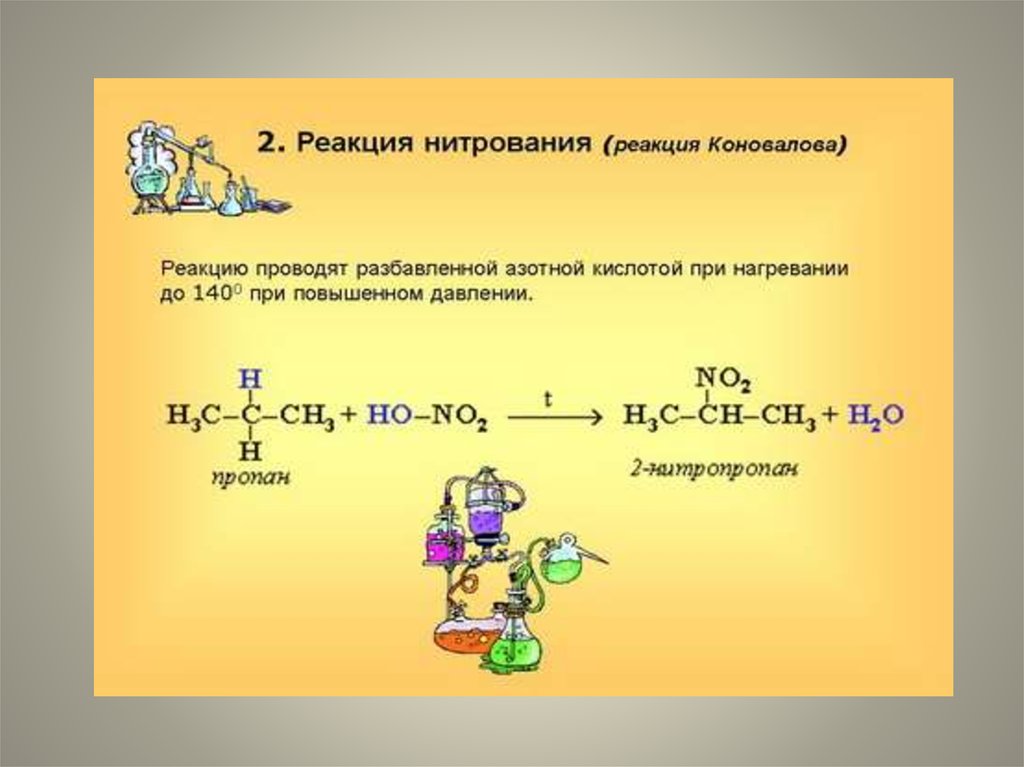
51.
• При нитрованииалканов также
соблюдается порядок
реакционной
способности С-Нсвязей, характерный
для реакций
радикального
замещения:
• С тр.>С втор. > C перв.
52. 3.Сульфирование.
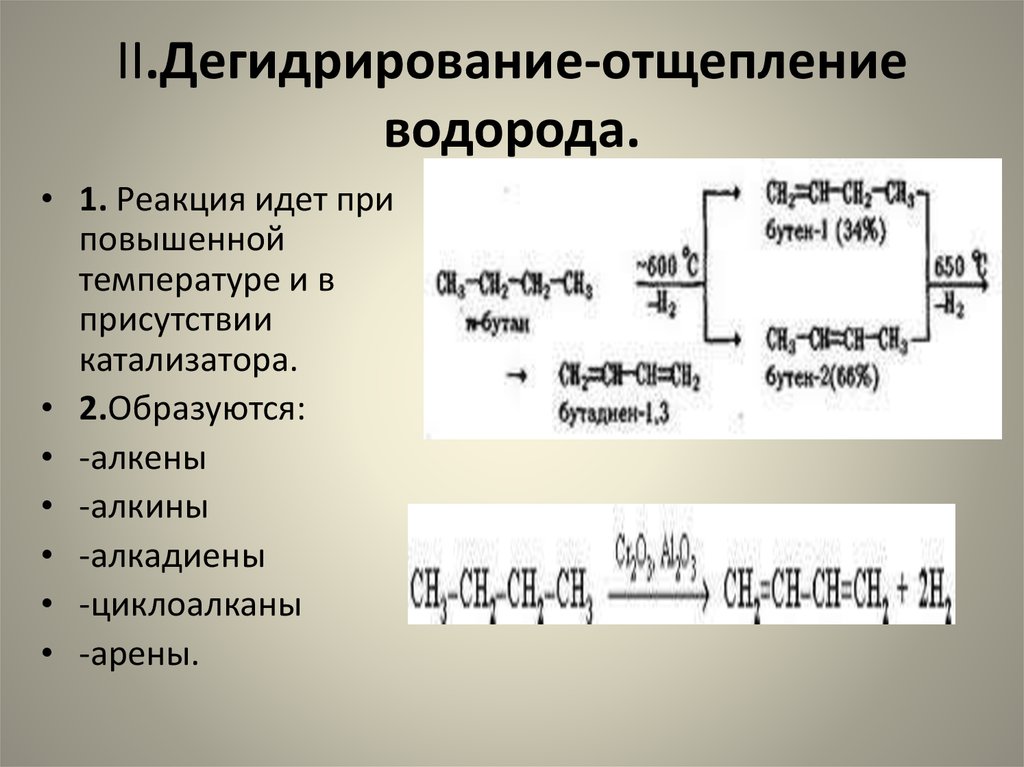
53. II.Дегидрирование-отщепление водорода.
• 1. Реакция идет приповышенной
температуре и в
присутствии
катализатора.
• 2.Образуются:
• -алкены
• -алкины
• -алкадиены
• -циклоалканы
• -арены.
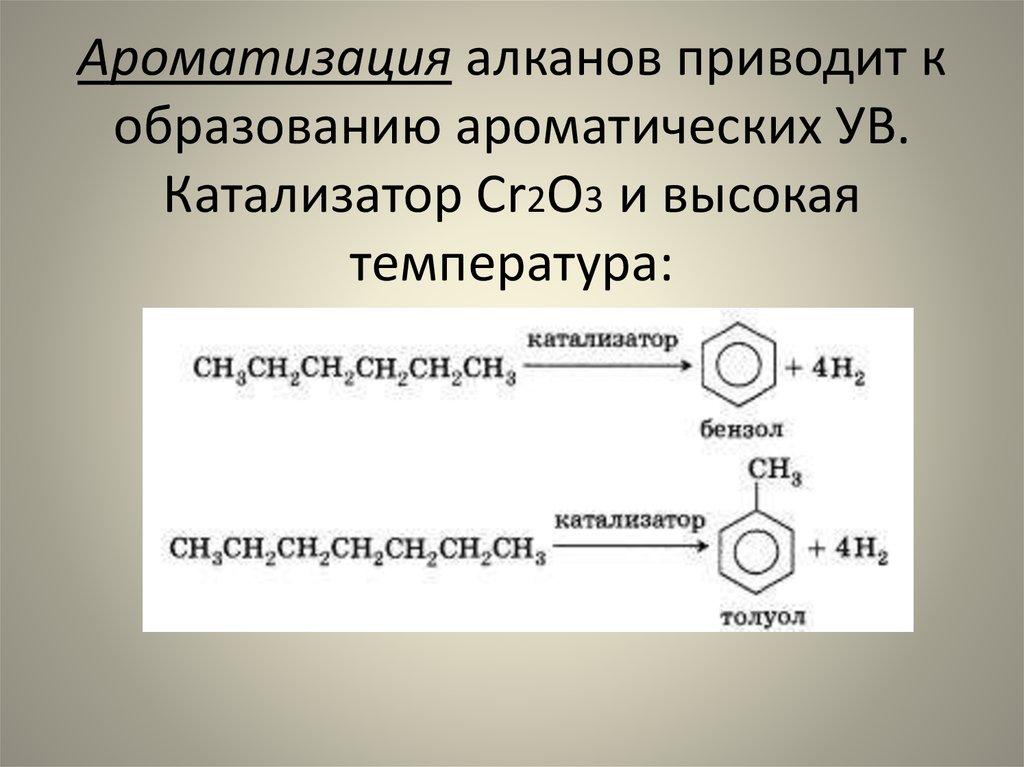
54. Ароматизация алканов приводит к образованию ароматических УВ. Катализатор Сr2О3 и высокая температура:
55. III.Крекинг- разрыв связи С-С
• Образуются двапродукта: алкан и
алкен-1:
• -крекинг идет (как
правило) посередине;
• крекингу подвергаются
в основном алканы
бензиновой фракции.
56. IV.Изомеризация- перестройка углеродной цепи.
• Образуются изомерывещества содинаковой МФ, но
разным химическим
строением.
• Катализатор- АlCl3
57.
58. V.Реакции окисления.
• 1.Горение алканов:59. При мягком окислении СН4 в присутствии различных катализаторов кислородом воздуха (при 200 °C) могут образоваться:
При мягком
окислении СН4 в
присутствии
различных
катализаторов
кислородом
воздуха (при
200 °C) могут
образоваться:
метиловый спирт:
2СН4 + О2 → 2СН3ОН;
формальдегид:
СН4 + О2 → СН2О + Н2O;
муравьиная кислота:
2СН4 + 3О2 → 2НСООН +2Н2O.
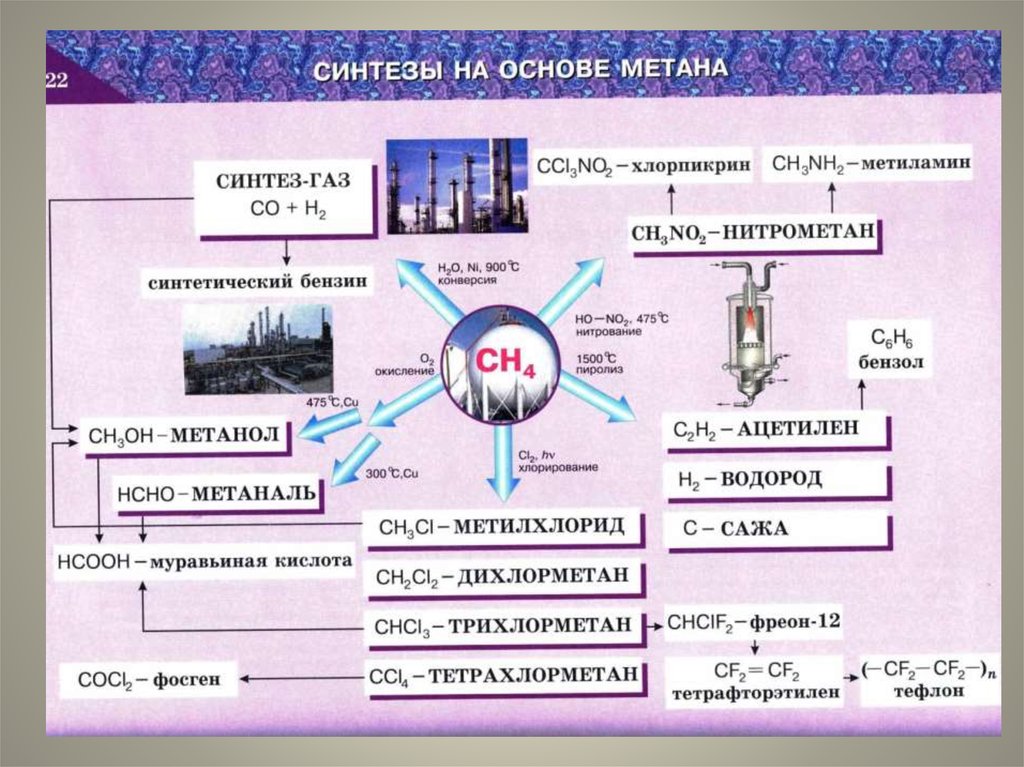
60. Особые свойства метана.
• Конверсия метананагревание с водянымпаром:
Эта реакция используется для
получения водорода. Синтезгаз служит сырьем для
получения различных
углеводородов.
• Пиролиз метананагревание метана
при высокой при
1500 °C без доступа
кислорода с
образованием
ацетилена:
61. Способы получения метана и его гомологов.
СПОСОБЫ ПОЛУЧЕНИЯ МЕТАНА ИЕГО ГОМОЛОГОВ.
Способы получения
62. Получение метана
1.Гидролиз карбида алюминия:
Аl4C3+12НОН→4Al(ОН)3 + 3СН4
Кислотный гидролиз:
Аl4C3+12НCl→4AlCl3 + 3СН4
Аl4C3+12НNО3→4Al(NО3)3 + 3СН4
Аl4C3+6Н2SО4→2Al2(SО4)3 + 3СН4
63.
• 2.Сплавление ацетата натрия (калия) сощелочью:
• CH3COONa + NaOH→ CH4↑ + Na2CO3
• 3. Синтез на основе водяного газа (Ni)
CO+3H2 →CH4 +H2O
64. Получение гомологов метана.
• 1.Реакция Вюрца- взаимодействиегалогеналканов с металлическим натрием.
Реакция необходима для удлинения цепи.
• 2.Реакция Дюма (декарбоксилирование)
сплавление солей карбоновых кислот со
щелочами.
• 3.Гидрирование алкенов, алкинов,
алкадиенов.
65. Реакция Вюрца.
• Взаимодействиегалогеналканов с
металлическим
натрием.
• При взаимодействии
галогеналканов с
металлическим
натрием получаются
алканы с удвоенным
числом атомов
углерода
• Эта реакция была
открыта французским
химиком Ш.А. Вюрцем
(1854) и носит его имя.
• .
66.
• Взаимодействие двуходинаковых
галогеналкана
приводит к
образованию одного
нового алкана.
• Если взять два разных
галогеналкана, то
получится смесь
различных алканов
67. Декарбоксилирование
• При сплавлениибезводных солей
карбоновых кислот со
щелочами получаются
алканы, содержащие
на один атом углерода
меньше по сравнению
с углеродной цепью
исходных карбоновых
кислот.
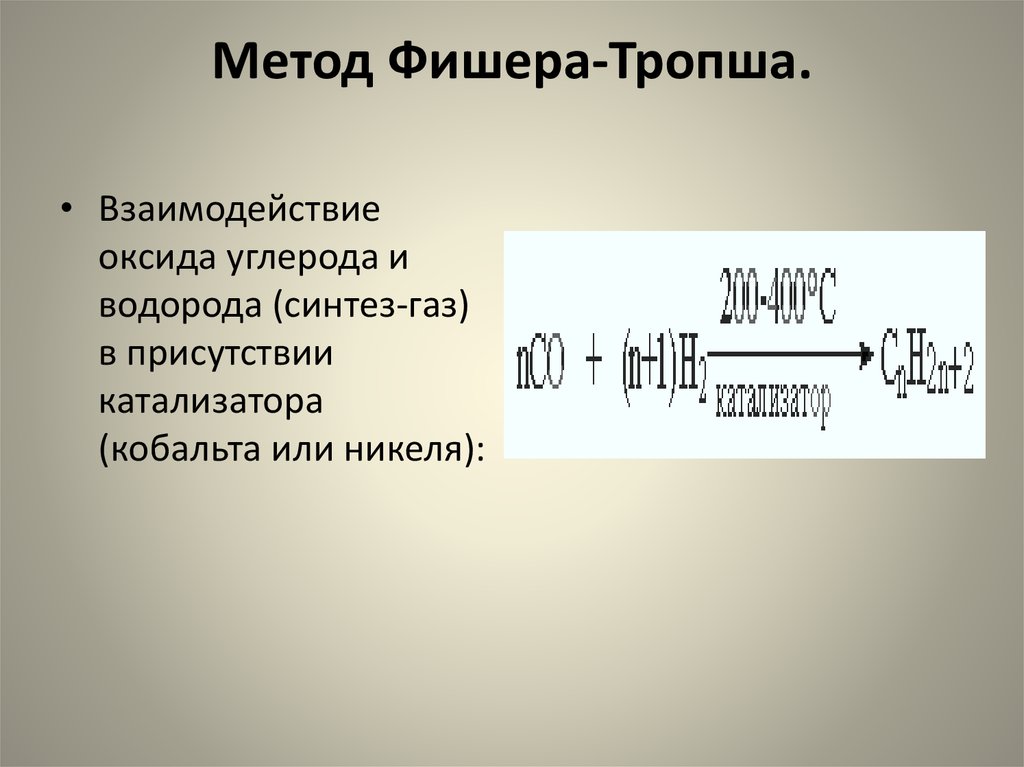
68. Метод Фишера-Тропша.
• Взаимодействиеоксида углерода и
водорода (синтез-газ)
в присутствии
катализатора
(кобальта или никеля):
69. Гидрирование алкенов, алкинов, алкадиенов.
• При взаимодействииалкенов с водородом
(реакция гидрирования)
в присутствии
металлических
катализаторов (никель,
платина, палладий)
происходит
присоединение
водорода по двойным
связям с образованием
алканов.
70. Реакция Кольбе.
• Электролиз солейщелочных металлов и
карбоновых кислот

















































 chemistry
chemistry








