Similar presentations:
Введение в биотехнологию
1. ВВЕДЕНИЕ В БИОТЕХНОЛОГИЮ
АДИЕВА АЙНА АХМЕДОВНАдоктор биологических наук,
профессор кафедры ЕНД
2.
Биотехноло́гия — дисциплина, изучающая возможностииспользования живых организмов, их систем или продуктов их
жизнедеятельности для решения технологических задач
3.
Биотехнология – это промышленное использование биологическихпроцессов и систем на основе выращивания высокоэффективных форм
микроорганизмов, культур клеток и тканей растений и животных с
необходимыми человеку свойствами.
• Отдельные
биотехнологические
процессы
(хлебопечение,
виноделие) известны с древних времен. Но наибольших успехов
биотехнология достигла во второй половине XX века и приобретает
всё большее значение для человеческой цивилизации.
• Особенностью биотехнологии является то, что она сочетает в себе
самые передовые достижения научно-технического прогресса с
накопленным опытом прошлого, выражающимся в использовании
природных источников для создания полезных для человека
продуктов.
• Любой биотехнологический процесс включает ряд этапов:
подготовку объекта, его культивирование, выделение, очистку,
модификацию и использование полученных продуктов.
• Многоэтапность
и
сложность
процесса
обусловливает
необходимость привлечения к его осуществлению самых разных
специалистов: генетиков и молекулярных биологов, цитологов,
биохимиков, вирусологов, микробиологов и физиологов, инженеровтехнологов, конструкторов биотехнологического оборудования
4. Структура современной биотехнологии
• В современной биотехнологиииспользуются биологические системы
всех уровней: от молекулярногенетического до биогеоценотического
(биосферного);
• при этом создаются принципиально
новые биологические системы, не
встречающиеся в природе.
• Биологические системы,
используемые в биотехнологии,
вместе с небиологическими
компонентами (технологическое
оборудование, материалы, системы
энергоснабжения, контроля и
управления) называют
рабочими системами
5.
Объектами биотехнологии служат многочисленные представители групп живыхорганизмов — микроорганизмы (вирусы, бактерии, протисты, дрожжи и др.),
растения, животные, а также изолированные из них клетки и субклеточные
структуры (органеллы). Биотехнология базируется на протекающих в живых
системах физиолого-биохимических процессах, в результате которых
осуществляются выделение энергии, синтез и расщепление продуктов
метаболизма, формирование химических и структурных компонентов клетки.
6. Биотехнология в растениеводстве
Ученые не только создают высокоурожайные сорта растений, устойчивые к
неблагоприятным факторам, но и разрабатывают биотехнологические пути
защиты растений. На промышленную основу поставлен выпуск биологических
средств борьбы с вредителями на основе использования их естественных
врагов и паразитов, а также токсических продуктов, образуемых живыми
организмами.
Важное место в повышении урожайности растений отводится
биологическим удобрениям, включающим в себя различные бактерии. Так,
азотобактерин обогащает почву не только азотом, но и витаминами,
фитогормонами и биорегуляторами. Препарат фосфобактерин превращает
сложные органические соединения фосфора в простые, легко усвояемые
растениями.
Все большее распространение получает использование биогумуса —
высокоэффективного естественного органического удобрения. Как показали
исследования, биогумус существенно повышает плодородие почвы и ее
устойчивость к водной и ветровой эрозии, быстро восстанавливает
плодородие низкоплодородных участков, улучшает экологическую обстановку.
Промышленное получение биогумуса освоено во многих странах.
7. Метод: культура тканей
Всё шире на промышленной основе применяется метод вегетативногоразмножения сельскохозяйственных растений культурой тканей. Он
позволяет не только быстро размножать новые перспективные сорта
растений, но и получить незараженный вирусами посадочный материал.
8. Биотехнология в животноводстве
• В последние годы повышается интерес к дождевым червям как кисточнику животного белка для сбалансирования кормовых
рационом животных, птиц, рыб, пушных зверей, а также белковой
добавки, обладающей лечебно-профилактическими свойствами.
• Биотехнология позволяет получать экологически чистые виды
топлива путем биопереработки отходов промышленного и
сельскохозяйственного производств. Например, созданы установки,
в которых используются бактерии для переработки навоза и других
органических отходов.
• Для повышения продуктивности животных нужен полноценный
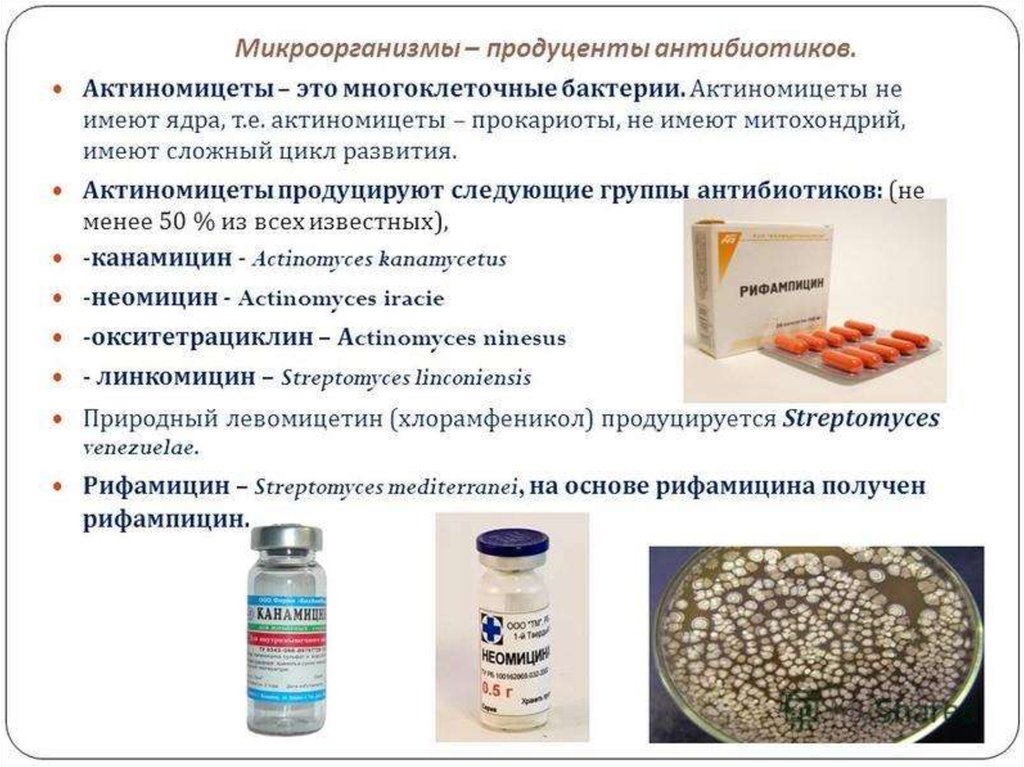
корм. Микробиологическая промышленность выпускает кормовой
белок на базе различных микроорганизмов - бактерий, грибов,
дрожжей, водорослей. Как показали промышленные испытания,
богатая
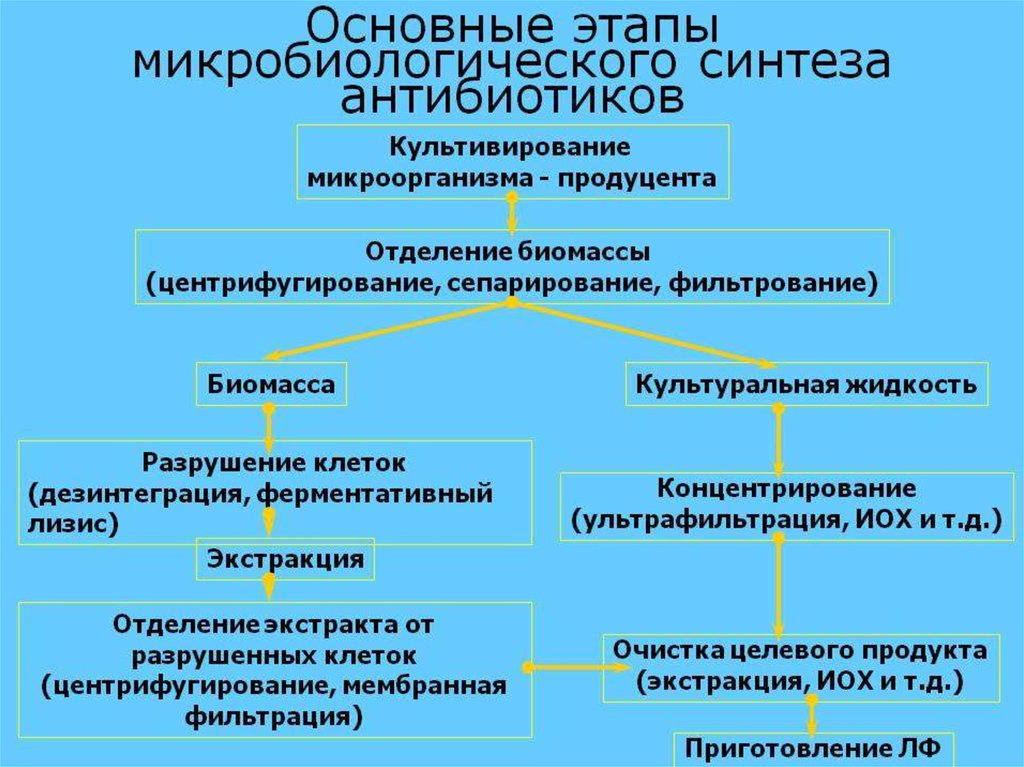
белками
биомасса
одно-клеточных
организмов
эффективно усваивается сельскохозяйственными животными.
Так, 1т. кормовых дрожжей позволяет сэкономить 5-7 т. зерна.
Это имеет большое значение, поскольку 80% площадей
сельско-хозяйственных угодий в мире отводятся для
производства корма скоту и птице.
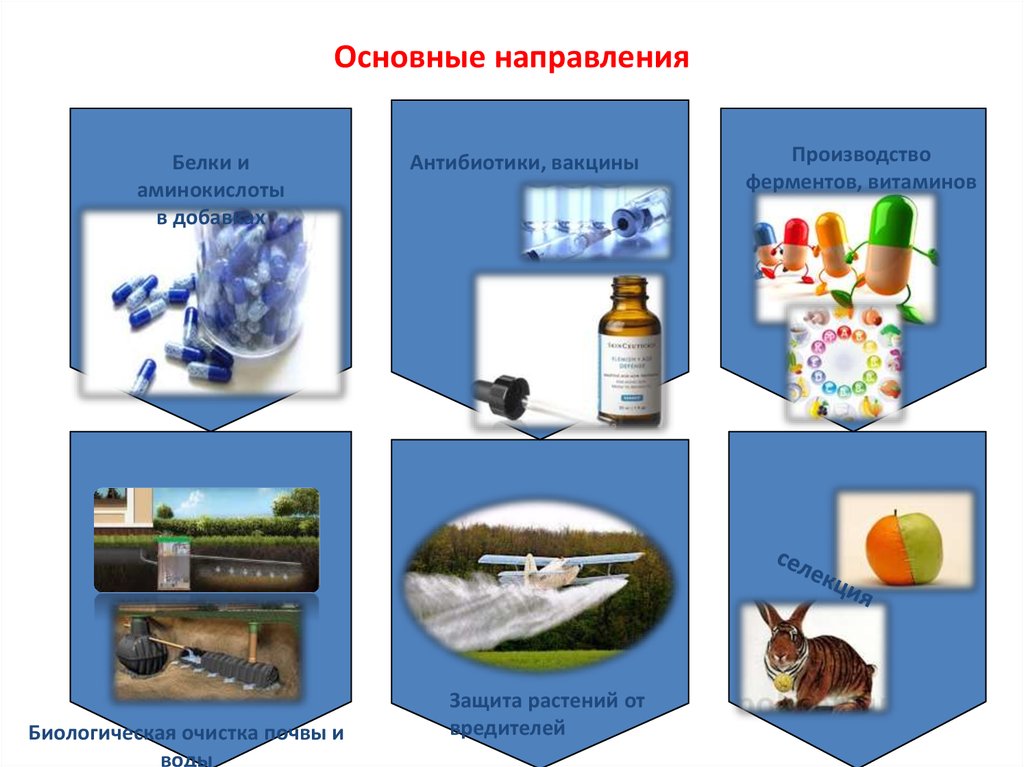
9. Основные направления
Белки иаминокислоты
в добавках
Биологическая очистка почвы и
воды
Антибиотики, вакцины
Защита растений от
вредителей
Производство
ферментов, витаминов
10.
11. биоинженерия
Биоинженерия или биомедицинская инженерия — это дисциплина,направленная на углубление знаний в области инженерии, биологии и
медицины
и
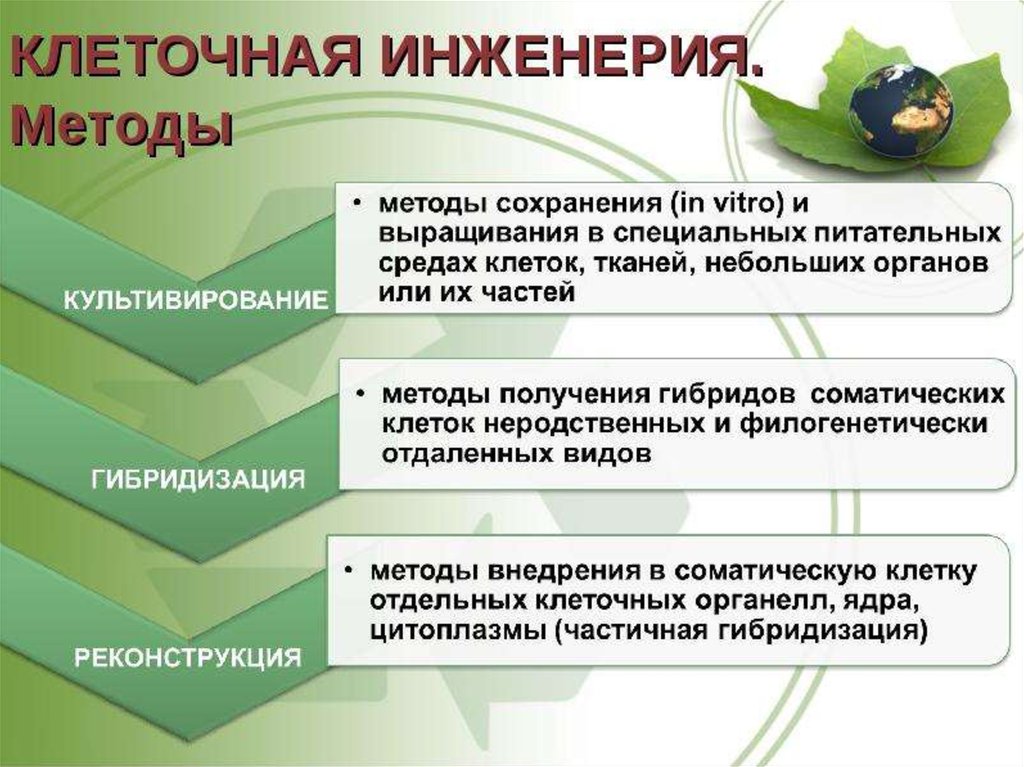
укрепление
здоровья
человечества
за
счет
междисциплинарных разработок, которые объединяют в себе
инженерные подходы с достижениями биомедицинской науки и
клинической практики.
12. биомедицина
Раздел медицины, изучающий с теоретическихпозиций организм человека, его строение и функцию в норме и патологии,
патологические состояния, методы их диагностики, коррекции и лечения.
Биомедицина включает накопленные сведения и исследования, в большей
или меньшей степени общие медицине, ветеринарии, стоматологии и
фундаментальным естественно-биологическим наукам:
химия, биологическая химия, биология, гистология,
генетика, эмбриология, анатомия, физиология, патология,
биомедицинский инжиниринг, зоология, ботаника и микробиология
13. наномедицина
Слежение, исправление, конструирование и контроль надбиологическими системами человека на молекулярном
уровне, используя наноустройства и наноструктуры В мире
уже созданы ряд технологий для наномедицинской отрасли. К
ним относятся адресная доставка лекарств к больным
клеткам, лаборатории на чипе, новые бактерицидные
средства.
14. биофармакология
Раздел фармакологии, который изучает физиологическиеэффекты, производимые веществами биологического и
биотехнологического
происхождения.
Фактически,
биофармакология — это плод конвергенции двух
традиционных наук — биотехнологии, а именно, той ее
ветви,
которую
именуют
«красной»,
медицинской
биотехнологией, и фармакологии, ранее интересовавшейся
лишь низкомолекулярными химическими веществами, в
результате взаимного интереса.
15. Биоинформатика
математические методы
компьютерного анализа
в сравнительной геномике
(геномная биоинформатика).
разработка алгоритмов и
программ для предсказания
пространственной структуры
белков (структурная
биоинформатика).
исследование стратегий,
соответствующих
вычислительных методологий, а
также общее управление
информационной сложности
биологических систем.
В биоинформатике используются
методы прикладной
математики, статистики и информат
ики. Биоинформатика используется
в биохимии, биофизике, экологии и в
других областях.
16. бионика
Прикладная наука о применении в технических устройствах исистемах принципов организации, свойств, функций и структур живой
природы, то есть формы живого в природе и их промышленные
аналоги. Проще говоря, бионика - это соединение биологии и техники.
Бионика рассматривает биологию и технику совсем с новой стороны,
объясняя, какие общие черты и какие различия существуют в природе и
в технике.
17. Биоремедиация
БиоремедиацияКомплекс методов очистки вод, грунтов и атмосферы с
использованием метаболического потенциала биологических
объектов — растений, грибов, насекомых, червей и других
организмов.
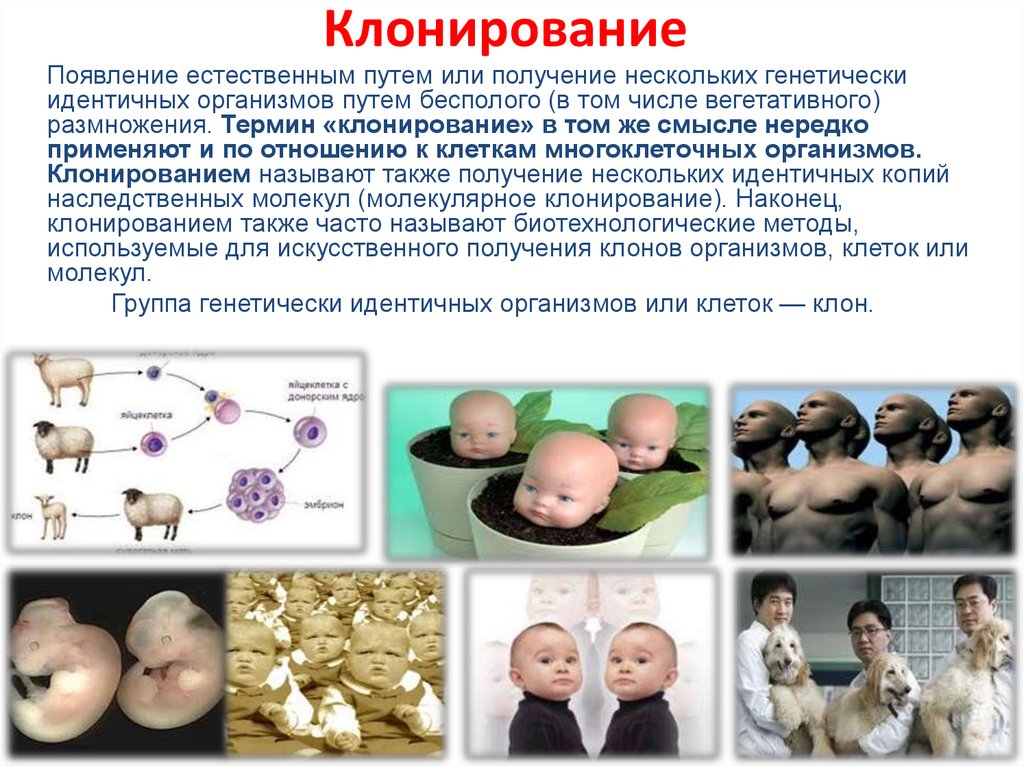
18. Клонирование
КлонированиеПоявление естественным путем или получение нескольких генетически
идентичных организмов путем бесполого (в том числе вегетативного)
размножения. Термин «клонирование» в том же смысле нередко
применяют и по отношению к клеткам многоклеточных организмов.
Клонированием называют также получение нескольких идентичных копий
наследственных молекул (молекулярное клонирование). Наконец,
клонированием также часто называют биотехнологические методы,
используемые для искусственного получения клонов организмов, клеток или
молекул.
Группа генетически идентичных организмов или клеток — клон.
19. гибридизация
Процесс образования или получения гибридов, в основе котороголежит объединение генетического материала разных клеток в одной
клетке. Может осуществляться в пределах одного вида
(внутривидовая гибридизация) и между
разными систематическими группами (отдалённая гибридизация, при
которой происходит объединение разных геномов).
Для первого поколения гибридов часто характерен гетерозис,
выражающийся в лучшей приспособляемости, большей плодовитости
и жизнеспособности организмов. При отдалённой гибридизации
гибриды часто стерильны.
20. Генная инженерия
Генная инженерия начала развиваться с 1973 года, когдаамериканские исследователи Стэнли Коэн и Энли Чанг
встроили бактериальную плазмиду в ДНК лягушки. Затем эту
трансформированную плазмиду вернули в клетку бактерии,
которая стала синтезировать белки лягушки, а также
передавать лягушачью ДНК своим потомкам. Таким образом,
был найден метод, позволяющий встраивать чужеродные
гены в геном определенного организма.
21. Развитие генной инженерии не могло не отразиться на производстве препаратов, способствующих скорейшему выздоровлению пациента.
Так, полученные путем все той жегенной инженерии, бактерии семейства Clostridium, введенные в
тело, растут и размножаются только в бедных кислородом
частях опухолей, которые являются наиболее сложно
излечимыми и по сей день.
С развитием генной инженерии
всё чаще стали проводить
различные опыты над
животными, в результате
которых ученые добивались
своеобразной мутации
организмов. Так, например,
компания «Lifestyle Pets»
создала с помощью генной
инженерии гипоаллергенного
кота, названного Ашера ГД. В
организм животного был введен
некий ген, позволявший
«обходить заболевания
стороной».
С помощью генной инженерии
исследователи из Университета
Пенсильвании представили новый
метод производства вакцин: с
помощью генетически
сконструированных грибов. В
результате был ускорен процесс
производства вакцин, что может,
по мнению пенсильванцев,
пригодиться в случае
биотеррористической атаки или
вспышки птичьего гриппа.
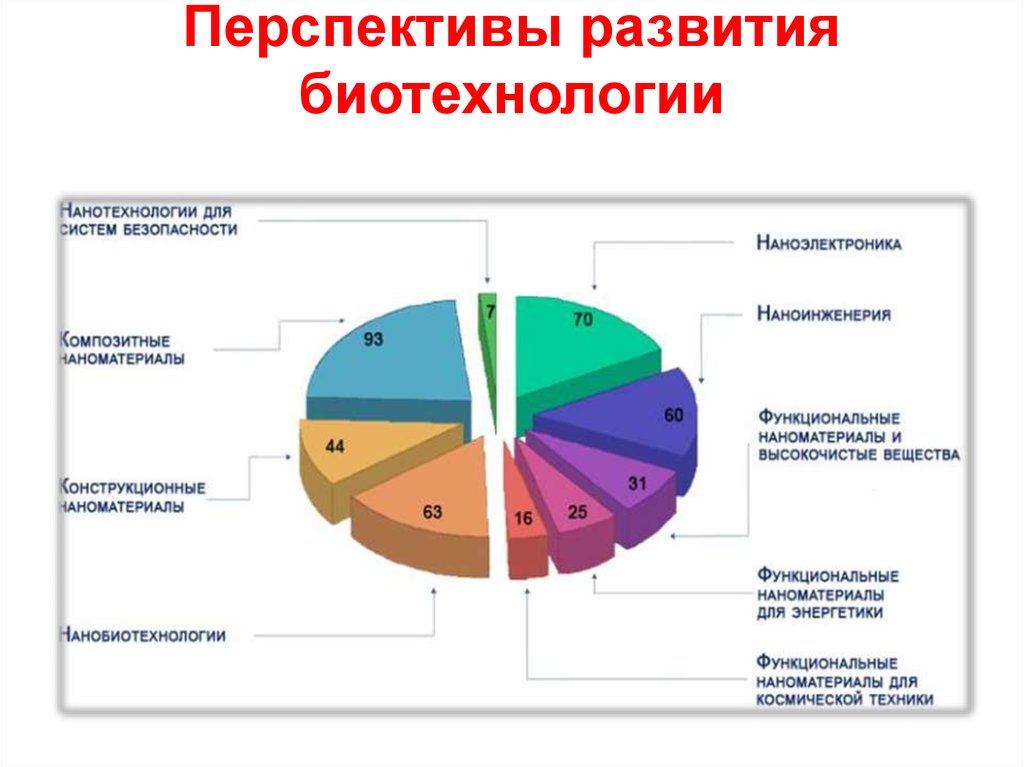
22. Перспективы развития биотехнологии
23. Лекция 2. ПОДБОР И КУЛЬТИВИРОВАНИЕ БИОТЕХНОЛОГИЧЕСКИХ ОБЪЕКТОВ
Главным звеном биотехнологического процесса являетсябиологический объект, способный осуществлять определенную
модификацию исходного сырья и образовывать тот или иной
необходимый продукт.
В качестве таких объектов биотехнологии могут выступать
клетки микроорганизмов, животных и растений, трансгенные
животные и растения, грибы, а также многокомпонентные
ферментные системы клеток и отдельные ферменты.
Основой большинства современных биотехнологических
производств является микробный синтез, т. е. синтез
разнообразных биологически активных веществ с помощью
микроорганизмов.
К сожалению, объекты растительного и животного происхождения в силу ряда
причин еще не нашли столь широкого применения. Поэтому в дальнейшем
целесообразно рассматривать микроорганизмы как основные объекты
биотехнологии.
24. Вопросы:
• Микроорганизмы как основные объектыбиотехнологии.
• Селекция биотехнологических объектов.
• Субстраты для культивирования
биологических объектов.
25.
• В настоящее время известно более 100 тысяч различныхвидов микроорганизмов - бактерии, актиномицеты,
цианобактерии.
• Во многих биотехнологических процессах используется
ограниченное число микроорганизмов, которые
классифицируются как GRAS ("generally recognized as
safe" обычно считаются безопасными).
• К ним относят бактерии Васillus subtilis, Васillus
amyloliquefaciens, другие виды бацилл и лактобацилл,
виды Streptomyces, а также виды грибов Aspergillus,
Penicillium, Mucor, Rhizopus, дрожжей Saccharomyces и
др.
• GRAS-микроорганизмы непатогенные, нетоксичные
и в основном не образуют антибиотики, поэтому
при разработке нового биотехнологического
процесса следует ориентироваться на данные
микроорганизмы, как базовые объекты
биотехнологии.
26. Требования к объекту
• Главным критерием при выборебиотехнологического объекта является способность
синтезировать целевой продукт.
• Помимо этого микроорганизмы должны обладать
высокой скоростью роста, утилизировать
необходимые для их жизнедеятельности дешевые
субстраты, быть резидентными к посторонней
микрофлоре, т.е., обладать высокой
конкурентоспособностью.
• Все вышеперечисленное обеспечивает значительное
снижение затрат на производство целевого
продукта.
27. Преимущества микроорганизмов:
• Одноклеточные организмы характеризуются более высокимискоростями роста и синтетических процессов, чем высшие
организмы.
• Интересны фотосинтезирующие микроорганизмы: часть из них
(цианобактерии и фотосинтезирующие эукариоты) в качестве
источника углерода утилизируют СО2, а некоторые представители
цианобактерий обладают способностью усваивать атмосферный
азот (т.е. являются крайне неприхотливыми к питательным
веществам). Фотосинтезирующие микроорганизмы перспективны
как продуценты аммиака, водорода, белка и ряда органических
соединений.
• Вызывают интерес термофильные микроорганизмы, растущие при
60-80°С. Это их свойство является практически непреодолимым
препятствием для развития посторонней микрофлоры, что
является надежной защитой от загрязнений. Среди термофилов
обнаружены продуценты спиртов, аминокислот, ферментов,
молекулярного водорода.
• Кроме того, скорость их роста и метаболическая активность в 1,5-2
раза выше, чем у мезофилов.
28.
• Ферменты, синтезируемые термофилами, характеризуютсяповышенной устойчивостью к нагреванию, некоторым
окислителям, детергентам, органическим растворителям и другим
неблагоприятным факторам. В то же время они мало активны при
обычных температурах.
• Так, протеазы одного из представителей термофильных
микроорганизмов при 20°С в 100 раз менее активны, чем при
75°С. Последнее является очень важным свойством для некоторых
промышленных производств. Например, широкое применение в
генетической инженерии нашел фермент Tag-полимераза из
термофильной бактерии Thermus aquaticus.
• При их культивировании температура среды, в которой они
пребывают, значительно превышает температуру окружающей
среды.
• Данный высокий перепад температур обеспечивает быстрый и
эффективный обмен тепла, что позволяет использовать
биологические реакторы без громоздких охлаждающих устройств.
А последнее, в свою очередь, облегчает перемешивание,
аэрацию, пеногашение, что в совокупности значительно
удешевляет процесс.
29.
Селекция биотехнологических объектов30.
31.
32.
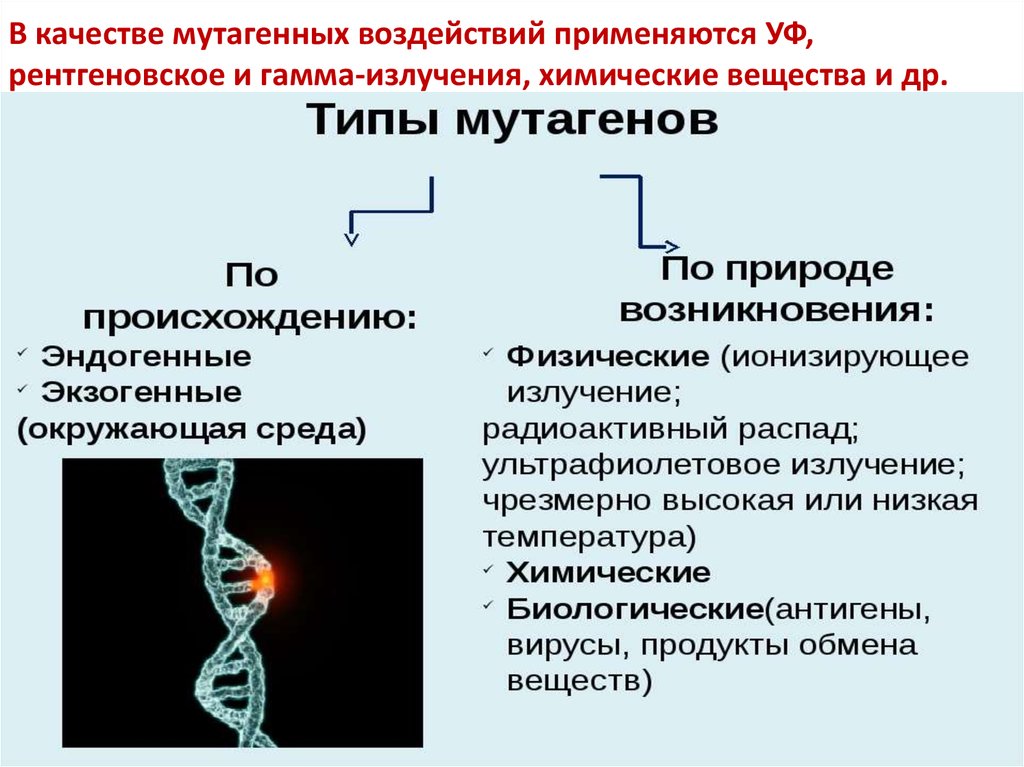
33. В качестве мутагенных воздействий применяются УФ, рентгеновское и гамма-излучения, химические вещества и др.
34. Субстраты для культивирования биообъектов
• Питательные среды для выращиванияобъектов биотехнологии, т.е. продуцентов тех
или иных соединений, могут быть
неопределенного состава и включать
различные биогенные добавки (растительные,
животные или микробные) – мясной экстракт,
кукурузную муку, морские водоросли и т. п.
• Применяются среды из чистых химических
соединений определенного состава, так
называемые синтетические.
35.
Компонентный состав сред определяется питательнымипотребностями продуцента. Во многих процессах
используют в качестве объектов гетеротрофные организмы,
которые в настоящее время подразделяются на:
органоавтотрофы
литогетеро
трофы
органогетеротрофы
• употребляющие органические вещества
как источники энергии
• использующие органические вещества
как источники углерода
• для которых органические вещества
служат и источниками энергии, и
источниками углерода
36. Требования к субстрату:
Сырье для получения целевого продукта должнобыть:
• недефицитным,
• дешевым,
• по возможности легкодоступным
Хорошо утилизируемым источником углерода для
биотехнологических целей является растительная
биомасса и, в меньшей степени, биомасса
животных организмов.
Растительные источники могут рассматриваться как
практически неистощимые. Наибольшая доля
биомассы образуется в виде древесины.
37. Природные сырьевые материалы
• Источником природного сырья являются сельскоехозяйство и отрасли лесоводства. Получаемые в этих
отраслях материалы представляют собой соединения
различной химической сложности и включают сахара,
крахмал, целлюлозу, гемицеллюлозу и лигнин.
• Наиболее подходящим и доступным питательным
субстратом для биотехнологических процессов является
сырье, используемое в производстве сахара – сахарная
свекла и сахарный тростник и крахмалосодержащие
сельскохозяйственные продукты, включающие
различные злаки, такие как кукуруза, рис, пшеница,
картофель, различные корнеплоды, сладкий картофель.
38.
• Половину высушенной растительной массы каксельскохозяйственного, так и "лесного" происхождения
составляет один из самых распространенных
биополимеров – полисахарид целлюлоза, являющийся
ценным источником энергии и углерода.
• Чистая целлюлоза может быть довольно легко
разрушена путем химического или
ферментативного гидролиза до растворимых
сахаров, которые затем легко подвергаются
ферментации (сбраживанию) микроорганизмами с
образованием этанола, бутанола, ацетона,
одноклеточного белка, метана и многих других
продуктов.
• Наибольшие трудности встречаются при попытках
утилизации древесины, в которой целлюлоза
находится в комплексе с гемицеллюлозой и лигнином.
Лигноцеллюлозные комплексы характеризуются очень
высокой степенью устойчивости к биодеградации.
39. Использование побочных продуктов в качестве сырья для биотехнологии
Одной из главных задач биотехнологии является максимальноеиспользование огромных объемов органических отходов, повсеместно
образующихся в мировом производстве.
Биотехнологическая утилизация этих отходов:
1.обеспечит удаление источников загрязнения
(например, сточных вод),
2.обусловит превращение этих отходов в
полезные целевые продукты.
Так, многие побочные материалы пищевой промышленности оказываются
экономически малозначащими и часто выбрасываются в магистральные
водные системы, обусловливая мощное загрязнение внешней среды. В связи
с этим, весьма перспективной может быть разработка технологии их
утилизации в качестве биотехнологического сырья, с извлечением двойной
выгоды.
40.
Широко распространенными видамиотходов, которые нашли уже сейчас
применение в биотехнологических
процессах в качестве сырья для
ферментации, являются меласса (черная
патока) и молочная сыворотка.
Меласса представляет собой
побочный продукт, появляющийся
при производстве сахара, и содержит
до 50 % сахаров.
Меласса широко используется как питательный
субстрат для ферментационных процессов в
производстве антибиотиков, органических
кислот и коммерческих дрожжей для
хлебопечения; помимо этого, она используется
в чистом виде в качестве добавки в корма
животным.
41. Сыворотка, получаемая при производстве сыра, также может быть использована в качестве питательного субстрата для ферментации.
42.
Более сложные продуктыотходов, такие, как солома и
жом (отход сахарного
производства), также
имеющиеся в больших
количествах и во многих местах,
по мере улучшения процессов
расщепления лигноцеллюлозных
соединений все больше находят
применение в
биотехнологических
производствах.
43. Химические и нефтехимические субстраты
• Наилучшим субстратом из компонентов нефти являютсян-алканы с числом углеродных атомов от 10 до 20. Их
могут утилизировать большинство бактерий и дрожжи.
• Однако нефть и газ истощаются. Поэтому
биотехнологии ориентируются на возобновляемые
источники сырья.
• Большое внимание уделяется различным видам
растительной массы: плоды, соки, клубни, травяная
масса и древесина. Используются также отходы
сельского хозяйства, деревообрабатывающей и
бумажной промышленности, а также многих отраслей
пищевой промышленности.
• Возможность использования перечисленных сырьевых
материалов является основой создания безотходных
производств.
44.
45. ЛЕКЦИЯ 3. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ: ПРОЦЕССЫ ПРОИЗВОДСТВА ПОЛЕЗНЫХ ВЕЩЕСТВ
Промышленная микробиология – это наука ополучении различных целевых продуктов на основе
жизнедеятельности микроорганизмов.
В настоящее время в различных процессах
промышленной микробиологии получают около 200
соединений, обладающих коммерческой ценностью.
Важнейшими среди них являются: алкалоиды, аминокислоты,
антибиотики, антиметаболиты, антиоксиданты, белки, витамины,
гербициды, инсектициды, коферменты, липиды, нуклеиновые
кислоты, органические кислоты, пигменты, ПАВ, полисахариды,
полиоксиалканаты, противоопухолевые агенты, растворители, сахара,
стерины, ферменты, нуклеотиды, нуклеозиды, эмульгаторы.
46.
47.
48. Вопросы:
Белок одноклеточных.
Аминокислоты.
Органические кислоты.
Витамины.
Антибиотики.
49. Белок одноклеточных
• Наиболее дефицитным компонентом пищиявляется белок, в особенности, белок животного
происхождения. Мировая потребность в белке в
настоящее время удовлетворяется примерно на 40
%.
• По многим важным показателям биомасса
микроорганизмов может обладать весьма высокой
питательной ценностью. В немалой степени эта
ценность определяется белками: у большинства
видов он составляет значительную долю сухой
массы клеток. Качество микробных белков близко
белкам животного происхождения.
50.
• Применение микробных белков вкормопроизводстве улучшает качество и
усвояемость традиционных растительных
кормов.
• Например, 1 т кормовых дрожжей обеспечивает
экономию 5 т зерна и увеличивает
продуктивность в животноводстве на 15-30 %.
• Современный средний завод по производству
микробного белка мощностью 50 т/год и
занимающий 0.2 га может обеспечить
потребность в белке до 10 млн. человек.
Сельскохозяйственные технологии для таких
масштабов производства требуют до 16 тыс. га,
засеянных пшеницей, либо содержание фермы с
производительностью 400 поросят/день.
51.
52.
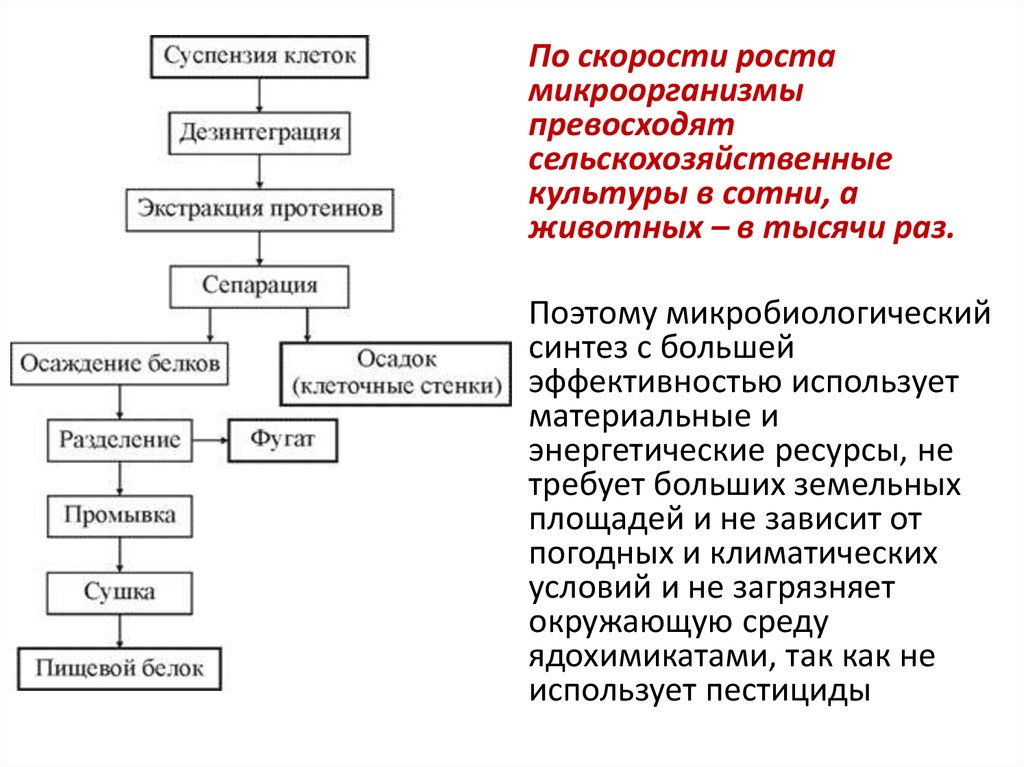
• По скорости ростамикроорганизмы
превосходят
сельскохозяйственные
культуры в сотни, а
животных – в тысячи раз.
• Поэтому микробиологический
синтез с большей
эффективностью использует
материальные и
энергетические ресурсы, не
требует больших земельных
площадей и не зависит от
погодных и климатических
условий и не загрязняет
окружающую среду
ядохимикатами, так как не
использует пестициды
53.
Микроорганизмы способны усваивать различныеуглеродсодержащие субстраты, которые принято
подразделять на несколько поколений:
• 1-е поколение – углеводы;
• 2-е поколение – жидкие углеводороды;
• 3-е поколение – оксидаты углеводородов,
газообразные углеводороды, углекислый газ,
включая смеси с водородом.
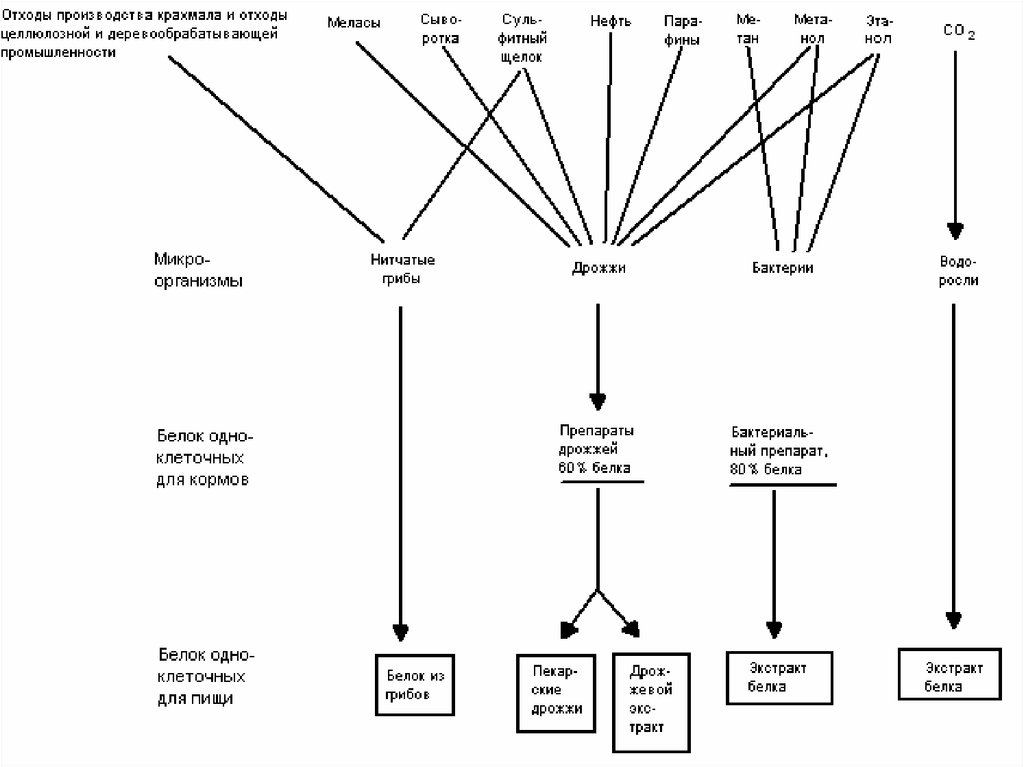
Независимо от вида используемого сырья, типовая
схема микробиологического производства белка
включает получение и подготовку сырья, получение
посевного материала, ферментацию, выделение,
инактивацию, сгущение микробной биомассы,
последующее высушивание и стандартизацию
готового продукта.
54. Субстраты 1-го поколения – углеводы
• Идею использования биомассы микроорганизмов в качествебелковых компонентов питания с 1890 г. начал пропагандировать
Дельбрюк, который вместе с коллегами разработал первый
технологический процесс выращивания пивных дрожжей
Saccharomyces cerevisiae. Полученную дрожжевую биомассу
рекомендовали использовать в качестве белковой добавки в
пищевые продукты.
• Во время первой мировой войны мощность действующих в
Германии установок по производству дрожжевого белка
достигала 10 тыс. тонн/г. Получаемый продукт использовали
главным образом, добавляя в мясные фарши.
• В настоящее время в микробиологических производствах белка
применяется различное сахаросодержащее сырье. Это отходы
пищевой, молочной, спиртовой, сахарной и целлюлозной
промышленности и продукты переработки растительного сырья
(древесины, соломы, торфа, несъедобных частей растений –
стебли, лузга, кочерыжки). Наибольшее распространение получили
виды дрожжей рода Candida: C. utilis, C. scottii, C. tropicalis,
способные утилизировать наряду с гексозами пентозы и
толерантные к наличию фурфурола в среде.
55. Субстраты 2-го поколения – жидкие углеводороды
• Способность микроорганизмов использовать вкачестве основного ростового субстрата
углеводороды была доказана Таусоном в 1935 г.
Было установлено, что микроорганизмами
могут усваиваться практически все классы
углеводородов, включая прямогонные
дизельные фракции, очищенные жидкие
парафины, масляные дистилляты и другие
нефтепродукты, содержащие парафины.
• В качестве штаммов-продуцентов белка
одноклеточных на углеводородах
наибольшее распространение получили
дрожжи рода Candida – С. Maltosa, С. Scottii.
56. Субстраты III-го поколения - оксидаты углеводородов, газообразные углеводороды, углекислота, водород
Субстраты III-го поколения - оксидаты углеводородов,
газообразные углеводороды, углекислота, водород
Перспективными видами сырья для крупнотоннажного
получения микробного белка принято считать спирты,
природный газ, водород.
Масштабы производства, технологичность низших
спиртов и качество получаемого микробного белка
выдвинули метанол и этанол в разряд наиболее
перспективных субстратов. Исследование процессов
микробного синтеза на спиртах с середины 70-х годов
были развернуты всеми развитыми странами. Было
показано, что способность усваивать метанол присуща
как дрожжам (Candida), так и бактериям (Pseudomonas,
Methylomonas).
Усвоение метанола микроорганизмами происходит в
результате 3-х последовательных стадий через
формальдегид и формиат до углекислоты:
СН3ОН → НСОН → НСООН → О2.
57.
• В середине 70-х годов активизировалисьисследования, направленные на разработку
технологий получения микробного белка с
использованием хемолитоавтотрофных
микроорганизмов.
• Хемолитоавтотрофные водородокисляющие
бактерии, использующие в качестве источника
углерода углекислоту, а энергии – реакцию
окисления водорода образуют биомассу (СН2О) по
схеме:
6 Н2 + 2 О2 + СО2 = (СН2О) + 5 Н2О,
• Перспективность водородокисляющих бактерий
определяется их автотрофией и независимостью от
дефицитных источников органического сырья,
быстрым ростом, высоким содержанием
полноценного по аминокислотному составу белка,
отсутствием внеклеточных промежуточных
продуктов обмена органической природы
58. Аминокислоты
Аминокислоты с каждым годом находят все большееприменение в качестве кормовых и пищевых добавок и
приправ, сырья фармацевтической и парфюмерной
промышленности.
• Около 30 % производимых аминокислот используется в
пищевой промышленности. Так, цистеин предотвращает
пригорание пищи в процессе приготовления, улучшает
качество хлеба при выпечке, усиливает запах пищи.
Глицин, обладающий освежающим, сладковатым вкусом,
используется при производстве напитков. Глутаминовая
кислота – для усиления вкуса и консервирования пищи.
• Ряд аминокислот (аргинин, аспартат, цистеин,
фенилаланин и др.) используют в медицине, в химической
и фармацевтической промышленности в качестве
предшественников для производства детергентов,
полиаминокислот, полиуретана и препаратов для
сельского хозяйства
59. Получение аминокислот возможно несколькими путями:
• химическим синтезом;• гидролизом природного белкового сырья;
• в биотехнологических процессах.
Химический синтез дает рацемат-продукт,
содержащий как L-, так и D-формы аминокислот. За
исключением глицина, который не имеет оптически
активных изомеров, и метионина, усвояемого
организмами в обеих формах, D-изомеры обладают
токсичностью.
Получение оптически активных L-изомеров
аминокислот из гидролизатов природных материалов
растительного и животного происхождения связано с
многоступенчатой и дорогостоящей очисткой.
60.
Микробиологический метод получения аминокислот, наиболеераспространенный в настоящее время, основан на способности
микроорганизмов синтезировать все L-аминокислоты, а в
определенных условиях – обеспечивать их сверхсинтез.
• Биосинтез аминокислот в микробных клетках протекает в виде так
называемых свободных аминокислот или «пула аминокислот», из
которого в процессах конструктивного метаболизма
синтезируются клеточные макромолекулы. Для синтеза всех
белков требуется 20 аминокислот. Пути синтеза большинства
аминокислот взаимосвязаны.
• При этом одни кислоты являются предшественниками для
биосинтеза других.
• Пируват является предшественником аланина, валина, лейцина;
• 3-фосфоглицерат – серина, глицина, цистеина;
• щавелево-уксусная кислота – аспартата, аспарагина, метионина,
лизина, треонина, изолейцина;
• α-кетоглутаровая кислота – глутамата, глутамина, аргинина,
пролина;
• фосфоэнолпируват+эритрозо-4-фосфат – фенилаланина, тирозина,
триптофана;
• 5-фосфорибозил-1-пирофосфат + АТФ – гистидина.
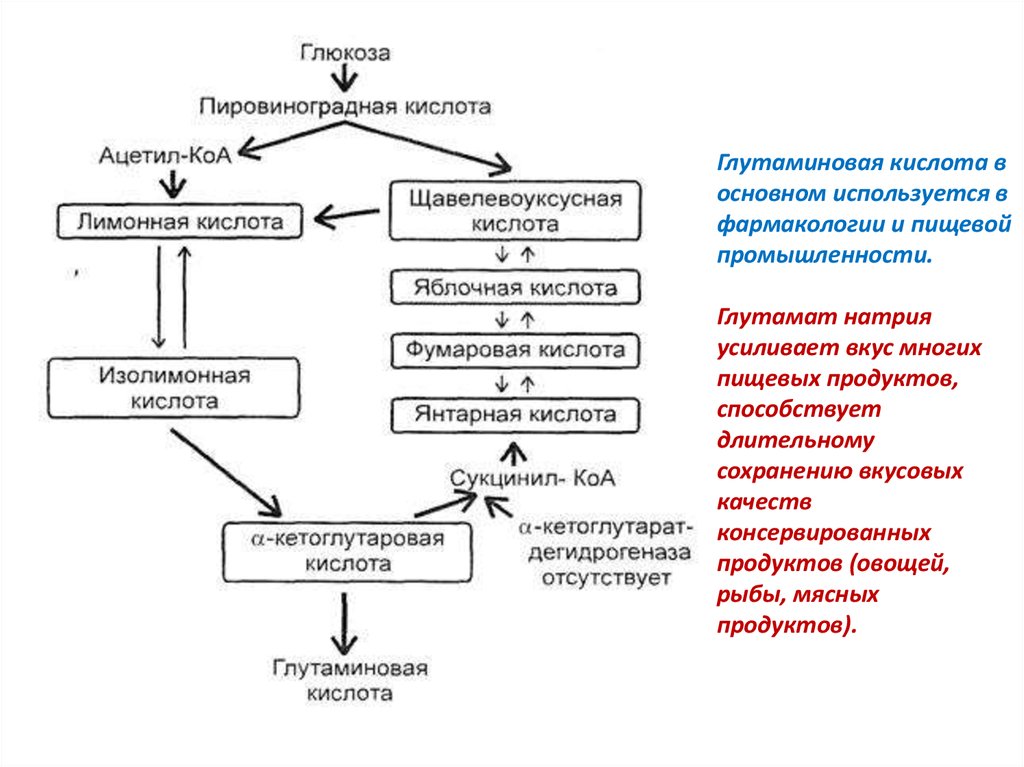
61. Технология получения глутаминовой кислоты
L-глутаминовая кислота (α-аминоглутаровая) – перваяаминокислота, полученная на основе промышленного
микробиологического синтеза: НООС–СН2–СН2–NН2СН–СООН
• Глутаминовая кислота является важнейшей аминокислотой
растительных и животных белков, не будучи незаменимой. Синтез
глутаминовой кислоты происходит в цикле трикарбоновых кислот
в результате ферментативного восстановительного аминирования
2- кетоглутаровой кислоты НАДФ-зависимой
глутаматдегидрогеназой. 2-кетоглутаровая кислота образуется в
свою очередь из изолимонной кислоты под воздействием
изоцитратдегидрогеназы. Необходимый для синтеза
глутаминовой кислоты НАД(Ф)Н постоянно регенерируется в
процессе окисления изолимонной кислоты в 2-кетоглутаровую.
Возможность получения глутаминовой кислоты из углеводов на
основе микроорганизмов впервые была продемонстрирована в
1957 г. японскими исследователями Киносита, Асаи и др.
Продуцировать глутаминовую кислоту способны дрожжи,
микроскопические грибы, бактерии. Бактерии обеспечивают
наибольший выход по отношению к использованному
углеродному субстрату (не менее 40-50 %).
62.
Глутаминовая кислота восновном используется в
фармакологии и пищевой
промышленности.
Глутамат натрия
усиливает вкус многих
пищевых продуктов,
способствует
длительному
сохранению вкусовых
качеств
консервированных
продуктов (овощей,
рыбы, мясных
продуктов).
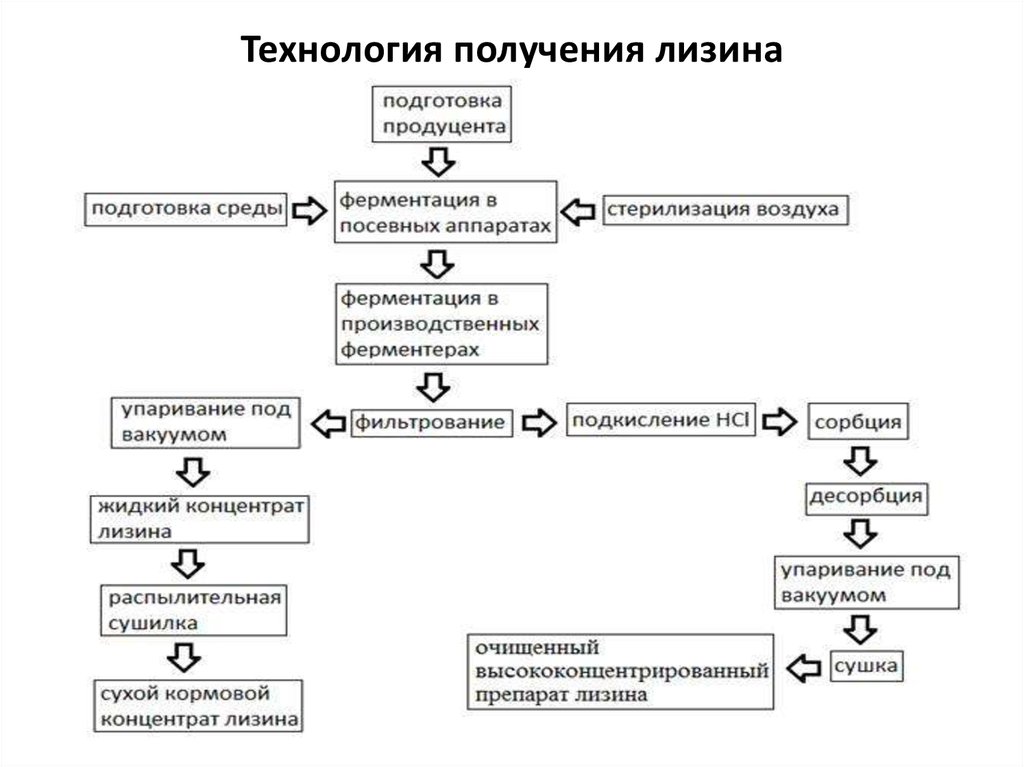
63. Технология получения лизина
L-Лизин (СН2NН2–(СН2)3–NН2СН–СООН) в организмевысших животных и человека определяет
биологическую ценность переваримого белка.
• Данная аминокислота способствует секреции
пищеварительных ферментов и транспорту кальция в
клетки, улучшает общий азотный баланс в организме.
• Синтез L-лизина у микроорганизмов осуществляется
различными путями. Дрожжи, грибы и микроводоросли
синтезируют лизин из α-кетоглутаровой кислоты.
• Производственные штаммы-продуценты лизина – это
ауксотрофные штаммы глутаматпродуцирующих
коринебактерий (Corynebacterium glutamaticum).
• Эффективный процесс получения лизина реализован на
более доступном субстрате – уксусной кислоте.
64. Технология получения лизина
65. Технология получения триптофана
L-Триптофан относится к незаменимым аминокислотам.• Триптофан, наряду с другими ароматическими
аминокислотами, фенилиаланином и тирозином, в
последние годы находит все большее применение.
• Отсутствие или дефицит триптофана в организме
приводит к ряду тяжелых заболеваний (диабет,
туберкулез и т.д. Используется триптофан в
биохимических исследованиях, в небольших
количествах – в животноводстве.
• Микробиологический синтез L-триптофана
осуществляют на основе мутантных штаммов дрожжей
(Candida) и бактерий (E. coli, Bacillus), дефицитных по
тирозину и фенилаланину. Промышленный синтез Lтриптофана осуществляется на основе сахаров.
66. Органические кислоты
• Органические кислоты широко используют впищевой и фармацевтической промышленности, в
технике и в качестве химического сырья.
• Отдельные органические кислоты (лимонную,
яблочную) можно получать экстракцией из
природного растительного сырья; другие (уксусную,
молочную) – в процессах органического синтеза.
• Более 50 органических кислот могут быть получены
на основе микробиологического синтеза.
67.
• Органические кислоты в системе микробногометаболизма являются продуктами деградации
источника энергии и углерода.
• Лимонная, изолимонная, кетоглутаровая, янтарная,
фумаровая и яблочная кислоты – интермедиаты
цикла трикарбоновых кислот у большинства
аэробных микроорганизмов.
• Глюконовая, кетоглюконовая и винная кислоты –
промежуточные продукты прямого окисления
глюкозы (без фосфорилирования) некоторых
аэробных бактерий и грибов.
• Молочная, масляная и пропионовая кислоты
являются конечными продуктами метаболизма
углеводов у анаэробных бактерий.
• Уксусная кислота – продукт окисления этанола;
68.
• Большинство органических кислот получают,лимитируя рост клеток-продуцентов
дефицитом азота или фосфора при избытке
углеродсодержащего субстрата.
Все микробиологические процессы
получения органических кислот – двухфазные:
1 фаза – так называемый сбалансированный
рост при максимальном накоплении биомассы;
2 фаза – замедление скорости роста клеток. В
результате этого прирост биомассы
прекращается и начинается интенсивное
кислотообразование.
• В качестве продуцентов используют
бактериальные, дрожжевые и грибные
культуры (Lactobacillus, Aspergillus, Candidia,
Penicillium).
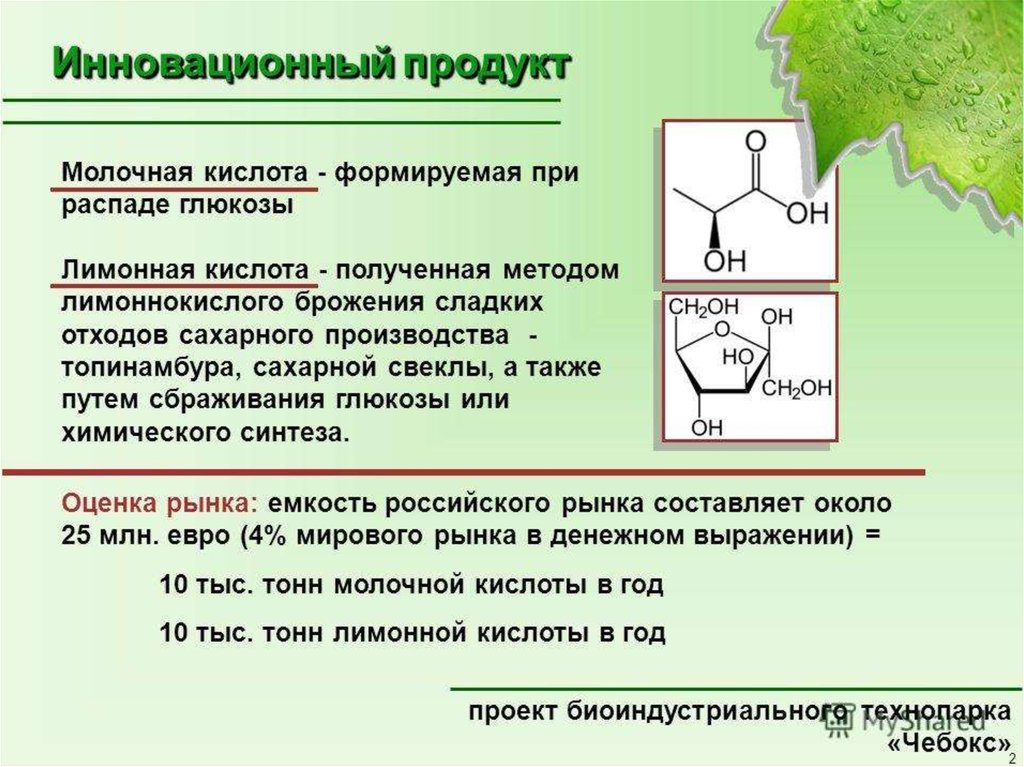
69. Получение лимонной кислоты
• Лимонная кислота (СН2 –СООН–СОНСООН–СН2СООН) – трехосновная оксикислота,
широко распространенная в плодах и ягодах.
• Лимонная кислота была идентифицирована в
качестве продукта метаболизма плесневых
грибов в 1893 г. Вемером.
• В настоящее время это кислота по объемам
производства (свыше 350 тыс. т/г) занимает
первое место среди всех органических кислот.
70.
• У микроорганизмов синтез лимонной кислотыреализуется в цикле дикарбоновых кислот. Образуемая
в результате гликолиза пировиноградная кислота
связывается с углекислотой; синтезируемая при этом
щавелевоуксусная кислота реагирует с уксусной
кислотой с образованием лимонной кислоты, то есть
образование лимонной кислоты включает реакции
гликолиза и ряд реакций цикла Кребса. При каждом
обороте цикла молекула щавелевоуксусной кислоты
взаимодействует с уксусной, образуя лимонную
кислоту.
• В промышленном производстве лимонной кислоты в
качестве продуцента в основном используют Aspergillus
niger, но также применяют и А.wentii.
• Сверхсинтез лимонной кислоты реализуется при
больших концентрациях сахаров в среде (14-24 %) и
является ответной реакцией продуцента на дефицит
фосфора, а также других металлов.
71. Получение молочной кислоты
Молочная кислота – органическая кислота,образуемая в результате анаэробного превращения
углеводов молочнокислыми бактериями. В 1847 г. С.
Блодно доказал, что данная кислота является
продуктом брожения, а Л. Пастер установил, что этот
процесс вызывают бактерии.
Образование молочной кислоты из глюкозы
возможно несколькими путями:
1. при сбраживании глюкозы молочнокислыми
бактериями;
2. гетероферментный путь – распад глюкозы до
пировиноградной кислоты и восстановление
последней до молочной кислоты.
72.
• Применяют молочную кислоту в пищевойпромышленности для получения напитков,
мармеладов, в процессах консервирования, а также
в кормопроизводстве. Соли молочной кислоты
используют в фармацевтике.
• Промышленное производство молочной кислоты
начато в конце ХIХ века с участием молочнокислых
бактерий Lactobacillus.
• Молочнокислое брожение протекает в анаэробных
условиях, однако лактобациллы относятся к
факультативным анаэробам, поэтому при
ферментации воздух полностью не удаляют из
ферментеров.
• В качестве сырья используют тростниковое сырье и
гидролизаты крахмала, при этом концентрация
сахаров в исходной среде в зависимости от
характера брожения составляет примерно от 5 до
20 %.
73.
74. Получение уксусной кислоты
Уксусная кислота (СН3СООН) – широко используется впищевой, химической, микробиологической
промышленности, в медицине. Получение уксусной
кислоты из спиртосодержащих жидкостей было
известно более 10 тыс. лет назад.
• Уксуснокислое брожение основано на способности
уксуснокислых бактерий окислять спирт кислородом
воздуха с участием алкогольдегидрогеназы в
уксусную кислоту:
СН3СН2ОН + О2 → СН3СООН + Н2О, при этом из 1 моля
этанола образуется моль уксусной кислоты.
• Данный процесс могут реализовать многие бактерии,
но в промышленных технологиях для получения
уксуса используют уксуснокислые бактерии рода
Acetobacter, интерес представляют также бактерии
Gluconobacter.
75.
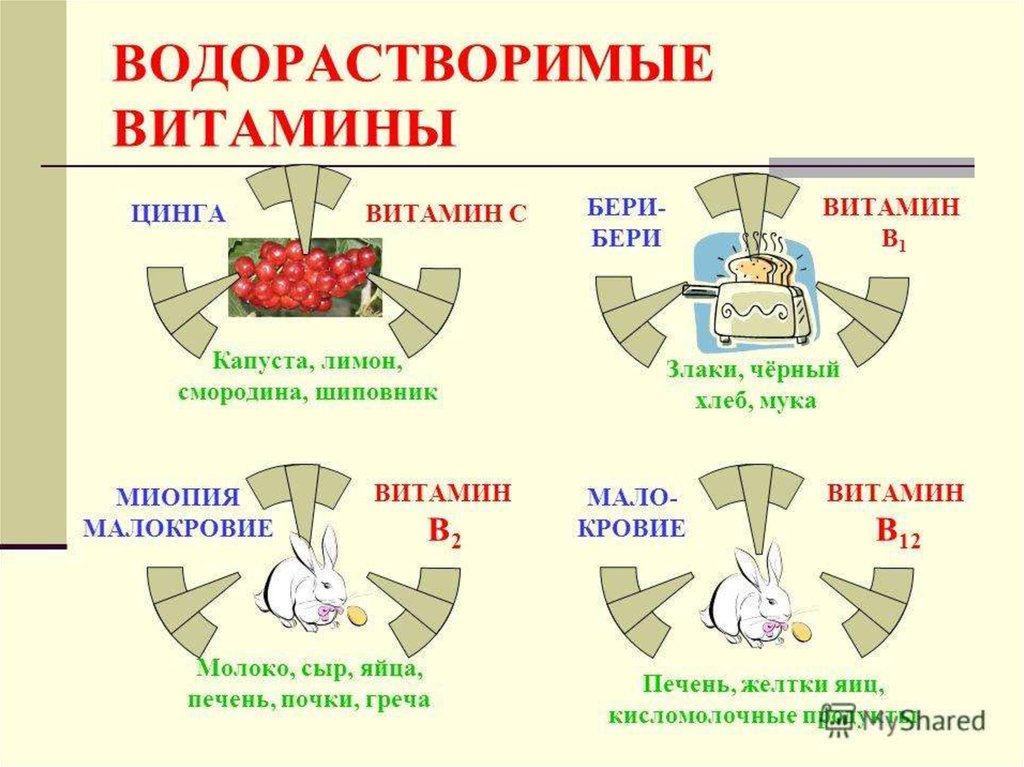
76. Витамины
• Витамины – это низкомолекулярные органическиевещества, способные в очень низких концентрациях
оказывать сильное и разнообразное действие.
• Природным источником многих витаминов
являются растения и микроорганизмы.
• В настоящее время в производстве многих
витаминов ведущие позиции принадлежат
химическому синтезу, однако при производстве
отдельных витаминов микробный синтез имеет
огромное значение, например при производстве
кормовых препаратов витаминов.
77.
78. Микробиологическим путем получают некоторые витамины группы В, а также эргостерин и каротин, являющиеся, соответственно,
предшественникамивитаминов Д2 и
провитамина А.
Отдельные
витамины кобаламины
продуцируются
только микробными
клетками.
79. Получение витамина В2
• Вначале этот витамин выделяли из природного сырья(в максимальных концентрациях он присутствует в
моркови и в печени). Затем был разработан как
химический, так и микробиологический способы
промышленного синтеза.
• Для рибофлавина характерно функционирование в
коэнзимных формах: ФМН (флавиномононуклеотид) и
ФАД (флавиноадениндинуклеотид).
• Источники рибофлавина – высшие растения,
дрожжи, мицелиальные грибы. Все они способны
синтезировать рибофлавин. Животные, не
синтезирующие этот витамин, должны получать
его в виде комбикормов.
80.
• Продуцентами витаминаявляются бактерии
(Microccocus glutamaticus),
дрожжи (Candida flaveri) и
плесневые грибы
(Aspergillus niger).
• Для медицинских целей
микробиологический
рибофлавин получают на
основе гриба Aspergillus.
Ферментацию проводят в
течении 7 суток при 28°С и
хорошей аэрации (0,3
м3/м3-мин.). Кристаллы
рибофлавина
накапливаются в гифах и
вне мицелия.
81. Получение витамина В12
• Этот витамин был открыт одновременно в США и вАнглии.
• Он регулирует углеводный и липидный обмен,
участвует в метаболизме незаменимых
аминокислот, пуриновых и пиримидиновых
оснований, стимулирует образование
гемоглобина, применяется для лечения
злокачественной анемии, лучевой болезни,
заболеваний печени и в других случаях.
• Сначала витамин В12 получали исключительно из
природного сырья (1 тонна печени – 15 милиграмм
витамина).
• Единственный способ его получения в настоящее
время – это микробиологический синтез в
промышленном масштабе.
82.
• Продуцентом витамина В12 являютсяпропионовокислые бактерии из рода Propionibacterium.
• Выращивание пропионовых бактерий производится
периодическим методом в анаэробных условиях на
среде с кукурузным экстрактом, глюкозой, солями
кобальта и сульфатом аммония. Образующиеся
кислоты нейтрализуются щелочью. Через 72 часа после
начала ферментации вносят предшественники
витамина.
• Длительность ферментации – трое суток. Полученную
массу сепарируют, стабилизируют нитритом натрия,
охлаждают, нейтрализуют, коагулируют белки и
фильтруют. Очищают на ионообменной смоле,
кристаллизуют и проводят химическую очистку
продукта.
83. Антибиотики
• Антибиотики (антибиотические вещества) – этопродукты обмена микроорганизмов,
избирательно подавляющие рост и развитие
бактерий, микроскопических грибов,
опухолевых клеток.
• В научную литературу термин введен в 1942 г.
Ваксманом, – «антибиотик – против жизни».
• В настоящее время описано свыше 6000
антибиотиков, но на практике применяется
только около 150, так как многие обладают
высокой токсичностью для человека, другие –
инактивируются в организме и пр.
84.
85. По спектру биологического действия антибиотики делятся:
– антибактериальные, обладающие сравнительно узкимспектром действия (пенициллин, эритромицин,
грамицидин, бацитрацин), подавляют развитие
грамположительных микроорганизмов (стафилококки,
стрептококки, пневмококки), и широкого спектра действия
(стрептомицин, тетрациклины, неомицин, хлоромицетин),
подавляющие как грамположительных, так и
грамотрицительных микроорганизмов (кишечную
палочку, дифтерии, брюшного тифа);
– противогрибковые, группа полиеновых антибиотиков
(нистатин, гри-зеофульвин и др.), действующие на
микроскопические грибы;
– противоопухолевые (актиномицины, митомицин и др.),
действующие на опухолевые клетки человека и животных,
а также на микроорганизмы.
86. Механизмы повреждающих воздействий антибиотиков на клетки
пенициллины, новобиоцин, цефалоспорины подавляют процессы образования клеточныхстенок;
стрептомицин, полимиксины - изменяют
проницаемость мембран;
грамицидины - подавляют окислительное
фосфорилирование;
хлорамфеникол - подавляет отдельные этапы
синтеза белка на рибосомах;
азасерин и сарколизин – вызывают нарушения в
процессах синтеза нуклеиновых кислот и т.д.
87.
Описано около 600 антибиотиков, которыесинтезируются бактериями.
Эти антибиотики по химическому строению принадлежат к
полипептидам и низкомолекулярным белкам.
Однако в промышленных масштабах выпускается
незначительное число антибиотиков
бактериального происхождения.
Важнейшими их них являются:
грамицидин (Bacillus brevis),
полимиксины (Bacillus polymyxa),
бацитрацины (Bacillus licheni-formis),
низины (Streptococcus lactis).
88.
89.
90.
Самое большое количество (свыше 70 %) антибиотиков,выпускаемых промышленностью синтезируется
актиномицетами. Среди них – антибиотики различного
химического строения, которые относят к нескольким
группам:
1. аминогликозиды – стрептомицин (Streptomyces griseus),
неомицины (Streptomyces fradiae, Str. albogriseolus), канамицины
(Str. kanamyceticus), гентамицины (Micromonospora purpurea) и
др.;
2. тетрациклины – хлортетрациклин (Str. aureofaciens),
окситетрациклин (Str. rimosus);
3. актиномицины – большая группа близких по строению
препаратов, синтезируемых различными микроорганизмами, в
том числе (Streptomyces antibioticus, Str. chrysomallus, Str. flavus);
4. макролиды – эритромицин (Streptomyces erythreus),
олеандоимицин (Str. antibioticus), магнамицин (Str. halstedii),
филипин (Str. filipensis);
5. анзамицины – стрептоварицины (Str. spectabilis), рифамицины
(Nocardia mediterranea), галамицины (Micromonospora
halophytica), нафтамицин (Str. collinus) и др.
91.
92. Мицелиальные грибы также синтезируют большое количество антибиотиков (около 1200).
Наиболее известны среди них следующие:• пенициллины (Penicillium chrysogenum, P.
brevicompactum, Aspergillus flavus, Asp.
nidulans);
• цефалоспорины (Cephalosporium
acremonium), фумалгин (Aspergillus
fumigatus), гризеофульвин (Penicillium
nigricans, P. griseofulvum), трихоцетин
(Trichthecium roseum).
93.
94.
Синтез антибиотиков микробными клетками – это специфическийпроцесс обмена веществ, возникший и закрепленный в процессе
эволюции организма. Каждый микробный вид способен образовывать
один или несколько вполне определенных антибиотических веществ.
Выделенные из природных источников, так называемые «дикие»
штаммы обладают низ кой антибиотической активностью.
В промышленности применяют в качестве продуцентов штаммы,
которые по сравнению с исходными штаммами обладают
повышенной на 2–3 порядка антибиотической активностью.
Это достигается двумя способами:
• генетическими усовершенствованиями организмов;
• оптимизацией условий ферментации.
Антибиотики – это вторичные продукты обмена
микроорганизмов.
Характерная особенностью развития продуцентов
антибиотических веществ – ярко выраженная двухфазность:
• 1 фаза развития микроорганизмов – накопление биомассы;
• 2 фаза – синтез антибиотика.
95.
При этом очень важно создать условия ферментации,адекватные этой двухфазности с учетом
ингибирующего действия антибиотика как продукта
обмена на продуцент.
Требования к промышленному созданию
антибиотиков:
обеспечение строжайших условий стерильности в
ходе всех стадий биотехнологического процесса;
разработка и создание эффективной аппаратуры с
высокими газо-динамическими характеристиками;
средств борьбы с сильным пенообразованием;
методов получения стерильных препаратов
антибиотиков высокой степени чистоты.
96. Антибиотики немедицинского назначения
Применяются в сельском хозяйстве,получают также в условиях строго
стерильной регламентированной культуры,
однако готовый продукт представляет собой
высушенную биомассу продуцента или
культуральную среду. В таком препарате,
помимо антибиотика, содержатся также
другие биологически активные вещества
(витамины группы В, ферменты, витамины,
аминокислоты).
Наиболее известны среди применяемых в
качестве кормовых антибиотических
препаратов – биовит и биомицин,
являющиеся препаратами
хлортетрациклина, а также гризин,
бацитрацин и гигромицин.
97.
Подавляя развитие болезнетворных микроорганизмов, тем самымснижая заболеваемость и смертность, антибиотики ускоряют рост и
развитие животных и птицы.
• Так, применение антибиотиков в свиноводстве
обеспечивает дополнительный привес от каждой тысячи
животных до 120 ц при сокращении расхода кормов на 5–10
%. При добавлении антибиотиков в корм кур-несушек можно
дополнительно получить до 15 тыс. яиц в год от 1000 кур.
В течение последних 25 лет антибиотики применяют также для борьбы с
фитопатогенами, возбудителями которых являются микроорганизмы.
Антибиотические вещества наносят на вегетативные части растения, а
также на семена или вносят в почву. В результате селективного действия
на фитопатогенные микроорганизмы антибиотики задерживают рост
или убивают микроорганизмы-возбудители, не нанося вреда растению.
• Наиболее эффективными фитопатогенными препаратами
являются трихотецин, полимицин, фитобактериомицин,
гризеофульвин.
98. ЛЕКЦИЯ 4. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
В конце 60-х – начале 70-х гг. на базе технической биохимии, химическойтехнологии, химической энзимологии и ряда инженерных дисциплин возникло
новое научно-техническое направление биотехнологии – инженерная
энзимология, к которой относят систему методов получения,
очистки, стабилизации и применения ферментов.
Задача инженерной энзимологии – конструирование
биоорганических катализаторов с заданными свойствами на
основе ферментов или ферментных комплексов и разработка
на их базе различных эффективных и экологически чистых
биотехнологических процессов.
Высокая субстратная специфичность ферментативного катализа и уникальная
способность ускорять реакции в десятки и сотни раз в условиях нормального
давления и физиологических температур позволяют получать высокие выходы
продуктов и создавать практически безотходные биотехнологические
процессы, не загрязняющие окружающую среду.
Эффективные биотехнологические процессы на основе ферментативного
катализа используются в различных сферах человеческой деятельности:
пищевой промышленности, энергетике, медицине, биоэлектрокатализе и
микроэлектронике.
99. Вопросы
• Получение и применение ферментов.• Иммобилизованные ферменты.
• Процессы на основе иммобилизованных
ферментов.
• Ферменты в микроанализе.
100. Получение и применение ферментов
Ферменты – это специфические катализаторы белковойприроды, вырабатываемые клетками и тканями организмов,
способные во много раз ускорять течение химических и
биохимических реакций, не входя в состав конечных продуктов.
• Источники ферментов – растительные и животные ткани,
микроорганизмы.
Химический синтез ферментов в промышленных масштабах очень
сложен, дорог и экономически не целесообразен.
Микробиологический метод получения ферментов – наиболее
перспективен. Его преимущества заключаются в следующем:
• богатство ассортимента ферментов, синтезируемых
микроорганизмами,
• возможность управления ферментативными системами и
составом производимых препаратов,
• высокая скорость размножения микроорганизмов и
возможность использования различных, в том числе доступных
и недорогих субстратов.
101.
• В промышленных масштабах получают главнымобразом внеклеточные ферменты. Из описанных к
настоящему времени более 2000 ферментов
практическое значение имеют около 50.
Все ферменты подразделяются на 6 классов:
• оксидоредуктазы
• трансферазы
• гидролазы
• лиазы
• изомеразы
• синтетазы
• Негидролитические ферменты – оксидоредуктазы,
лиазы, изомеразы и лигазы используются
сравнительно редко.
102. Значение ферментов
• Целлюлазы применяют для осахаривания крахмала из картофеля изерна, а также увеличения выхода агар-агара из водорослей.
• Липазы находят применение в производстве сухого молока и для
ускорения созревания сыров.
• Протеиназы применяют для удаления серицина (белок, входящий в
состав шелка, вырабатываемого гусеницами тутового
шелкопряда) и высвобождения шелковых волокон из шелка-сырца.
Протеиназы террилин и стрептокиназа обладают тромболитическим
действием и применяются для борьбы с тромбозами.
• Бактериальную аспарагиназу, расщепляющую аспарагин,
необходимый лейкозным клеткам, применяют при ряде
злокачественных заболеваний.
• Холестеринэстераза гидролизует холестерин, локализованный на
внутренних стенках кровеносных сосудов.
• Ферментные препараты применяют в сельском хозяйстве при
производстве кормов и в кожевенной промышленности. Все большее
применение ферменты находят в тонком органическом синтезе, а
также в медицине.
103.
• Наряду с отбором наиболее активных штаммовпродуцентов ферментов, широко используютиндуцибельные и репрессибельные ферменты,
которые синтезируются клетками в результате
изменения условий ферментации или
генетического аппарата клетки.
Индуцибельные - ферменты, скорость синтеза
которых изменяется в зависимости от условий
существования организма.
Репрессибельные - ферменты, синтез которых
ингибируется в том случае, если продукт
катализируемой им реакции легко доступен
бактериальной клетке.
• К индуцибельным относятся многие ферменты,
имеющие коммерческую ценность.
104.
• Выход ферментов можно увеличить также спомощью новейших методов биотехнологии.
• С помощью плазмид или трансдуцирующих
фагов можно увеличить копийность генов,
кодирующих синтез целевых ферментов.
Плазмиды - внехромосомные генетические
структуры бактерий, способные автономно
размножатся и существовать в цитоплазме
бактериальной клетки.
Трансдуцирующие фаги - штаммы ДНКсодержащих фагов, способные переносить
генетический материал от одного к другому
хозяину, что нередко сопровождается
появлением у реципиента новых свойств.
105. Биотехнологическое производство ферментов реализуется двумя способами: поверхностным и глубинным.
• Твердофазная поверхностная ферментация заключается ввыращивании продуцента на поверхности тонкого слоя твердой
сыпучей среды.
• Поверхностный метод ферментации является экстенсивным методом
с большой долей ручного труда. При этом, однако, он не энергоемок
и обеспечивает более высокий выход продукта на единицу массы
среды по сравнению с глубинной ферментацией.
• Глубинная ферментация в жидкой среде может быть реализована как
в условиях периодического процесса, так и с применением проточных
систем.
• Глубинный способ микробиологического получения ферментов
проходит в контролируемых условиях ферментации, исключает
ручной труд, позволяет автоматизировать процесс. Синтез фермента в
глубинной культуре протекает в течение 3-4 суток при непрерывной
подаче стерильного воздуха, стабилизации рН и температуры среды
на строго определенных уровнях.
106. Питательная среда для ферментации
Основным углеродным сырьем служат различные сортакрахмала (кукурузный, пшеничный, картофельный),
кукурузный экстракт, свекловичный жом, а также
глюкоза, мальтоза, декстрины.
В качестве источника азота применяют органические
соединения (гидролизаты казеина или микробных
биомасс), а также минеральные соли (NaNO3, NH4NO3,
NH4HPO4, (NH4)2SO4).
Для биосинтеза целлюлолитических ферментов
источником углерода служит хлопок, солома,
целлюлоза; липолитических – липиды.
107. Иммобилизованные ферменты
• Широкие перспективы открылись перед инженернойэнзимологией в результате создания нового типа
биоорганических катализаторов, так называемых
иммобилизованных ферментов.
• Термин «иммобилизованные ферменты» узаконен
сравнительно недавно, в 1974 г. Сандэремом и Реем,
хотя еще в 1916 г. Нельсон и Гриффи показали, что
инвертаза, адсорбированная на угле или алюмогеле,
сохраняет свою каталитическую активность.
• Иммобилизация – это процесс прикрепления
ферментов к поверхности природных или
синтетических материалов, включение их в
полимерные материалы, полые волокна и
мембранные капсулы, поперечная химическая сшивка.
108.
109. Методы иммобилизации
адсорбцияхимическое
связывание
• фиксирование фермента на поверхности различных материалов –
неорганических (силикагель, пористое стекло, керамика, песок,
обожженная глина, гидроокиси титана, циркония, железа) и
органических (хитин, целлюлоза, полиэтилен, ионообменные смолы,
вспененная резина, полиуретан с ячеистой структурой)
• Недостаток метода – непрочность связей. При незначительном
изменении условий среды (рН, температуры, ионной силы,
концентрации продукта) возможна десорбция фермента с
поверхности носителя.
• Иммобилизация путем химической сшивки фермента с носителем
характеризуется высокой эффективностью и прочностью связи. Для
предотвращения снижения каталитической активности фермента место
сшивки удаляют от активного центра катализатора, и присоединение
проводят не по белковой части молекулы, а по углеводной.
• Недостатком метода иммобилизации на основе физической адсорбции
или ковалентного присоединения является необходимость использования
достаточно больших количеств катализатора, а также в процессе
иммобилизации существенно снижается их каталитическая активность.
110.
В качестве полимерных носителей применяют природные и синтетическиематериалы (желатин, коллаген, хитин, целлюлозу, полиакриламид,
фоточувствительные полимеры). Раствор фермента смешивают с раствором
мономеров носителя. Далее создают условия для процесса полимеризации, в
ходе которого происходит механическое включение фермента в структуру
носителя. Важным моментом является равномерность распределения молекул
фермента в объеме носителя и однородность получаемых агрегатов. Наиболее
часто используют полиакриламидный гель (ПААГ), желатин или агар-агар. Гели
в зависимости от природы используемого полимерного материала отличаются
по ряду показателей.
• Например, гели ПААГ недостаточно прочные, но этого можно избежать при
использовании ПААГ, содержащего жесткую арматуру из керамики.
111.
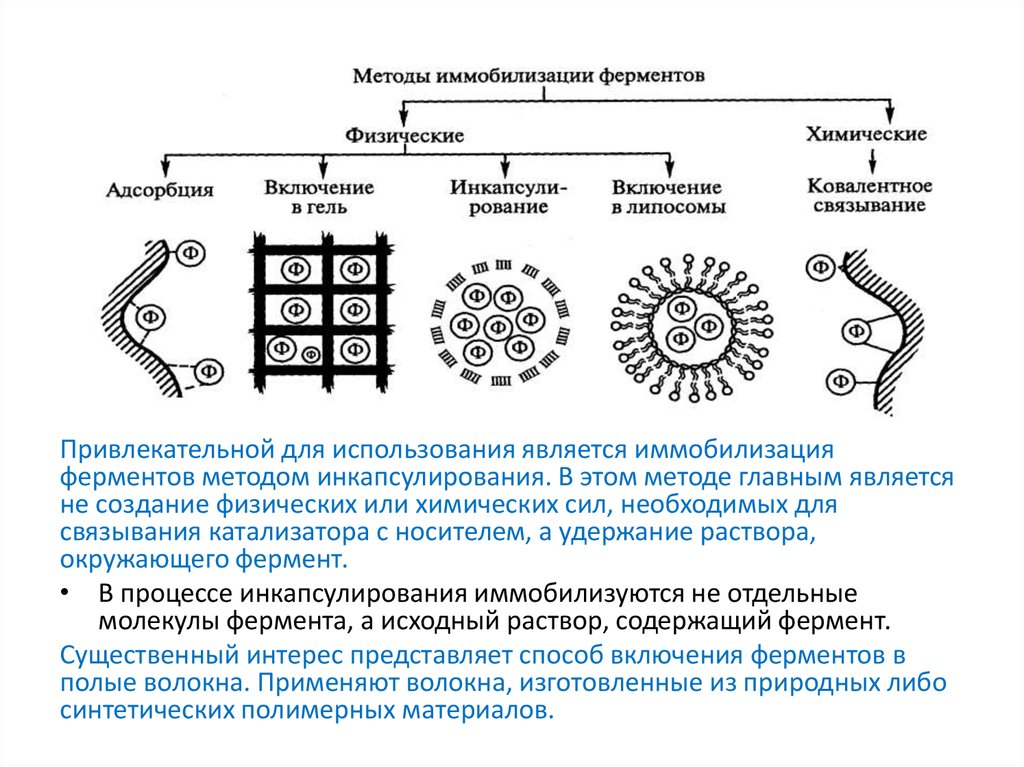
Привлекательной для использования является иммобилизацияферментов методом инкапсулирования. В этом методе главным является
не создание физических или химических сил, необходимых для
связывания катализатора с носителем, а удержание раствора,
окружающего фермент.
• В процессе инкапсулирования иммобилизуются не отдельные
молекулы фермента, а исходный раствор, содержащий фермент.
Существенный интерес представляет способ включения ферментов в
полые волокна. Применяют волокна, изготовленные из природных либо
синтетических полимерных материалов.
112. Процессы на основе иммобилизованных ферментов
• Сферы применения иммобилизованных ферментовразнообразны – это тонкий органический синтез и
преобразование энергии, ферментная аналитика и получение
целевых продуктов, конверсия растительного сырья и создание
лекарственных препаратов.
• Для таких процессов разрабатывают специальные
биореакторы. Иммобилизованный фермент в таком
биореакторе представляет собой неподвижную фазу, через
которую протекает субстрат, подлежащий
биопревращению.
• Реакторы бывают периодического и непрерывного
действия.
• В развитых странах внедрены биотехнологические процессы с
иммобилизованными ферментами при получения глюкозофруктозных сиропов, L-аминокислот, диетического
безлактозного молока, сахаров из молочной сыворотки,
синтеза L-аспарагиновой и L-яблочной кислот из фумаровой
кислоты.
113. Ферменты в микроанализе
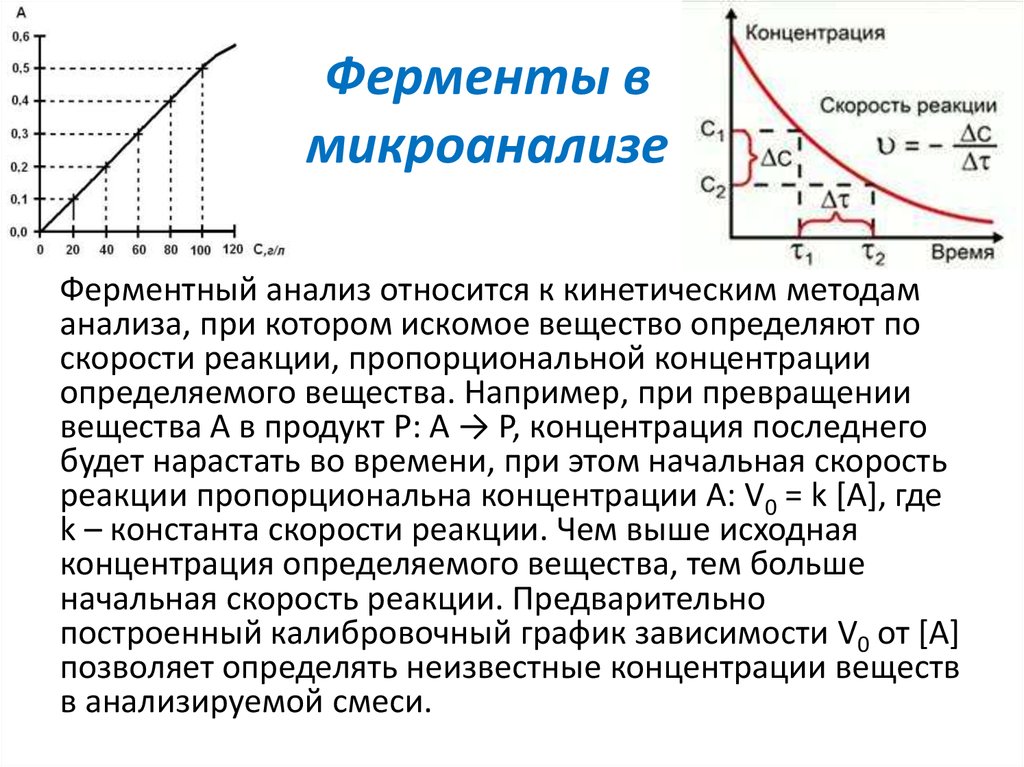
Ферментный анализ относится к кинетическим методаманализа, при котором искомое вещество определяют по
скорости реакции, пропорциональной концентрации
определяемого вещества. Например, при превращении
вещества А в продукт Р: А → P, концентрация последнего
будет нарастать во времени, при этом начальная скорость
реакции пропорциональна концентрации А: V0 = k [А], где
k – константа скорости реакции. Чем выше исходная
концентрация определяемого вещества, тем больше
начальная скорость реакции. Предварительно
построенный калибровочный график зависимости V0 от [А]
позволяет определять неизвестные концентрации веществ
в анализируемой смеси.
114.
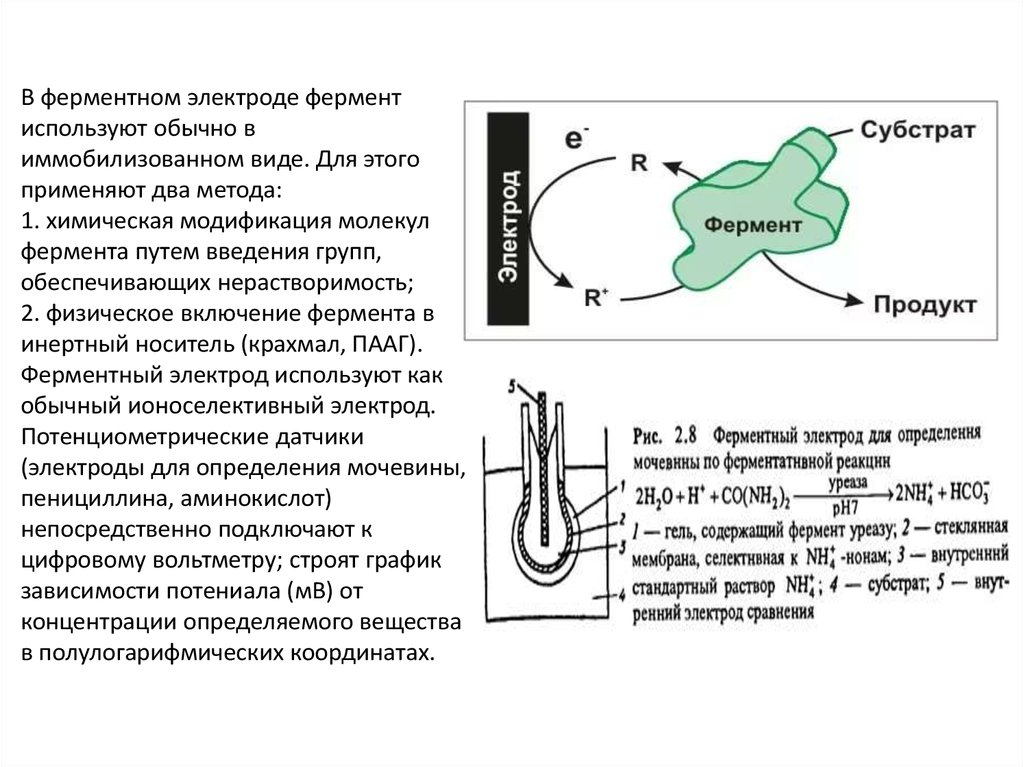
Ферментный электрод – это комбинация датчика, основойкоторого является ионоселективный электрод с иммобилизованным
ферментом.
Понятие ферментного электрода - Кларк и Лайон в 1962 г. В то время
использовали растворимые ферменты.
Описали потенциометрический ферментный электрод для определения
мочевины - Гильбо и Монталво в 1969 г.
Иммобилизованный фермент в конструкции электрода первыми
применили Апдайк и Хикс в 1971 г., укрепив иммобилизованную в геле
глюкозооксидазу на поверхности полярографического кислородного
датчика (датчик вольтометрического или амперметрического типа
позволяет измерять ток при наложении постоянного напряжения). В
настоящее время разработано свыше 100 конструкций ферментных
электродов.
115.
В ферментном электроде ферментиспользуют обычно в
иммобилизованном виде. Для этого
применяют два метода:
1. химическая модификация молекул
фермента путем введения групп,
обеспечивающих нерастворимость;
2. физическое включение фермента в
инертный носитель (крахмал, ПААГ).
Ферментный электрод используют как
обычный ионоселективный электрод.
Потенциометрические датчики
(электроды для определения мочевины,
пенициллина, аминокислот)
непосредственно подключают к
цифровому вольтметру; строят график
зависимости потениала (мВ) от
концентрации определяемого вещества
в полулогарифмических координатах.
116.
Эра широкого внедрения ферментных электродов биосенсоров, только начинается. Помимо высокойчувствительности и быстродействия, они существенно
уменьшают объем анализируемых проб, автоматизируют и
упрощают схему анализа.
Особенно эффективно применение ферментных методов
анализа для контроля состояния окружающей среды, в
пищевой и биотехнологической промышленности, в
клинической аналитике, а также в научных исследованиях.
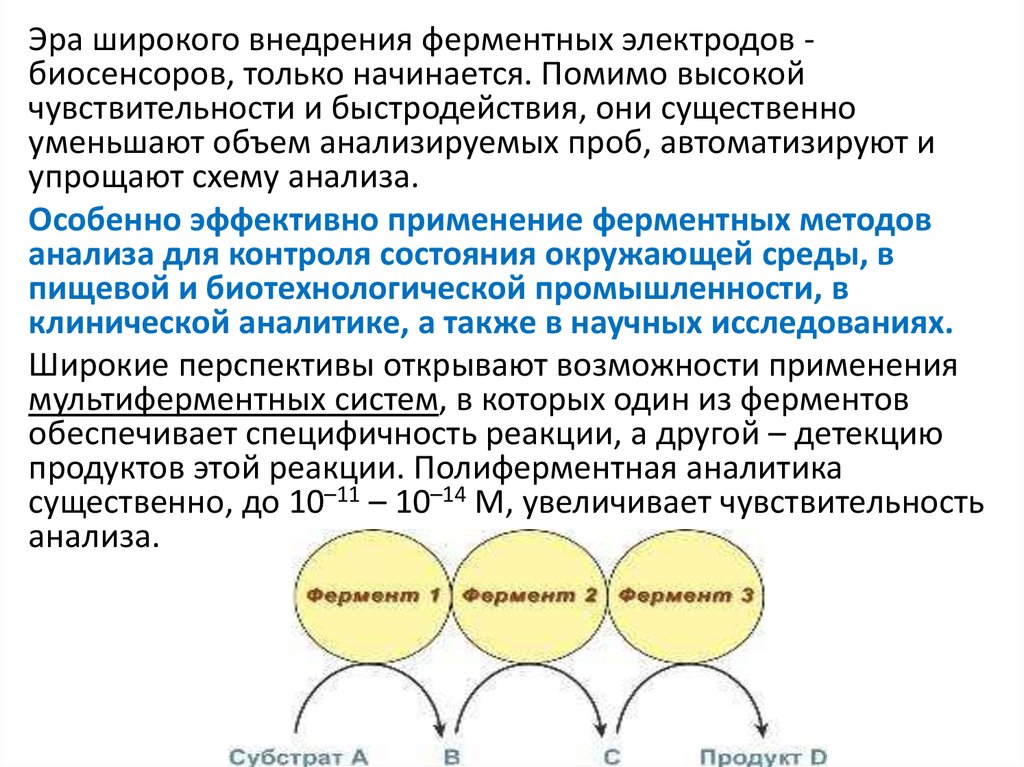
Широкие перспективы открывают возможности применения
мультиферментных систем, в которых один из ферментов
обеспечивает специфичность реакции, а другой – детекцию
продуктов этой реакции. Полиферментная аналитика
существенно, до 10–11 – 10–14 М, увеличивает чувствительность
анализа.
117.
Перспективным методом анализа считают также биолюминесцентный микроанализ наоснове светлячковой и бактериальной люцифераз. Эти методы анализа позволяют
определять, например, АТФ и НАД с чувствительностью до 10–14 М. Сопряжение
люцифераз с другими ферментами, катализирующими протекание реакции с
образованием АТФ и НАДН, открывают широкие возможности для создания
высокоспецифичных, экспрессных и высокочувствительных методов анализа.
Люциферазы - специфические ферменты, участвующие в преобразовании энергии и
обеспечивающие крайне высокий энергетический выход реакции, в определенных
случаях достигающий 10% и выше. Несмотря на небольшие межвидовые различия все
люциферазы имеют сходное строение.
118. Лекция. Генная и клеточная инженерия
В настоящее время разрабатываются иприменяются принципиально новые методы,
основанные на технологии рекомбинантных
ДНК. Модификация генетического материала
осуществляется разными методами: в живом
организме (in vivo) и вне его (in vitro),
соответственно, это два направления –
клеточная инженерия и генетическая
инженерия.
119. Клеточная инженерия
• В настоящее время можно культивировать клетки практическивсех тканей и органов человека, животных и растений.
Культивирование клетки становится основой современных
наукоемких технологий в биотехнологии и медицине,
например, в биотехнологии – получение биологически
активных веществ, вакцин, диагностикумов, клетокпродуцентов; в медицине – заместительная клеточная
терапия, позволяющая восстанавливать поврежденные ткани
(например, кожу после ожога) путем трансплантации
нормальных здоровых клеток человека, выращенных in vitro.
• В наши дни в промышленных масштабах в биореакторах с
помощью клеток животных и человека налажено
производство многочисленных вакцин и диагностикумов,
производство гормонов (инсулина и др.) интерферона,
ферментов, фактора свертывания крови, эритропоэтина и др.
препаратов.
120.
121.
122.
123.
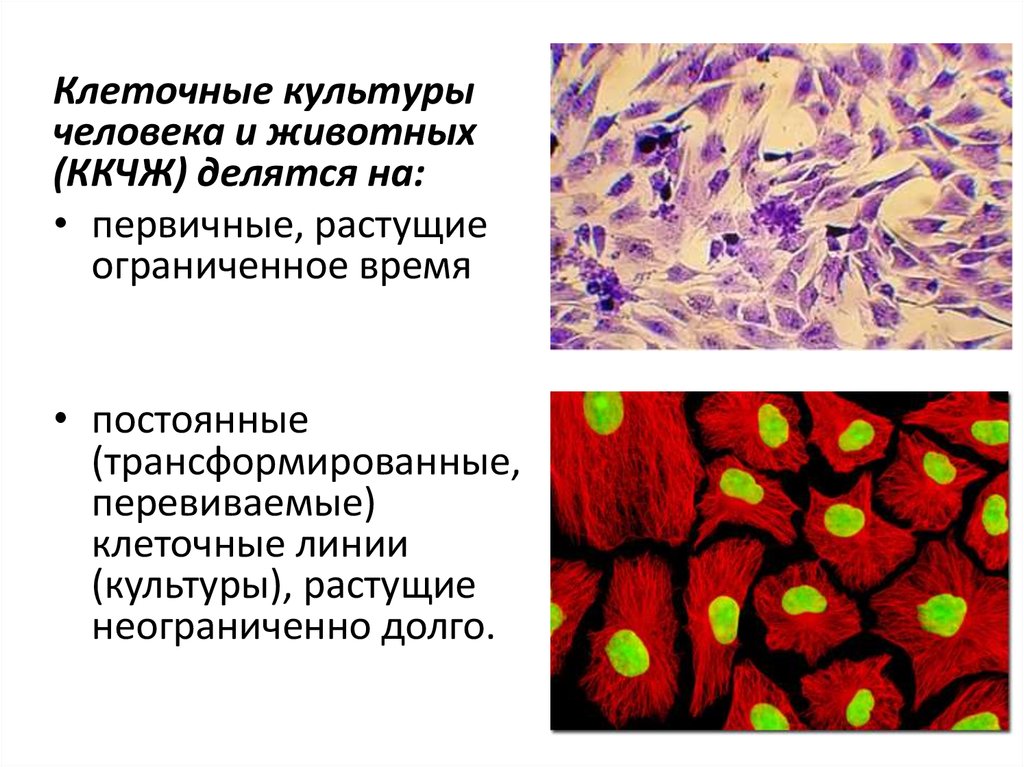
Клеточные культурычеловека и животных
(ККЧЖ) делятся на:
• первичные, растущие
ограниченное время
• постоянные
(трансформированные,
перевиваемые)
клеточные линии
(культуры), растущие
неограниченно долго.
124.
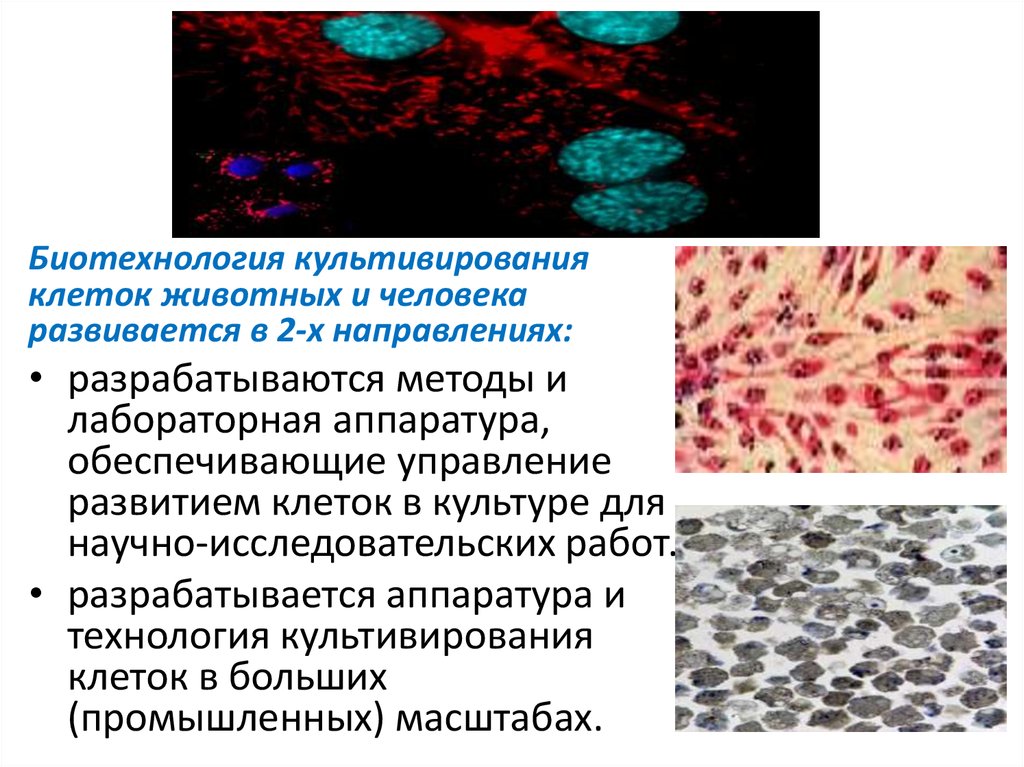
Биотехнология культивированияклеток животных и человека
развивается в 2-х направлениях:
• разрабатываются методы и
лабораторная аппаратура,
обеспечивающие управление
развитием клеток в культуре для
научно-исследовательских работ.
• разрабатывается аппаратура и
технология культивирования
клеток в больших
(промышленных) масштабах.
125. Параметры для культивирования клеток человека и животных
При культивировании учитываются разные параметры:• константные параметры – качество материала, форма и
объем культуры.
• вариабельные параметры – скорость вращения или
покачивания, качество и объем среды, тип клеток и
размер посевного материала, рН, t, О2, СО2,
окислительно-восстановительный потенциал и
концентрация основных источников питания среды.
Для ККЧЖ используются естественные среды:
• коагулянты – сгусток плазмы;
• биологические жидкости – сыворотка, амниотическая,
асцитическая жидкость и др.;
• тканевые экстракты, например, эмбриональный
экстракт.
126.
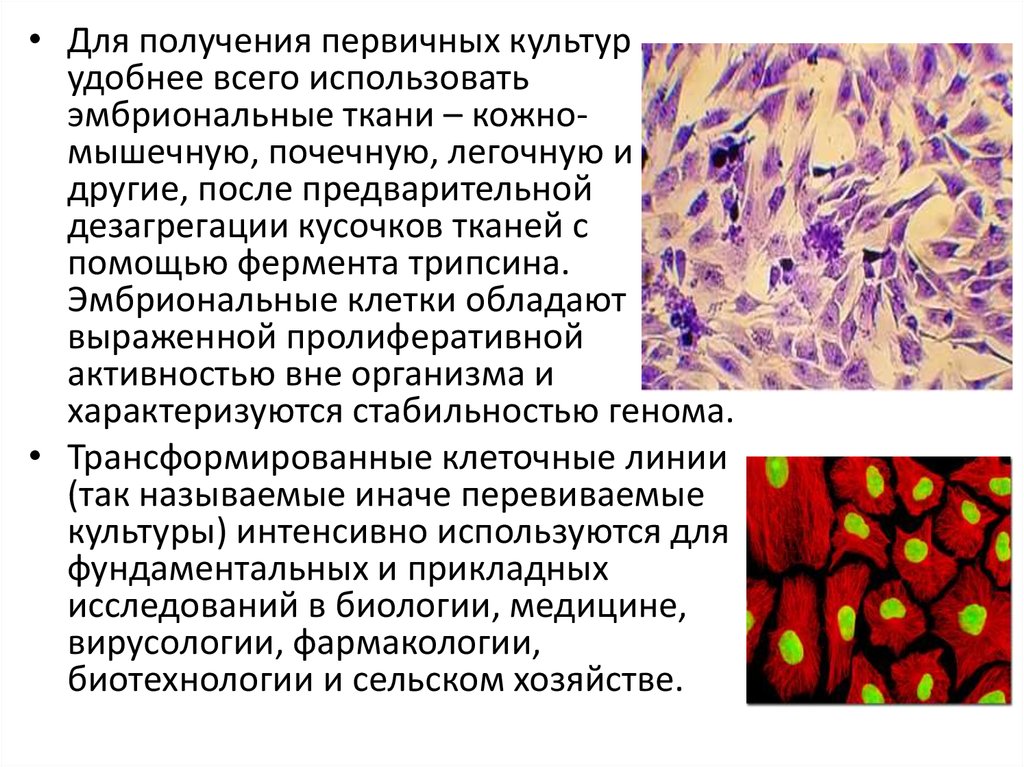
• Для получения первичных культурудобнее всего использовать
эмбриональные ткани – кожномышечную, почечную, легочную и
другие, после предварительной
дезагрегации кусочков тканей с
помощью фермента трипсина.
Эмбриональные клетки обладают
выраженной пролиферативной
активностью вне организма и
характеризуются стабильностью генома.
• Трансформированные клеточные линии
(так называемые иначе перевиваемые
культуры) интенсивно используются для
фундаментальных и прикладных
исследований в биологии, медицине,
вирусологии, фармакологии,
биотехнологии и сельском хозяйстве.
127.
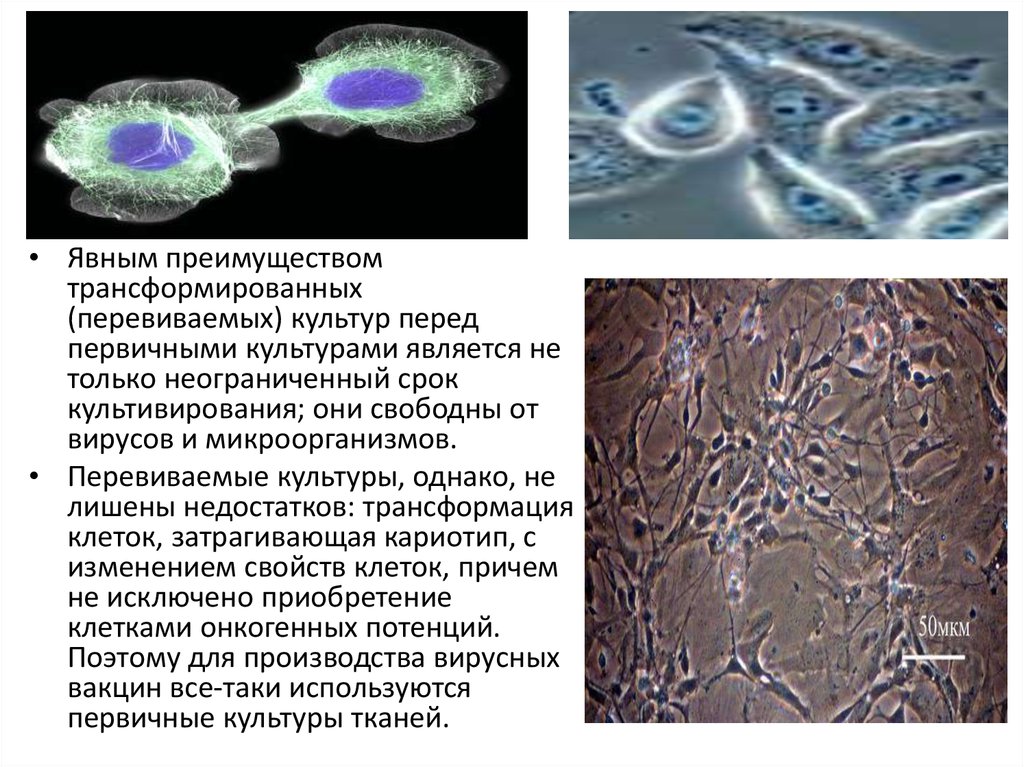
• Явным преимуществомтрансформированных
(перевиваемых) культур перед
первичными культурами является не
только неограниченный срок
культивирования; они свободны от
вирусов и микроорганизмов.
• Перевиваемые культуры, однако, не
лишены недостатков: трансформация
клеток, затрагивающая кариотип, с
изменением свойств клеток, причем
не исключено приобретение
клетками онкогенных потенций.
Поэтому для производства вирусных
вакцин все-таки используются
первичные культуры тканей.
128. ГЕННАЯ ИНЖЕНЕРИЯ
Названия «генетическая (или генная) инженерия» или «работа срекомбинантными ДНК» эквивалентны. Суть этой технологии
заключается в воссоединении фрагментов ДНК in vitro с
последующим введением новых («рекомбинантных»)
генетических структур в живую клетку.
• В 1972 г. Берг с сотрудниками создали первую рекомбинантную молекулу
ДНК, состоящую из фрагмента ДНК вируса и бактериофага с галактозным
опероном E. coli. Инструментом для генетического конструирования стали
две группы ферментов – рестриктирующие эндонуклеазы (рестриктазы) и
лигазы. Первые необходимы для получения однородных фрагментов ДНК,
вторые – для их соединения. Рестриктазы и лигазы в совокупности с
другими ферментами (нуклеазами, обратной транскриптазой, ДНКполимеразой и др.) обеспечивают проведение всех генноинженерных
манипуляций.
• Техника генетического конструирования in vitro включает несколько
последовательных процедур: получение нужного гена; встраивание его в
генетический элемент, способный к репликации (вектор); введение гена,
входящего в состав вектора, в организм-реципиент; идентификацию
(скрининг) и отбор клеток, которые приобрели желаемый ген или гены.




































































































 biology
biology








