Similar presentations:
Новости ревматологии 2018
1. Новости ревматологии 2018
ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава РоссииКафедра госпитальной терапии л/ф №1
Новости ревматологии
2018
Воеводина Виктория Олеговна
Студентка 1.6.10 А группы
2.
Новые оригинальные ГИБПТилдракизумаб (блокатор Il-23 p19) (Ilumya, Sun Pharmaceuticals) в виде 100 мг в
2017 году утвержден управлением по контролю за продуктами и лекарствами США
(FDA) для лечения распространенного хронического бляшечного псориаза средней и
тяжелой формы у взрослых.
DOI: 10.1016/S0140-6736(17)31279-5
Барицитиниб (ингибитор Янус киназы) (Olumiant, Eli Lilly and Company and Incyte
Corporation) 2 мг утвержден FDA и Европейским агентством по лекарственным
средства (EMA) для лечения ревматоидного артрита у взрослых, не ответивших на
лечение одним или более препаратами ингибитора фактора некроза опухоли (TNF).
doi: 10.3899/jrheum.171361.
3.
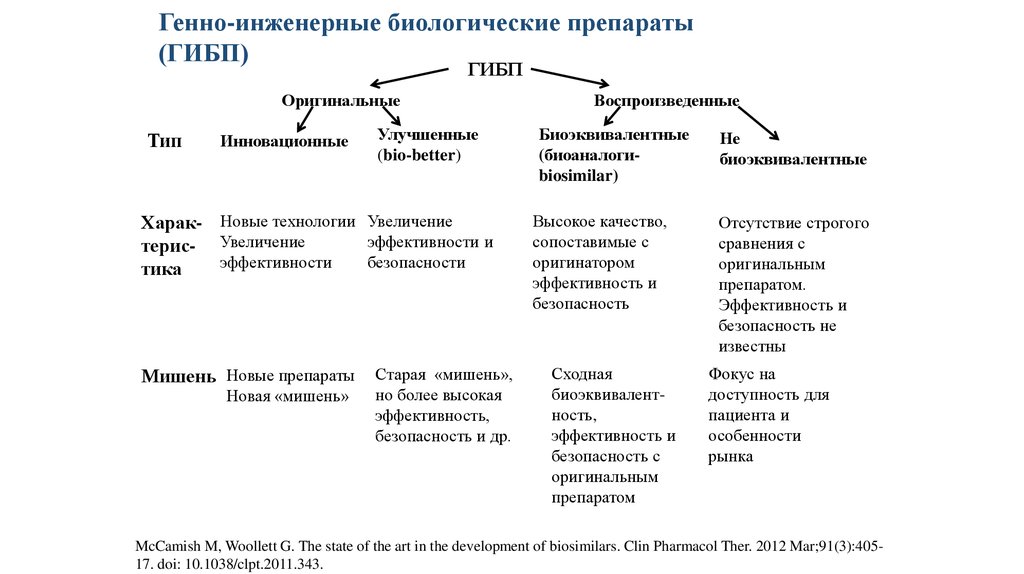
Генно-инженерные биологические препараты(ГИБП)
ГИБП
Оригинальные
Тип
Инновационные
Улучшенные
(bio-better)
Харак- Новые технологии Увеличение
эффективности и
терис- Увеличение
эффективности
безопасности
тика
Мишень Новые препараты
Новая «мишень»
Старая «мишень»,
но более высокая
эффективность,
безопасность и др.
Воспроизведенные
Биоэквивалентные
(биоаналогиbiosimilar)
Высокое качество,
сопоставимые с
оригинатором
эффективность и
безопасность
Сходная
биоэквивалентность,
эффективность и
безопасность с
оригинальным
препаратом
Не
биоэквивалентные
Отсутствие строгого
сравнения с
оригинальным
препаратом.
Эффективность и
безопасность не
известны
Фокус на
доступность для
пациента и
особенности
рынка
McCamish M, Woollett G. The state of the art in the development of biosimilars. Clin Pharmacol Ther. 2012 Mar;91(3):40517. doi: 10.1038/clpt.2011.343.
4.
Биосимиляры EULAR 20171. Биосимиляры благодаря более низкой стоимости позволяют увеличить доступность
ГИБП
2. Одобренные биосимиляры должны использоваться по тем же показаниям, что и
оригинальные препараты
3. При отсуствии значимой иммуногенности у оригинального препарата и
сопостовимой иммуногенности биосимииляра, нет необходимости измерять
аутоантитела к биосимиляру в клинической практике
4. При публикации 3 фазы РКИ должны быть представлены все данные по
преклиническим исследованиям и 1 фазе РКИ
5. Для экстраполяции достаточно 1 подтвержденного показания
6. Множественные переключения между биосимилярами и оригинальными
препаратами должны тщательно регистрироваться
7. Не должно быть переключения на биосимиляр(-ы) без согласия пациента и
лечащего врача
EULAR - Европейская лига по борьбе с ревматизмом
Cohen S, Kay J. Biosimilars: implications for rheumatoid arthritis therapy. Curr Opin Rheumatol. 2017;29(3):260-268
5.
Биоаналог Ритуксимаба в ревматологической практикеВ 2016 г завершено международное многоцентровое сравнительное
клиническое исследование препарата «Ацелбия» и препарата «Мабтера» у
больных ревматоидным артритом
Первый российский препарат на основе
моноклональных антител.
Показания к применению:
неходжкинская лимфома, хронический
лимфолейкоз, ревматоидный артрит,
гранулематоз Вегенера и
микроскопический полиангиит
• Доказана терапевтическая эквивалентность
биоаналога и оригинального препарата у
больных ревматоидным артритом
• Эквивалентная безопасность
• Переключение с биоаналога на оригинальный
препарат и наоборот не оказывает негативного
влияния на эффективность и переносимость
терапии
• Иммуногенность препаратов аналогична и
характеризуется низкой частотой выработки
антител к ритуксимабу
http://dx.doi.org/10.14412/1995-4484-2016-510-519
6.
Торопцова НВ. Научно-практическая ревматология. 2018;56(2):144-1517.
Градации риска переломов у больных, получающихглюкокортикоиды
Торопцова НВ. Научно-практическая ревматология. 2018;56(2):144-151
8.
Рекомендации по инициации лечения для профилактики ГКОП у особых популяций больных, начавших длительнуютерапию ГК
Женщины детородного возраста, имеющие средний или высокий риск переломов
Пациенты 30 лет и старше, которые получают очень высокие дозы ГК
Пациенты с органным трансплантантом, скоростью клубочковой фильтрации ≥30
мл/мин и без признаков метаболических заболеваний костей, которые продолжают
терапию ГК
Дети в возрасте 4–17 лет, получающие ГК ≥3 мес
Дети в возрасте 4–17 лет с остеопоротическими переломами, получающие ГК ≥3
мес
Торопцова НВ. Научно-практическая ревматология. 2018;56(2):144-151
9.
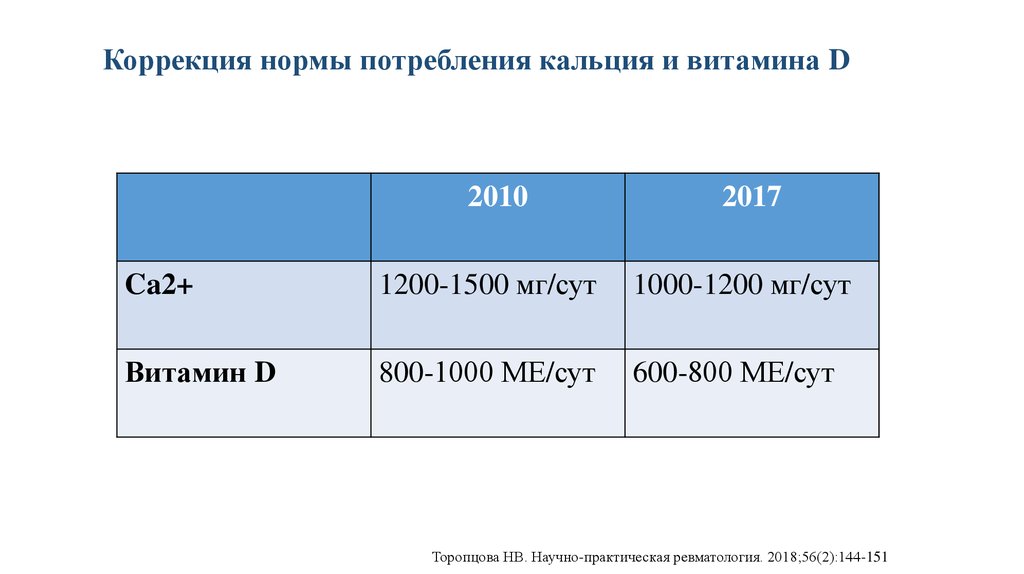
Коррекция нормы потребления кальция и витамина D2010
2017
Ca2+
1200-1500 мг/сут
1000-1200 мг/сут
Витамин D
800-1000 МЕ/сут
600-800 МЕ/сут
Торопцова НВ. Научно-практическая ревматология. 2018;56(2):144-151
10.
Амирджанова ВН, Каратеев АЕ, Погожева ЕЮ. Научно-практическая ревматология. 2018;56(5):549-555.11.
Клинические рекомендации1. Рекомендации по применению БПВП в периоперационном периоде у больных РА,
АС, ПсА, ЮИА, СКВ.
Рекомендовано: продолжить прием текущей дозы метотрексата, лефлуномида,
гидроксихлорохина или сульфасалазина.
2. Рекомендации по применению ГИБП в периоперационном периоде у больных РА,
АС, ПсА, ЮИА, СКВ.
Рекомендовано: отменить все существующие ГИБП до планового ЭКС или ЭТС
3. РА, АС, ПсА, ЮИА и тофацитиниб
Рекомендована отмена тофацитиниба за 7 дней до ЭКС или ЭТС
Амирджанова ВН, Каратеев АЕ, Погожева ЕЮ. Научно-практическая ревматология. 2018;56(5):549-555.
12.
Клинические рекомендации4. Активная СКВ.
Рекомендовано продолжить прием текущей дозы микофенолата мофетила,
азатиоприна, циклоспорина или такролимуса на протяжении всего
периоперационного периода у всех пациентов, которым проводится ЭКС или
ЭТС.
5. Неактивная СКВ.
Рекомендовано отменить микофенолата мофетил, азатиоприн, циклоспорин
или такролимус за 1 нед до ЭКС или ЭТС у всех пациентов.
6. РА, АС, ПсА, ЮИА, СКВ: возобновление терапии ГИБП после ЭКС и ЭТС.
Рекомендовано возобновить терапию ГИБП после ЭКС и ЭТС через 14 дней
после заживления операционной раны.
Амирджанова ВН, Каратеев АЕ, Погожева ЕЮ. Научно-практическая ревматология. 2018;56(5):549-555.










 medicine
medicine








