Similar presentations:
Окислительно-восстановительные реакции химических элементов
1.
окислительновосстановительныереакции
Сборная по химии
8 класс
Назаров М.А.
2. Сумма степеней окисления химических элементов в соединении равна 0
x-2
3·(-2) + 2·x = 0
- 6 + 2·x = 0
Al2O3
2·x =
6X = 3
+3
3.
В этой химической реакции степени окисленияхимических элементов в исходных веществах и
в продуктах реакции не изменяются
+2
-2
+1 -1
+2
-1
+1
-2
Сu О + 2 HCl → CuCl2 + H2O
Химические реакции, протекающие без изменения
степеней окисления химических элементов,
не относятся к окислительно-восстановительным
реакциям.
4.
+2-2
+2 -2
0
+4
-2
CuO + CO → Cu + CO2
у атома меди степень окисления уменьшилась
У атома углерода степень окисления увеличилась
Химические реакции, протекающие c изменением
степеней окисления химических элементов,
относятся к окислительно-восстановительным
реакциям.
5. По изменению степеней окисления химических элементов химические реакции делят на две группы:
ОкислительновосстановительныеНе окислительно восстановительные
6. Составление уравнений окислительно - восстановительных реакций методом электронного баланса
Составлениеуравнений
окислительно восстановительных
реакций методом
электронного
баланса
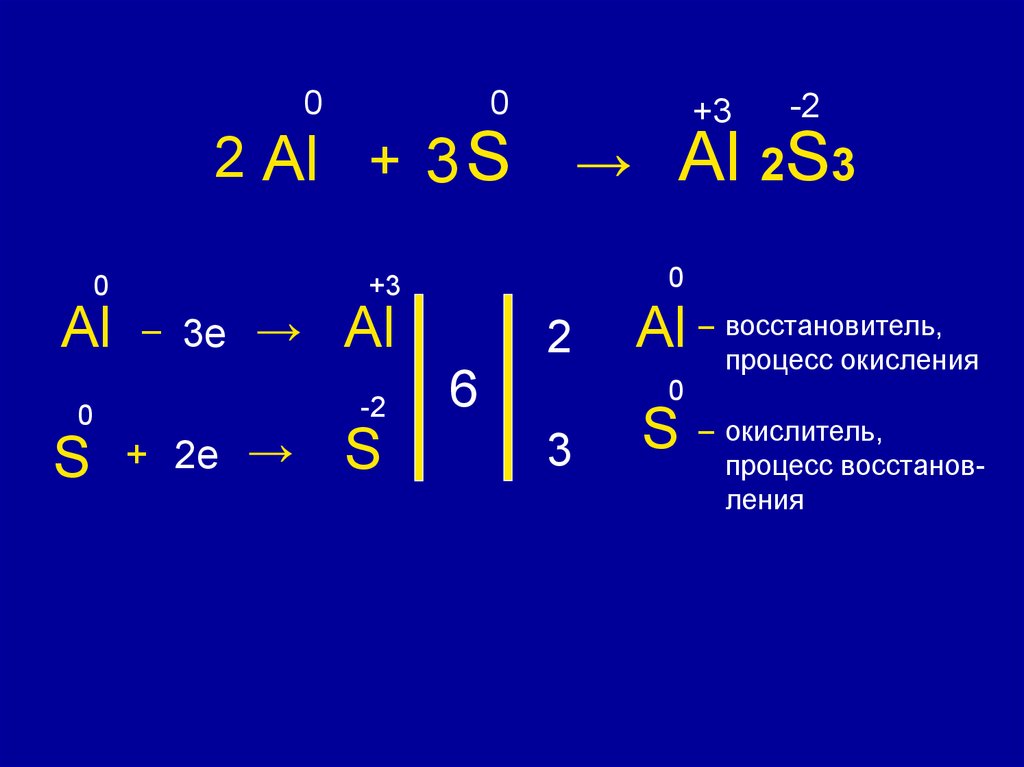
7.
00
→
2 Al + 3 S
0
Al
0
S
→
Al
-2
+ 2e →
S
-2
Al 2S3
0
+3
– 3e
+3
2
6
Al – восстановитель,
процесс окисления
0
3
S
– окислитель,
процесс восстановления
8.
0Восстановитель –
элемент, который
отдает электроны.
Окислитель –
элемент, который
принимает электроны.
+2
S – 2e → S
0
-3
P + 3e → P
9.
Процесс окисления –это процесс отдачи электронов.
0
+2
S – 2e → S
Процесс восстановления –
это процесс присоединения
электронов.
0
-3
P + 3e → P
10.
Значениеокислительновосстановительных
реакций
11. Лесные пожары
C + O2 → CO212. фотосинтез
О2О2
О2
О2
CO2 + H2O → C6H12O6 + O2
13. Коррозия металлов
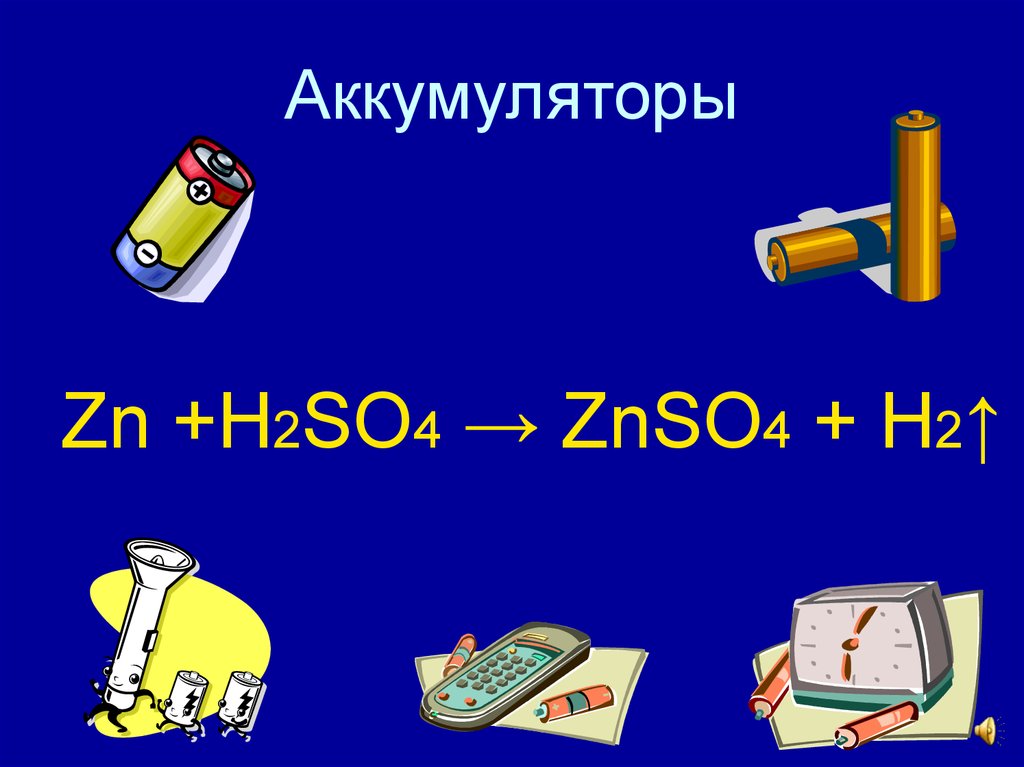
Fe +H2O +O2 → Fe(OH)314. Аккумуляторы
Zn +H2SO4 → ZnSO4 + H2↑15. Извержение вулканов
S + O2 → SO216. Сгорание топлива
17. Брожение глюкозы
C6H12O6 → C2H5OH + CO2Бродильный цех
18. Взрывчатые вещества
P + KClO3 → P2O5 + KCl19. Молния
N2 + O2 → 2 NO20. Салют
Спасибо за внимание!Теперь ещё немного по галогенам)))
Fe + O2 → Fe2O3


















 chemistry
chemistry








