Similar presentations:
Общая характеристика халькогенов. Кислород
1.
Общая характеристикахалькогенов.
Кислород
2.
ОХалькогены – это элементы VIA группы.
S
Название халькогены означает «рождающие
руды».
Se
Te
Po
3.
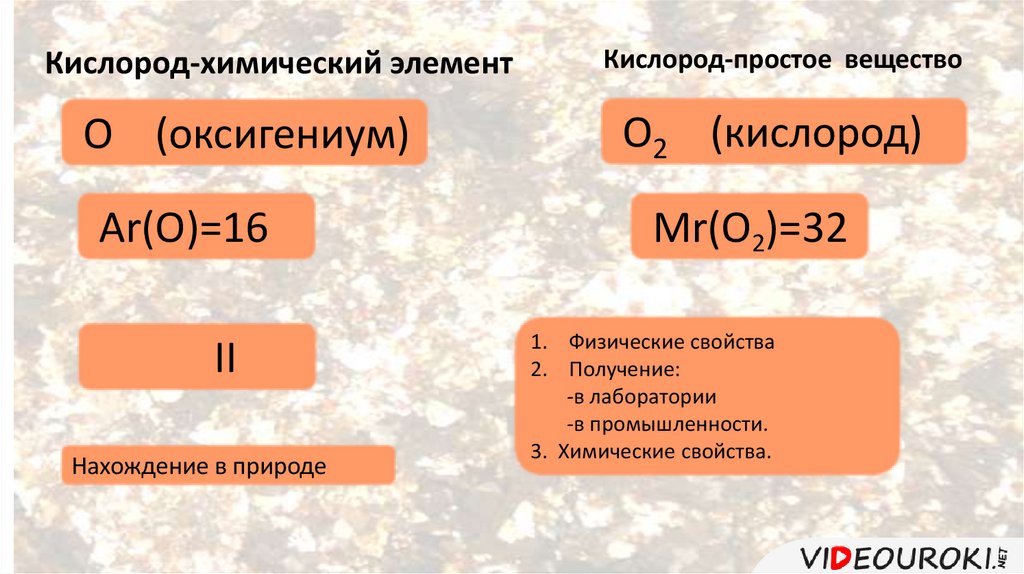
Кислород-химический элементO (оксигениум)
Ar(O)=16
II
Нахождение в природе
Кислород-простое вещество
O2 (кислород)
Мr(O2)=32
1. Физические свойства
2. Получение:
-в лаборатории
-в промышленности.
3. Химические свойства.
4.
Состав земной корыО
Si
Al
Остальные
Состав воздуха
Азот
Кислород
Остальные
1%
7%
18%
26%
49%
21%
78%
5.
Получение кислородаВ промышленности
Из жидкого воздуха.
6.
В 1774 г. получил кислород.t
2HgO = 2Hg + O2↑
А. Лавуазье
Дж. Пристли
Дал название кислороду –
oxygenium,
т.е. «рождающий кислоты».
Получил кислород
нагреванием
селитры.
К. Шееле
7.
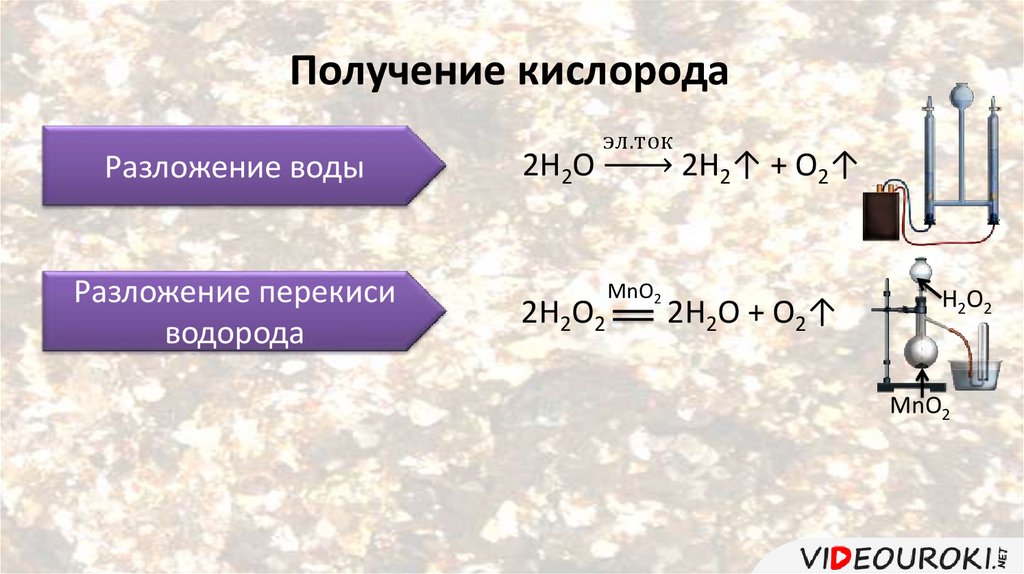
Получение кислородаРазложение воды
Разложение перекиси
водорода
2Н2О
эл.ток
2Н2О2
MnO2
2Н2↑ + О2↑
2Н2О + О2↑
Н2О2
MnO2
8.
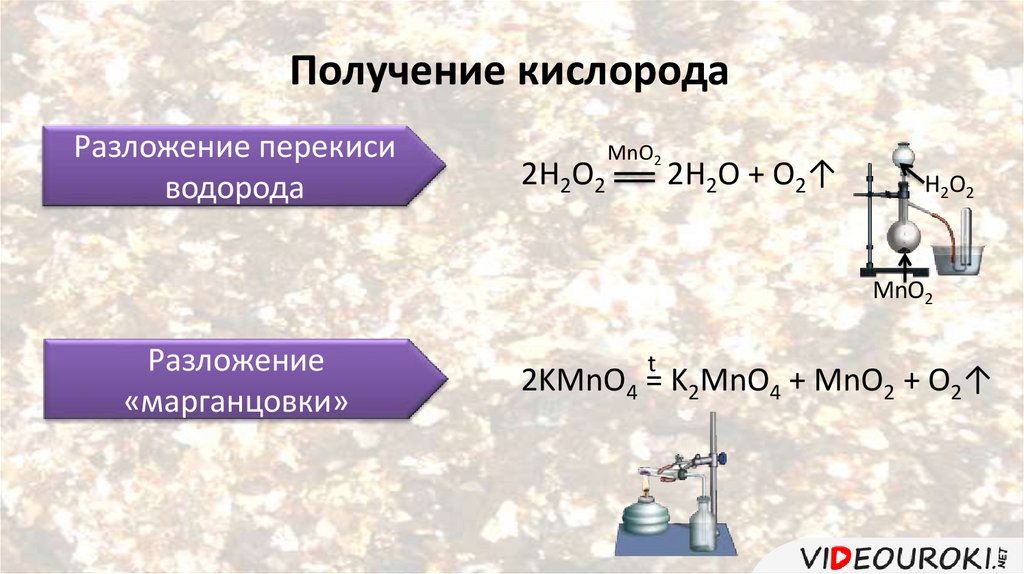
Получение кислородаРазложение перекиси
водорода
2Н2О2
MnO2
2Н2О + О2↑
Н2О2
MnO2
Разложение
«марганцовки»
t
2KMnO4 = K2MnO4 + MnO2 + O2↑
9.
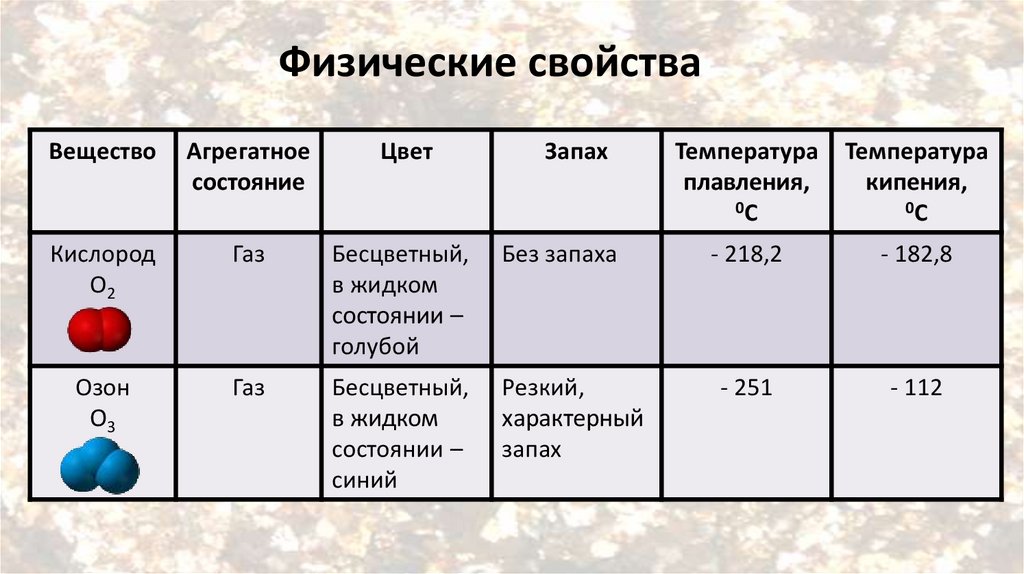
Физические свойстваВещество
Агрегатное
состояние
Цвет
Запах
Кислород
О2
Газ
Бесцветный,
в жидком
состоянии –
голубой
Без запаха
Озон
О3
Газ
Бесцветный,
в жидком
состоянии –
синий
Резкий,
характерный
запах
Температура
плавления,
0С
Температура
кипения,
0С
- 218,2
- 182,8
- 251
- 112
10.
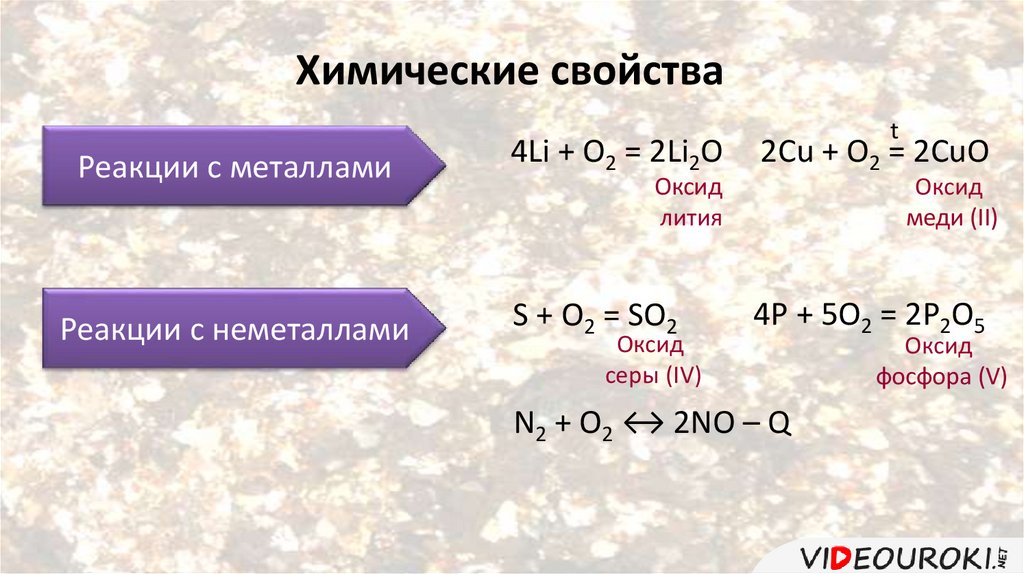
Химические свойстваРеакции с металлами
Реакции с неметаллами
t
4Li + O2 = 2Li2O
2Cu + O2 = 2CuO
S + O2 = SO2
4P + 5O2 = 2P2O5
Оксид
лития
Оксид
серы (IV)
Оксид
меди (II)
N2 + O2 ↔ 2NO – Q
Оксид
фосфора (V)
11.
Химические свойстваРеакции со сложными
веществами
CH4 + 2O2 = CO2↑ + 2H2O
2H2S + 3O2 = 2SO2↑ + 2H2O
12.
13.
В процессе фотосинтеза из углекислогогаза и воды образуется глюкоза и
кислород.
За счет этого процесса сохраняется
содержание свободного кислорода.
14.
Оксид марганца (IV) – катализатор.15.
Фермент каталаза – катализатор.16.
1Применение кислорода
O2
2
3
5
6
4
1 – в металлургии;
4 – в медицине;
2 – газовая сварка и
резка металлов;
5 – как окислитель ракетного
топлива;
3 – при работе водолазов и
пожарных;
6 – для получения взрывчатых
веществ.
17.
Хранение кислородаВ промышленности
O2
O2
O2
В лаборатории
18.
В реакциях кислород проявляет окислительные свойства.Кислород получают реакцией разложения перекиси
водорода, «марганцовки», воды, а в промышленности – из
воздуха.
Кислород участвует в круговороте веществ и применяется
в химической и металлургической промышленности.












 chemistry
chemistry








