Similar presentations:
Аминокилоты. Свойства
1.
ЗАДАНИЕ №СВОЙСТВА
2.
ФИЗИЧЕСКИЕ СВОЙСТВАБольшинство аминокислот – бесцветные кристаллические
вещества, лучше растворяются в воде, чем в органических
растворителях. Многие аминокислоты имеют сладкий вкус.
Температуры плавления разных аминокислот лежат в пределах
230–300°С.
Эти
свойства
отчётливо
на солеобразный характер этих соединений.
указывают
Особенности физических и химических свойств аминокислот
обусловлены их строением — присутствием одновременно
двух противоположных по свойствам функциональных
групп: кислотной (карбоксил) и основной (аминогруппа).
3.
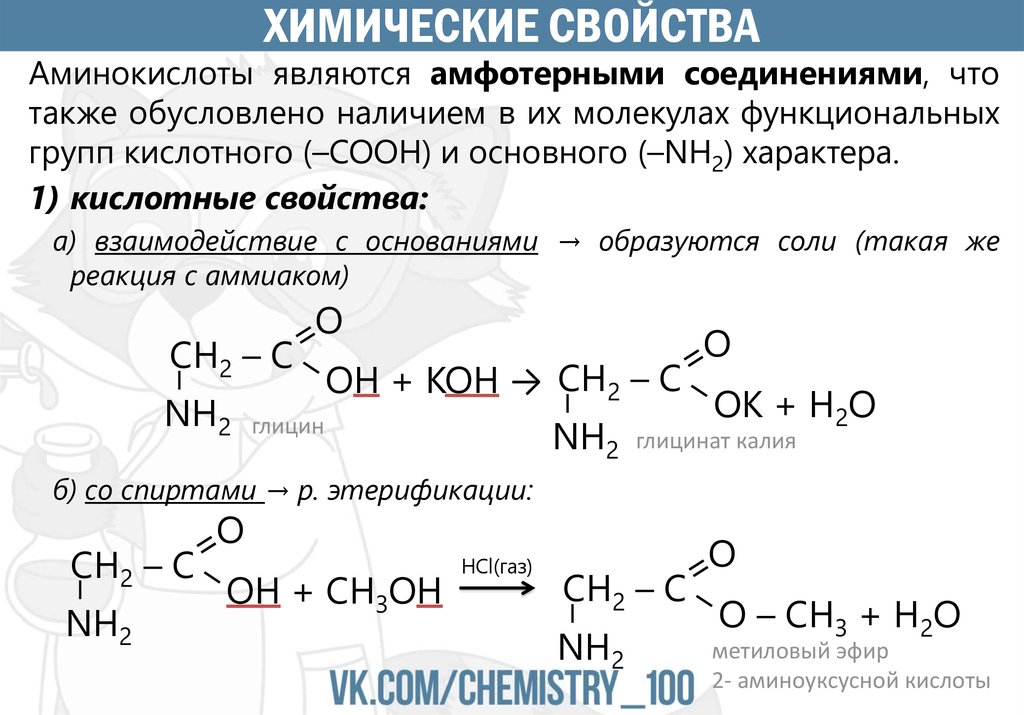
ХИМИЧЕСКИЕ СВОЙСТВААминокислоты являются амфотерными соединениями, что
также обусловлено наличием в их молекулах функциональных
групп кислотного (–COOH) и основного (–NH2) характера.
1) кислотные свойства:
а) взаимодействие с основаниями → образуются соли (такая же
реакция с аммиаком)
–
CH2 – C
O
–
NH2
OH + KOH → CH2 – C
NH2
глицин
O
OK + H2O
глицинат калия
б) со спиртами → р. этерификации:
–
C H2 – C
OH + CH3OH
HCl(газ)
CH2 – C
–
NH2
O
NH2
O
O – CH3 + H2O
метиловый эфир
2- аминоуксусной кислоты
4.
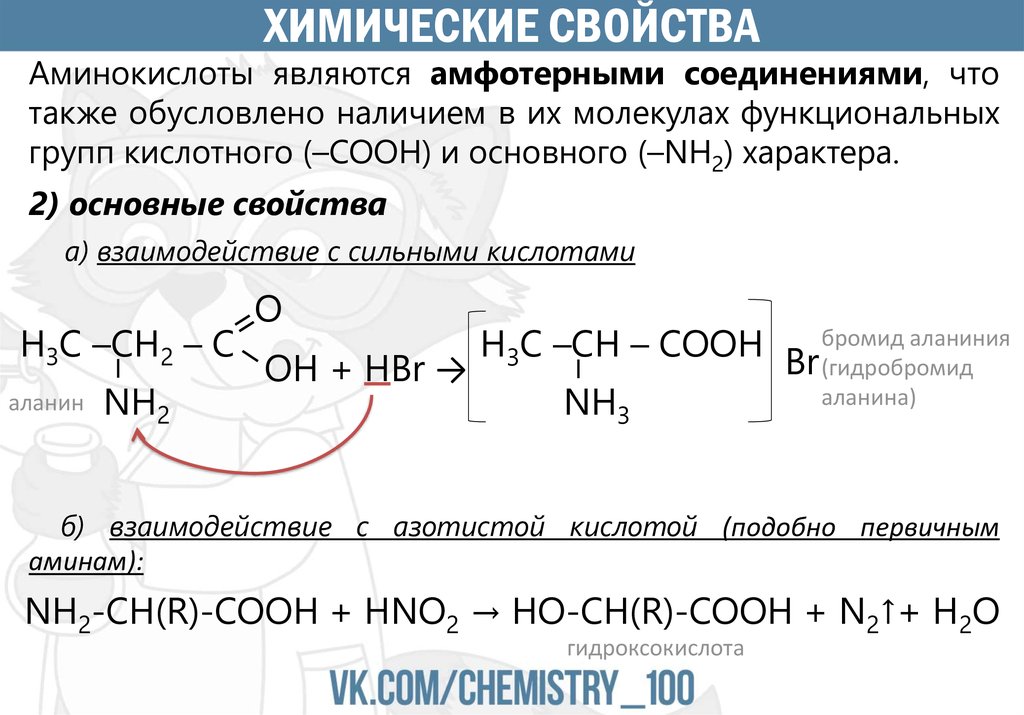
ХИМИЧЕСКИЕ СВОЙСТВААминокислоты являются амфотерными соединениями, что
также обусловлено наличием в их молекулах функциональных
групп кислотного (–COOH) и основного (–NH2) характера.
2) основные свойства
а) взаимодействие с сильными кислотами
аланин
NH2
аланиния
H3C –CH – COOH Br бромид
(гидробромид
OH + HBr →
аланина)
NH3
–
–
H3C –CH2 – C
O
б) взаимодействие с азотистой кислотой (подобно первичным
аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
5.
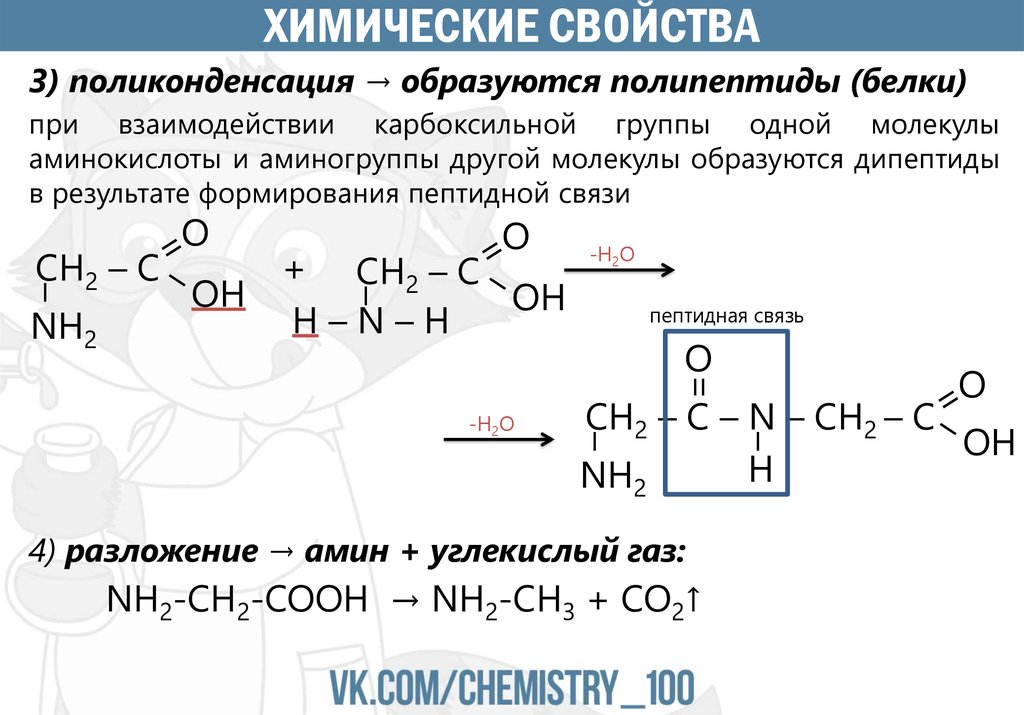
ХИМИЧЕСКИЕ СВОЙСТВА3) поликонденсация → образуются полипептиды (белки)
при взаимодействии карбоксильной группы одной молекулы
аминокислоты и аминогруппы другой молекулы образуются дипептиды
в результате формирования пептидной связи
+ CH2 – C
OH
OH
Н–N–H
-H2O
пептидная связь
O
O
=
NH2
O
–
–
CH2 – C
O
4) разложение → амин + углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
–
CH2 – C – N – CH2 – C
OH
H
NH2
–
-H2O
6.
ХИМИЧЕСКИЕ СВОЙСТВА4) внутримолекулярная нейтрализация → образуется
биполярный цвиттер-ион:
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа
представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула
обладает значительным дипольным моментом при нулевом суммарном заряде.
Именно из таких молекул построены кристаллы большинства аминокислот.
H2N – CH2 – C
O
OH
+
H3N – CH2 – C
O
O–
В водных растворах аминокислоты существуют в виде
равновесных смесей молекул и биполярных ионов, которые в
кислой среде переходят в катионную форму, а в щелочной – в
анионную.
7.
ХИМИЧЕСКИЕ СВОЙСТВАПри
образовании
внутренних
солей
моноаминомонокарбоновых кислот характер среды не
изменяется. Такие аминокислоты называются нейтральными.
Суммарный заряд внутренних солей равен нулю.
При образовании внутренних солей моноаминодикарбоновых
кислот образуется избыток ионов водорода, поэтому водные
растворы этих кислот имеют pH < 7. Такие кислоты называются
кислыми. Суммарный заряд внутренних солей отрицательный.
При образовании внутренних солей диаминомонокарбоновых
кислот образуется избыток гидроксид-ионов, поэтому их
водные растворы имеют pH > 7. Такие аминокислоты
называются основными. Суммарный заряд внутренних солей
положительный.
8.
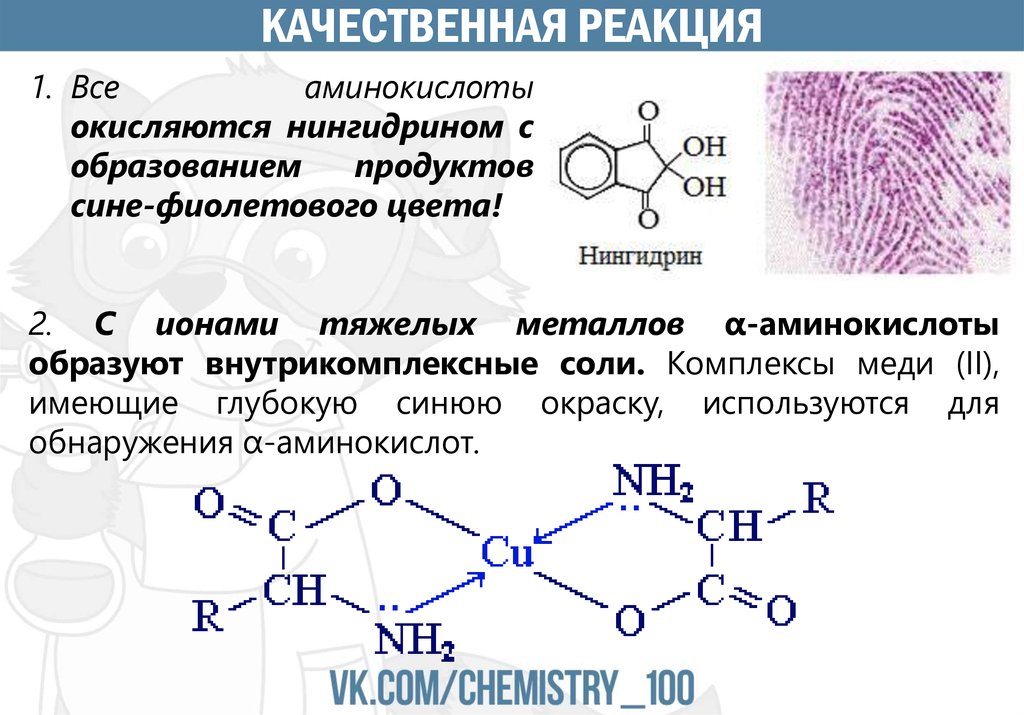
КАЧЕСТВЕННАЯ РЕАКЦИЯ1. Все
аминокислоты
окисляются нингидрином с
образованием
продуктов
сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты
образуют внутрикомплексные соли. Комплексы меди (II),
имеющие глубокую синюю окраску, используются для
обнаружения α-аминокислот.




 chemistry
chemistry








