Similar presentations:
Кривые титрования. (Лекция 6)
1. КРИВЫЕ ТИТРОВАНИЯ
2. План:
Титрование сильной кислоты сильным основанием(или наоборот).
Кривая титрования слабой одноосновной кислоты.
сильным основанием.
Кривая титрования слабого основания сильной
кислотой.
Кривые титрования многоосновных кислот и их
солей.
3. HCl + NaOH ↔ NаCl + H2O
,[OH
0
1
]
1
0
м
о
л
ь
/
10
4
1
4
10
HCl + NaOH ↔ NаCl + H2O
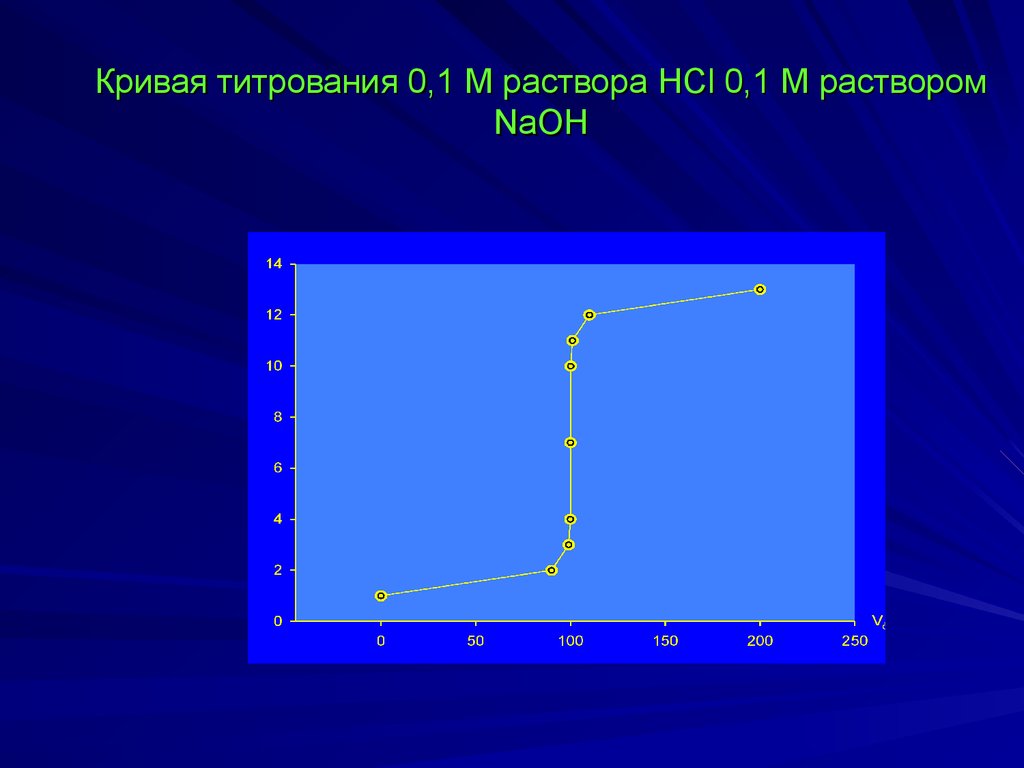
Исходный раствор:
[H+] = [HCl] = 1.10-1 рН= -lg[HCl] = 1,00
В начале скачка титрования раствор недотитрован на
0,1 %, т.е. прибавлено 99,9 мл 0,1 М NaOH,
[H+] = 0,0001 моль/л или 10-4, рН = 4.
В ТЭ рН = 7.
В конце скачка титрования раствор перетитрован на 0,1
рН = –lg[H+] = –lg10-10 = 10,0
4.
Кривая титрования 0,1 М раствора HCl 0,1 М растворомNaOH
5.
Кривая титрования раствора HCl раствором NaOH:1 – 1 М растворы, 2 – 0,1 М растворы,
3 – 0,01 М растворы, 4 – 0,001 М растворы
ðÍ
16
1
2
3
4
14
12
10
8
6
4
2
0
0
50
100
150
200
250
V
6.
Температура раствораС повышением температуры увеличивается ионное
произведение воды (при 25°С Кw=1,00∙10-14; при
100°С Кw=55,00∙10-14), сужается естественная шкала
кислотности воды, и если нейтральная среда при
25°С характеризуется [H+]=[ОH-]=10-7, то при 100°С
[H+]=[ОH-]=7,41∙10-7. Это приводит к уменьшению
диапазона рН кривых титрования и уменьшению
скачка титрования.
7.
Силы титруемой кислоты или основания (Ка, Кb)Можно оттитровать вещества, у которых
Ка, Кb ≥ 5·10-8
8.
C5
0
b
рН
К
lgа 4,76 lg 4,76
а
СH3COOH + NaOH ↔ СH3COONa + H2O
СH3COOH + OH- ↔ СH3COO- + H2O
Kа (СH3COOH) =1,74∙10-5, pKа (СH3COOH) = 4,76.
рН исходного раствора:
рН = ½ рKа – ½ lg Са = ½ ∙ 4,76 – ½ ∙ lg 0,1 = 2,88
Точка полунейтрализации. Оттитровано 50%
СH3COOH.
9.
C9
,
b
рН
К
lgа
4,76
lg01
76
а
Точка начала скачка титрования. Раствор недотитрован
на 0,1%:
Точка эквивалентности:
pН = 7 + ½ рКа + ½ lgCb = 7+½ ∙ 4,76 + ½ ∙ lg 0,1 =
= 7+2,38-0,5=8,88
10.
,[OH
0
1
] 10 10м
оль/
4
1
4
10
Точка конца скачка титрования. Раствор перетитрован на 0,1%
рН = –lg[H+] = –lg10-10 = 10,0
11.
Кривая титрования 0,1 М раствора CH3COOH0,1 М раствором NaOH
ðÍ
14
12
10
8
6
4
2
0
50
100
150
200
250
Vò
12.
NH3·H2O + HCl ↔ NH4Cl + H2ONH3·H2O + H+ ↔ NH4+ + H2O
Кb (NH3) = 1,76 .10-5, pКb (NH3) = 4,755.
рН исходного раствора:
pH = 7+½ pKa + ½ lgCb
рКа = 14 - рКb = 14 - 4,755 = 9,245 = 9,25
рН = 7 + ½ . 9,25 + ½ lg 0,1 = 11,13
13.
C5
0
b
ррН
lН
К
g
9
,
2
l
g
9
,
2
5
а
а
C
0
,
1
b
К
lgа 9,25 lg9 925 3 6,25
а
Точка полунейтрализации (оттитровано 50%
NH3·H2O):
Точка начала скачка титрования (оттитровано 99,9%
NH3·H2O):
Точка эквивалентности (оттитровано 100% NH3·H2O):
рН = ½ рКа - ½ lg Са = ½ . 9,25 - ½ lg 0,l = 5,13
14.
,[H] 10м
0
1
оль/
4
Точка конца скачка титрования (перетитровано на
0,1 %):
рН = –lg[H+] = –lg10-4 = 4
15. Кривая титрования 0,1 М раствора NH4OH 0,1 М раствором HCl
ðÍ12
10
8
6
4
2
0
0
50
100
150
200
250
V
ò
16.
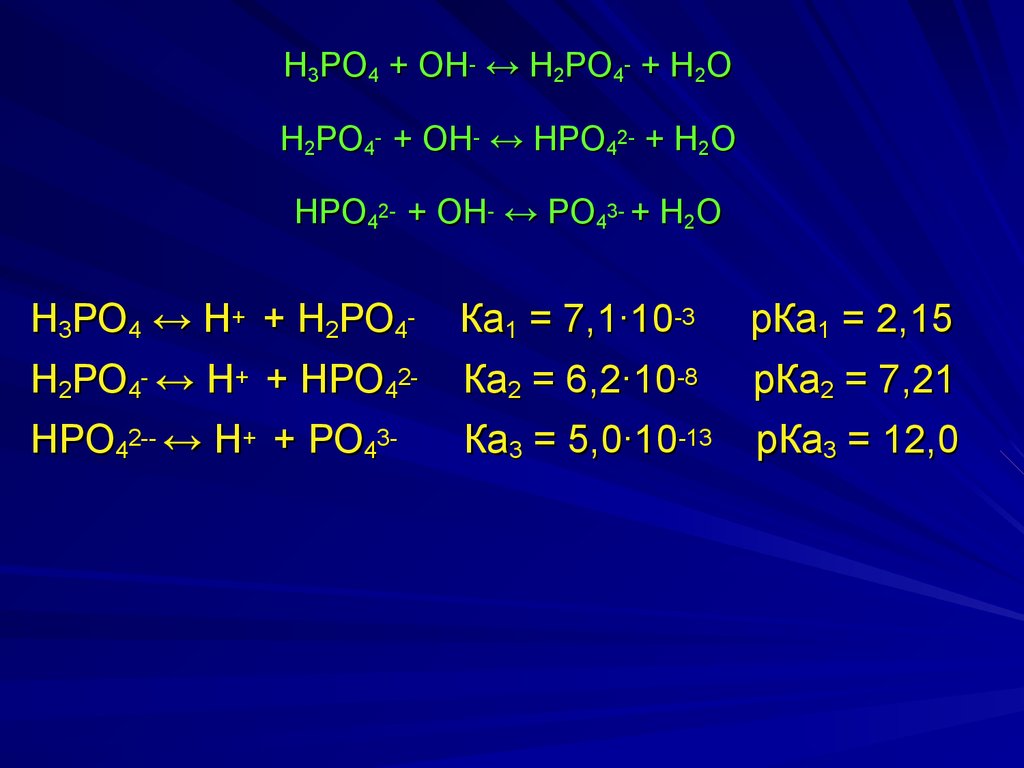
Н3РО4 + ОН- ↔ Н2РО4- + Н2ОН2РО4- + ОН- ↔ НРО42- + Н2О
НРО42- + ОН- ↔ РО43- + Н2О
Н3РО4 ↔ Н+ + Н2РО4Н2РО4- ↔ Н+ + НРО42НРО42-- ↔ Н+ + РО43-
Ка1 = 7,1∙10-3
Ка2 = 6,2∙10-8
рКа1 = 2,15
рКа2 = 7,21
Ка3 = 5,0∙10-13
рКа3 = 12,0
17.
;8
,К
К
а
6
2
1
0
6
2
тК
8
,
7
1
0
1
3
7
1
1
3
К
а
,т23 К
а32w
5
0
1
6
8
,
1
0
8
6
2
1
4
2
2
,30 13
5
Константы титрования
рКт1 = рКа2 – рКа1 = 7,21 – 2,15 = 5,06
рКт2 =рКа3 – рКа2 = 12,0 – 7,21 = 4,79
рКт3 = рКw
рКw – рКа3 = 14,00 – 12,0 = 2,0.
2,0.
18.
19.
Кривая титрования 0,1 М раствора H3PO4 0,1 Мраствором NaOH
ðÍ
14
12
HPO42-
10
8
6
H2PO4
4
_
2
0
0
50
100
150
200
250
300
350
V,ì ë
20.
Для щавелевой кислотыКа1=5,6.10-2 (рКа1 = 1,25),
Ка2=5,4.10-5 (рКа2 = 4,27).
рКт1 = 4,27-1,25 = 3,02
21.
14
К
1
0
4
w
К
2
,
0
8
1
b
1
,К
тb122 К
4
8
a
2
1
4
8
w
7
5
ab
11
8
,К
b
2
1
0
4
2w
1
,
0
7
4
8
1
4
7
4
5
1
0
,2 108
2
H2CO3 ↔ HCO3- + H+
HCO3- ↔ CO32- + Н+
Ка1 = 4,5∙10-7
Ка2 = 4,8∙10-11
рКа1 = 6,35
рКа2 = 10,32
22.
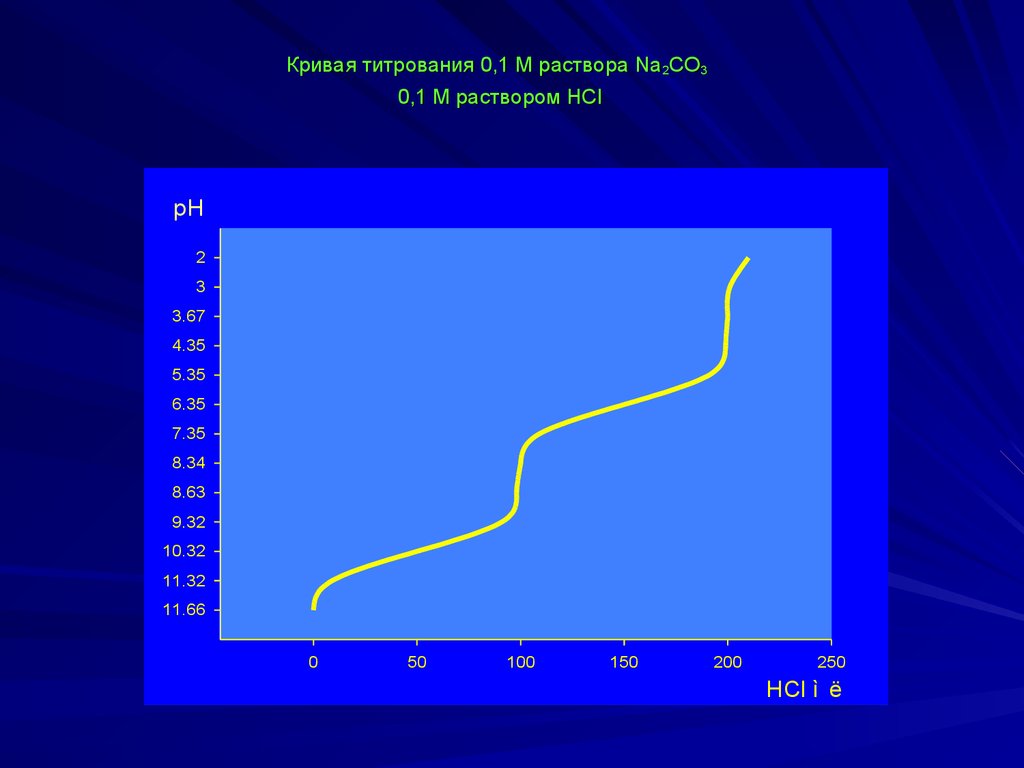
Na2CO3 + HCl ↔ NaHCO3 + NaClNaHCO3 + HCl ↔ H2CO3 + NaCl
23.
pH = 7 + ½ pKa2 + ½ lgCb= 7 + ½.10,32 + ½ lg0,1lg0,1 = = 11,66
рН в ТЭ:
рH1 = ½(рКа1 + рКа2) = ½(6,35 + 10,32) = 8,34
рН2 = ½ рКа1 - ½ lg Са = ½ . 6,35 - ½ lg 0,l
0,l =
= 3,175+0,5 = 3,68
24.
При титровании Na2СO3 с метиловым оранжевым fэ(Naэ(Na2CO3) = ½,
при титровании с фенолфталеином
fэ(Na
э(Na2CO3) = 1.
Vф.ф. = ½V
½Vм.о.
25.
Кривая титрования 0,1 М раствора Na2CO30,1 М раствором HCl
pH
2
3
3.67
4.35
5.35
6.35
7.35
8.34
8.63
9.32
10.32
11.32
11.66
0
50
100
150
200
250
HCl ì ë






















 physics
physics chemistry
chemistry








