Similar presentations:
Бензол
1. бензол
БЕНЗОЛПодготовил:Абдилдабеков Елдос СИБ 18-2
2. Из истории открытия:
В 1681 году при нагревании каменного угля без доступа воздуха был получен светильный газ.В 1792 году начала работать промышленная установка по его производству.
В 1814 году в Лондоне целый квартал освещался этим газом, но было отмечено, что в холодное время
года газовые фонари давали тусклое освещение.
Этот вопрос исследовал М.Фарадей.
На дне железных баллонов, в которых под давлением хранили светильный газ, он обнаружил
жидкость и вывел ее состав.
Состав оказался С6 Н6 .
В 1833 году Митчерлих получил это вещество перегонкой бензойной кислоты с известью,
Ю.Либних дал веществу название бензол.
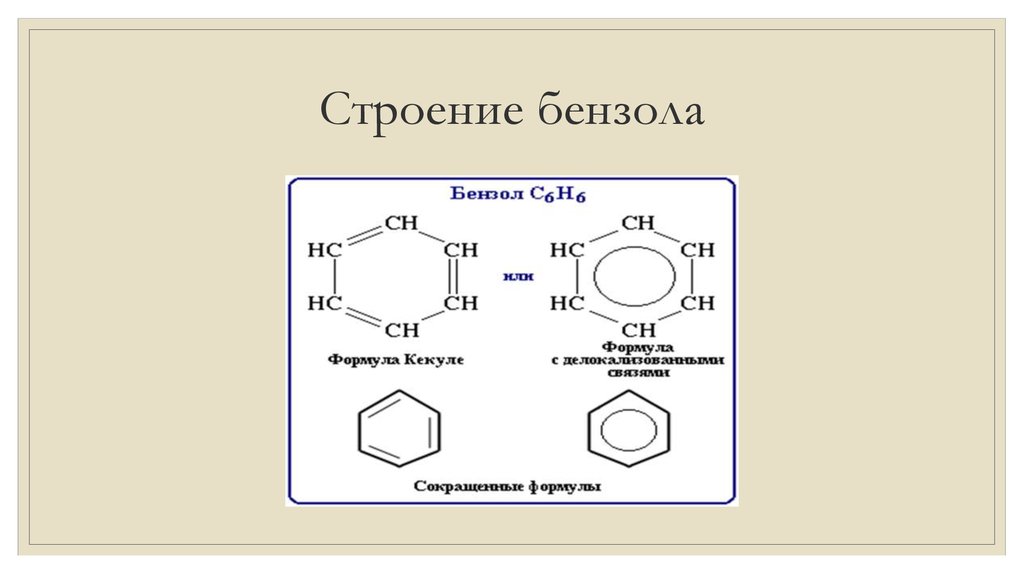
1865 год А.Кекуле предложил его структурную формулу.
3. Строение бензола
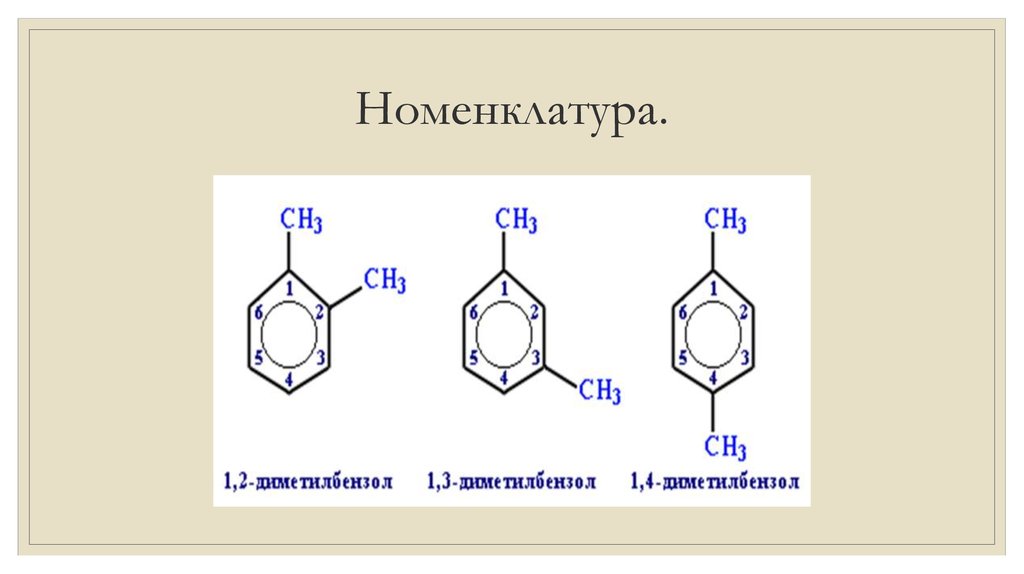
4. Номенклатура.
5. Получение бензола:
Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизациянефти», т.к. из нее получают гексан: С6H14 → C6H6 + 4H2
Дегидрирование циклогексана: этот метод хорошо тем, что можно получить не только бензол, но
и его гомологи. Для этого надо взять циклогексан с нужным количеством атомов С в боковой цепи:
С6H12 → C6H6 + 3H2
Алкилирование бензола: реакция проводится в присутствии катализатора — галогенидов
алюминия, например, AlCl3: C6H6 + CH3Cl → C6H5CH3 + HCl
Именная реакция — реакция Зелинского. Получение бензола из ацетилена: 3С2H2 → C6H6
6. Химические свойства:
Реакция электрофильного замещения: С6 Н6 + C2 H5 BrFeBr3
C6 H6 C2 H5
Алкилирование бензола, реакция Фриделя — Крафтса с образованием алкилбензолов: C6 H6 +
C2 H5 Br
FeBr3
C6 H5 C2 H5 + HBr
Реакции сульфирования и нитрования: С6 H6 + HNO3
H2SO4
C6 H5 NO2 + H2 O
C6 H6 + H2 SO4 ՜ C6 H5 SO3 H + H2 O
Горение бензола: 2C6 H6 + 15O2 ՜ 12CO2 + 6H2 O
7. Применение бензола:
1. Капрон2. Инсектициды
3. Фенопформальдегидная смола
4. Красители
5. Лекарственные вещества
6. Полистирол
8. фенол
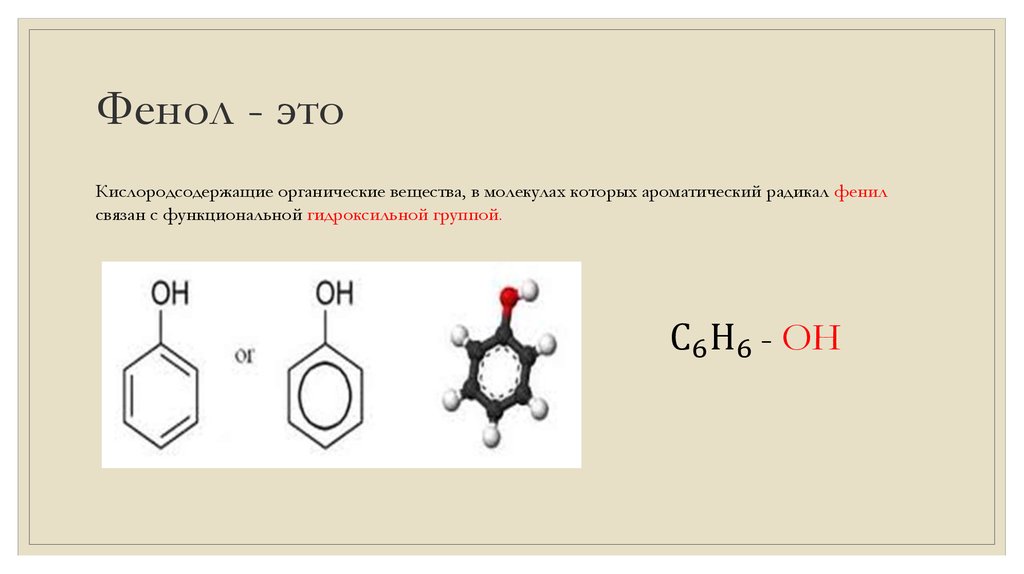
ФЕНОЛ9. Фенол - это
Кислородсодержащие органические вещества, в молекулах которых ароматический радикал фенилсвязан с функциональной гидроксильной группой.
С6 Н6 - ОН
10. Способы получения:
• Коксование каменного угля• Из бензола (устаревший способ): С6 Н6
Cl2
C6 H5 Cl
NaOH
C6 H5 OH
• Кумольный способ
Коксование каменного угля
проводят в коксовых печах.
Кокс сортируют и направляют
на металлургические заводы
11. Способы получения:
При коксовании, то есть при нагревании без доступа воздуха, из каменного угля получают четыреосновных продукта:
o Кокс – твердый остаток, практически чистый углерод (производство чугуна)
o Каменноугольная смола, содержащая несколько сотен орг. соед. (бензол, фенол)
o Аммиачная вода, содержащая аммиак, фенол и др.
o Коксовый газ, состоящий из метана
12. Физические свойства
Игольчатые кристаллы с характерным запахом (розовеют на воздухе в результате окисления), малорастворим в холодной воде, неограниченно – в горячей.
13. Химические свойства:
Взаимодействие фенола с натрием: C6 H5 OH + NaOH ՜ C6 H5 ONa + H2 OВзаимодействие с бромной водой: C6 H5 OH + 3Br2 ՜ C6 H2 Br3 OH + 3HBr
Взаимодействие с концентрированной азотной кислотой: C6 H5 OH +
3HNO3 ՜ C6 H2 (NO2 )3 OH + 3H2 O
Взаимодействие с хлоридом железа(III): 6C6 H5 OH + FeCl3 ՜ Fe(C6 H5 OH)6 Cl3
14. Применение фенола:
1. Моющие средства2. Заменитель сахара
3. Пестициды
4. Антисептики
5. Красители
6. Медицинские препараты
7. Фенолформальдегидные смолы
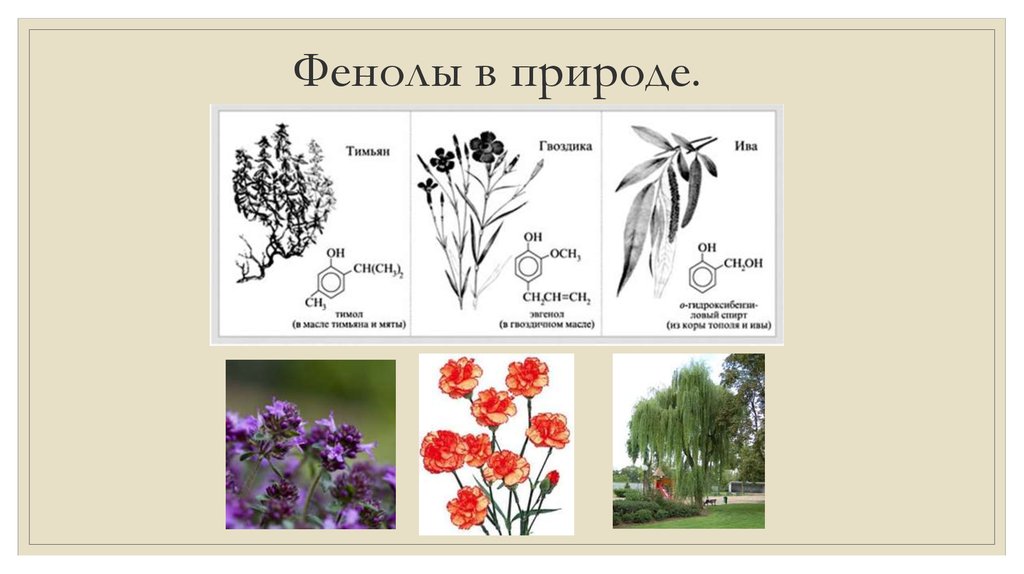
15. Фенолы в природе.
16. толуол
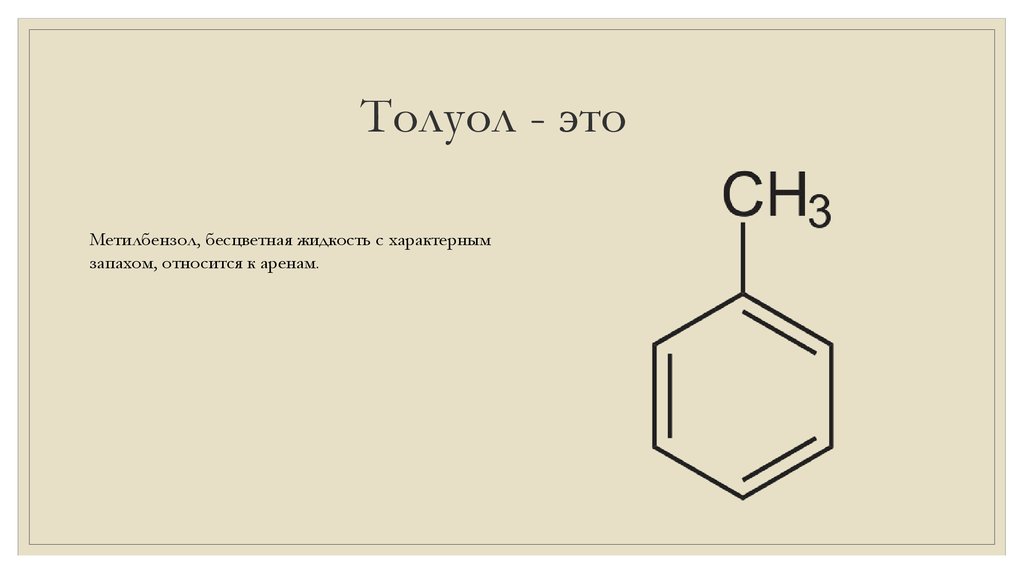
ТОЛУОЛ17. Толуол - это
Метилбензол, бесцветная жидкость с характернымзапахом, относится к аренам.
18. Способы получения:
◦ Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективнойэкстракцией и последующей ректификацией.
◦ Также хорошие выходы достигаются при каталитическом дегидрировании гептана через
метилциклогексан.
◦ Толуол также образует с водой азеотропную смесь.
◦ Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида
железа в качестве катализатора.
19. Физические свойства:
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие.Смешивается в неограниченных пределах с углеводородами, многими спиртами, простыми и
сложными эфирами, не смешивается с водой.
Показатель преломления света 1,4969 при 20 °C.
Горюч, сгорает коптящим пламенем.
20. Химические свойства:
Взаимодействие с перманганатом калия в кислой среде: 5C6 H5 CH3 + 6KMnO4 +9H2 SO4 ՜ 5C6 H5 COOH + 6MnSO4 + 3K 2 SO4 + 14H2 0
Взаимодействие с перманганатом калия в нейтральной среде: C6 H5 CH3 +
2KMnO4 ՜ C6 H5 COOH + 2MnO2 + 2KOH
21. Применение толуола:
1. Сырье для производства бензола2. Сырье для производства бензойной кислоты
3. Сырье для производства нитротолуолов
4. Сырье для производства тринитротолуола и др. органических веществ
5. Растворитель для многих полимеров
6. Входит в состав различных товарных растворителей для лаков и красок
7. Применяется как растворитель в химическом синтезе
22. Опасность и обращение.
◦ Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражениенервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе
необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит,
необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с
использованием вытяжной вентиляции.
◦ При высоких концентрациях пары действуют наркотически, вызывая сильные галлюцинации. Входит
в состав клея Момент, пользуется популярностью у токсикоманов. Опытным путем установлено, сто
психоактивное действие клея Момент интенсивней действия чистого толуола.
◦ Пары толуола образуют с воздухом взрывоопасную смесь. Толуол используется как сырье для
получения взрывчатого вещества – тринитротолуола.

















 chemistry
chemistry








