Similar presentations:
Аналитические реакции
1.
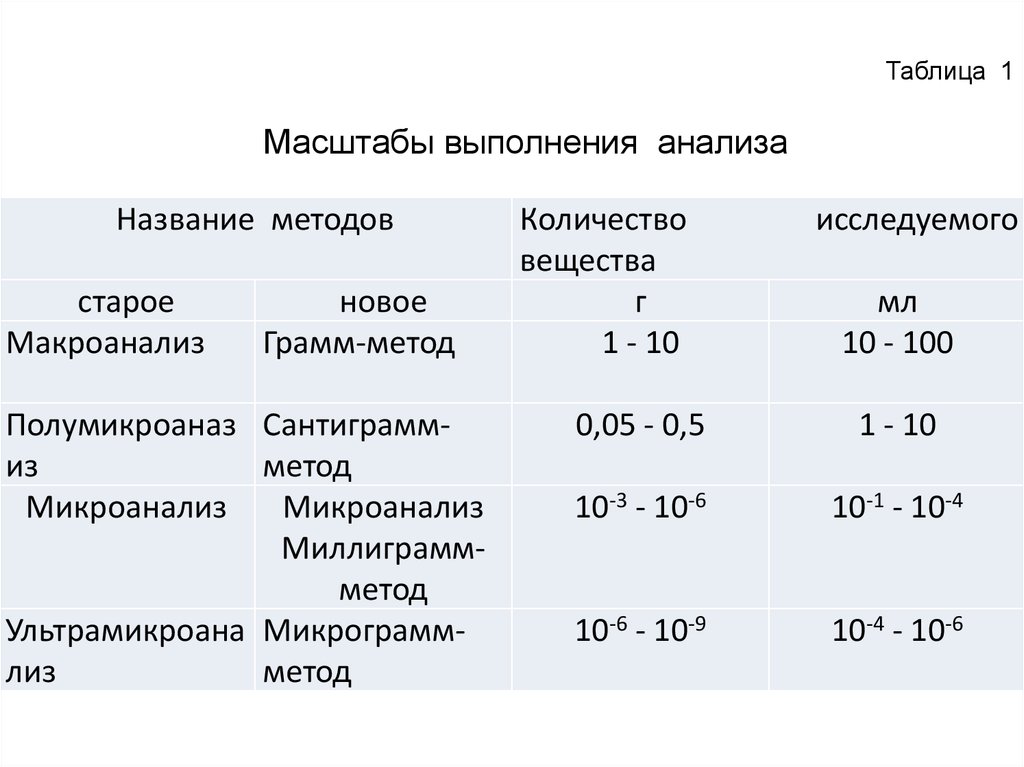
Таблица 1Масштабы выполнения анализа
Название методов
старое
Макроанализ
новое
Грамм-метод
Полумикроаназ Сантиграммиз
метод
Микроанализ
Микроанализ
Миллиграммметод
Ультрамикроана Микрограммлиз
метод
Количество
вещества
г
1 - 10
исследуемого
мл
10 - 100
0,05 - 0,5
1 - 10
10-3 - 10-6
10-1 - 10-4
10-6 - 10-9
10-4 - 10-6
2.
Реакции, которые сопровождаются внешниманалитическим эффектом :
Образование или растворение осадка
Например.
AgNO3 + HCl AgCl + HNO3 (реакция обмена)
AgCl +2NH3*H2O [Ag(NH3)2]Cl+2H2O(реакция комплексообразования)
белый осадок
бесцветный раствор
Изменение
цвета
раствора
или
образование
окрашенного соединения:
Например. Реакция окисления - восстановления
2 Mn (NO3)2 + 5 NaBiO3 + 4 HNO3 = 2NaMnO4 + 5(BiO)NO3 +
Бесцветный
раствор
восстановитель
кристаллы
окислитель
+ 3NaNO3 + 2H2O
розовый раствор
3.
Выделение газаНапример.
Na2CO3 + 2 HCl = 2 NaCl + H2CO3 ;
H2CO3 СО2 + H2O
4.
Частные, характерные аналитические реакции, прикоторых различные реагенты дают характерные
аналитические эффекты с одним ионом.
Например.
Pb2+ + 2 KI = 2 K + + PbI2 ( желтый осадок )
Pb2+ + K2CrO4 = 2 K+ + PbCrO4 ( желтый осадок )
Pb2+ + 2 HCl = 2 H+ + PbCl2 ( белый осадок )
Pb2+ + H2SO4 = 2 H+ + PbSO4 ( белый осадок )
5.
Групповые (общие) аналитические реакции, при которых одингрупповой (общий) реагент образует характерный аналитический
эффект с разными ионами. Групповыми реагентами могут быть
кислоты - HCl, H2SO4, H2S, основания - NaOH, KOH, NH4OH, соли BaCl2, AgNO3, ( NH4)2CO3, Na3PO4.
Например. Групповым реагентом на II аналитическую группу
катионов является 2М рас-твор HCl :
Pb2+ + 2 HCl = 2 H+ + PbCl2 ( белый осадок )
Ag+ + HCl = H+ + AgCl ( белый осадок )
Групповым реагентом на I аналитическую группу анионов может
быть раствор соли BaCl2 :
SO42- + BaCl2 = 2 Cl- + BaSO4 ( белый осадок )
СО32- + BaCl2 = 2 Cl- + BaCO3
( белый осадок )
SiO32- + BaCl2 = 2 Cl- + BaSiO3 ( белый осадок )
2 PO43- + 3 BaCl2 = 6 Cl- + Ba3(PO4)2 ( белый осадок )
HPO42- + Ba2+ = BaHPO4 ( белый осадок)
6.
Fe3+ + 3 SCN- = Fe (SCN)3Например, открываемый минимум Ca2+ составляет 0,1 мг.)
реакцией
CaCl2 + H2SO4 + 2 H2O = 2 HCl + CaSO4*2 H2O
1
m = v 10 6
g
Co2+ + 4 SCN- =
[ Co ( SCN )4 ]2- , добавить ацетон
тетратиоцианокобальтат (II) анион голубой раствор
7.
Ag+ + 2 S2O32Cu2+ + 2 S2O32Pb2+ + 2 S2O32Pb2+ + 3 S2O32-= [Ag(S2O3)2]3= [Cu(S2O3)2]2= [Pb(S2O3)2]2= [Pb(S2O3)3]4-
Кнест. = 3,4 x 10-14
Кнест. = 5,1 x 10-13
Кнест. = 7,7 x 10-6
Кнест. = 4,5 x 10-7
Например.
CH3COOH и CH3COONa pH смеси ~ 4,7 ацетатный буфер
слабая кислота ее соль
уксусная
ацетат натрия
NH4OH
и
слабое основание
раствор аммиака
NH4Cl pH смеси ~9 (аммиачный) буфер
соль слабого основания
хлорид аммония
KH2PO4 и Na2HPO4 pH смеси ~ 4,8 - 8 фосфатный буфер
8.
Na+ + [Sb(OH)6]- = Na [Sb(OH)6]белый мелкокристаллический осадок
гексагидроксостибат (V) натрия
NH4+ + OH- = NH3 + H2O
Pb2+ + 2 Cl- = PbCl2 ,
если [Pb2+] [Cl-]2 < ПР (PbCl2). В этом случае следует
повторить открытие Pb2+ c реагентом KI. Справочные
значения произведения растворимости:
ПР (PbCl2) = 1,6 x 10-5 ,
ПР (PbI2) = 1,9 x 10-9
[Pb2+] [I-]2 > ПР (PbI2).
9.
Na2B4O7 + CoO = 2 NaBO2 Co(BO2)2.CoSO4*6H2O+ 4NH4SCN (NH4)2[Co(SCN)4]+(NH4)2SO4 +6H2O
кристаллы
кристаллы
кристаллы синего цвет
Fe3+ + K+ + [Fe(CN)6]4- = KFe[Fe(CN)6]
Метод анализа, основанный на применении реакций, при
помощи которых можно обнаружить искомые ионы в
отдельных порциях, не прибегая к определенной схеме
систематического анализа, называется дробным методом
анализа.
10.
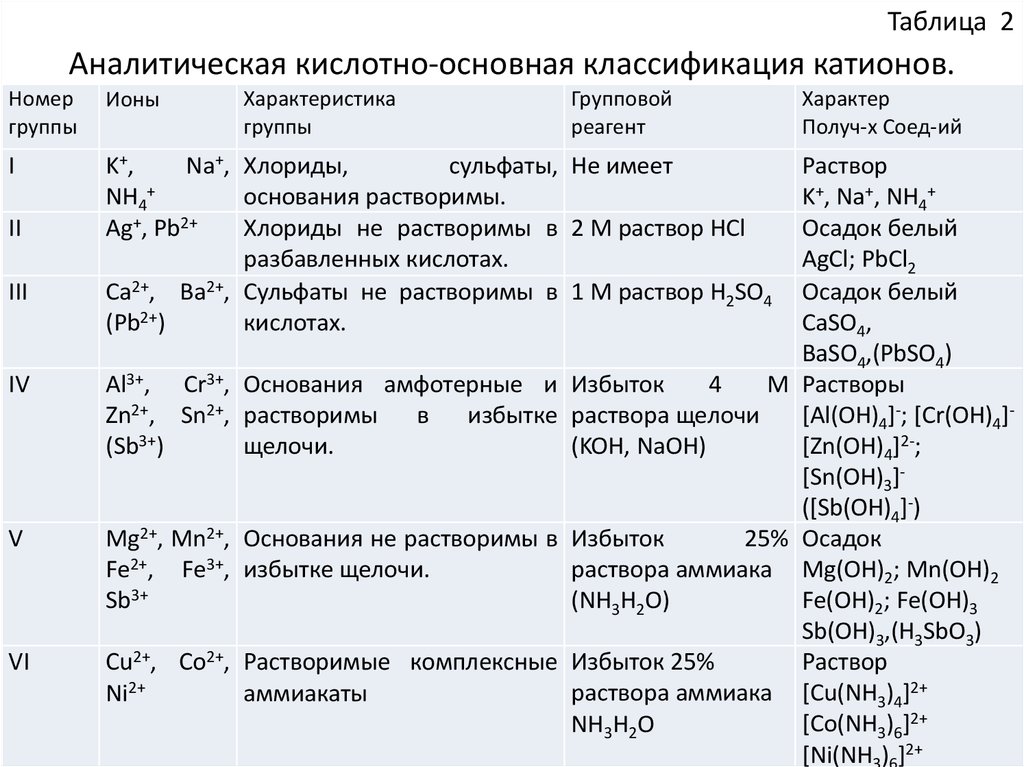
Таблица 2Аналитическая кислотно-основная классификация катионов.
Номер
группы
Ионы
I
K+,
Na+, Хлориды,
сульфаты, Не имеет
NH4+
основания растворимы.
Хлориды не растворимы в 2 М раствор HCl
Ag+, Pb2+
разбавленных кислотах.
Ca2+, Ba2+, Сульфаты не растворимы в 1 М раствор H2SO4
(Pb2+)
кислотах.
II
III
IV
Al3+, Cr3+,
Zn2+, Sn2+,
(Sb3+)
V
Mg2+, Mn2+,
Fe2+, Fe3+,
Sb3+
VI
Cu2+, Co2+,
Ni2+
Характеристика
группы
Групповой
реагент
Характер
Получ-х Соед-ий
Раствор
K+, Na+, NH4+
Осадок белый
AgCl; PbCl2
Осадок белый
CaSO4,
BaSO4,(PbSO4)
Основания амфотерные и Избыток
4
М Растворы
растворимы
в
избытке раствора щелочи
[Al(OH)4]-; [Cr(OH)4][Zn(OH)4]2-;
щелочи.
(KOH, NaOH)
[Sn(OH)3]([Sb(OH)4]-)
Основания не растворимы в Избыток
25% Осадок
раствора аммиака Mg(OH)2; Mn(OH)2
избытке щелочи.
Fe(OH)2; Fe(OH)3
(NH3H2O)
Sb(OH)3,(H3SbO3)
Растворимые комплексные Избыток 25%
Раствор
раствора аммиака [Cu(NH3)4]2+
аммиакаты
[Co(NH3)6]2+
NH3H2O
[Ni(NH3)6]2+
11.
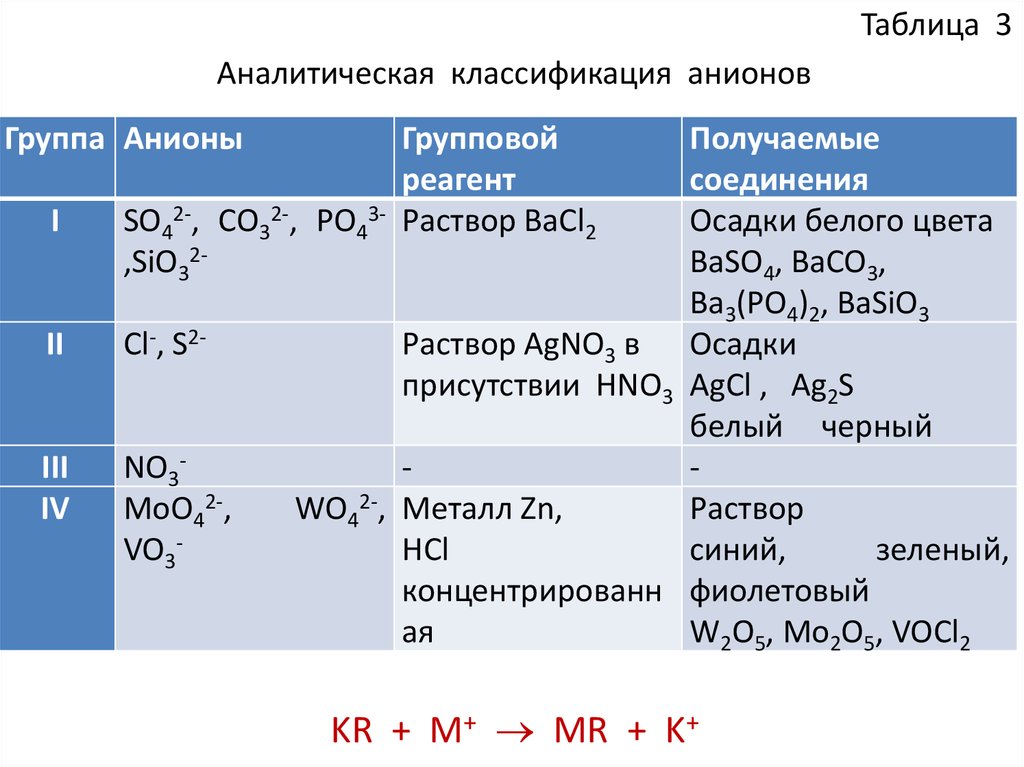
Таблица 3Аналитическая классификация анионов
Получаемые
соединения
SO42-, CO32-, PO43Осадки белого цвета
BaSO4, BaCO3,
,SiO32Ba3(PO4)2, BaSiO3
Раствор AgNO3 в Осадки
Cl-, S2присутствии HNO3 AgCl , Ag2S
белый черный
NO3MoO42-,
WO42-, Металл Zn,
Раствор
HCl
синий,
зеленый,
VO3концентрированн фиолетовый
ая
W2O5, Mo2O5, VOCl2
Группа Анионы
I
II
III
IV
Групповой
реагент
Раствор BaCl2
KR + M+ MR + K+
12.
Например. Можно ли перевести осадок Ag2CO3 в AgCl ?Справочные значения ПР для этих малорастворимых
соединений :
ПР (Ag2CO3) = 8,2x10-12 , ПР (AgCl) = 1,8x10-10.
Для превращения можно использовать реакцию :
Ag2CO3 + 2 HCl = 2 AgCl + H2CO3
В этой реакции катион Ag+ переходит из одного вида
осадка в другой, а анион исходного осадка связывается в
малодиссоциируемую (слабую) угольную кислоту
( К1= 4,4х10-7, К2 = 4,7х10-11, К1х К2 = 20,68х10-18). Для этого
уравнения выражение константы равновесия имеет вид :
Кр =
ПР Ag 2 CO 3
ПР 2 AgCl K H 2 CO 3
8,2 10 12
3,4 10 20 20,68 10 18
116
, 1025
13.
Sn2+ + H2S = SnS + 2H+Zn2+ + H2S = ZnS + 2H+
коричневый
белый
ПР(SnS) = 1x10-26
ПР(ZnS) = 1,2x10-23
ПР(SnS) = [Sn2+][S2-]
ПР(ZnS) = [Zn2+][S2-]
Откуда
[S2-] = ПР/[Sn2+] = 1x10-26/0,1 = 1x10-25 моль
[S2-] = 1,2x10-23/0,1 = 1,2x10-22 моль
Из расчета следует вывод, что, если 1,2x10-22 > [S2-] > 1x1025, то будет осаждаться только SnS.
H2S 2 H+ + S2-
H S
=
11
, 10
2
Кдис.
2
H S
2
21
14.
[H+] =+
[H ] =
11
, 10 21 0,1
= 33 моль/ л.
25
1 10
11
, 10 21 0,1
= 0,96 моль/л, рН = -lg0,96 = 1.
22
1,2 10
0,96 < [H+] < 33
2 [SbCl6] - + 5 H2S = Sb2S5 + 10 H+ + 12 Cl2 [SbCl6]3- + 3 H2S = Sb2S3 + 6 H+ + 12 Clоранжевый
осадок
15.
2BaCrO4 + 3 H+ 2 Ba2+ + HCr2O7- + H2OПР BaCrO 4
Кр =
+
[H ] =
3
K( H 2 O) K HCr2 O 7
10
14
2,3 10 10
2
1,6 10
10 2
Ba HCr O
H
2 2
2
2
7
3
5 2
0,97 10 2 9,7 10 3 ,
3NH4+ +HPO42-+12 MoO42- +23H+ =(NH4)3[PMo12O40] +12H2O
желтый осадок
аммонийная соль фосфорномолибденовой
гетерополикислоты
16.
H2CrO4 +CrO3
=
H2[CrO4(CrO3)]
хромовая
кислота
ангидрид
хромовой кислоты
или H2Cr2O7
дихромовая
кислота
H3PO4 + 12MoO3 = H3[PO4(MoO3)12] или H3[P(Mo12O40)]
фосфорная ангидрид
фосфорномолибденовая
кислота
молибденовой
гетерополикислота
H2MoO4 кислоты
[Pb2+] [Cl-]2 = [ 0,25 ] [ 2 ]2 = 1
[Pb2+] [Cl-]2 = ПР(PbCl2)
2
Pb
ПР PbCl 2
Cl
1
2
1,65 10 5
2 2
4,0 10 6
[Pb2+] [SO42-] = 4,0*10-6 x 1 = 4,0*10-6
17.
Например.AgCl + 2NH3H2O
белый
осадок
=
концентрированный
раствор
[Ag(NH3)2]Cl + 2 H2O
бесцветный
раствор
Уравнение реакции в ионно-молекулярном виде:
AgCl + 2NH3H2O = [Ag(NH3)2]+ + Cl- + 2 H2O
ПР=1,8х10-10
Кн=9,3х10-8
Выражение константы равновесия для этой реакции имеет
вид :
ПР(AgCl) K ( NH 3 H 2 O) 1,8 10 1,8 10
15
Кр =
6
,
2
10
K([Ag( NH 3 ) 2 ] ) K 2 ( H 2 O)
9,3 10 8 (10 14 ) 2
2
10
5 2
18.
Fe3+ + 6 SCN- = [Fe(SCN)6]32MoO42- + Sn2+ + 10 SCN- + 12 H+ + 6 Cl- = 2[MoO(SCN)5]2- +[SnCl6]2- + 6H2O
красный цвет
[Ag(NH3)2]+ + I- = AgI + 2 NH3
Кн= 9,3х10-8
ПР 8,3х10-17
19.
Al3+ + 3OH- = Al(OH)3 - амфотерный гидроксид2 Cr3+
2 WO42- +
Al(OH)3 + OH- = [Al(OH)4]+ 3 H2O2 + 10 OH- = 2 CrO42- + 8 H2O
Zn
бесцветный
окислитель
восстановитель
S2-
2 MoO42-
+
восстановитель
+ 6 H+ = W2O5
синий
окислитель
+ Zn2+ + 3H2O
+ 6 H+ = Mo2O5 + S + 3 H2O
HVO3 + OH- = H2O + VO3-
синий цвет
(VO3- - преобладает в щелочных растворах)
кислота
VO2(OH) + H+=H2O + VO2+ (катион
VO2+- преобладает в кислых растворах)
основание
VO2+ + 2 H+ = H2O + VO+++
в сильнокислых растворах
20.
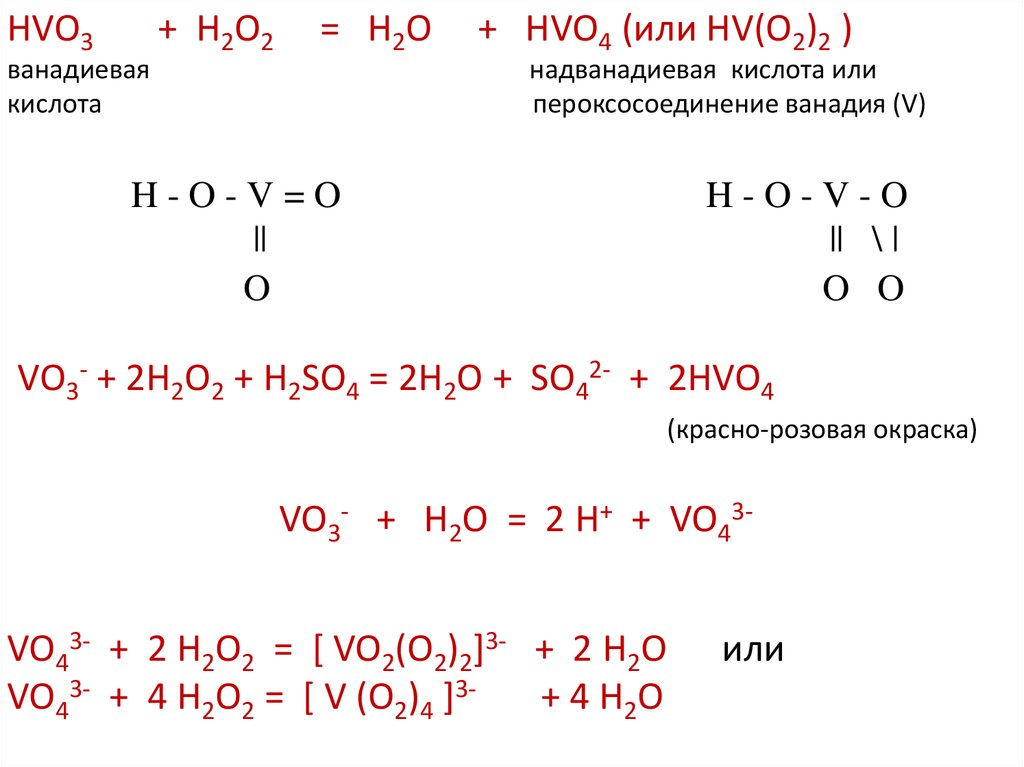
HVO3ванадиевая
кислота
+ H2O2
= H2O
+ HVO4 (или HV(O2)2 )
надванадиевая кислота или
пероксосоединение ванадия (V)
H-O-V=O
||
O
H-O-V-O
|| \ |
O O
VO3- + 2H2O2 + H2SO4 = 2H2O + SO42- + 2HVO4
(красно-розовая окраска)
VO3- + H2O = 2 H+ + VO43VO43- + 2 H2O2 = [ VO2(O2)2]3- + 2 H2O
VO43- + 4 H2O2 = [ V (O2)4 ]3+ 4 H2O
или
21.
VO43- + 2 H2O2 = [ VO2(O2)2]3- + 2 H2OVO43- + 4 H2O2 = [ V (O2)4 ]3+ 4 H2O
или
2 VO3- + 3 Zn + 12 H+ + 6 H2O = 2 [ V(H2O)6 ]2+ + 3 Zn2+
фиолетовый
Ионы ванадия различной степени окисления имеют
разную окраску:
Степень окисления Формула иона
Цвет
ванадия
V
VO3Бесцветный
IV
VO++
Светло-синий
IV
V2O2++++
Синий
III
V+++
Зеленый
II
V++
Фиолетовый

















 chemistry
chemistry








