Similar presentations:
Нервно-мышечный блок. Модуль 1: общие сведения о миорелаксантах
1. Нервно-мышечный блок
Модуль 1: общие сведения омиорелаксантах
Слайд 1
2. Миорелаксанты – необходимая составляющая общей анестезии
Обеспечивают хирургический доступ к органам безпрепятствий в виде произвольного или
рефлекторного сокращения мышц1
– Брюшная полость
– Грудная клетка
Позволяют выполнить эндотрахеальную интубацию2
Снижают потребность в анестетиках2
МР = миорелаксанты.
1. Hunter JM. N Engl J Med. 1995;332:1691–1699; 2. Zlotos DP. Mini Rev Med Chem. 2005;5:595–606.
Слайд 2
3. Миорелаксанты угнетают нервно-мышечную передачу1
Миорелаксанты угнетают нервномышечную передачу1МР препятствуют связыванию ацетилхолина с его
рецепторами, что приводит к блокаде нервно-мышечной
передачи
Миорелаксанты делятся на:
– Деполяризующие
• Ацетилхолин - подобный эффект на ацетилхолиновые рецепторы
• Вызывают открытие ионных каналов, что приводит к
деполяризации мембраны мышечной клетки и мышечным
фасцикуляциям
• Не метаболизируются холинэстеразой, что сприводит к более
длительной занятости рецепторов и развитию миорелаксации
– Недеполяризующие
• Конкурирующие действие за связь с рецепторами ацетилхолина
• Ионные каналы остаются закрытыми, приводя к развитию
миоплегии
МР = миорелаксанты.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 3
4. Мониторинг нервно-мышечной передачи путем стимуляции периферического нерва1
Мониторинг нервно-мышечной передачи необходим для точнойдозировки МР
Для мониторинга глубины нервно-мышечного блока чаще всего
используется четырехразрядная (TOF) стимуляция
В течение 2 секунд подается серия из четырех
супрамаксимальных импульсов
– Оценивается количество или соотношение ответов мышцы
– T4 снижается при блоке 70%–75% н-холинорецепторов
– T3 , T2 и T1 исчезают при блоке 85%, 85%–90% и 90%–98%
н-холинорецепторов соответственно
– TOF-отношение ≥ 0,9 свидетельствует о полном
клиническом восстановлении нервно-мышечной передачи
МР = миорелаксанты; T1 , T2 , T3 , T4 = интенсивность первого, второго, третьего и четвертого ответов в режиме стимуляции TOF.
1. Murphy GS et al. Int Anesthesiol Clin. 2004;42:25–40.
Слайд 4
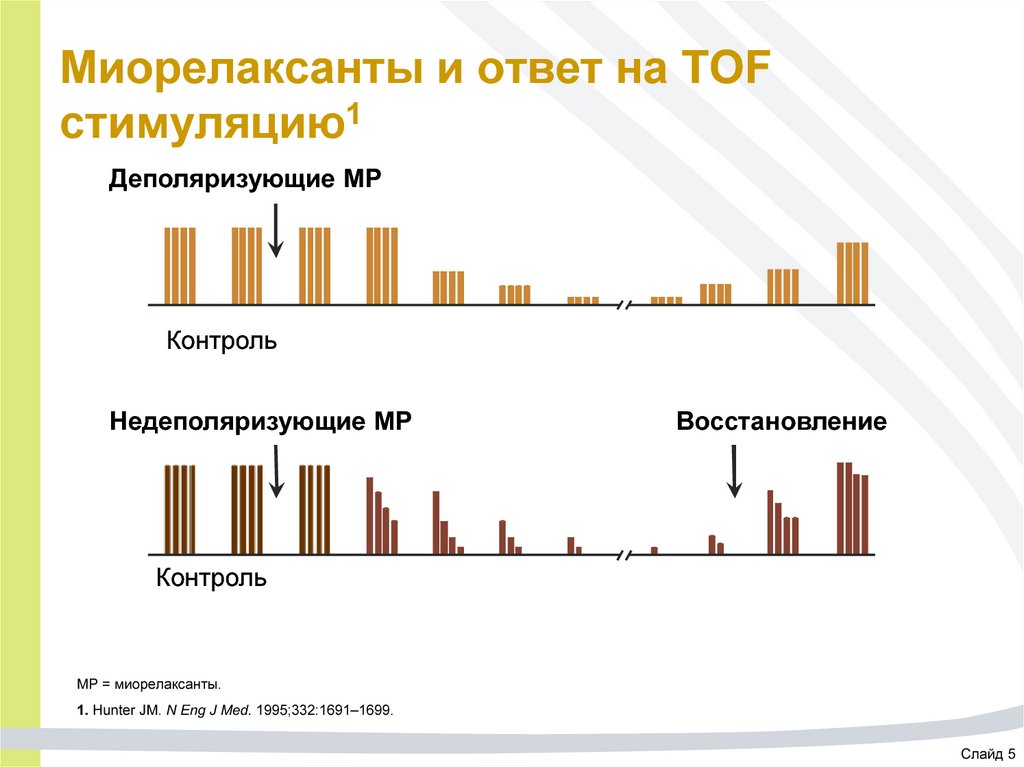
5. Миорелаксанты и ответ на TOF стимуляцию1
Деполяризующие МРКонтроль
Недеполяризующие МР
Восстановление
Контроль
МР = миорелаксанты.
1. Hunter JM. N Eng J Med. 1995;332:1691–1699.
Слайд 5
6. Устранение нервно-мышечного блока
Предпочтительно быстрое, полное и надежноевосстановление нейромышечной проводимости1
– Спонтанное восстановление после введения недеполяризующих МР
нецелесообразно2
– Спонтанное устранение блока после введения деполяризующих МР и
недеполяризующего МР мивакурия происходит достаточно быстро3
Устранение действия недеполяризующих МР
выполняется путем введения препаратов для
устранения нервно-мышечного блока
– Ингибиторы холинэстеразы3
– Селективные релаксант-связывающие препараты (например,
сугаммадекс)4
МР = миорелаксанты.
1. Jones RK et al. Anesthesiology. 2008;109:816–824; 2. Fisher DM. Am J Health Syst Pharm. 1999;56:S4–S9; 3. Morgan GE Jr et al. Clinical
Anesthesiology. 4th ed. McGraw-Hill; 2006; 4. Groudine SB et al. Anesth Analg. 2007;104:555–562.
Слайд 6
7. Идеальный МР для хирургических вмешательств
Недеполяризующий механизм действияБыстрое начало действия
Короткая продолжительность действия
Быстрое восстановление
Отсутствие кумуляции
Отсутствие тяжелых побочных эффектов со стороны
сердечно-сосудистой системы
Не вызывает высвобождения гистамина
Обратимость действия
Отсутствие лекарственных взаимодействий
Фармакологически неактивные метаболиты
Независимость от экскреторной функции органов
Стабильность в растворе и готовая к введению форма
выпуска
МР = миорелаксант.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 7
8. Существующие МР1
ДеполяризующиеНедеполяризующие
Бензилизохинолины
Аминостероиды
Сукцинилхолин
Атракурий
Цисатракурий
Мивакурий
Доксакурий
Панкуроний
Пипекуроний
Векуроний
Рокуроний
МР = миорелаксанты.
1. Morgan GE Jr et al. Clinical Anesthesiology. 4th ed. McGraw-Hill; 2006.
Слайд 8
9. Сукцинилхолин считался миорелаксантом выбора1
Деполяризующий механизм действияБыстрое начало действия
Короткая продолжительность действия
Спонтанное восстановление из нервно-мышечного
блока
1. Fisher DM. Am J Health Syst Pharm. 1999;56:S4–S9.
Слайд 9
10. Сукцинилхолин вызывает множество побочных эффектов1
Побочные эффекты сукцинилхолина иногда могутприводить к тяжелым осложнениям, включая:
–
–
–
–
синдром злокачественной гипертермии
ригидность жевательных мышц
воздействие на сердечно-сосудистую систему
миалгия
1. Fisher DM. Am J Health Syst Pharm. 1999;56:S4–S9.
Слайд 10
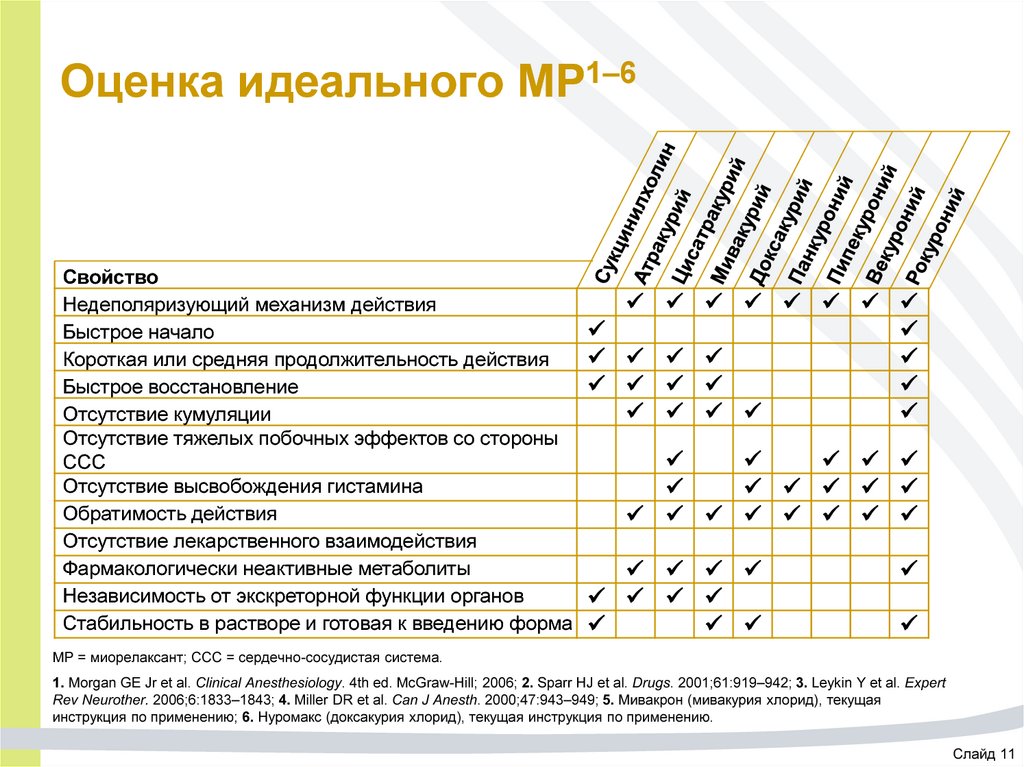
11. Оценка идеального МР1–6
СвойствоНедеполяризующий механизм действия
Быстрое начало
Короткая или средняя продолжительность действия
Быстрое восстановление
Отсутствие кумуляции
Отсутствие тяжелых побочных эффектов со стороны
ССС
Отсутствие высвобождения гистамина
Обратимость действия
Отсутствие лекарственного взаимодействия
Фармакологически неактивные метаболиты
Независимость от экскреторной функции органов
Стабильность в растворе и готовая к введению форма
МР = миорелаксант; ССС = сердечно-сосудистая система.
1. Morgan GE Jr et al. Clinical Anesthesiology. 4th ed. McGraw-Hill; 2006; 2. Sparr HJ et al. Drugs. 2001;61:919–942; 3. Leykin Y et al. Expert
Rev Neurother. 2006;6:1833–1843; 4. Miller DR et al. Can J Anesth. 2000;47:943–949; 5. Мивакрон (мивакурия хлорид), текущая
инструкция по применению; 6. Нуромакс (доксакурия хлорид), текущая инструкция по применению.
Слайд 11
12. Рокуроний1
Рокуроний представляетсобой недеполяризующий
миорелаксант, который
связывается с н-холинорецепторами концевой
пластинки мембраны мышечных клеток
Рокуроний показан:
– Как компонент общей анестезии для облегчения
интубации трахеи при обычной и быстрой
последовательной индукции, а также для обеспечения
мышечной релаксации во время оперативного
вмешательства
– Как компонент интенсивной терапии для облегчения
интубации трахеи и искусственной вентиляции легких
1. ЭСМЕРОН™ (рокурония бромид), текущая инструкция по применению.
Слайд 12
13. Рокуроний приближается по свойствам к идеальному МР
Недеполяризующий механизм действия1Быстрое начало действия2
Средняя продолжительность действия2
Отсутствие клинически значимых побочных эффектов со
стороны сердечно-сосудистой системы3,4
Отсутствие значительного высвобождения гистамина4,5
Отсутствие образования или накопления активных
метаболитов6
Обратимость при введении селективного миорелаксантсвязывающего препарата (сугаммадекс) или ингибиторов
холинэстеразы7
МР = миорелаксант.
1. Booij LHDJ et al. Anaesthesia. 1991;46:341–343; 2. Cooper RA et al. Anaesthesia. 1993;48:103–105; 3. Hudson ME et al. Can J Anaesth.
1998;45:139–143; 4. Levy JH et al. Anesth Analg. 1994;78:318–321; 5. Naguib M et al. Br J Anaesth. 1995;75:588–592; 6. van den Broek L et
al. J Clin Anesth. 1994;6:288-296; 7. Jones RK et al. Anesthesiology. 2008;109:816–824.
Слайд 13
14. Нервно-мышечный блок
Модуль 2: Начало действиямиорелаксантов
Слайд 1
15. Свойства идеального МР1
1. Недеполяризующий механизм действия2. Быстрое начало действия
МР = миорелаксант.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 2
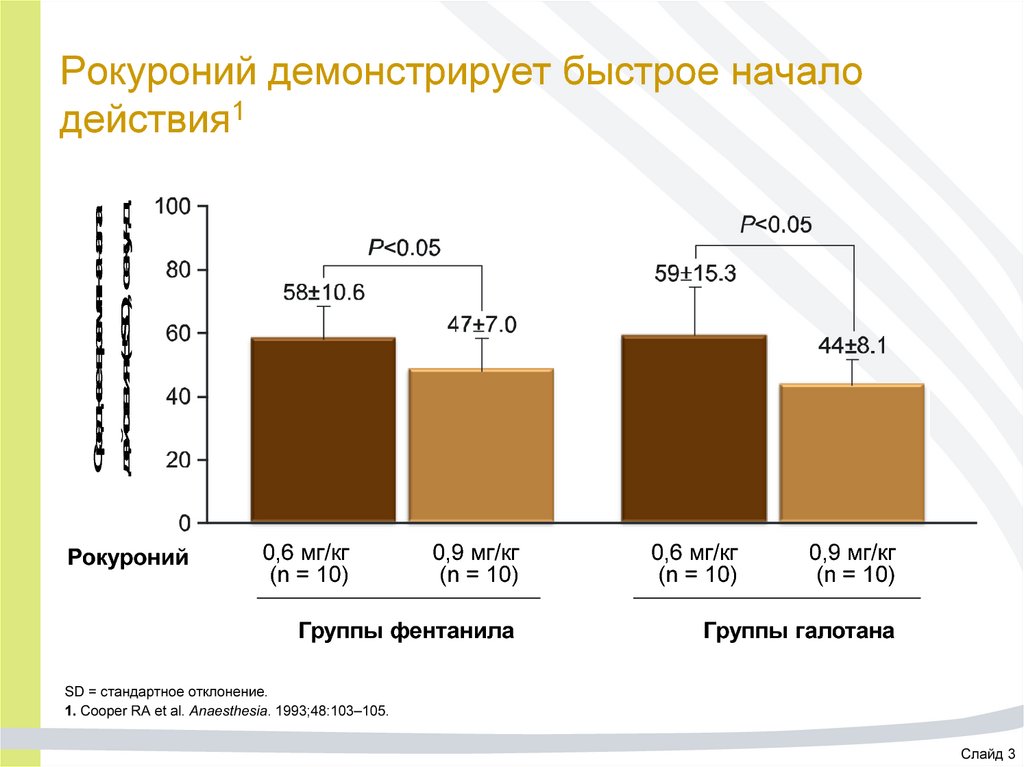
16. Рокуроний демонстрирует быстрое начало действия1
Среднее время началадействия (±SD), секунд
Рокуроний демонстрирует быстрое начало
действия1
Рокуроний
0,6 мг/кг
(n = 10)
0,9 мг/кг
(n = 10)
Группы фентанила
0,6 мг/кг
(n = 10)
0,9 мг/кг
(n = 10)
Группы галотана
SD = стандартное отклонение.
1. Cooper RA et al. Anaesthesia. 1993;48:103–105.
Слайд 3
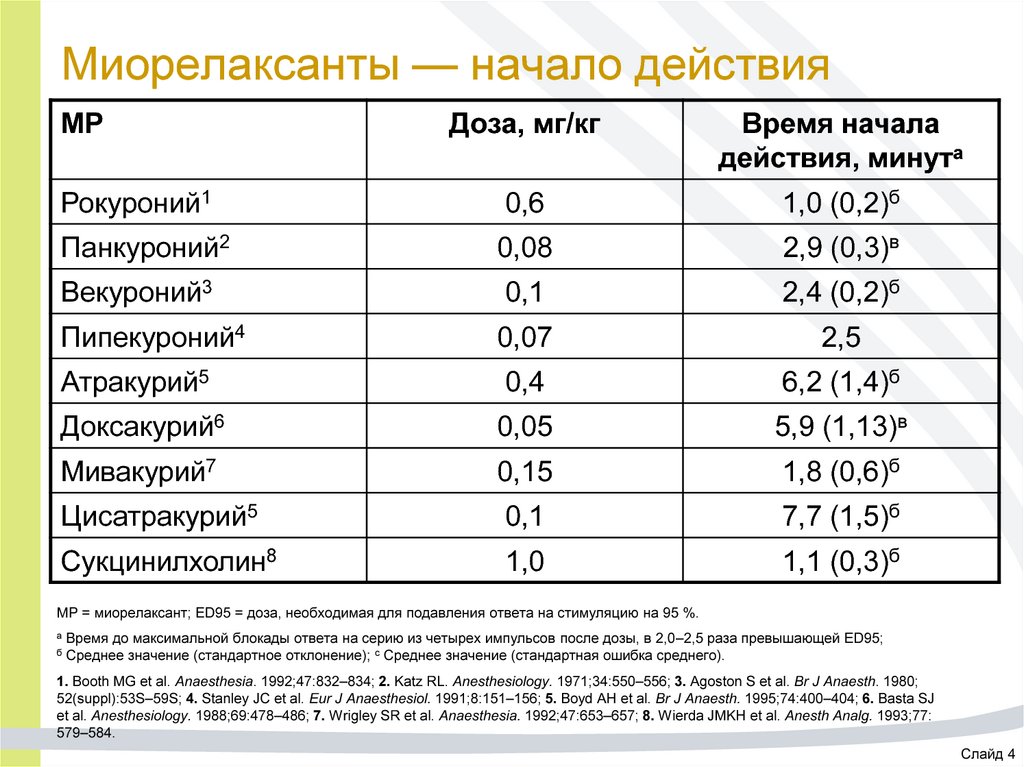
17. Миорелаксанты — начало действия
МРДоза, мг/кг
Время начала
действия, минута
Рокуроний1
0,6
1,0 (0,2)б
Панкуроний2
0,08
2,9 (0,3)в
Векуроний3
0,1
2,4 (0,2)б
Пипекуроний4
0,07
2,5
Атракурий5
0,4
6,2 (1,4)б
Доксакурий6
0,05
5,9 (1,13)в
Мивакурий7
0,15
1,8 (0,6)б
Цисатракурий5
0,1
7,7 (1,5)б
Сукцинилхолин8
1,0
1,1 (0,3)б
МР = миорелаксант; ED95 = доза, необходимая для подавления ответа на стимуляцию на 95 %.
а
б
Время до максимальной блокады ответа на серию из четырех импульсов после дозы, в 2,0–2,5 раза превышающей ED95;
Среднее значение (стандартное отклонение); с Среднее значение (стандартная ошибка среднего).
1. Booth MG et al. Anaesthesia. 1992;47:832–834; 2. Katz RL. Anesthesiology. 1971;34:550–556; 3. Agoston S et al. Br J Anaesth. 1980;
52(suppl):53S–59S; 4. Stanley JC et al. Eur J Anaesthesiol. 1991;8:151–156; 5. Boyd AH et al. Br J Anaesth. 1995;74:400–404; 6. Basta SJ
et al. Anesthesiology. 1988;69:478–486; 7. Wrigley SR et al. Anaesthesia. 1992;47:653–657; 8. Wierda JMKH et al. Anesth Analg. 1993;77:
579–584.
Слайд 4
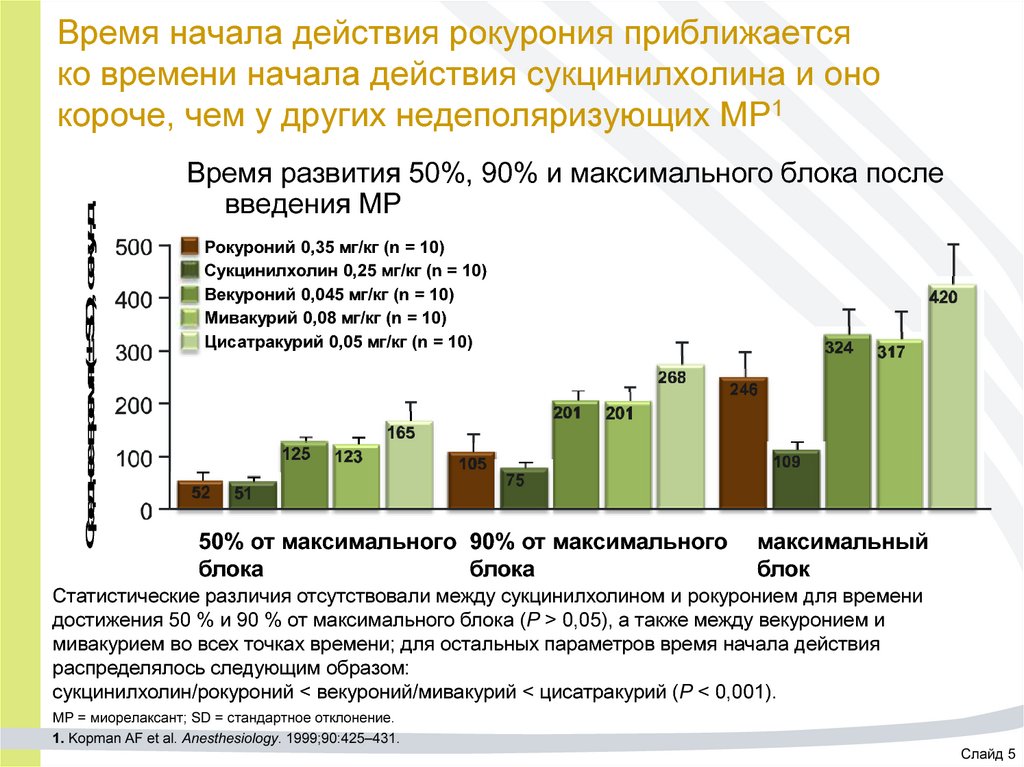
18. Время начала действия рокурония приближается ко времени начала действия сукцинилхолина и оно короче, чем у других
Среднее время (± SD), секундВремя начала действия рокурония приближается
ко времени начала действия сукцинилхолина и оно
короче, чем у других недеполяризующих МР1
Время развития 50%, 90% и максимального блока после
введения МР
Рокуроний 0,35 мг/кг (n = 10)
Сукцинилхолин 0,25 мг/кг (n = 10)
Векуроний 0,045 мг/кг (n = 10)
Мивакурий 0,08 мг/кг (n = 10)
Цисатракурий 0,05 мг/кг (n = 10)
50% от максимального 90% от максимального
блока
блока
максимальный
блок
Статистические различия отсутствовали между сукцинилхолином и рокуронием для времени
достижения 50 % и 90 % от максимального блока (P > 0,05), а также между векуронием и
мивакурием во всех точках времени; для остальных параметров время начала действия
распределялось следующим образом:
сукцинилхолин/рокуроний < векуроний/мивакурий < цисатракурий (P < 0,001).
МР = миорелаксант; SD = стандартное отклонение.
1. Kopman AF et al. Anesthesiology. 1999;90:425–431.
Слайд 5
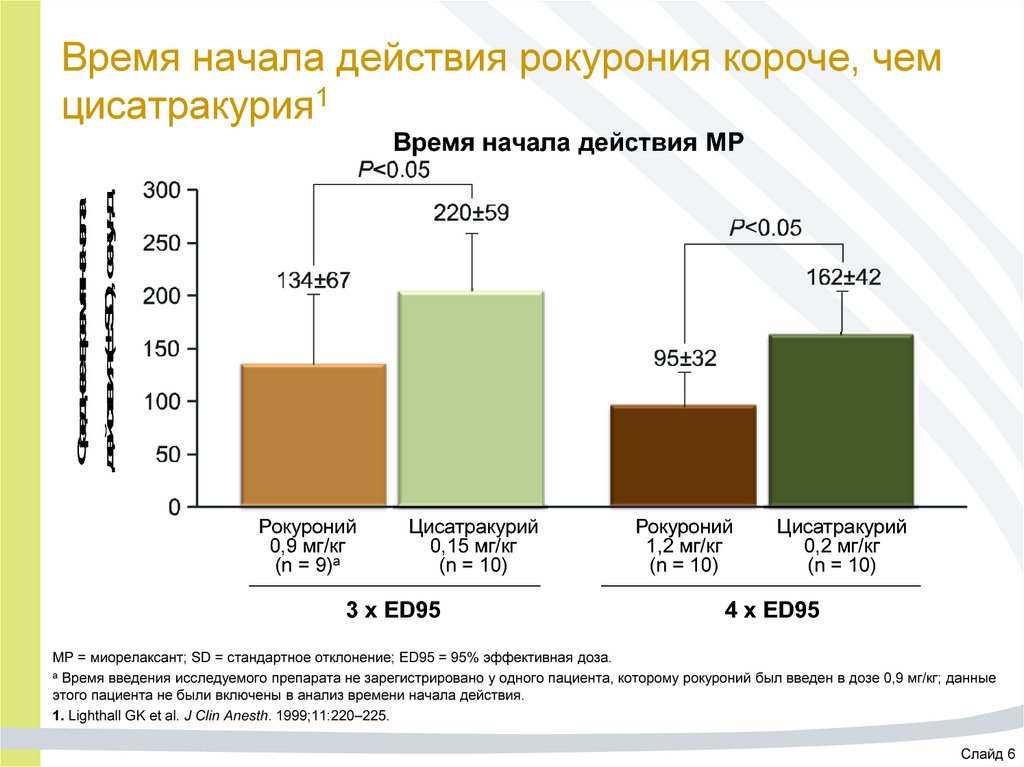
19. Время начала действия рокурония короче, чем цисатракурия1
Среднее время началадействия (± SD), секунд
Время начала действия МР
Рокуроний
0,9 мг/кг
(n = 9)а
Цисатракурий
0,15 мг/кг
(n = 10)
3 x ED95
Рокуроний
1,2 мг/кг
(n = 10)
Цисатракурий
0,2 мг/кг
(n = 10)
4 x ED95
МР = миорелаксант; SD = стандартное отклонение; ED95 = 95% эффективная доза.
a Время введения исследуемого препарата не зарегистрировано у одного пациента, которому рокуроний был введен в дозе 0,9 мг/кг; данные
этого пациента не были включены в анализ времени начала действия.
1. Lighthall GK et al. J Clin Anesth. 1999;11:220–225.
Слайд 6
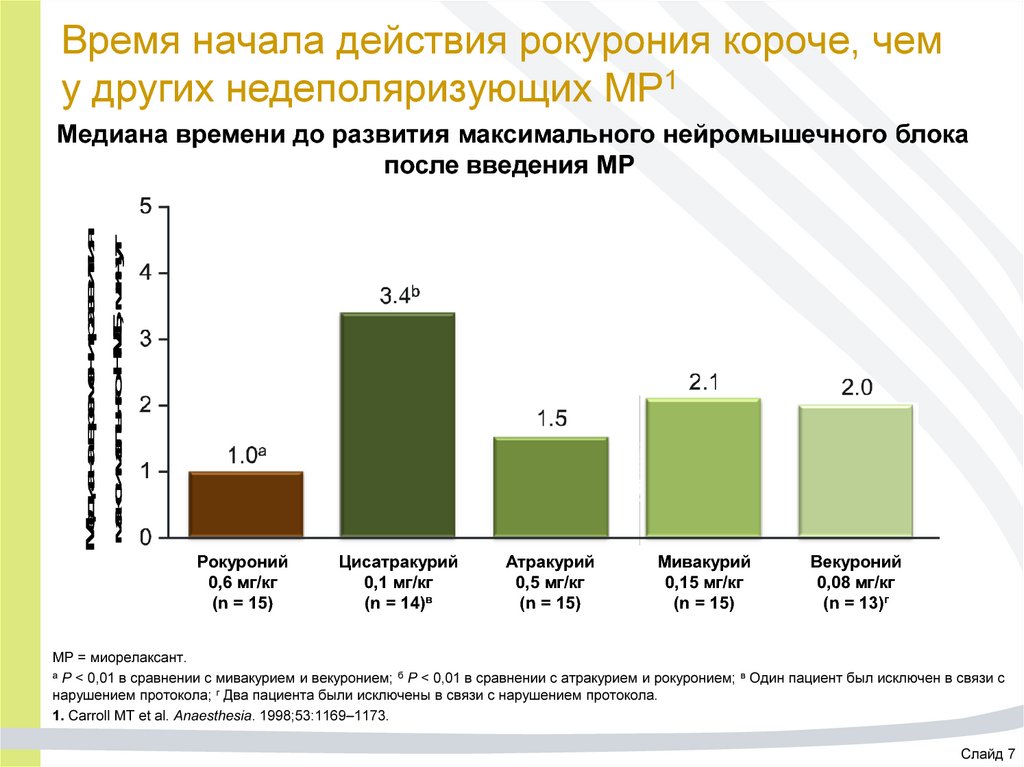
20. Время начала действия рокурония короче, чем у других недеполяризующих МР1
Медиана времени развитиямаксимальнго НМБ, минут
Медиана времени до развития максимального нейромышечного блока
после введения МР
Рокуроний
0,6 мг/кг
(n = 15)
Цисатракурий
0,1 мг/кг
(n = 14)в
Атракурий
0,5 мг/кг
(n = 15)
Мивакурий
0,15 мг/кг
(n = 15)
Векуроний
0,08 мг/кг
(n = 13)г
МР = миорелаксант.
а P < 0,01 в сравнении с мивакурием и векуронием; б P < 0,01 в сравнении с атракурием и рокуронием; в Один пациент был исключен в связи с
нарушением протокола; г Два пациента были исключены в связи с нарушением протокола.
1. Carroll MT et al. Anaesthesia. 1998;53:1169–1173.
Слайд 7
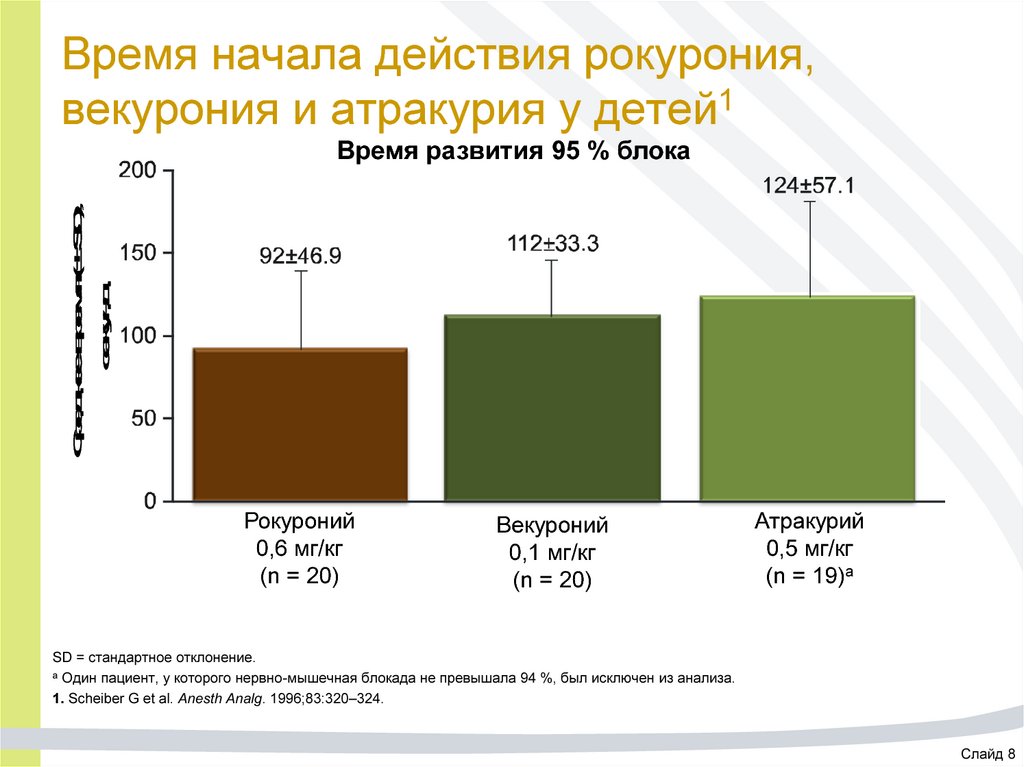
21. Время начала действия рокурония, векурония и атракурия у детей1
Среднее время (± SD),секунд
Время развития 95 % блока
Рокуроний
0,6 мг/кг
(n = 20)
Векуроний
0,1 мг/кг
(n = 20)
Атракурий
0,5 мг/кг
(n = 19)а
SD = стандартное отклонение.
а Один пациент, у которого нервно-мышечная блокада не превышала 94 %, был исключен из анализа.
1. Scheiber G et al. Anesth Analg. 1996;83:320–324.
Слайд 8
22. Рокуроний обладает более быстрым началом действия, чем другие недеполяризующие МР, и обеспечивает более хорошие условия для
интубации трахеи1Время начала действия
после введения МР
Условия интубации
через 90 секунд
Количество пациентов
Среднее время начала
действия (±SD), секунд
Рокуронийб 0,6 мг/кг (n = 19)в
Векуроний 0,1 мг/кг (n = 20)
Мивакурий 0,16 мг/кг (n = 20)
Рокуроний
0,6 мг/кг
(n = 15)
Векуроний
0,1 мг/кг
(n = 20)г
Мивакурий
0,16 мг/кг
(n = 20)
Отлично
Хорошо
Плохо
Невозможно
МР = миорелаксант; SD = стандартное отклонение.
а P < 0,05 в сравнении с мивакурием; б P < 0,05 в сравнении с векуронием и мивакурием; с Один пациент не был включен в анализ в связи с
анатомическими особенностями.
1. Wierda JMKH et al. Anaesthesia. 1995;50:393–396.
Слайд 9
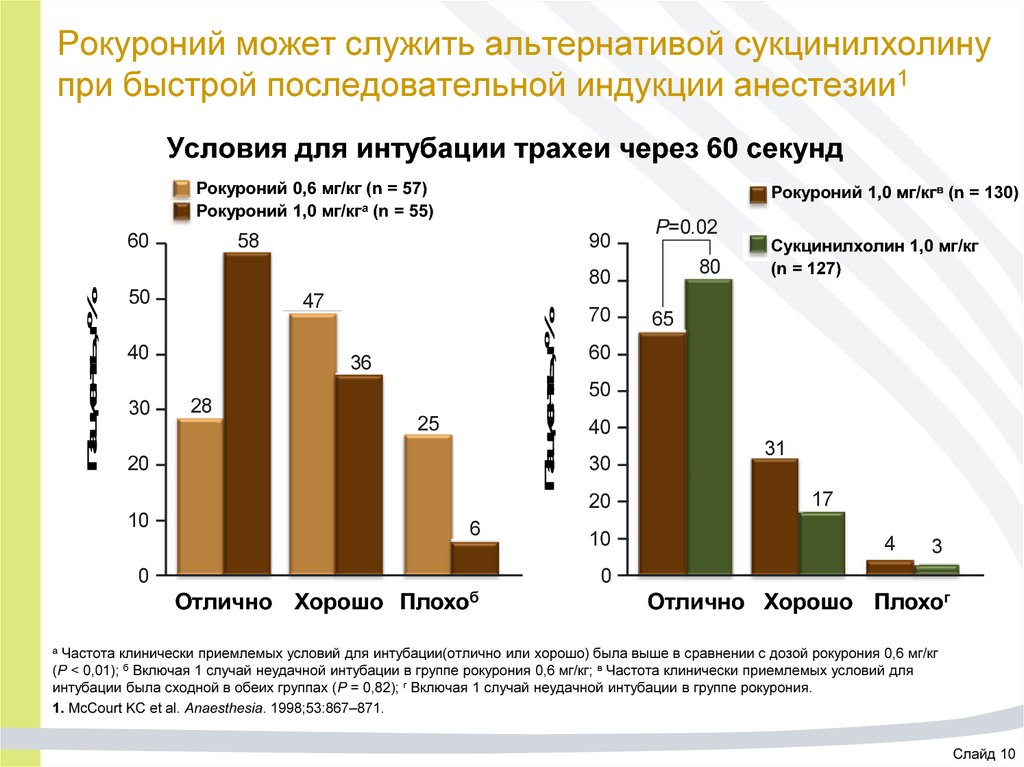
23. Рокуроний может служить альтернативой сукцинилхолину при быстрой последовательной индукции анестезии1
Условия для интубации трахеи через 60 секундРокуроний 0,6 мг/кг (n = 57)
Рокуроний 1,0 мг/кга (n = 55)
60
Рокуроний 1,0 мг/кгв (n = 130)
58
90
P=0.02
80
50
47
40
30
70
Пациенты, %
Пациенты, %
80
36
28
25
20
10
6
0
Сукцинилхолин 1,0 мг/кг
(n = 127)
65
60
50
40
30
20
10
31
17
4
3
0
Отлично Хорошо
Плохоб
Отлично Хорошо Плохог
Частота клинически приемлемых условий для интубации(отлично или хорошо) была выше в сравнении с дозой рокурония 0,6 мг/кг
(P < 0,01); б Включая 1 случай неудачной интубации в группе рокурония 0,6 мг/кг; в Частота клинически приемлемых условий для
интубации была сходной в обеих группах (P = 0,82); г Включая 1 случай неудачной интубации в группе рокурония.
1. McCourt KC et al. Anaesthesia. 1998;53:867–871.
a
Слайд 10
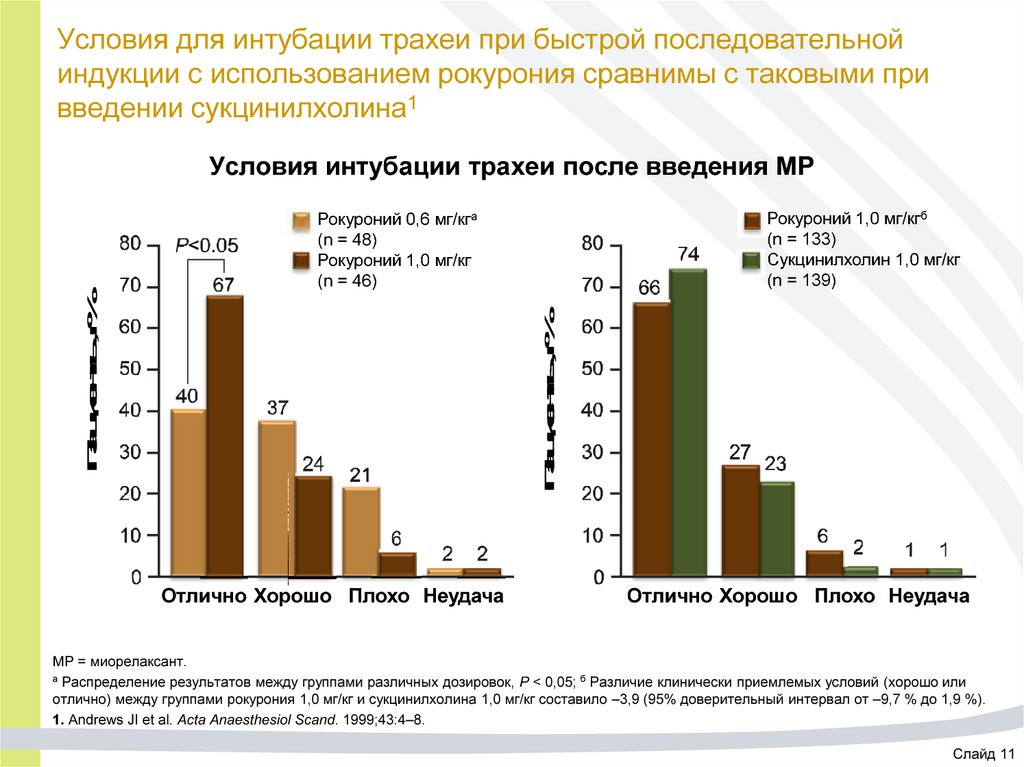
24. Условия для интубации трахеи при быстрой последовательной индукции с использованием рокурония сравнимы с таковыми при введении
сукцинилхолина1Условия интубации трахеи после введения МР
Рокуроний 1,0 мг/кгб
(n = 133)
Сукцинилхолин 1,0 мг/кг
(n = 139)
Пациенты, %
Пациенты, %
Рокуроний 0,6 мг/кга
(n = 48)
Рокуроний 1,0 мг/кг
(n = 46)
Отлично Хорошо Плохо Неудача
Отлично Хорошо Плохо Неудача
МР = миорелаксант.
а Распределение результатов между группами различных дозировок, P < 0,05; б Различие клинически приемлемых условий (хорошо или
отлично) между группами рокурония 1,0 мг/кг и сукцинилхолина 1,0 мг/кг составило –3,9 (95% доверительный интервал от –9,7 % до 1,9 %).
1. Andrews JI et al. Acta Anaesthesiol Scand. 1999;43:4–8.
Слайд 11
25. У детей приемлемые условия для интубации трахеи развиваются быстрее при использовании рокурония, чем векурония или атракурия1
Числопациентов
Рокуроний
0,6 мг/кга
(n = 20)
5
60
90
120
150
180
30
60
90
120
150
180
30
60
90
120
150
180
Число
пациентов
10
5
Число
пациентов
15
10
5
0
а
30
15
0
Атракурий
0,5 мг/кг
(n = 20)
Отлично
Хорошо
Удовлетворительно
Плохо
10
0
Векуроний
0,1 мг/кг
(n = 20)
Условия для интубации
15
P < 0,05 в сравнении с группами векурония и атракурия.
1. Scheiber G et al. Anesth Analg. 1996;83:320–324.
Время, секунд
Слайд 12
26. Нервно-мышечный блок
Модуль 3: клиническая продолжительность действияи управляемость
Слайд 1
27. Свойства идеального МР1
1. Недеполяризующий механизм действия2. Быстрое начало действия
3. Короткая и управляемая клиническая
продолжительность действия
МР = миорелаксант.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 2
28. Продолжительность действия МР: основные определения
Клиническая продолжительность действия: время отвведения МР до восстановления Т1 до 25% от
контрольного значения1–4
– Отражает продолжительность оптимальной хирургической
релаксации после введенной дозы
– Соответствует интервалу времени, после которого действие
МР может быть продолжено введением поддерживающих
доз или безопасно прекращено введением антагониста
Общая продолжительность: время от введения МР
до спонтанного восстановления Т1 до 90 % от
контрольного значения1–4
МР = миорелаксант; T1 = высота первого ответа на стимуляцию серией из четырех импульсов (TOF).
1. ЭСМЕРОН™ (рокурония бромид), инструкция по применению; 2. Hunter JM. N Engl J Med. 1995;332:1691–1699; 3. Carroll MT et
al. Anaesthesia. 1998;53:1169–1173; 4. Wierda JMKH et al. Br J Anaesth. 1990;64:521–523.
Слайд 3
29. Клиническая продолжительность действия рокурония в дозе 0,6 мг/кг1
Время, минутКлиническая продолжительность действия
рокурония в дозе 0,6 мг/кг1
Клиническая
продолжительностьа
Общая
продолжительностьб
а Определяется
как время спонтанного восстановления до величины 25 % от контрольной амплитуды ответа.
как время спонтанного восстановления до величины 90 % от контрольной амплитуды ответа.
1. ЭСМЕРОН™ (рокурония бромид), инструкция по применению.
б Определяется
Слайд 4
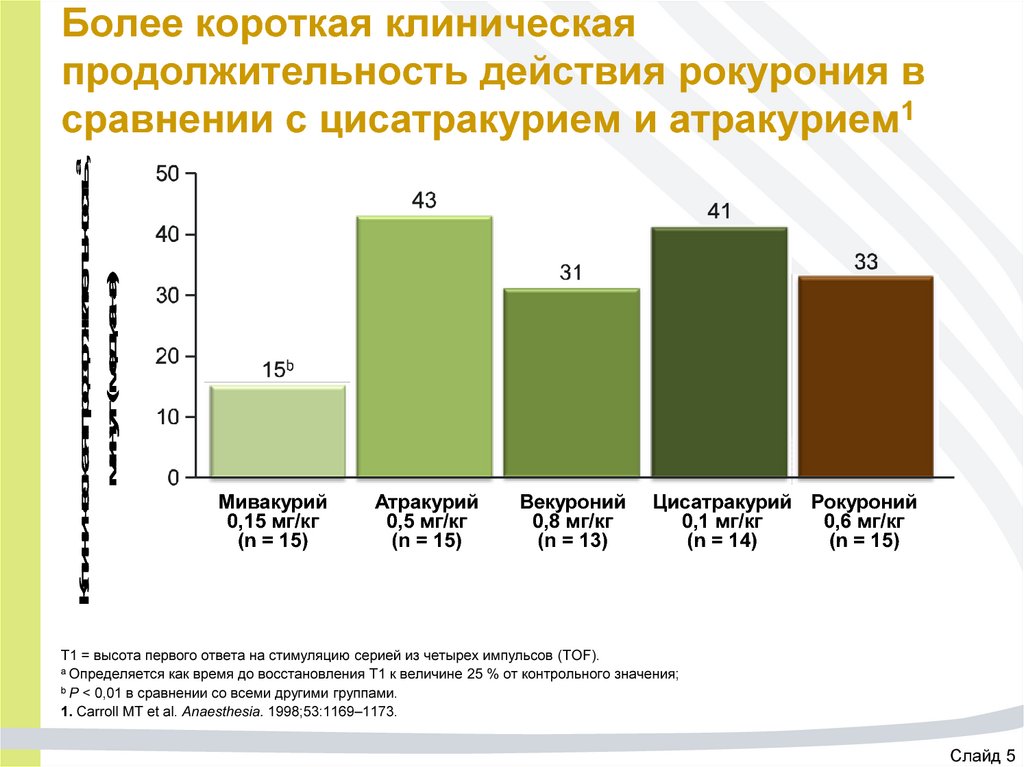
30. Более короткая клиническая продолжительность действия рокурония в сравнении с цисатракурием и атракурием1
Клиническая продолжительностьа,минут (медиана)
Более короткая клиническая
продолжительность действия рокурония в
сравнении с цисатракурием и атракурием1
Мивакурий
0,15 мг/кг
(n = 15)
Атракурий
0,5 мг/кг
(n = 15)
Векуроний
0,8 мг/кг
(n = 13)
Цисатракурий Рокуроний
0,1 мг/кг
0,6 мг/кг
(n = 14)
(n = 15)
T1 = высота первого ответа на стимуляцию серией из четырех импульсов (TOF).
а Определяется как время до восстановления Т1 к величине 25 % от контрольного значения;
b P < 0,01 в сравнении со всеми другими группами.
1. Carroll MT et al. Anaesthesia. 1998;53:1169–1173.
Слайд 5
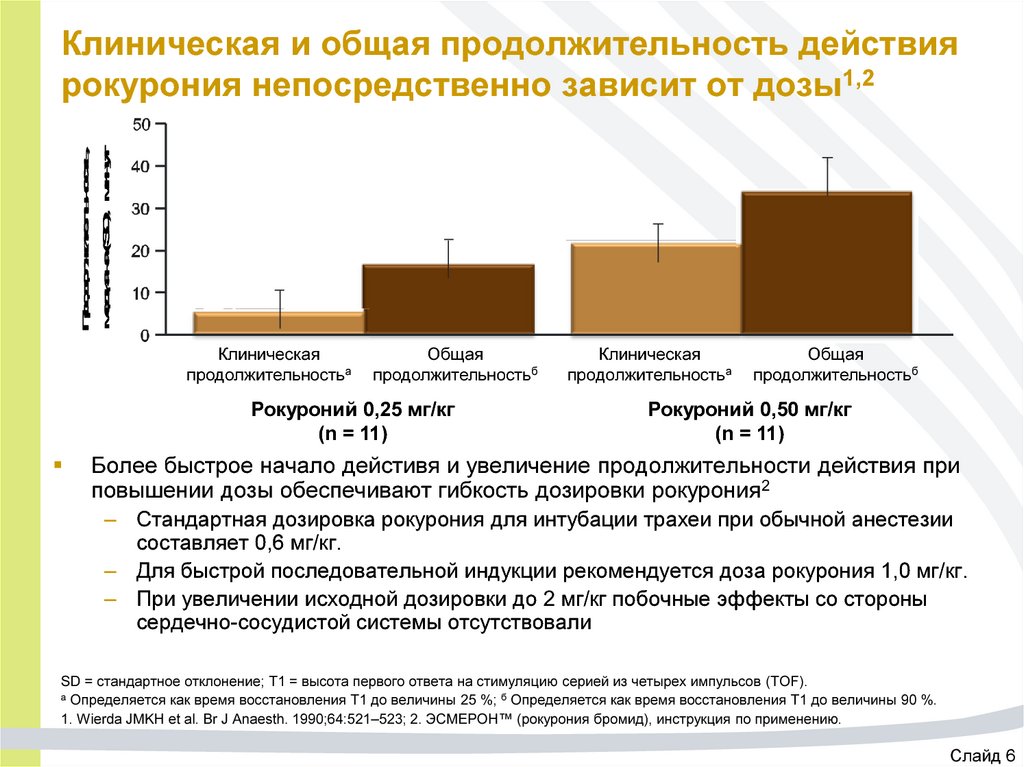
31. Клиническая и общая продолжительность действия рокурония непосредственно зависит от дозы1,2
Продолжительность,медиана (SD), минут
Клиническая и общая продолжительность действия
рокурония непосредственно зависит от дозы1,2
Клиническая
продолжительностьа
Общая
продолжительностьб
Рокуроний 0,25 мг/кг
(n = 11)
Клиническая
продолжительностьа
Общая
продолжительностьб
Рокуроний 0,50 мг/кг
(n = 11)
Более быстрое начало дейстивя и увеличение продолжительности действия при
повышении дозы обеспечивают гибкость дозировки рокурония2
– Стандартная дозировка рокурония для интубации трахеи при обычной анестезии
составляет 0,6 мг/кг.
– Для быстрой последовательной индукции рекомендуется доза рокурония 1,0 мг/кг.
– При увеличении исходной дозировки до 2 мг/кг побочные эффекты со стороны
сердечно-сосудистой системы отсутствовали
SD = стандартное отклонение; T1 = высота первого ответа на стимуляцию серией из четырех импульсов (TOF).
а Определяется как время восстановления Т1 до величины 25 %; б Определяется как время восстановления Т1 до величины 90 %.
1. Wierda JMKH et al. Br J Anaesth. 1990;64:521–523; 2. ЭСМЕРОН™ (рокурония бромид), инструкция по применению.
Слайд 6
32. Влияние возраста, пола, функции почек и печени на продолжительность действия рокурония
Продолжительность действия рокурония можетувеличиваться:
– У пожилых пациентов в сравнении с молодыми1
– У женщин в сравнении с мужчинами2
– У пациентов с почечной недостаточностью в сравнении с
пациентами с нормальной функцией почек3,4
– У пациентов с печеночной недостаточностью в сравнении с
пациентами с нормальной функцией печени5
Продолжительность действия рокурония может
уменьшаться:
– У детей в сравнении с новорожденными и взрослыми6
1. Matteo RS et al. Anesth Analg. 1993;77:1192–1197; 2. Xue FS et al. Anesth Analg. 1997;85:667–671; 3. Cooper RA et al. Br J Anaesth.
1993;71:222–226; 4. Robertson EN et al. Eur J Anaesth. 2005;22:4–10; 5. van Miert MM et al. Br J Clin Pharmacol. 1997;44:139–144; 6.
Wierda JW et al. Br J Anaesth. 1997;78:690–695.
Слайд 7
33. Рокуроний улучшает интубационные условия при использовании ларингеальной маски1
Введение ЛМаБез сопротивления
Незначительное
сопротивление
Умеренное/выраженное
сопротивление
Движения конечностейа
Отсутствуют
Незначительные
Выраженные
Рокуроний
0,2 мг/кг (n = 28)
Физиологический
раствор (n = 23)
Пациенты, %
При введении рокурония либо физиологического раствора отсутствовали
значимые различия реакции со стороны дыхательных путей
Вероятность как минимум хороших условий для установки ЛМб составила
примерно 80 % при введении рокурония и 30 % – при введении физиологического
раствора.
ЛМ = ларингеальная маска.
а P < 0,05, точный критерий Фишера; б Определялись как не более чем легкое сопротивление при введении ЛМ, сокращения диафрагмы
(кашель, икота или вдохи) продолжительностью менее 10 секунд либо не более чем незначительные движения конечностей.
1. Sastry SG et al. J Clin Anesth. 2005;17:163–166.
Слайд 8
34. Свойства идеального МР1
1. Недеполяризующий механизм действия2. Быстрое начало действия
3. Короткая и управляемая клиническая продолжительность
действия
4. Быстрое восстановление нейромышечной проводимости
МР = миорелаксант.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 9
35. Частота послеоперационного остаточного блока для рокурония значимо ниже в сравнении с цисатракурием1
Частота ПОК на моментзапланированной экстубации, %
Частота послеоперационного остаточного блока
для рокурония значимо ниже в сравнении с
цисатракурием1
Рокуроний
0,6 мг/кг (n = 142)
Цисатракурий
0,1 мг/кг (n = 175)
ПОК = послеоперационная остаточная кураризация.
1. Maybauer DM et al. Anaesthesia. 2007;62:12–17.
Слайд 10
36. Восстановление из глубокого НМБ, вызванного рокуронием, происходит значительно быстрее при использовании сугаммадекса в
сравнении снеостигмином1
Среднее время восстановления TOF-отношения до 0,9 из глубокого НМБ,
вызванного рокуронием в дозе 0,6 мг/кг, было значимо меньше при
использовании сугаммадекса в сравнении с неостигмином (P < 0,0001):
– 2,9 минуты при введении сугаммадекса 4,0 мг/кг
– 50,4 минуты при введении неостигмина 70 мкг/кг
Устранение НМБ с помощью сугаммадекса наступает в 17 раз быстрее, чем с
помощью неостигмина
Полное восстановление нейромышечной проводимости после введения
сугаммадекса наблюдалось у 70 % пациентов через 3 минуты и у 97 % – через
5 минут
При введении неостигмина у 73% пациентов для полного восстановления
нейромышечной проводимости требовалось от 30 до 60 минут, у 23 % – более
60 минут
TOF = серия из четырех импульсов; НМБ = нервно-мышечный блок
1. Jones RK et al. Anesthesiology. 2008;109:816–824.
Слайд 11
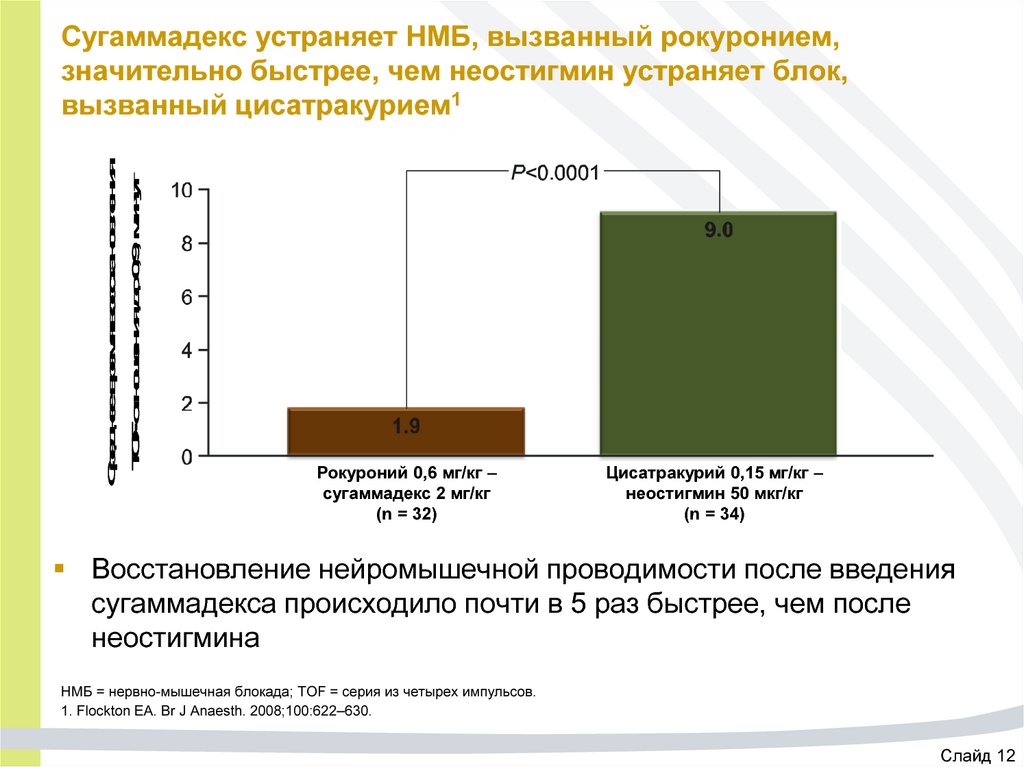
37. Сугаммадекс устраняет НМБ, вызванный рокуронием, значительно быстрее, чем неостигмин устраняет блок, вызванный цисатракурием1
Среднее время восстановленияTOF-отношения до 0,9, минут
Сугаммадекс устраняет НМБ, вызванный рокуронием,
значительно быстрее, чем неостигмин устраняет блок,
вызванный цисатракурием1
Рокуроний 0,6 мг/кг –
сугаммадекс 2 мг/кг
(n = 32)
Цисатракурий 0,15 мг/кг –
неостигмин 50 мкг/кг
(n = 34)
Восстановление нейромышечной проводимости после введения
сугаммадекса происходило почти в 5 раз быстрее, чем после
неостигмина
НМБ = нервно-мышечная блокада; TOF = серия из четырех импульсов.
1. Flockton EA. Br J Anaesth. 2008;100:622–630.
Слайд 12
38. Нервно-мышечный блок
Модуль 4: Гемодинамическаястабильность
Слайд 1
39. Свойства идеального МР1
1. Недеполяризующий механизм действия2. Быстрое начало действия
3. Короткая и управляемая клиническая
продолжительность действия
4. Быстрое восстановление
5. Отсутствие высвобождения гистамина либо
нежелательных реакций со стороны сердечнососудистой системы
МР = миорелаксант.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 2
40. Сердечно-сосудистые эффекты миорелаксантов1,2
Блокада мускариновых рецепторов(м-холинорецепторов)
Ганглиоблокирующее действие
Усиление высвобождения норадреналина
Блокада обратного захвата норадреналина
Высвобождение гистамина
– Вазодилатация
• Артериальная гипотензия
• Тахикардия
МР = миорелаксант
1. Mirakhur RK. Eur J Anaesthesiol. 1994;(suppl 9):133–140; 2. Hunter JM. Anaesthesia.1993;48:561–563.
Слайд 3
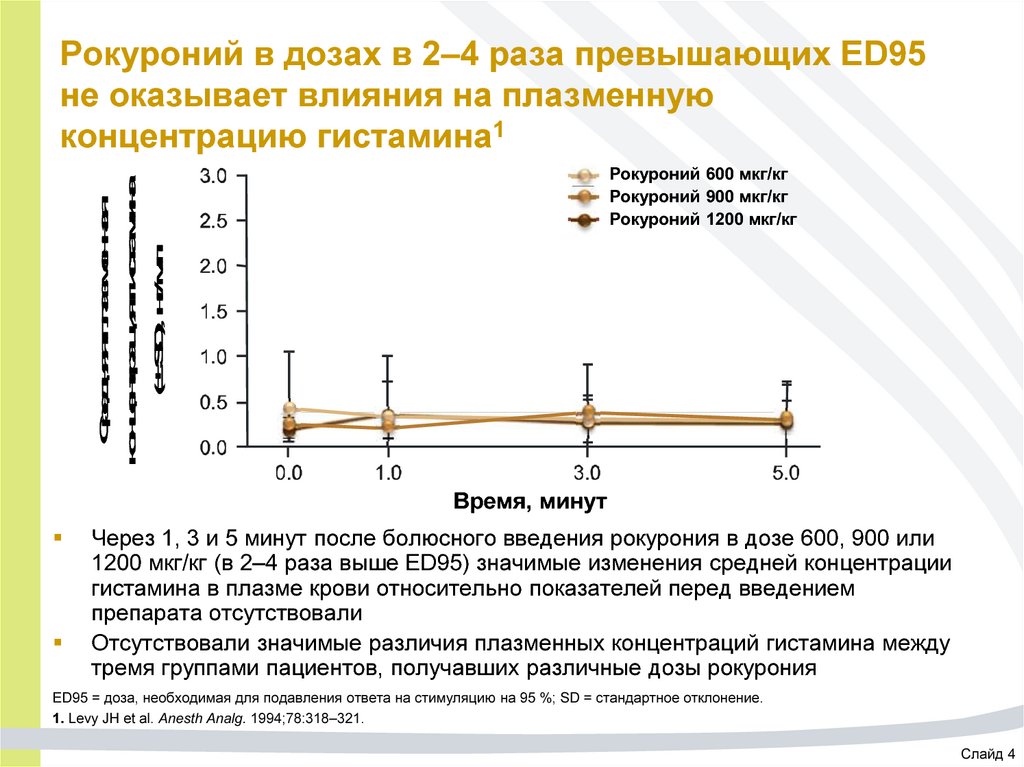
41. Рокуроний в дозах в 2–4 раза превышающих ED95 не оказывает влияния на плазменную концентрацию гистамина1
Средняя плазменнаяконцентрация гистамина
(± SD), нг/мл
Рокуроний 600 мкг/кг
Рокуроний 900 мкг/кг
Рокуроний 1200 мкг/кг
Время, минут
Через 1, 3 и 5 минут после болюсного введения рокурония в дозе 600, 900 или
1200 мкг/кг (в 2–4 раза выше ED95) значимые изменения средней концентрации
гистамина в плазме крови относительно показателей перед введением
препарата отсутствовали
Отсутствовали значимые различия плазменных концентраций гистамина между
тремя группами пациентов, получавших различные дозы рокурония
ED95 = доза, необходимая для подавления ответа на стимуляцию на 95 %; SD = стандартное отклонение.
1. Levy JH et al. Anesth Analg. 1994;78:318–321.
Слайд 4
42. Рокуроний в дозах в 2–4 раза превышающих ED95 не оказывает влияния на среднее артериальное давление1
Среднее артериальноедавление (± SD), мм рт. ст.
Рокуроний 600 мкг/кг
Рокуроний 900 мкг/кг
Рокуроний 1200 мкг/кг
Время, минут
На протяжении первых 6 минут после введения болюсной дозы рокурония 600, 900
или 1200 мкг/кг (в 2,0, 3,0 и 4,0 раза выше ED95) отсутствовали значимые изменения
среднего АД относительно показателей перед введением рокурония
Отсутствовали значимые различия среднего АД в момент развития максимального
эффекта препарата между тремя группами пациентов, получавших различные дозы
рокурония
ED95 = доза, необходимая для подавления ответа на стимуляцию на 95 %; SD = стандартное отклонение.
1. Levy JH et al. Anesth Analg. 1994;78:318–321.
Слайд 5
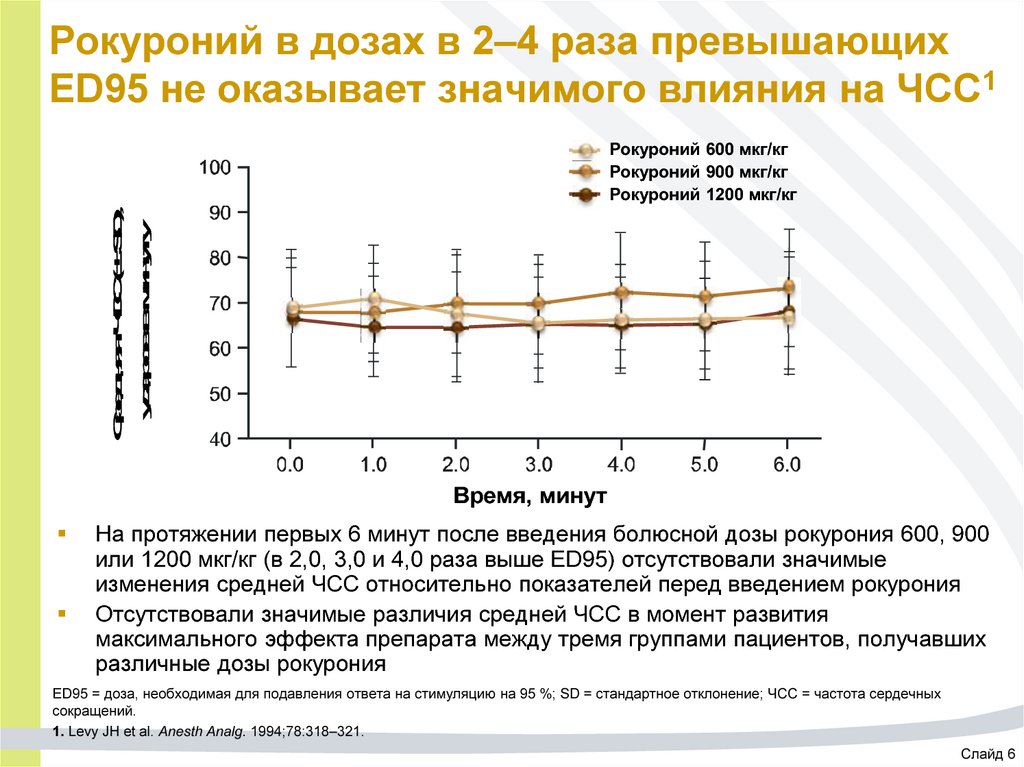
43. Рокуроний в дозах в 2–4 раза превышающих ED95 не оказывает значимого влияния на ЧСС1
Средняя ЧСС (± SD),ударов в минуту
Рокуроний 600 мкг/кг
Рокуроний 900 мкг/кг
Рокуроний 1200 мкг/кг
Время, минут
На протяжении первых 6 минут после введения болюсной дозы рокурония 600, 900
или 1200 мкг/кг (в 2,0, 3,0 и 4,0 раза выше ED95) отсутствовали значимые
изменения средней ЧСС относительно показателей перед введением рокурония
Отсутствовали значимые различия средней ЧСС в момент развития
максимального эффекта препарата между тремя группами пациентов, получавших
различные дозы рокурония
ED95 = доза, необходимая для подавления ответа на стимуляцию на 95 %; SD = стандартное отклонение; ЧСС = частота сердечных
сокращений.
1. Levy JH et al. Anesth Analg. 1994;78:318–321.
Слайд 6
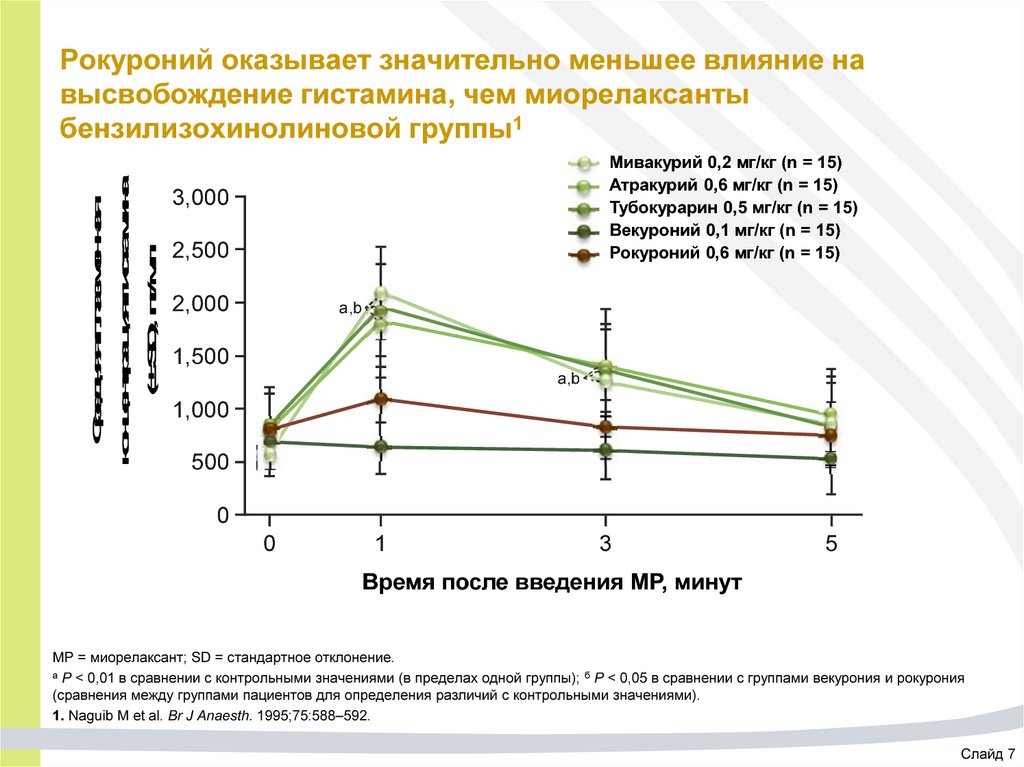
44. Рокуроний оказывает значительно меньшее влияние на высвобождение гистамина, чем миорелаксанты бензилизохинолиновой группы1
Средняя плазменнаяконцентрация гистамина
(± SD), пг/мл
Рокуроний оказывает значительно меньшее влияние на
высвобождение гистамина, чем миорелаксанты
бензилизохинолиновой группы1
Мивакурий 0,2 мг/кг (n = 15)
Атракурий 0,6 мг/кг (n = 15)
Тубокурарин 0,5 мг/кг (n = 15)
Векуроний 0,1 мг/кг (n = 15)
Рокуроний 0,6 мг/кг (n = 15)
3,000
2,500
2,000
a,b
1,500
a,b
1,000
500
0
0
1
3
5
Время после введения МР, минут
МР = миорелаксант; SD = стандартное отклонение.
а P < 0,01 в сравнении с контрольными значениями (в пределах одной группы); б P < 0,05 в сравнении с группами векурония и рокурония
(сравнения между группами пациентов для определения различий с контрольными значениями).
1. Naguib M et al. Br J Anaesth. 1995;75:588–592.
Слайд 7
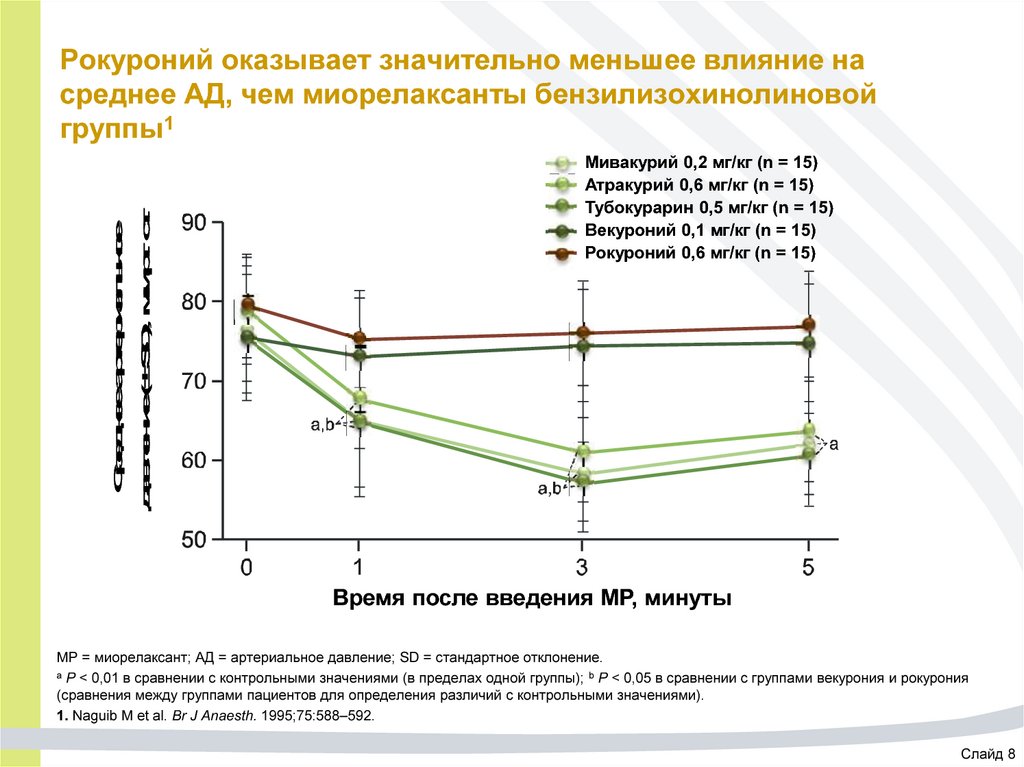
45. Рокуроний оказывает значительно меньшее влияние на среднее АД, чем миорелаксанты бензилизохинолиновой группы1
Среднее артериальноедавление (± SD), мм рт. ст.
Рокуроний оказывает значительно меньшее влияние на
среднее АД, чем миорелаксанты бензилизохинолиновой
группы1
Мивакурий 0,2 мг/кг (n = 15)
Атракурий 0,6 мг/кг (n = 15)
Тубокурарин 0,5 мг/кг (n = 15)
Векуроний 0,1 мг/кг (n = 15)
Рокуроний 0,6 мг/кг (n = 15)
Время после введения МР, минуты
МР = миорелаксант; АД = артериальное давление; SD = стандартное отклонение.
а P < 0,01 в сравнении с контрольными значениями (в пределах одной группы); b P < 0,05 в сравнении с группами векурония и рокурония
(сравнения между группами пациентов для определения различий с контрольными значениями).
1. Naguib M et al. Br J Anaesth. 1995;75:588–592.
Слайд 8
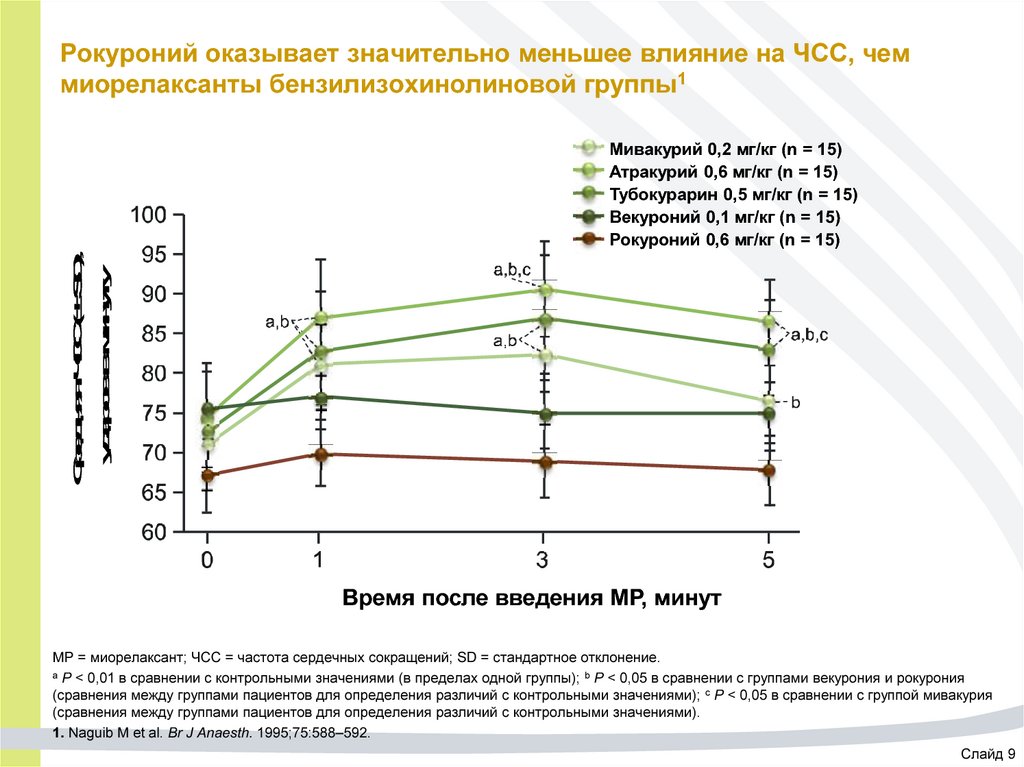
46. Рокуроний оказывает значительно меньшее влияние на ЧСС, чем миорелаксанты бензилизохинолиновой группы1
Средняя ЧСС (± SD),ударов в минуту
Мивакурий 0,2 мг/кг (n = 15)
Атракурий 0,6 мг/кг (n = 15)
Тубокурарин 0,5 мг/кг (n = 15)
Векуроний 0,1 мг/кг (n = 15)
Рокуроний 0,6 мг/кг (n = 15)
Время после введения МР, минут
МР = миорелаксант; ЧСС = частота сердечных сокращений; SD = стандартное отклонение.
а P < 0,01 в сравнении с контрольными значениями (в пределах одной группы); b P < 0,05 в сравнении с группами векурония и рокурония
(сравнения между группами пациентов для определения различий с контрольными значениями); c P < 0,05 в сравнении с группой мивакурия
(сравнения между группами пациентов для определения различий с контрольными значениями).
1. Naguib M et al. Br J Anaesth. 1995;75:588–592.
Слайд 9
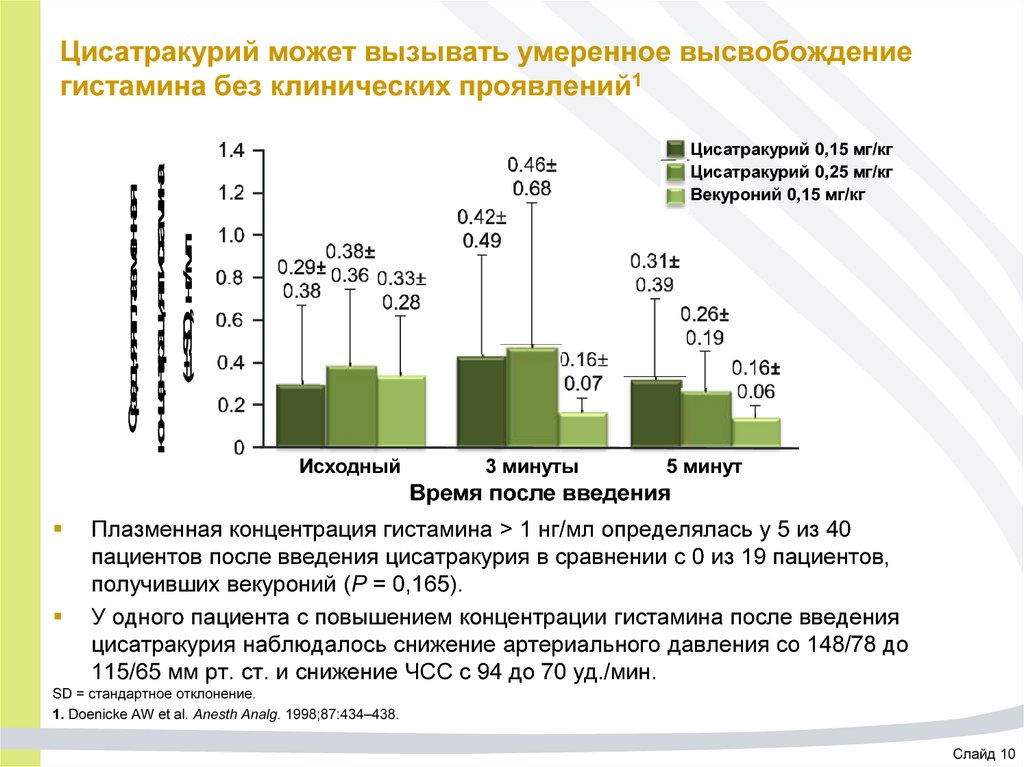
47. Цисатракурий может вызывать умеренное высвобождение гистамина без клинических проявлений1
Средняя плазменнаяконцентрация гистамина
(± SD), нг/мл
Цисатракурий может вызывать умеренное высвобождение
гистамина без клинических проявлений1
Цисатракурий 0,15 мг/кг
Цисатракурий 0,25 мг/кг
Векуроний 0,15 мг/кг
Исходный
3 минуты
5 минут
Время после введения
Плазменная концентрация гистамина > 1 нг/мл определялась у 5 из 40
пациентов после введения цисатракурия в сравнении с 0 из 19 пациентов,
получивших векуроний (P = 0,165).
У одного пациента с повышением концентрации гистамина после введения
цисатракурия наблюдалось снижение артериального давления со 148/78 до
115/65 мм рт. ст. и снижение ЧСС с 94 до 70 уд./мин.
SD = стандартное отклонение.
1. Doenicke AW et al. Anesth Analg. 1998;87:434–438.
Слайд 10
48. Заключение: гемодинамическая стабильность при использовании рокурония
В исследованиях на пациентах, получавших рокуроний, былопродемонстрировано:
отсутствие значимых изменений высвобождения гистамина в
плазме крови, среднего артериального давления либо частоты
сердечных сокращений при дозе рокурония, в 4 раза превышающей
ED951,2
значительно меньшее изменение плазменной концентрации
гистамина, среднего артериального давления и частоты сердечных
сокращений по сравнению с пациентами, получавшими атракурий,
мивакурий и тубокурарин2
ED95 = доза, необходимая для подавления ответа на стимуляцию на 95 %.
1. Levy JH et al. Anesth Analg. 1994;78:318–321; 2. Naguib M et al. Br J Anaesth. 1995;75:588–592.
Слайд 11
49. Нервно-мышечный блок
Модуль 5: метаболизм миорелаксантовСлайд 1
50. Свойства идеального МР1
1. Недеполяризующий механизм действия2. Быстрое начало действия
3. Короткая и управляемая клиническая
продолжительность действия
4. Быстрое восстановление
5. Отсутствие высвобождения гистамина либо
нежелательных реакций со стороны сердечнососудистой системы
6. Отсутствие фармакологически активных
метаболитов
МР = миорелаксант.
1. Booij LH. Pharm World Sci. 1997;19:1–12.
Слайд 2
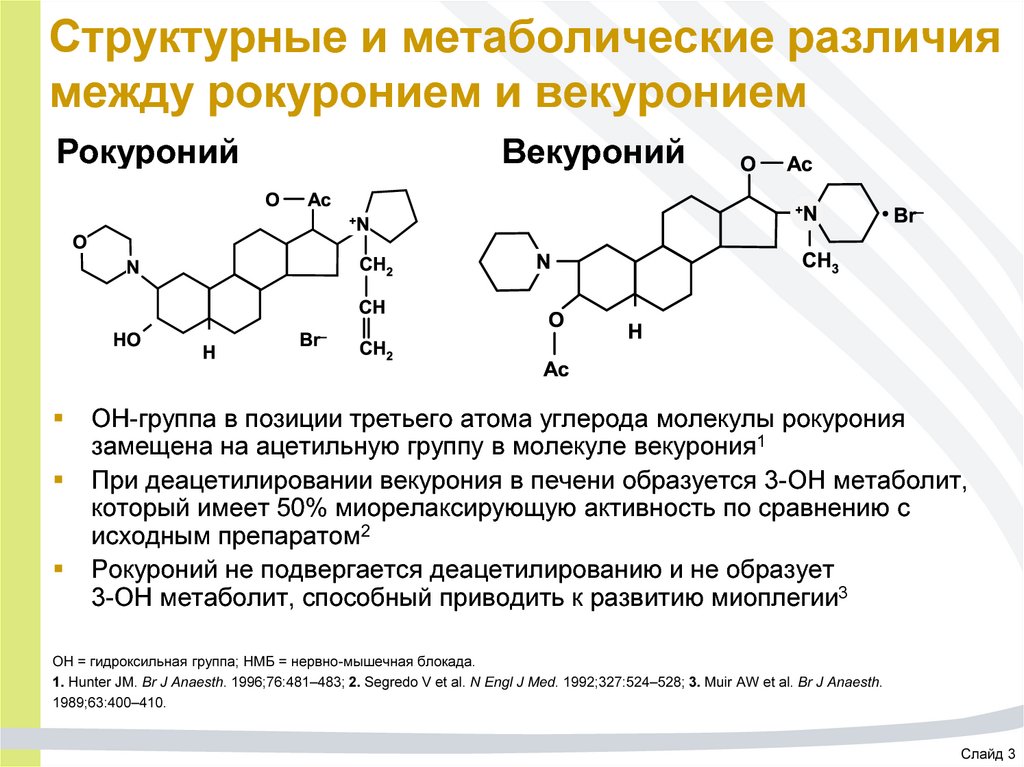
51. Структурные и метаболические различия между рокуронием и векуронием
РокуронийВекуроний
OH-группа в позиции третьего атома углерода молекулы рокурония
замещена на ацетильную группу в молекуле векурония1
При деацетилировании векурония в печени образуется 3-OH метаболит,
который имеет 50% миорелаксирующую активность по сравнению с
исходным препаратом2
Рокуроний не подвергается деацетилированию и не образует
3-OH метаболит, способный приводить к развитию миоплегии3
OH = гидроксильная группа; НМБ = нервно-мышечная блокада.
1. Hunter JM. Br J Anaesth. 1996;76:481–483; 2. Segredo V et al. N Engl J Med. 1992;327:524–528; 3. Muir AW et al. Br J Anaesth.
1989;63:400–410.
Слайд 3
52. Метаболический профиль рокурония1
Выводится с мочой и желчьюВ течение 12–24 ч с мочой выводится до 40 %
препарата.
Степень извлечения через 9 дней после введения
радиоактивно меченной дозы:
– 47% в моче
– 43% в фекалиях
Приблизительно 50 % извлекалось в виде исходного
соединения
1. ЭСМЕРОН™ (рокурония бромид), инструкция по применению.
Слайд 4
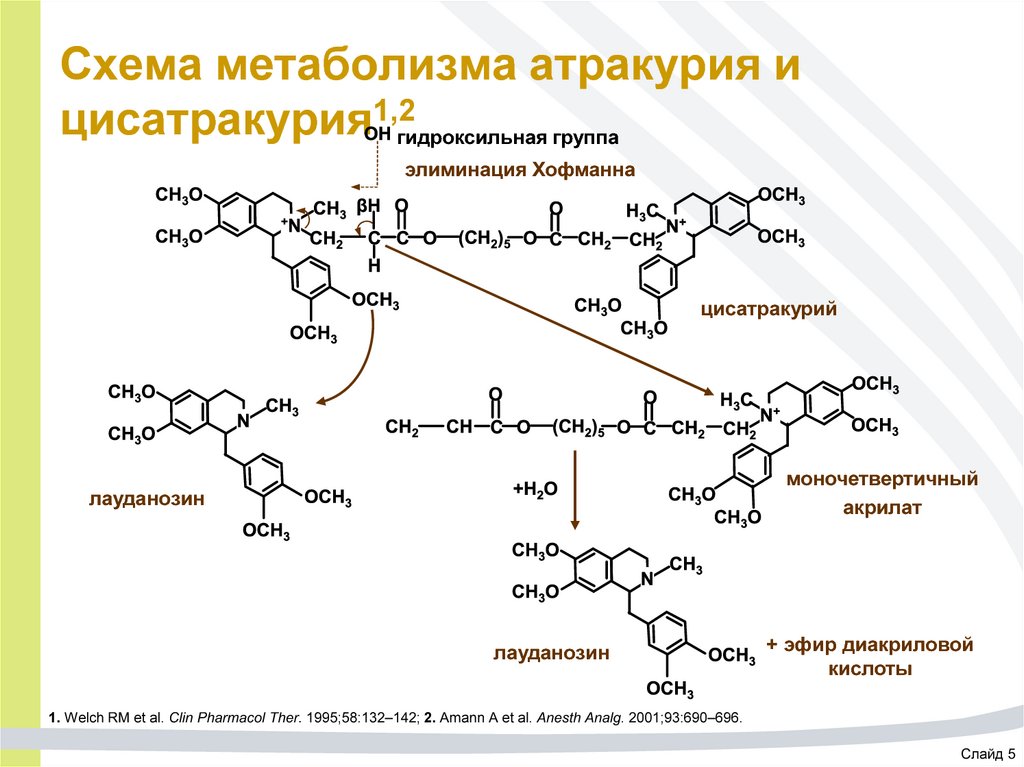
53. Схема метаболизма атракурия и цисатракурия1,2
Схема метаболизма атракурия ицисатракурия1,2гидроксильная группа
элиминация Хофманна
цисатракурий
моночетвертичный
акрилат
лауданозин
лауданозин
+ эфир диакриловой
кислоты
1. Welch RM et al. Clin Pharmacol Ther. 1995;58:132–142; 2. Amann A et al. Anesth Analg. 2001;93:690–696.
Слайд 5
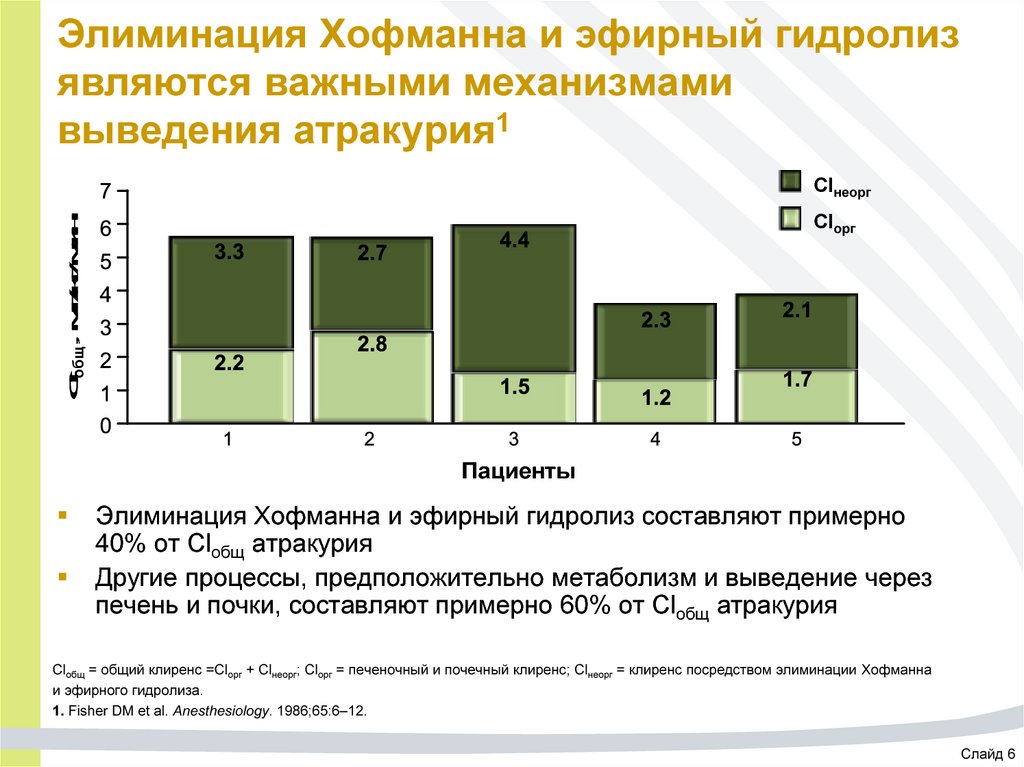
54. Элиминация Хофманна и эфирный гидролиз являются важными механизмами выведения атракурия1
ClнеоргClобщ, мл/кг/мин
Clорг
Пациенты
Элиминация Хофманна и эфирный гидролиз составляют примерно
40% от Clобщ атракурия
Другие процессы, предположительно метаболизм и выведение через
печень и почки, составляют примерно 60% от Clобщ атракурия
Clобщ = общий клиренс =Clорг + Clнеорг; Clорг = печеночный и почечный клиренс; Clнеорг = клиренс посредством элиминации Хофманна
и эфирного гидролиза.
1. Fisher DM et al. Anesthesiology. 1986;65:6–12.
Слайд 6
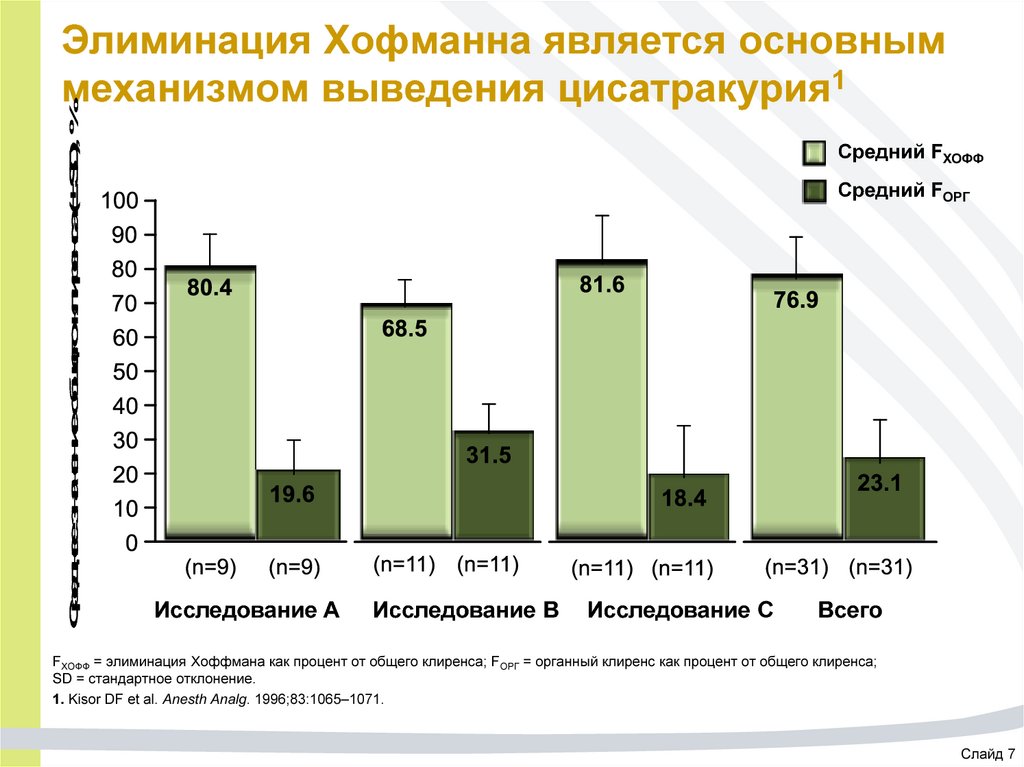
55. Элиминация Хофманна является основным механизмом выведения цисатракурия1
Среднее значение общего клиренса (± SD), %Элиминация Хофманна является основным
механизмом выведения цисатракурия1
Средний FХОФФ
Средний FОРГ
Исследование A
Исследование B
Исследование C
Всего
FХОФФ = элиминация Хоффмана как процент от общего клиренса; FОРГ = органный клиренс как процент от общего клиренса;
SD = стандартное отклонение.
1. Kisor DF et al. Anesth Analg. 1996;83:1065–1071.
Слайд 7
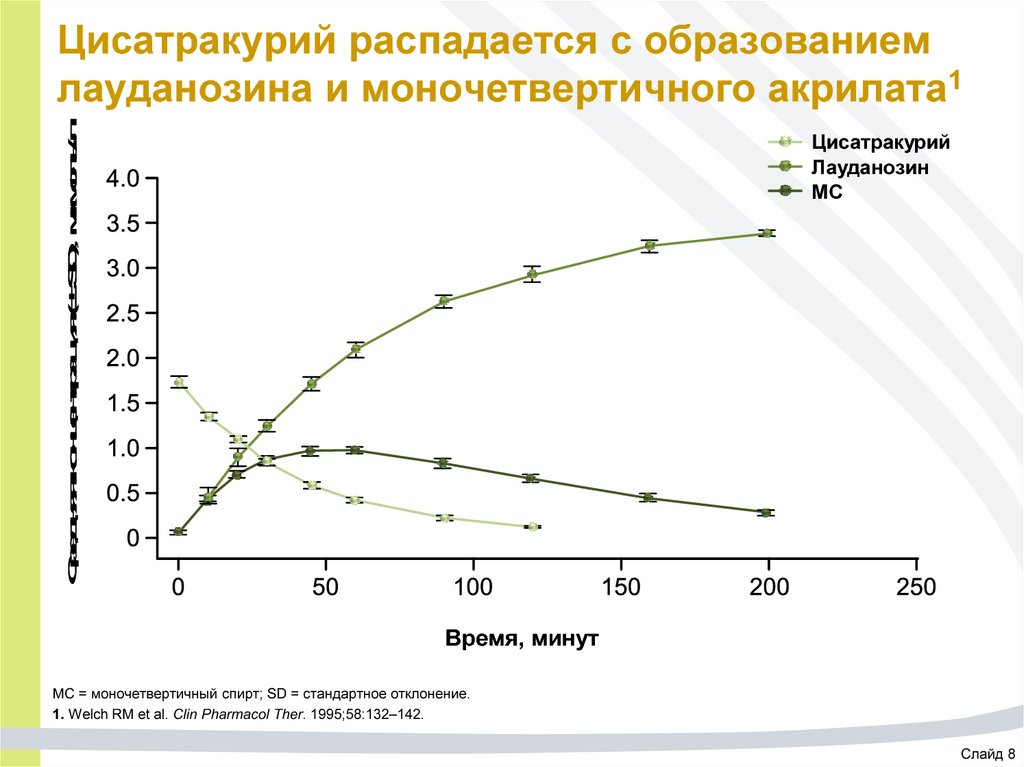
56. Цисатракурий распадается с образованием лауданозина и моночетвертичного акрилата1
Средняя концентрация (± SD), мкмоль/лЦисатракурий распадается с образованием
лауданозина и моночетвертичного акрилата1
Цисатракурий
Лауданозин
МС
Время, минут
МС = моночетвертичный спирт; SD = стандартное отклонение.
1. Welch RM et al. Clin Pharmacol Ther. 1995;58:132–142.
Слайд 8
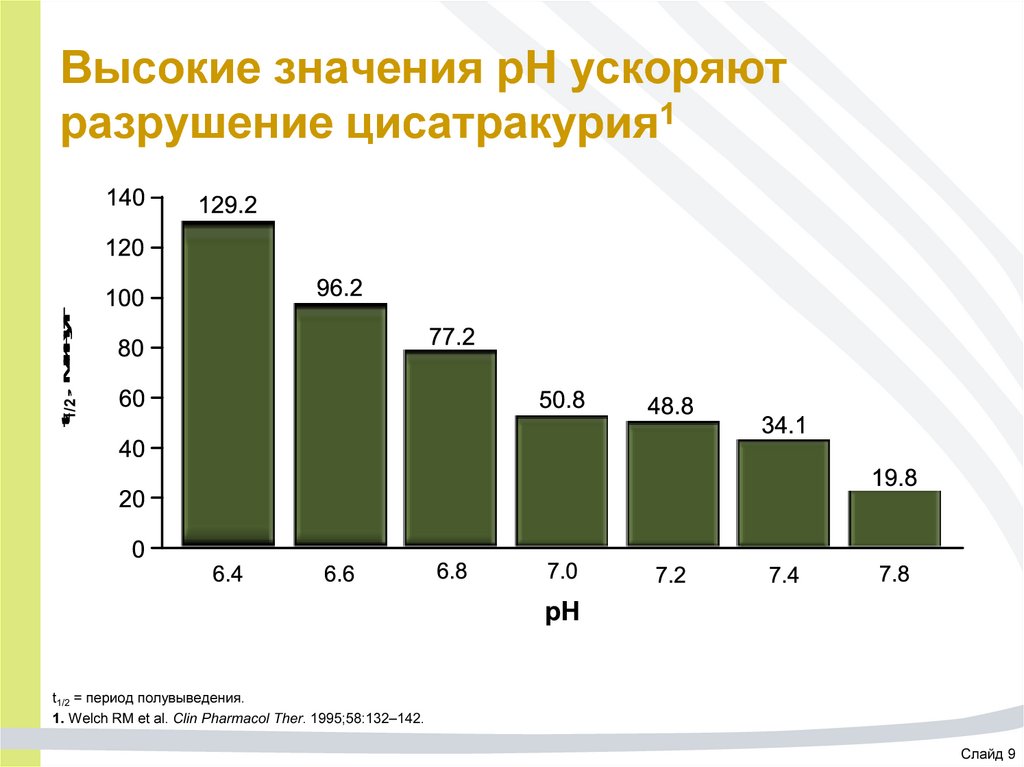
57. Высокие значения pH ускоряют разрушение цисатракурия1
t1/2, минутВысокие значения pH ускоряют
разрушение цисатракурия1
t1/2 = период полувыведения.
1. Welch RM et al. Clin Pharmacol Ther. 1995;58:132–142.
Слайд 9
58. Преимущества и недостатки элиминации Хофманна
Видимые преимущества– Не зависящее от функций органов выведение
миорелаксанта больше подходит пациентам с почечной
или печеночной недостаточностью1,2
Недостатки
– Высокие дозы лауданозина вызывают судорожную
активность у лабораторных животных3
– Клиренс лауданозина снижен у пациентов с печеночной
недостаточностью, требуя осторожности при длительных
инфузиях миорелаксантов, которые метаболизируются
путем элиминации Хофманна4
МР = миорелаксант.
1. Fisher DM et al. Anesthesiology. 1986;65:6–12; 2. Hunter JM. N Engl J Med. 1995;332:1691–1699; 3. Chapple DJ et al. Br J Anaesth. 1987;
59:218–225; 4. Ward S et al. Br J Anaesth. 1986;58:6S–10S.
Слайд 10
59. Рокуроний при почечной недостаточности и циррозе печени
Почечная недостаточность и нарушение функциипечени приводит к снижению клиренса рокурония1–3
– Продолжительность действия рокурония у пациентов с
такими нарушениями может увеличиваться.3
Тем не менее, рокуроний может с осторожностью
использоваться у пациентов с почечной
недостаточностью или клинически значимыми
нарушениями функции печени3
1. Robertson EN et al. Eur J Anaesth. 2005;22:4–10; 2. van Miert MM et al. Br J Clin Pharmacol. 1997;44:139–144; 3. ЭСМЕРОН™ (рокурония
бромид), инструкция по применению.
Слайд 11
60. Нервно-мышечный блок
Модуль 6: преимущества интубации сприменением миорелаксантов
Слайд 1
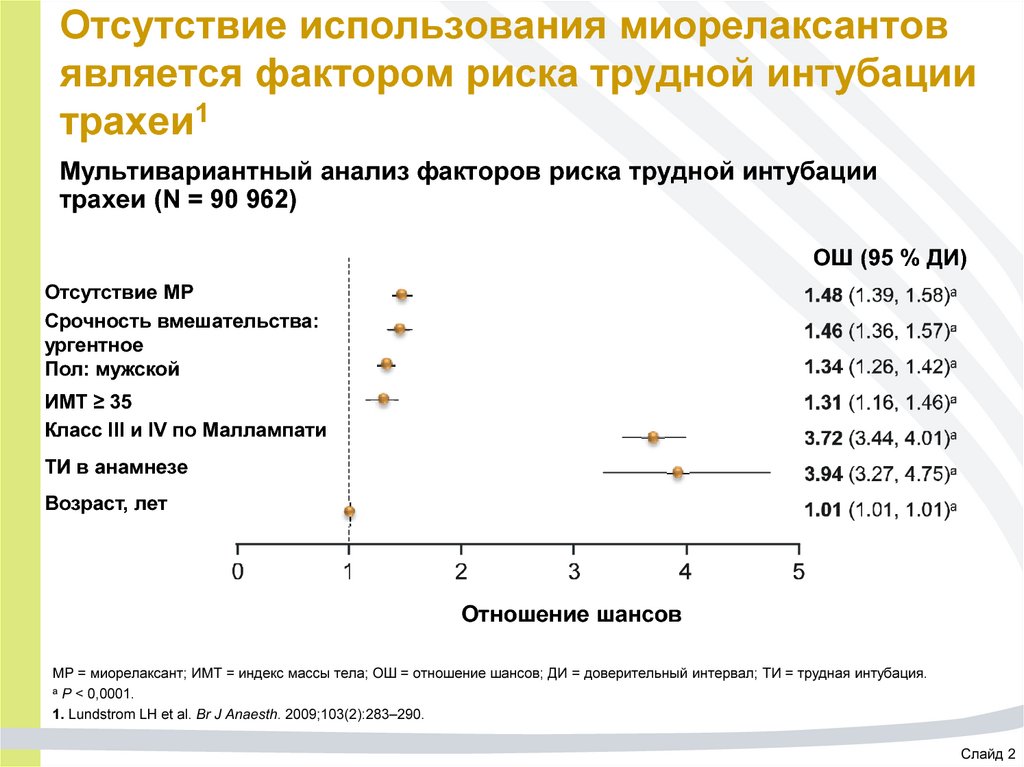
61. Отсутствие использования миорелаксантов является фактором риска трудной интубации трахеи1
Мультивариантный анализ факторов риска трудной интубациитрахеи (N = 90 962)
ОШ (95 % ДИ)
Отсутствие МР
Срочность вмешательства:
ургентное
Пол: мужской
ИМТ ≥ 35
Класс III и IV по Маллампати
ТИ в анамнезе
Возраст, лет
Отношение шансов
МР = миорелаксант; ИМТ = индекс массы тела; ОШ = отношение шансов; ДИ = доверительный интервал; ТИ = трудная интубация.
a P < 0,0001.
1. Lundstrom LH et al. Br J Anaesth. 2009;103(2):283–290.
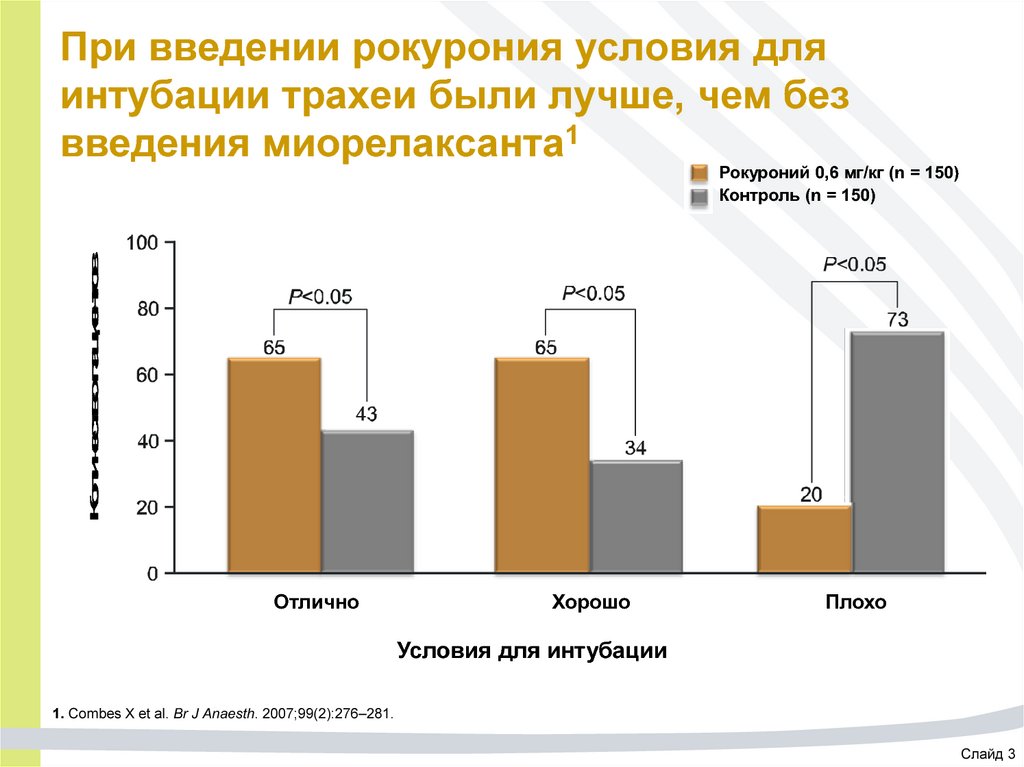
Слайд 2
62. При введении рокурония условия для интубации трахеи были лучше, чем без введения миорелаксанта1
Количество пациентовРокуроний 0,6 мг/кг (n = 150)
Контроль (n = 150)
Отлично
Хорошо
Плохо
Условия для интубации
1. Combes X et al. Br J Anaesth. 2007;99(2):276–281.
Слайд 3
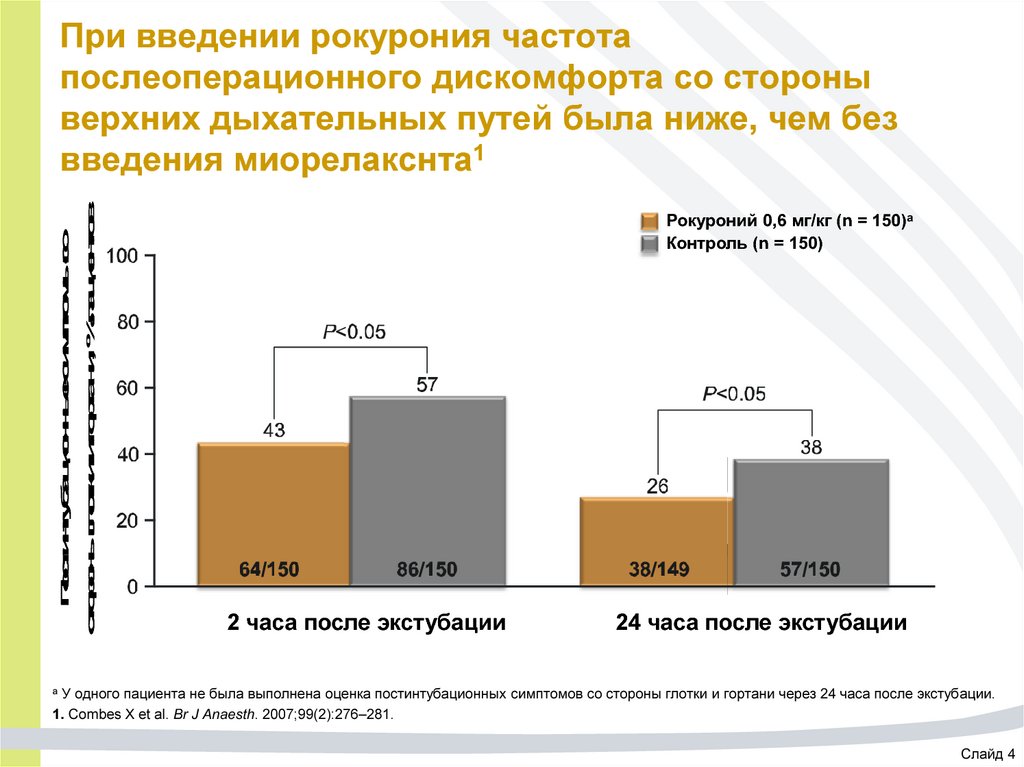
63. При введении рокурония частота послеоперационного дискомфорта со стороны верхних дыхательных путей была ниже, чем без введения
Постинтубационные симптомы состороны глотки и гортани, % пациентов
При введении рокурония частота
послеоперационного дискомфорта со стороны
верхних дыхательных путей была ниже, чем без
введения миорелакснта1
Рокуроний 0,6 мг/кг (n = 150)а
Контроль (n = 150)
2 часа после экстубации
24 часа после экстубации
У одного пациента не была выполнена оценка постинтубационных симптомов со стороны глотки и гортани через 24 часа после экстубации.
1. Combes X et al. Br J Anaesth. 2007;99(2):276–281.
a
Слайд 4
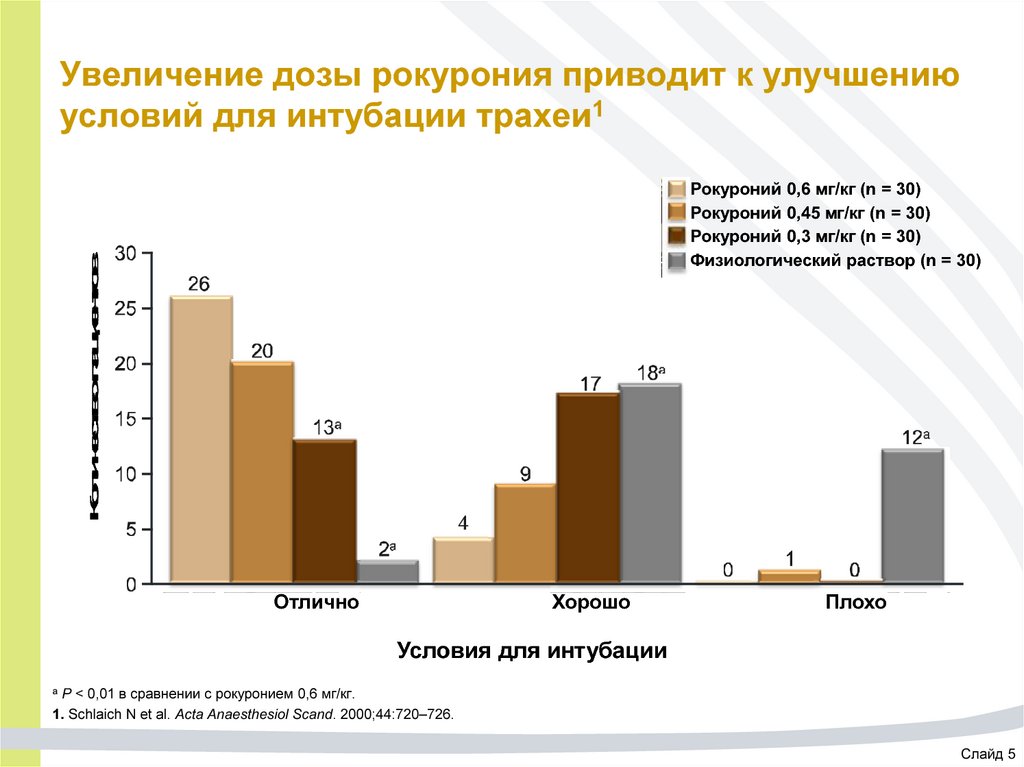
64. Увеличение дозы рокурония приводит к улучшению условий для интубации трахеи1
Количество пациентовРокуроний 0,6 мг/кг (n = 30)
Рокуроний 0,45 мг/кг (n = 30)
Рокуроний 0,3 мг/кг (n = 30)
Физиологический раствор (n = 30)
Отлично
Хорошо
Плохо
Условия для интубации
P < 0,01 в сравнении с рокуронием 0,6 мг/кг.
1. Schlaich N et al. Acta Anaesthesiol Scand. 2000;44:720–726.
a
Слайд 5
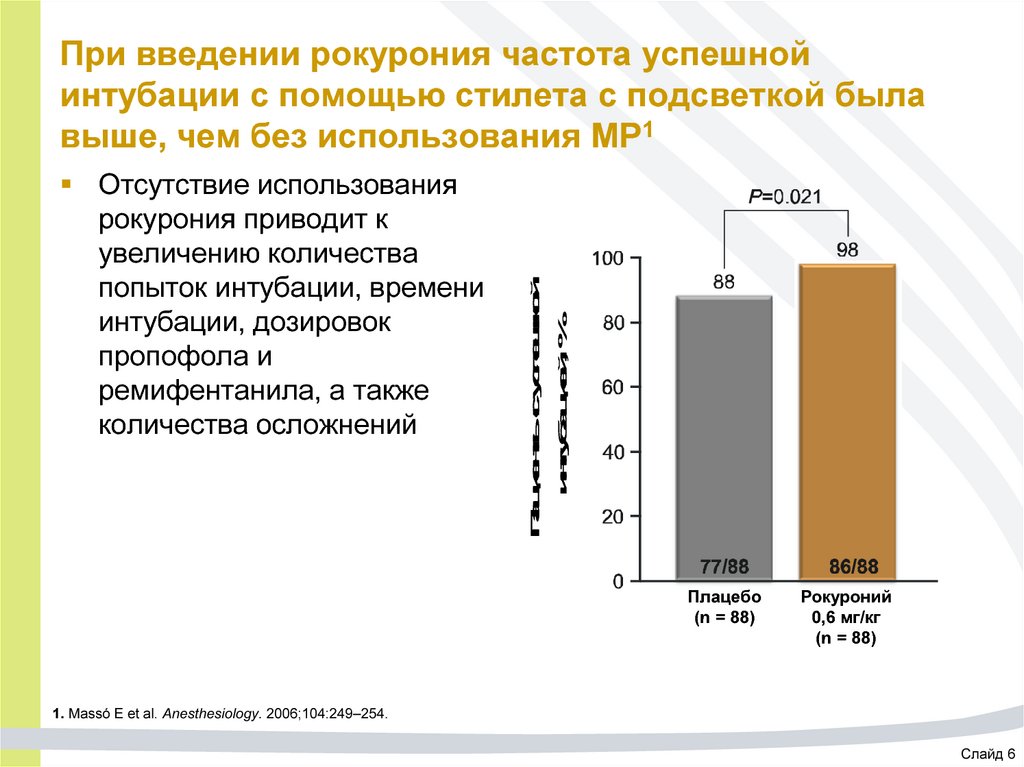
65. При введении рокурония частота успешной интубации с помощью стилета с подсветкой была выше, чем без использования МР1
Отсутствие использованиярокурония приводит к
увеличению количества
попыток интубации, времени
интубации, дозировок
пропофола и
ремифентанила, а также
количества осложнений
Пациенты с успешной
интубацией, %
При введении рокурония частота успешной
интубации с помощью стилета с подсветкой была
выше, чем без использования МР1
Плацебо
(n = 88)
Рокуроний
0,6 мг/кг
(n = 88)
1. Massó E et al. Anesthesiology. 2006;104:249–254.
Слайд 6
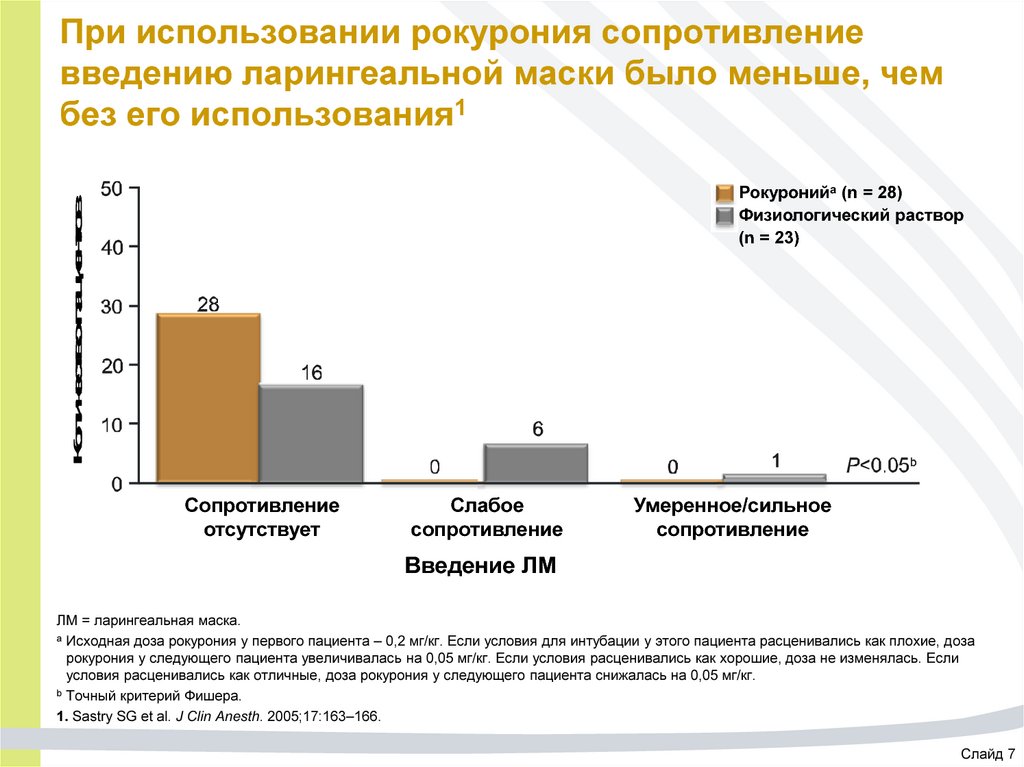
66. При использовании рокурония сопротивление введению ларингеальной маски было меньше, чем без его использования1
Количество пациентовРокуронийа (n = 28)
Физиологический раствор
(n = 23)
Сопротивление
отсутствует
Слабое
сопротивление
Умеренное/сильное
сопротивление
Введение ЛМ
ЛМ = ларингеальная маска.
a Исходная доза рокурония у первого пациента – 0,2 мг/кг. Если условия для интубации у этого пациента расценивались как плохие, доза
рокурония у следующего пациента увеличивалась на 0,05 мг/кг. Если условия расценивались как хорошие, доза не изменялась. Если
условия расценивались как отличные, доза рокурония у следующего пациента снижалась на 0,05 мг/кг.
b Точный критерий Фишера.
1. Sastry SG et al. J Clin Anesth. 2005;17:163–166.
Слайд 7
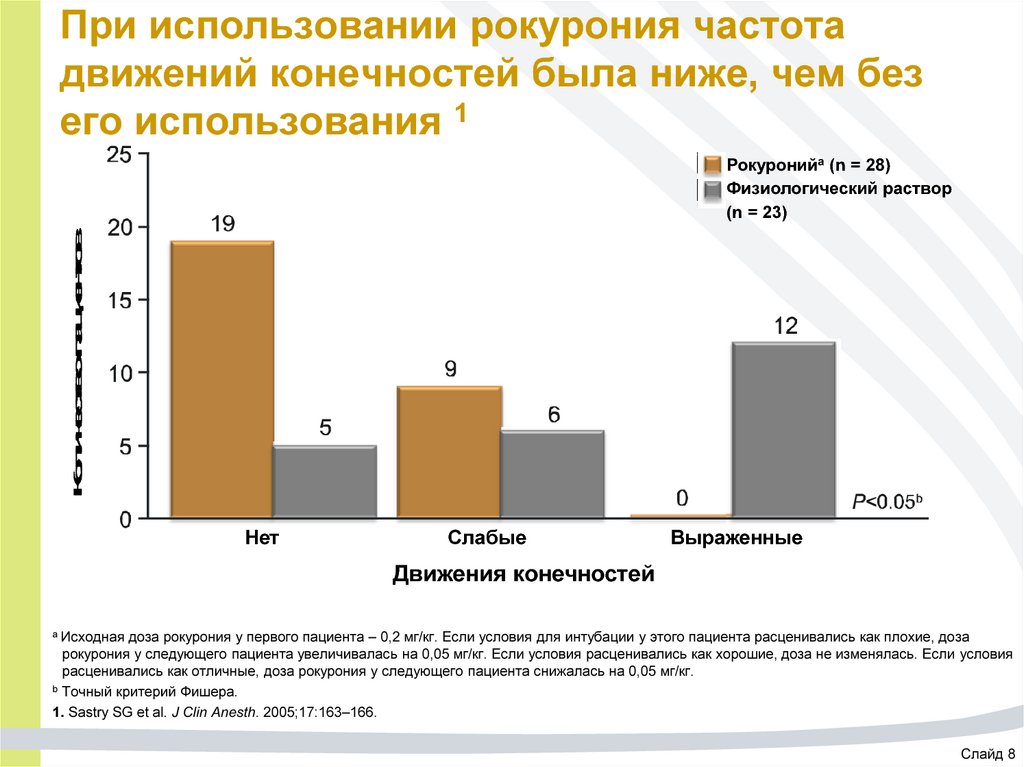
67. При использовании рокурония частота движений конечностей была ниже, чем без его использования 1
Количество пациентовРокуронийа (n = 28)
Физиологический раствор
(n = 23)
Нет
Слабые
Выраженные
Движения конечностей
a Исходная
доза рокурония у первого пациента – 0,2 мг/кг. Если условия для интубации у этого пациента расценивались как плохие, доза
рокурония у следующего пациента увеличивалась на 0,05 мг/кг. Если условия расценивались как хорошие, доза не изменялась. Если условия
расценивались как отличные, доза рокурония у следующего пациента снижалась на 0,05 мг/кг.
b Точный критерий Фишера.
1. Sastry SG et al. J Clin Anesth. 2005;17:163–166.
Слайд 8
68. Нервно-мышечный блок
Модуль 7: обзор миорелаксантовSide 68
69. Классы миорелаксантов
Деполяризующие МР1– Аналогично ацетилхолину связываются с α субъединицей
постсинаптических никотиновых рецепторов
– Единственным доступным в настоящее время
деполяризующим МР является сукцинилхолин
Недеполяризующие МР1
– Конкурируют с ацетилхолином за связывание с α
субъединицей постсинаптических никотиновых рецепторов
– Представлены бензилизохинолинами и аминостероидами
МР=миорелаксант
1. Hunter JM. N Engl J Med. 1995;332(25):1691–1699.
Side 69
70. Сукцинилхолин
Выпущен в 1952 году1Является единственным доступным в настоящее время деполяризующим МР2
Преимущества: быстрое начало действия, через 30–60 секунд после в/в
введения3
– Ультракороткая длительность действия, 4–6 минуты после однократного
внутривенного введения3,4
– Дешевый4
Недостатки: удлинение миорелаксации при сниженной активности
холинэстеразы плазмы крови5
– Вызывает много нежелательных явлений3,4
• Повышение внутриглазного и внутрижелудочного давления
• Побочные эффекты со стороны сердечнососудистой системы
• Гиперкалиемия
• Синдром злокачественной гипертермии
• Послеоперационная боль в мышцах
– Ограничения использования у детей3
МР = миорелаксант; в/в = внутривенно.
1. Foldes FF et al. N Engl J Med. 1952;247(16):596–600; 2. Hunter JM. N Engl J Med. 1995;332(25):1691–1699; 3. Succinylcholine Drug
Information. www.merck.com/mmpe/lexicomp/succinylcholine.html. Updated 2009. Accessed 26 August 2010; 4. Bettelli G. Curr Opin Anaesthesiol.
2006;19:600–605; 5. Ostergaard D et al. Med Toxicol Adverse Drug Exp. 1989;4:351–368.
Side 70
71. Недеполяризующие МР: бензилизохинолины
Четвертичные соединения аммония имеющие не менее одногоположительно заряженного атома азота, позволяющего
связываться с α субъединицей постсинаптического
никотинового рецептора1
Бензилизохинолиновые МР1,2
– Атракурий
– Цисатракурий
– Мивакурий
МР = миорелаксант.
1. Hunter JM. N Engl J Med. 1995;332(25):1691–1699; 2. Moore EW et al. Br J Anaesth. 2001;87:912–925.
Side 71
72. Атракурий
Бензилизохинолиновый МР средней продолжительности действия,впервые вышедший в 1982 году1,2
Преимущества
– Огран-независимая элиминация Хофманна позволяет применять
препарат у пациентов с нарушениями функции почек и печени1–3
Недостатки
– Более длительный клинический эффект, чем при применении
рокурония и векурония4
– Возможно высвобождение гистамина и отрицательное влияние на
сердечнососудистую систему1,5
– Возможно накопление лауданозина при длительной инфузии
препарата пациентам с нарушением функции печени1,6
МР = миорелаксант.
1. Atracurium besylate injection [prescribing information]. Bedford, OH: Bedford Laboratories; 2004; 2. Hunter JM. N Engl J Med. 1995;332(25): 1691–
1699; 3. Fisher DM et al. Anesthesiology. 1986;65:6–12; 4. Carroll MT et al. Anaesthesia. 1998;53:1169–1173; 5. Naguib M et al. Br J Anaesth.
1995;75:588–592; 6. Ward S et al. Br J Anaesth. 1986;58(suppl 1):6S–10S.
Side 72
73. Цисатракурий
Бензилизохинолиновый МР со средней скоростью наступления эффекта исредней продолжительностью действия, впервые выпущенный в 1996 году1,2
Преимущества
– Меньшая способность вызывать высвобождение гистамина и оказывать
влияние на сердечнососудистую систему в сравнении с атракурием1,3
– Орган-независимая элиминация Хофманна позволяет применять препарат
у пациентов с нарушением функции печени и почек1,4
Недостатки
– Более медленное наступление эффекта в сравнении с другими
миорелаксантами 1,3,5
– Возможное накопление лауданозина при длительных инфузиях у пациентов
с нарушением функции печени1
– У некоторых пациентов, получавших лечение цисатракурием, наблюдались
повышение уровней гистамина, снижение частоты сердечных сокращений и
артериального давления6
– Возможность развития послеоперационного остаточного блока7
МР = миорелаксант
1. Nimbex® Injection (cisatracurium besylate) [prescribing information]. North Chicago, IL: Abbott Laboratories; 2008; 2. Naguib M et al. Curr Opin
Anaesthesiol. 2009;22:483–490; 3. Bettelli G. Curr Opin Anaesthesiol. 2006;19:600–605; 4. Kisor DF et al. Clin Pharmacokinet. 1999;36:27–40; 5.
Adamus M et al. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2006;150:333–338; 6. Doenicke AW. Anesth Analg. 1998;87:434– 438;
7. Maybauer DM et al. Anaesthesia. 2007;62:12–17.
Side 73
74. Мивакурий
Бензилизохинолиновый МР, впервые вышедший для клиническогоиспользования в 1990х годах1,2
Первый недеполяризующий МР короткого действия3
Преимущества1
– Короткий клинический эффект (13–23 минут, в зависимости от дозы)
– Быстрое спонтанное восстановление (индекс восстановления мышечной
активности ~6 минут после применения дозы 0,15 мг/кг)
– Отсутствие активных метаболитов
Недостатки
– Может способствовать высвобождению гистамина и отрицательно влиять
на сердечнососудистую систему 1,4
– У пожилых пациентов и пациентов с нарушением функции почек и печени
выраженность миоплегирующего эффекта может изменяться, что требует
коррекции дозировки1
– Удлинение миоплегии в случае снижения активности холинэстеразы
плазмы крови1
МР = миорелаксант.
1. Mivacron® Injection (mivacurium chloride) [prescribing information]. Boronia, Victoria, Australia; GlaxoSmithKline; 2008; 2. Naguib M et al.
Curr Opin Anaesthesiol. 2009;22:483–490; 3. Bettelli G. Curr Opin Anaesthesiol. 2006;19:600–605; 4. Naguib M et al. Br J Anaesth.
1995;75:588–592.
Side 74
75. Недеполяризующие МР: аминостероиды
Четвертичные соединения аммония, имеющие неменее одного положительно заряженного атома
азота для связывания с α субъединицей
постсинаптических никотиновых рецепторов1
Аминостероидные МР1
–
–
–
–
Панкуроний
Векуроний
Пипекуроний
Рокуроний
МР = миорелаксанты.
1. Hunter JM. N Engl J Med. 1995;332(25):1691–1699.
Side 75
76. Панкуроний
Аминостероидный МР, впервые выпущенный в 1967 году1,2Преимущества
– Слабый индуктор высвобождения гистамина1,2
Недостатки1,2
– Медленное начало действия
– Длительный клинический эффект в сравнении с другими МР
– Способен оказывать отрицательное влияние на
сердечнососудистую систему
– Активный 3-OH метаболит
– У пациентов с нарушениями функции почек и печени может
наблюдаться более длительное действие
NMBA=neuromuscular blocking agent.
1. Pancuronium Bromide Injection [prescribing information]. Lake Forest, IL: Hospira; 2004; 2. Mirakhur RK. Yale J Biol Med. 1993;66:463–471.
Side 76
77. Векуроний
Аминостероидный МР средней продолжительности действия, впервыевыпущенный в начале 1980-х годов1,2
Преимущества
– Длительность клинического эффекта меньше, чем у панкурония (25–
40 минут)1
– Не вызывает значительного высвобождения гистамина и не
оказывает значимых эффектов на сердечнососудистую систему1,3
– У пациентов с нарушениями функции почек увеличения
продолжительности действия не наблюдается1
Недостатки1
– Имеет 3-дезацетил метаболит, который обладает 50% (и более)
активностью векурония
– У пациентов с нарушением функции печени восстановление
мышечной функции замедляется
МР = миорелаксант.
1. Vecuronium Bromide for Injection [prescribing information]. Bedford, OH: Bedford Laboratories; 2007; 2. Naguib M et al. Curr Opin Anaesthesiol.
2009;22:483–490; 3. Naguib M et al. Br J Anaesth. 1995;75:588–592.
Side 77
78. Пипекуроний
Аминостероидный МР длительного действия, впервые вышедший вначале 1990-х годов1
Преимущества
– Подходит для продолжительных оперативных вмешательств1,2
– Не вызывает значимого высвобождения гистамина и не оказывает
значимого влияния на сердечнососудистую систему3,4
Недостатки
– Медленное начало действия5,6
– Длительный клинический эффект и длительный период
восстановления6–8
– У пациентов с нарушением функции почек и печени может
возникать удлинение эффекта4,9
МР = миорелаксант.
1. Hunter JM. N Engl J Med. 1995;332:1691–1699; 2. Wierda JM et al. Anesth Analg. 1989;68:208–213; 3. Naguib M et al. Br J Anaesth.
1991;67:320–322; 4. Embree PB. J Am Assoc Nurse Anesth. 1993;61:382–387; 5. Gyermak L et al. Int J Clin Pharmacol Ther. 1994;32:600–605;
6. Mirakhur RK. Yale J Biol Med. 1994;66:463–471; 7. Caldwell JE et al . Br J Anaesth. 1988;61:693–697; 8. Foldes FF et al. Can J Anaesth.
1990;37:549–555; 9. Caldwell JE et al. Anesthesiology. 1989;70:7–12.
Side 78
79. Рокуроний - идеальный миорелаксант
Аминостероидный миорелаксант с быстрым наступлением эффекта исредней продолжительностью действия, впервые выпущенный в 1994
году1,2
Преимущества
– Быстрое наступление эффекта1,3
– Не имеет активных метаболитов4
– Более короткий клинический эффект, чем у цисатракурия и
атракурия3
– Быстрое восстановление мышечной функции с помощью
сугаммадекса5,6
– Более низкая частота остаточного блока в сравнении с
цисатракурием7
– Не вызывает значимого высвобождения гистамина и не оказывает
значимых эффектов на сердечнососудистую систему1,8,9
Недостатки
– У пациентов с заболеваниями почек и печени может наблюдаться
увеличение продолжительности действия1,10,11
МР = миорелаксант
1. ЭСМЕРОН™ (рокурония бромид), инструкция по применению; 2. Hunter JM. Br J Anaesth. 1996;76:481–483; 3. Carroll MT et al. Anaesthesia.
1998;53:1169–1173; 4. Muir AW et al. Br J Anaesth. 1989;63:400–410; 5. Flockton EA. Br J Anaesth. 2008;100:622–630; 6. Jones RK et al.
Anesthesiology. 2008;109:816–824; 7. Maybauer DM et al. Anaesthesia. 2007;62:12–17; 8. Naguib M et al. Br J Anaesth. 1995;75:588–592; 9. Levy
JH et al. Anesth Analg. 1994;78:318–321; 10. Robertson EN et al. Eur J Anaesth. 2005;22:4–10; 11. van Miert MM et al. Br J Clin Pharmacol.
1997;44:139–144.
Side 79
80. Преимущества и недостатки различных миорелаксантов
Пип10,12–Отдельные свойства
Сук1
Атр2–6
Цис7
Мив8
Панк9,10
Век11
Быстрое наступление
эффекта
+
–
–
–
–
–
–
+
Короткая/средняя
длительность эффекта
+
–
–
+
–
–
–
+
Гемодинамическая
Стабильность/высвобожд
ение гистамина
–
–
+
–
+/–
+
+
+
Выделение
печенью/почками
+
+/–
+/–
+/–
–
–
–
+
Неактивные метаболиты
+
+
+
+
–
–
+
+
Нетоксические
метаболиты
+
–
–
+
+
+
+
+
16
Рок3,17,18
МР = миорелаксант; Сук = сукцинилхолин; Атр= атракурий; Цис = цисатракурий; Мив = мивакурий; Панк = панкуроний; Век = векуроний; Пип
= пипекуроний; Рок = рокуроний; СС = сердечнососудистый.
1. Succinylcholine Drug Information. www.merck.com/mmpe/lexicomp/succinylcholine.html. Updated 2009. Accessed 26 August 2010; 2. Atracurium
besylate injection [prescribing information]. Bedford, OH: Bedford Laboratories; 2004; 3. Naguib M et al. Br J Anaesth. 1995;75:588–592; 4. Fisher DM
et al. Anesthesiology. 1986;65:6–12; 5. Ward S et al. Br J Anaesth. 1986;58(suppl 1):6S–10S; 6. Chapple DJ et al. Br J Anaesth. 1987;59: 218–225;
7. Nimbex® (cisatracurium besylate) [prescribing information]. North Chicago, IL: Abbott Laboratories; 2008; 8. Mivacron® Injection (mivacurium
chloride) [prescribing information]. Boronia, Victoria, Australia; GlaxoSmithKline; 2008; 9. Pancuronium Bromide Injection [prescribing information].
Lake Forest, IL: Hospira; 2004; 10. Mirakhur RK. Yale J Biol Med. 1993;66:463–471; 11. Vecuronium Bromide for Injection [prescribing information].
Bedford, OH: Bedford Laboratories; 2007; 12. Gyermak L et al. Int J Clin Pharmacol Ther. 1994;32:600–605; 13. Caldwell JE et al. Br J Anaesth.
1988;61:693–697; 14. Naguib M et al. Br J Anaesth. 1991;67:320–322; 15. Embree PB. J Am Assoc Nurse Anesth. 1993;61:382–387;
16. Caldwell JE et al. Anesthesiology. 1989;70:7–12; 17. ЭСМЕРОН™ (рокурониябромид), инструкция по применению.; 18. Muir AW et al. Br J
Anaesth. 1989;63:400–410.
Side 80
81. Краткая информация о препарате ЭСМЕРОН®
Терапевтический классЭсмерон® (рокурония бромид) - быстродействующий, недеполяризующий
миорелаксант средней продолжительности действия, обладающий всеми
фармакологическими эффектами (курареподобными), характерными для
данного класса препаратов. Он блокирует н-холинорецепторы скелетной
мышцы и препятствует деполяризующему действию ацетилхолина.
Антагонистами этого действия являются ингибиторы ацетилхолинэстеразы типа
неостигмина, эдрофония и пиридостигмина.
Показания
Препарат Эсмерон® показан для:
- облегчения интубации трахеи при проведении плановых хирургических
вмешательств и быстрой последовательной индукции анестезии и для
обеспечения релаксации скелетной мускулатуры во время хирургических
вмешательств различного характера у взрослых;
- облегчения интубации трахеи при проведении плановых хирургических
вмешательств и для обеспечения релаксации скелетной мускулатуры во время
хирургических вмешательств различного характера у детей с 1 месяца;
- облегчения интубации трахеи при проведении искусственной вентиляции легких
в отделениях интенсивной терапии у взрослых (кроме детей и пациентов
пожилого возраста).
82. Краткая информация о препарате ЭСМЕРОН®
Способ применения и дозыЭсмерон® вводится внутривенно как в виде болюсной инъекции, так и в виде
непрерывной инфузии. Как и в случае использования других миорелаксантов,
Эсмерон® должен вводится только опытными клиницистами, которые знакомы
с действием миорелаксантов, или под их наблюдением. Дозу препарата
Эсмерон®, как и в случае применения других миорелаксантов, нужно подбирать
индивидуально для каждого больного.
У взрослых пациентов в качестве общей схемы при проведении эндотрахеальной
интубации и для обеспечения мышечной релаксации при операциях различной
длительности и для использования в отделении интенсивной терапии могут
быть рекомендованы следующие дозировки.
При хирургических вмешательствах
Эндотрахеалъная интубация
Стандартная доза рокурония бромида для проведения эндотрахеальной интубации
во время обычной анестезии составляет 0,6 мг/кг, после которой адекватные
условия для интубации трахеи развиваются примерно через 60 сек у
большинства пациентов. При проведении быстрой последовательной индукции
анестезии для облегчения условий интубации трахеи рекомендуемая доза
составляет 1,0 мг/кг рокурония бромида. В этом случае адекватные условия для
интубации трахеи развиваются через 60 секунд почти у всех пациентов. При
использовании дозы 0,6 мг/кг рокурония бромида для проведения быстрой
последовательной индукции анестезии рекомендуется проводить интубацию
трахеи пациента через 90 сек после введения препарата.
83. Краткая информация о препарате ЭСМЕРОН®
Поддерживающая дозаРекомендуемая поддерживающая доза составляет 0,15 мг/кг рокурония бромида; в
случае длительного ингаляционного наркоза ее следует уменьшить до 0,075-0,1
мг/кг. Поддерживающие дозы лучше всего вводить в тот момент, когда
амплитуда мышечных сокращений восстановится до 25% от контрольного
уровня или при появлении 2-3 ответов при мониторинге в режиме
четырехразрядной стимуляции (TOF).
Непрерывная инфузия
Если рокурония бромид вводят посредством непрерывной инфузии, рекомендуется
начинать с нагрузочной дозы 0,6 мг/кг рокурония бромида, а когда нервномышечная проводимость начнет восстанавливаться, начать инфузию. Скорость
инфузии следует подобрать таким образом, чтобы сократительная реакция
скелетных мышц находилась на уровне 10% от контрольного уровня или
поддержания 1-2 ответов при мониторинге в режиме четырехразрядной
стимуляции (TOF). У взрослых при внутривенной общей анестезии скорость
инфузии, необходимая для поддержания нервно-мышечного блока на этом
уровне, составляет 0,3-0,6 мг/кг/ч, а при ингаляционном наркозе – 0,3-0,4
мг/кг/ч. Рекомендуется проводить постоянный мониторинг нервно-мышечной
проводимости, поскольку необходимая скорость инфузии может варьировать в
зависимости от индивидуальных особенностей пациента и от различных
методов анестезии.
84.
Краткая информация о препаратеЭСМЕРОН®
Применение препарата в педиатрической практике
. Для детей с 1 месяца рекомендуемая доза для интубации при проведении
обычной анестезии (0.6 мг/кг рокурония бромида) и поддерживающая доза (0.15
мг/кг рокурония бромида) такие же, как и для взрослых. При проведении
непрерывной инфузии в педиатрии скорость инфузии такая же, как и для
взрослых (0,3 – 0,6 мг/кг/ч), за исключением детей (2-11 лет), которым могут
потребоваться более высокие скорости инфузии. Начальная скорость инфузии
для детей рекомендуется такой же, как и для взрослых (0,3 – 0,6 мг/кг/ч). Уже во
время процедуры скорость должна быть скорректирована для того, чтобы
поддерживать амплитуду мышечных сокращений на уровне 10% от контрольной
амплитуды или наличие 1-2 ответов при мониторинге в режиме
четырехразрядной стимуляции (TOF). В настоящий момент недостаточно
данных по применению рокурония бромида у новорожденных (0-1 месяца).Опыт
применения рокурония бромида во время процедуры быстрой
последовательной индукции анестезии у детей ограничен. Поэтому рокурония
бромид не рекомендован для облегчения проведения интубации трахеи во
время быстрой последовательной индукции анестезии у детей.
85. Краткая информация о препарате ЭСМЕРОН®
Применение у пациентов пожилого возраста, у пациентов с нарушениемфункции печени и/или заболеванием желчевыводящих путей и/или почечной
недостаточностью
Стандартная интубационная доза для пациентов пожилого возраста и пациентов с
заболеваниями печени и/или желчевыводящих путей, и/или при наличии
почечной недостаточности при проведении обычной анестезии составляет 0,6
мг/кг рокурония бромида. При проведении процедуры быстрой
последовательной индукции у пациентов с предполагаемой пролонгированной
продолжительностью действия миорелаксанта рекомендуется использовать
дозу 0.6 мг/кг рокурония бромида. Независимо от техники введения,
рекомендуемая поддерживающая доза для этих пациентов составляет 0,075-0,1
мг/кг рокурония бромида, рекомендуемая скорость инфузии – 0,3-0,4 мг/кг/ч
Дозировка у пациентов с избыточной массой тела и ожирением
При использовании препарата у больных с избыточной массой тела или ожирением
(таковыми считаются больные, индекс массы тела которых на 30% и более
превышает норму) дозы рокурония бромида следует снижать, рассчитывая их,
исходя из нормальных для данного возраста и пола показателей индекса массы
тела.
86. Краткая информация о препарате ЭСМЕРОН®
Интенсивная терапияИнтубация трахеи
Дозы аналогичны таковым при хирургических вмешательствах.
Поддерживающая доза
Рекомендуется начинать с дозы 0,6 мг/кг рокурония бромида, с последующей
переводом на непрерывную инфузию препарата при восстановлении нервномышечной проводимости до 10% от исходного уровня или получении 1-2
ответов при стимуляции в режиме TOF. Дозы рокурония бромида должны быть
подобраны индивидуально в зависимости от эффекта. Рекомендуемая
начальная скорость инфузии для поддержания нервно-мышечного блока на
уровне 80-90% (1-2 ответов при стимуляции в режиме TOF) у взрослых
пациентов составляет 0,3-0,6 мг/кг/ч в течение первого часа введения, после
чего, на протяжении 6-12 часов необходимо снижать скорость инфузии, в
соответствии с индивидуальной реакцией больного. После этого
индивидуальные потребности в определенной дозе препарата остаются
относительно постоянными.
Применение у особых групп пациентов
Эсмерон® не рекомендуется применять для облегчения проведения искусственной
вентиляции легких в отделении интенсивной терапии у детей и пациентов
пожилого возраста из-за отсутствия данных по безопасности и эффективности
препарата у этих групп пациентов.
87. Краткая информация о препарате ЭСМЕРОН®
Некоторая информация о безопасности препарата ЭСМЕРОН™Противопоказания
- Повышенная чувствительность к рокуронию или к бромид-иону или к любому
вспомогательному веществу;
- Детский возраст до 1 месяца (в связи с недостаточностью данных);
- Беременность, за исключением кесарева сечения (в связи с недостаточностью
данных);
- Период лактации (в связи с недостаточностью данных).
Особые указания и Меры Предосторожности
Поскольку Эсмерон® вызывает паралич дыхательных мышц, больным,
получающим этот препарат, абсолютно необходимо проводить искусственную
вентиляцию легких вплоть до адекватного восстановления самостоятельно
дыхания. Как и при использовании других миорелаксантов, важно
предусмотреть возможные трудности интубации трахеи, особенно в случае
использования препарата в составе методики быстрой последовательной
индукции анестезии. В случае возникновения трудностей при проведении
интубации трахеи, приводящих к необходимости немедленного восстановления
нейромышечной проводимости из блока, вызванного рокуронием, следует
использовать сугаммадекс.
88. Краткая информация о препарате ЭСМЕРОН®
Как и при применении других миорелаксантов, были отмечены случаи развитияостаточного блока и после использования препарата Эсмерон®. Для того,
чтобы предупредить осложнения, возникающие в результате развития
остаточного блока, рекомендуется проводить экстубацию трахеи только после
того, как нервно-мышечная проводимость восстановится в достаточной
степени. Также следует учитывать и другие факторы, которые могут вызывать
развитие остаточного блока после экстубации в послеоперационном периоде
(например, лекарственное взаимодействие или состояние больного).
Необходимо рассмотреть возможность введения сугаммадекса или других
препаратов, восстанавливающих нервно-мышечную проводимость, особенно в
тех случаях, когда возникновение остаточного блока наиболее вероятно.
После введения миорелаксантов могут развиваться анафилактические реакции.
Поэтому всегда следует предпринимать необходимые меры предосторожности,
целью которых является лечение таких реакций. Меры предосторожности
должны быть предприняты особенно в случае наличия анафилактических
реакций на миорелаксанты в анамнезе, поскольку известны случаи
перекрёстной аллергической реактивности на миорелаксанты.
89. Краткая информация о препарате ЭСМЕРОН®
После длительного введения миорелаксантов пациентам, находящимся вотделении интенсивной терапии, может отмечаться развитие
пролонгированного нервно-мышечного блока и/или мышечной слабости. Для
предотвращения возможной пролонгации нервно-мышечного блока и/или
передозировки необходимо, чтобы в течение всего периода применения
миорелаксантов осуществлялся мониторинг нервно-мышечной проводимости, а
также, чтобы больные получали адекватное обезболивание и седативные
препараты. Более того, миорелаксанты следует вводить в тщательно
подобранных дозах в соответствии с индивидуальной реакцией больного,
причем введение должно осуществляться опытным врачом, знакомым с
действием миорелаксантов или под его наблюдением, а также при
использовании соответствующей техники нервно-мышечного мониторинга.
После продолжительного введения недеполяризующих миорелаксантов в
комбинации с терапией кортикостероидами в отделении интенсивной терапии
возможно развитие миопатии. Поэтому больным, получающим и
миорелаксанты, и кортикостероиды, период введения миорелаксанта должен
быть по возможности максимально ограничен.Если для интубации применяется
суксаметоний, то введение препарата Эсмерон® следует отложить до
клинического восстановления нервно-мышечной проводимости после блока,
вызванного суксаметонием.
Следующие состояния могут оказывать влияние на фармакокинетику и/или
фармакодинамику препарата ЭМЕРОН: заболевания печени и/или
желчевыводящих путей и почечная недостаточность, увеличение времени
циркуляции; нейромышечные заболевания, гипотермия, ожирение, ожоги.
90. Краткая информация о препарате ЭСМЕРОН®
Состояния, которые могут усиливать эффект ЭСМЕРОНа: гипокалиемия(например, после продолжительной рвоты, диареи или терапии диуретиками),
гипермагниемия, гипокальциемия (после массивных трансфузий),
гипопротеинемия, дегидратация, ацидоз, гиперкапния и кахексия.
Беременность.
В отношении рокурония бромида отсутствуют клинические данные о действии
препарата во время беременности (за исключением кесарева сечения).
Назначение препарата Эсмерон® у беременных женщин в связи с
недостаточностью данных клинических исследований не рекомендуется (за
исключением кесарева сечения). При проведении операции кесарева сечения,
препарат Эсмерон® может применяться в составе методики быстрой
последовательной индукции анестезии, если не предполагаются трудности при
интубации трахеи и введена достаточная доза анестетика, или после интубации
с применением суксаметония. Показано, что применение препарата Эсмерон®
в дозе 0,6 мг/кг является безопасным у женщин, подвергающихся кесареву
сечению. Примечание 1: дозы 1,0 мг/кг исследовались при проведении быстрой
последовательной индукции анестезии, но не у пациенток, подвергающихся
операции кесарева сечения. Поэтому в этой группе пациентов только доза 0,6
мг/кг является рекомендованной. Примечание 2: Восстановление нервномышечной проводимости после введения миорелаксантов может быть
замедленным или быть неполным у пациенток, получающих соли магния для
лечения токсикоза беременных, поскольку соли магния усиливают нервномышечный блок. Поэтому у таких пациенток дозы препарата Эсмерон® должны
быть снижены и их необходимо титровать в зависимости от мышечного ответа.
91. Краткая информация о препарате ЭСМЕРОН®
Кормление грудью.В настоящее время остается неизвестным, выводится ли препарат Эсмерон® у
человека с грудным молоком. Назначение препарата Эсмерон® в период
лактации в связи с недостаточностью данных клинических исследований не
рекомендуется.
Лекарственные взаимодействия.
Показано, что ниже перечисленные лекарственные препараты влияют на силу
и/или продолжительность действия недеполяризующих миорелаксантов.
Усиление эффекта: Галогенезированные летучие анестетики; предшествующее
введение суксаметония; длительное сопутствующее введение
кортикостероидов и препарата Эсмерон® в отделении интенсивной терапии
может привести к увеличению продолжительности нервно-мышечного блока
или к миопатии; Препараты других групп: антибиотики (аминогликозиды,
линкозамиды и полипептидные антибиотики, антибиотики ациламинопенициллинового ряда); диуретики, хинидин и его изомер хинин, соли магния,
блокаторы кальциевых каналов, соли лития, местные анестетики (лидокаин
внутривенно, бупивакаин эпидурально) и острое введение фенитоина или βадреноблокаторов.
Рекураризация отмечалась после послеоперационного введения: аминогликозида,
линкозамида, полипептидных и ациламинопенициллиновых антибиотиков,
хинидина, хинина и солей магния
92. Краткая информация о препарате ЭСМЕРОН®
Снижение эффекта: Предшествующее длительное введение фенитоина иликарбамазепина; Ингибиторы протеаз (габексат, улинастатин);
Изменение эффекта: Введение других недеполяризующих миорелаксантов в
комбинации с препаратом Эсмерон® может вызвать ослабление или усиление
нервно-мышечного блока, в зависимости от очередности введения и от
применяемого миорелаксанта.
Суксаметоний, который вводят после препарата Эсмерон®, может усиливать или
ослаблять нервно-мышечный блок, вызванный препаратом Эсмерон®.
Влияние препарата Эсмерон® на другие лекарственные препараты
Комбинация препарата Эсмерон® с лидокаином может приводить к более
быстрому началу действия лидокаина.
Дети . Формальных исследований по изучению лекарственных взаимодействий не
проводилось. Упомянутые выше лекарственные взаимодействия у взрослых
пациентов, а также предостережения и меры предосторожности необходимо
иметь в виду при назначении препарата детям.
Побочное действие
Наиболее часто возникающие побочные лекарственные реакции включают: боль в
месте инъекции, изменение основных показателей состояния организма
(тахикардия, гипотензия) и увеличение продолжительности нервно-мышечного
блока. Наиболее часто сообщаемыми серьезными побочными лекарственными
реакциями в пострегистрационный период наблюдения за препаратом
являются «анафилактические и анафилактоидные реакции» и связанные с
ними симптомы.
93. Краткая информация о препарате ЭСМЕРОН®
Очень редко, но все-таки сообщается о возникновении тяжёлых анафилактическихреакций в результате применения миорелаксантов, включая Эсмерон®.
Анафилактические/ анафилактоидные реакции: бронхоспазм, изменения со
стороны сердечно-сосудистой системы (например, гипотензия, тахикардия,
сосудистый коллапс – шок) и изменения со стороны кожи (например,
ангионевротический отек, крапивница). В некоторых случаях эти реакции были
фатальными. Из-за возможной тяжести этих реакций всегда необходимо иметь
в виду возможность их возникновения и соблюдать соответствующие меры
предосторожности. Поскольку известно, что миорелаксанты способны вызывать
высвобождение гистамина как локально в месте инъекции, так и системно, то
поэтому при введении этих препаратов всегда необходимо учитывать
возможное возникновение зуда и эритематозных реакций в месте инъекции
и/или генерализованных гистаминоподобных (анафилактоидных) реакций. Было
показано только незначительное увеличение средних уровней гистамина в
плазме после быстрого болюсного введения 0,3-0,9 мг/кг рокурония бромида.
Применение препарата в педиатрической практике. Мета-анализ 11 клинических
исследований с участием детей (N=704), получавших рокурония бромид в дозах
до 1 мг/кг, было показано, что тахикардия, как нежелательное явление,
регистрировалась с частотой 1,4%.
94. Краткая информация о препарате ЭСМЕРОН®
ДругиеВ случае передозировки и пролонгирования нервно-мышечного блока, пациентам
следует продолжать проведение искусственной вентиляции легких и седации. В
такой ситуации доступны 2 опции для устранения нервно-мышечного блока: (1)
Для устранения глубокого и выраженного блока можно использовать
сугаммадекс. Доза сугаммадекса зависит от уровня нервно-мышечного блока.
(2) Ингибиторы ацетилхолинэстеразы (например, неостигмин, эдрофоний,
пиридостигмин) можно использовать однократно в соответсвующей дозе если
уже началось спонтанное восстановление нейромышечной проводимости.
Если введение ингибитора ацетилхолинэстеразы не устраняет
нейромышечного блока, вызванного Эсмероном,, необходимо продолжать
искусственную вентиляцию легких до тех пор, пока не восстановится
самостоятельное дыхание. Повторное введение ингибитора
ацетилхолинэстеразы может быть опасным.
В исследованиях на животных острая сердечнососудистая недостаточность,
приводящая, в конечном итоге, к остановке сердца, не возникала вплоть до
введения кумулятивной дозы Эсмерона, равной 750xED90 (135 мг•кг-1
рокурония бромида).
95.
Перед назначением любого препарата, упомянутого в данном материале,пожалуйста, ознакомьтесь с полной инструкцией по применению,
предоставляемой компанией-производителем.
Компания MSD не рекомендует применять препараты компании способами,
отличными от описанных в инструкции по применению.
ООО «МСД Фармасьютикалс»
Россия, 115093, Москва, ул. Павловская, д. 7, стр. 1
Тел.: +7 (495) 916-71-00, факс: +7 (495) 916-70-94
www.merck.com
ANES-1016597-0003; 07 2012
Side 95































































 medicine
medicine








