Similar presentations:
Хронические лейкозы (II часть)
1. Хронические лейкозы (II часть)
Хронические лейкозы(II часть)
Кафедра госпитальной терапии
К.м.н. доцент Н.Б.Булиева
2. Парапротеинемические гемобластозы-
опухолевые заболевание кроветворнойткани, представленные В-лимфоцитами и
плазматическими клетками, которые
синтезируют в избыточном количестве
моноклональные (патологические)
иммуноглобулины и их фрагменты
(парапротеины).
3. Классификация
Множественная миеломаМакроглобулинемия Вальденстрема
Болезнь тяжелых цепей
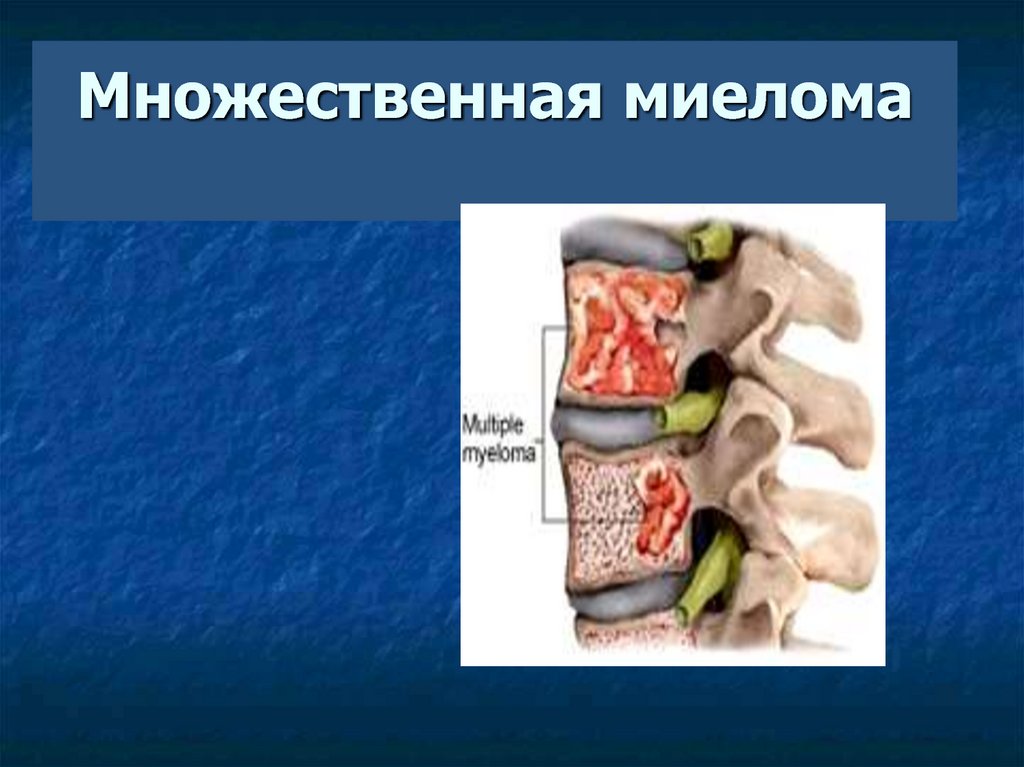
4. Множественная миелома
5. Множественная миелома
Множественная миелома – плазмоклеточная опухоль, характеризующаясядеструктивным поражением скелета,
развитием почечной недостаточности,
анемии и
гиперкальциемии ( CRAB)
6. История вопроса
1845г. -первые описания (МсIntyre и Watson)1848г.- Bence-Jones описал некую «живую материю»
белкового происхождения, полученную из мочи пациента,
выпадающую в осадок при нагревании и вновь
растворяющуюся при кипячении
1873г- О.А.Рустицкий описал патологическую анатомию и
гистологию заболевания, назвав его «множественной
миеломой»
1889г- O.Kahler связал миелому Рустицкого с
протеинурией Бенс-Джонса
1928г- М.И.Аринкин предложил методику прижизненного
исследования костного мозга при помощи стернальной
пункции
1931г- L.Lichtenstein, 1936г.- A.Ф. Коровников и
Г.А.Алексеев – впервые выставлен диагноз ММ на
основании данных стернальной пункции.
7.
8. Эпидемиология
- ММ составляет 1% всех онкологических заболеванийи не многим более 10% всех гемобластозов.
- Частота ММ составляет 1- 4 случаев на 100 000
населения
- Соотношение мужчин и женщин составляет 3:2
- Частота заболеваемости увеличивается с возрастом,
средний возраст 69 лет
9. Этиология
Этиологическая роль вирусов и ионизирующегоизлучения не доказана
-Профессиональные вредности: пестициды, инсектициды,
продукты нефти, тяжелые металлы, асбест
- Радиация
- Генетическая предрасположенность ( расовые различия,
семейные случаи)
- Хроническая антигенная стимуляция
( инфекции, воспаление, заболевания соединительной ткани,
аутоиммунные процессы, аллергические заболевания,
ревматоидный артрит)
10.
Объектом опухолевойтрансформации является клеткапредшественница В-лимфоцитов,
прошедшая этапы
актигензависимой
дифференцировки, способная
дифференцироваться до
плазмоцита, секретирующего PIg;
11.
Хромосомные поломки при ММПочти все пациенты с ММ имеют хромосомные
аномалии
Нарушения кариотипа: 8-30% пациентов
Плохой прогноз: моносомия 13 или гиподиплоидия
– Хороший прогноз: нормальный кариотип,
гипердиплоидия
–
12. Патогенез миеломы
Интрамедул.очаги
Стромальная
клетка к/м
Моноклональная
гаммапатия
неустан.генеза
ММ
Экстрамедул.
очаги
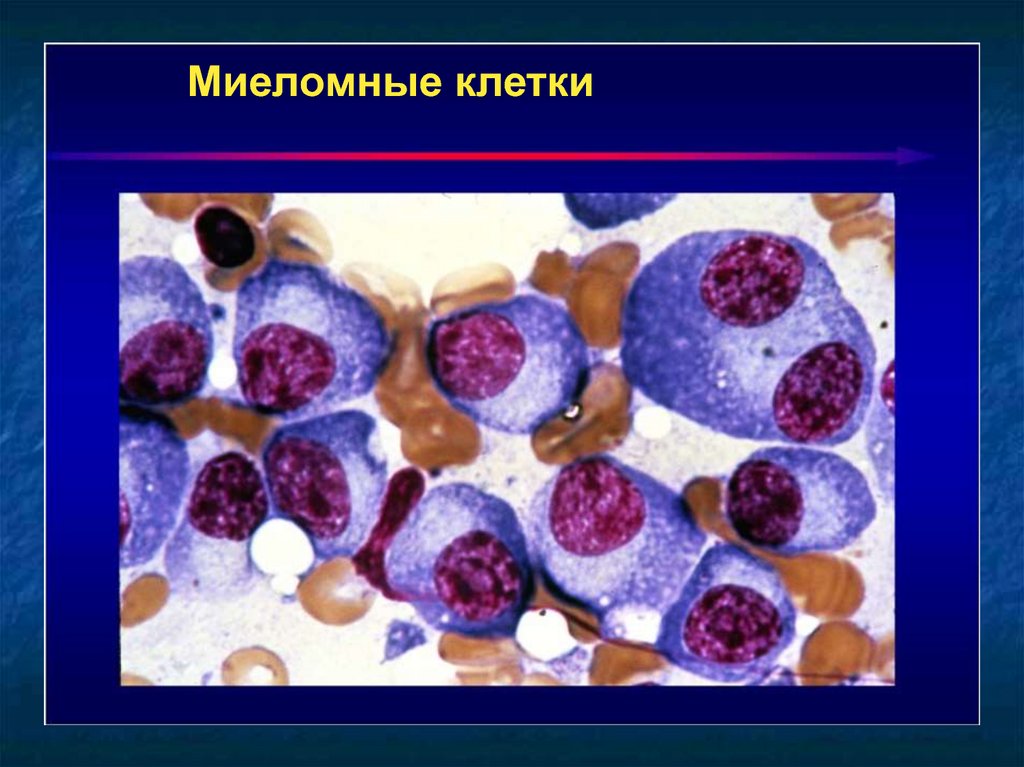
13.
Миеломные клетки14.
Основные жалобыКостные
боли: 58%
Слабость: 32%
Потеря веса: 24%
Парестезии: 5%
Около 20% пациентов не имеют
симптомов или они слабо
выражены
15. Клинические проявления миеломы
Скелетные находкиСолитарные
Эффекты,
ассоциированные с
костной деструкцией
Гиперкальциемия
Общие симптомы
или множественные
остеолитические повреждения
Диффузный остеопороз (остеопения)
у 20-40%
( утомляемость, жажда, тошнота, запоры,
повреждение почек, полиурия, сонливость,
судороги, кома)
Гиперкальцийурия
Костные переломы
Уменьшение роста (вертебральный
коллапс)
Общая слабость, недомогание, похудание,
рассеянность
16.
Периферическаякровь
Анемия,
лейкопения, тромбоцитопения,
ускорение СОЭ у 70%
Нарушение свертывания крови
Плазмоклеточный лейкоз
Изменения белков
плазмы
Гиперпротеинемия
(гипервязкость,
нарушение микроциркуляции, сонливость)
Гиперволемия
Моноклональные иммуноглобулины
Снижение уровня других иммуноглобулинов
Гипонатриемия
Повышенный β-2-микроглобулин
Гипоальбуминемия
Повышенный СРБ и ИЛ6 сыворотки
17.
Периферическаякровь
Анемия,
лейкопения, тромбоцитопения,
ускорение СОЭ у 70%
Нарушение свертывания крови
Плазмоклеточный лейкоз
Изменения белков
плазмы
Гиперпротеинемия
(гипервязкость,
нарушение микроциркуляции, сонливость)
Гиперволемия
Моноклональные иммуноглобулины
Снижение уровня других иммуноглобулинов
Гипонатриемия
Повышенный β-2-микроглобулин
Гипоальбуминемия
Повышенный СРБ и ИЛ6 сыворотки
18. Показания к обследованию при подозрении на ММ
Возраст старше 40 лет и любое из следующего:Необъяснимая боль в спине или костях
Необъяснимые переломы
Остеолитические поражения или остеопения
Анемия
Почечная недостаточность
Необъяснимая протеинурия
Необъяснимые отеки или асцит
Нефротический синдром
19.
формирование монетных столбиков изэритроцитов
Слабость, усталость, летаргия
Рецидивирующие инфекции
Ускорение СОЭ
Необъяснимая периферическая
нейропатия
Гиперкальциемия
Гипервязкость
Приобретенные нарушения
свертывания крови
20.
Основные симптомы при диагностикеММ
Моноклональный
белок: 93%
Костные деструкции: 67%
Плазмацитоз в костном мозге: 96%
Анемия (нормохромная нормоцитарная):
73%
Гиперкальциемия: 13%
21.
22. Критерии диагноза.
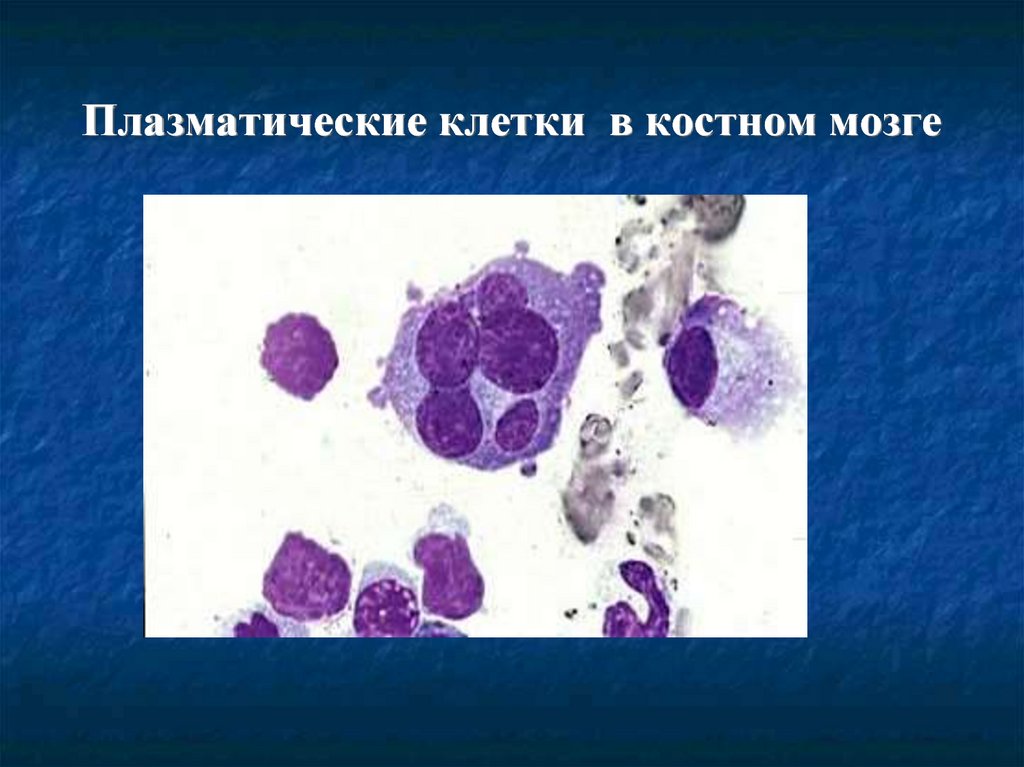
Гемограмма- анемия, ускоренная СОЭ,плазматические клетки (более 5%);
Миелограмма- увеличение плазматических
клеток (более 10%);
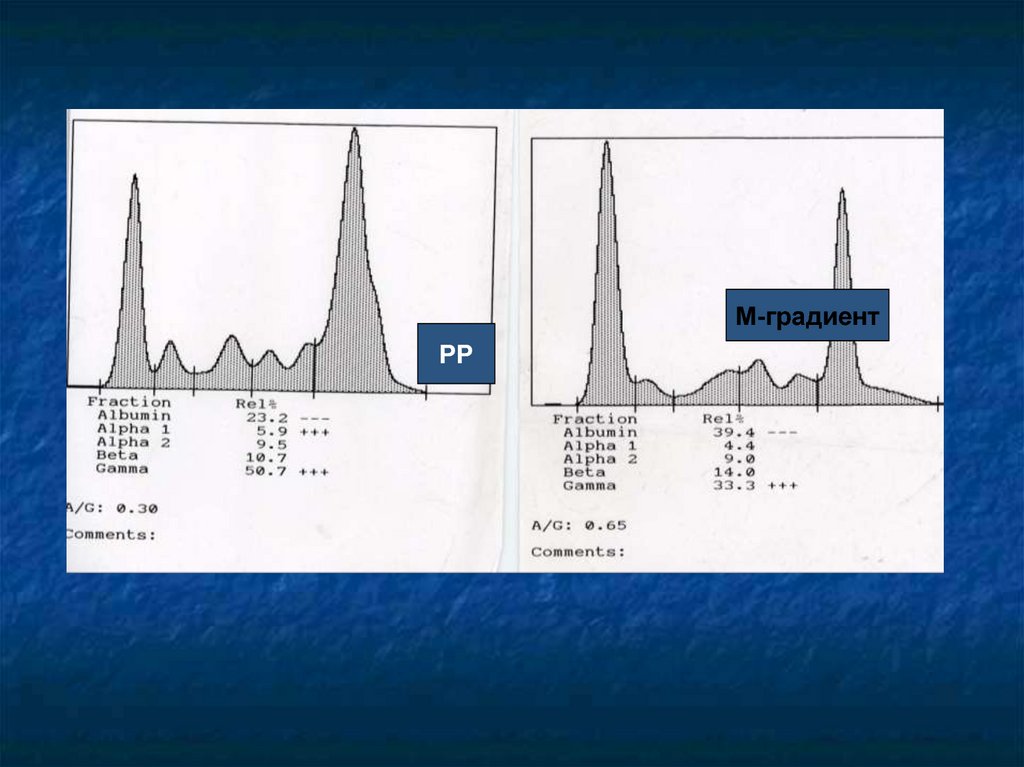
Парапротеинемия при БАК (М-градиент в
крови)
Белок Бенс-Джонса в моче;
моноклоновый иммуноглобулин в
сыворотке крови и в моче методом
электрофореза.
23. Лабораторная диагностика.
Общий анализ крови с подсчетомтромбоцитов, ретикулоцитов;
ОАМ;
Определение общего белка сыворотки
крови;
Электрофорез сывороточных белков и
определение М-компонента;
Определение суточной потери белка с
мочой- при наличии протеинурии;
24. Лабораторная диагностика (продолжение).
БАК- креатинин, мочевина, мочевая кислота, кальций,ЛДГ, щелочная фосфатаза, Bi, трансаминазы, СРБ;
Рентгенография всех костей скелета, кроме дистальных
отделов конечностей, если нет клинических признаков
поражения в этих областях);
Иммуннофенотипирование миеломных клеток (CD20+++,
CD56(-));
Цитогенетическое исследование (транслокации,
хромосомные аномалии, делеция или утрата 13
хромосомы и др.).
25.
26.
М-градиентРР
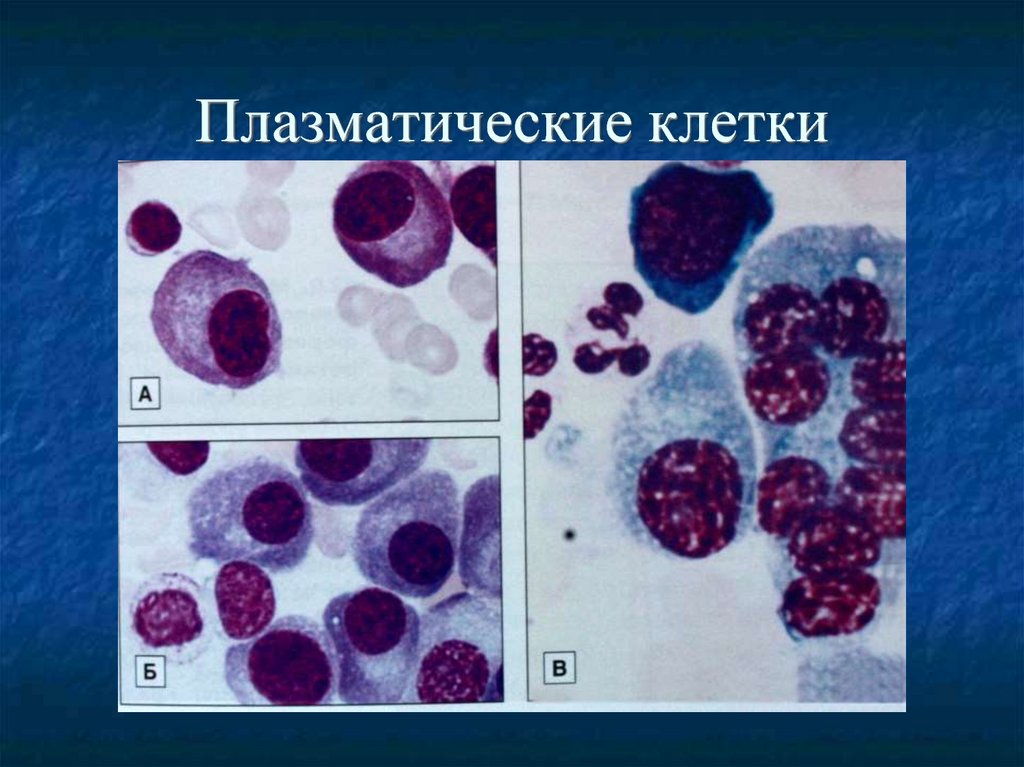
27. Плазматические клетки в костном мозге
28. Плазматические клетки
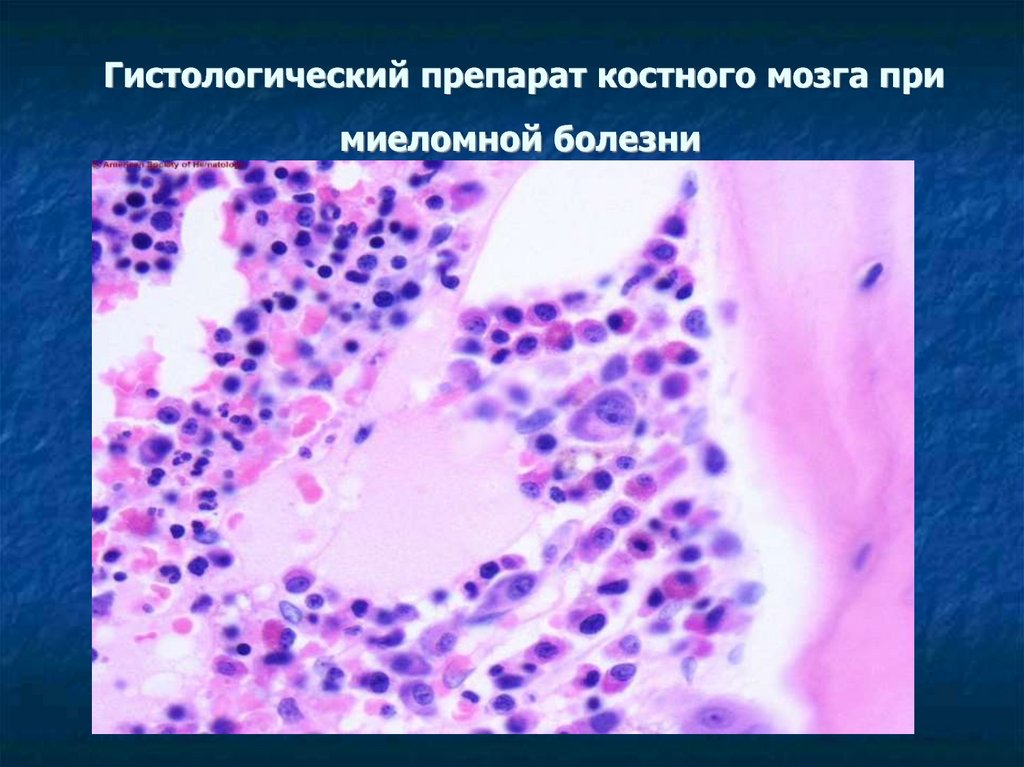
29. Гистологический препарат костного мозга при миеломной болезни
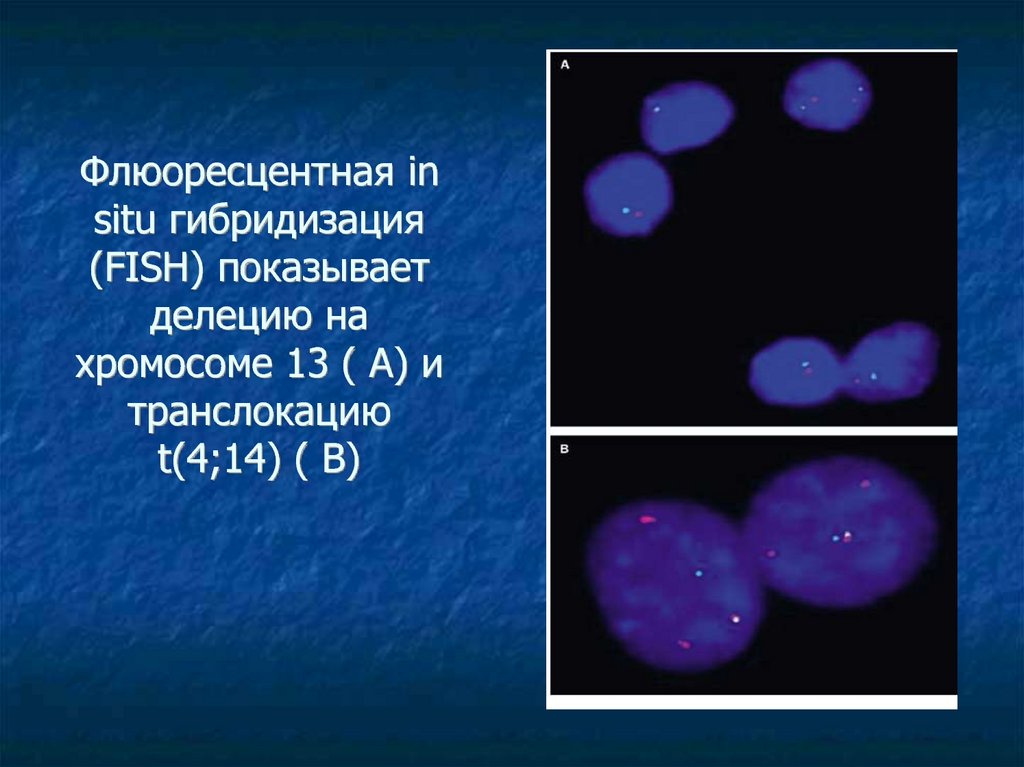
30. Флюоресцентная in situ гибридизация (FISH) показывает делецию на хромосоме 13 ( А) и транслокацию t(4;14) ( В)
Флюоресцентная insitu гибридизация
(FISH) показывает
делецию на
хромосоме 13 ( А) и
транслокацию
t(4;14) ( В)
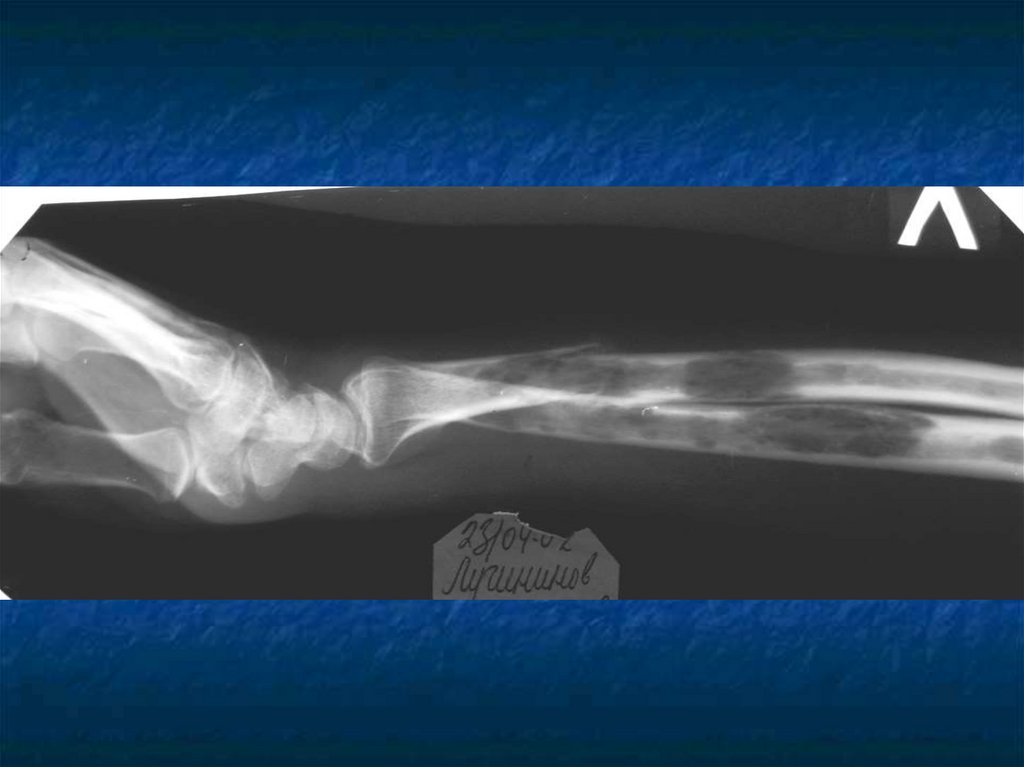
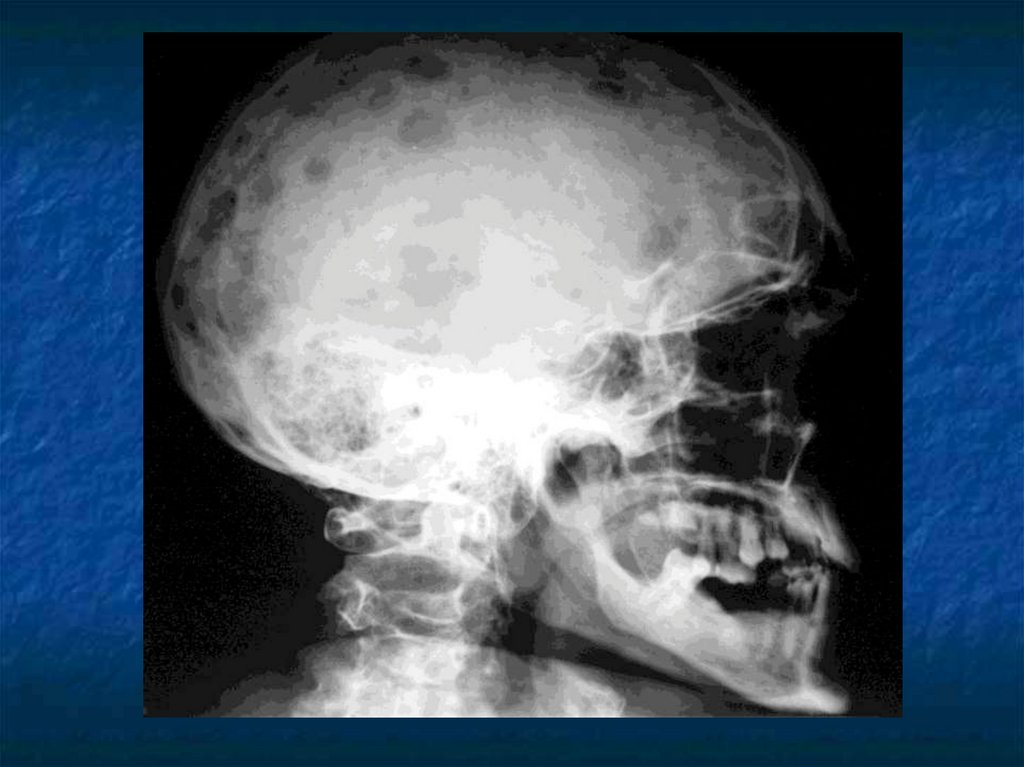
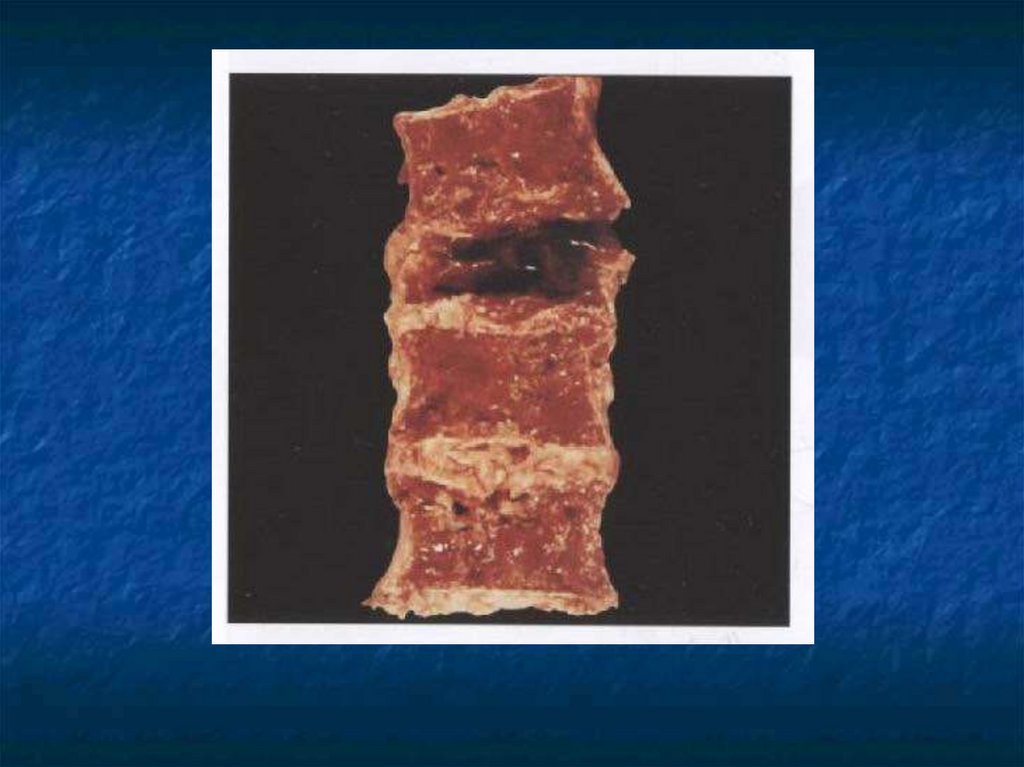
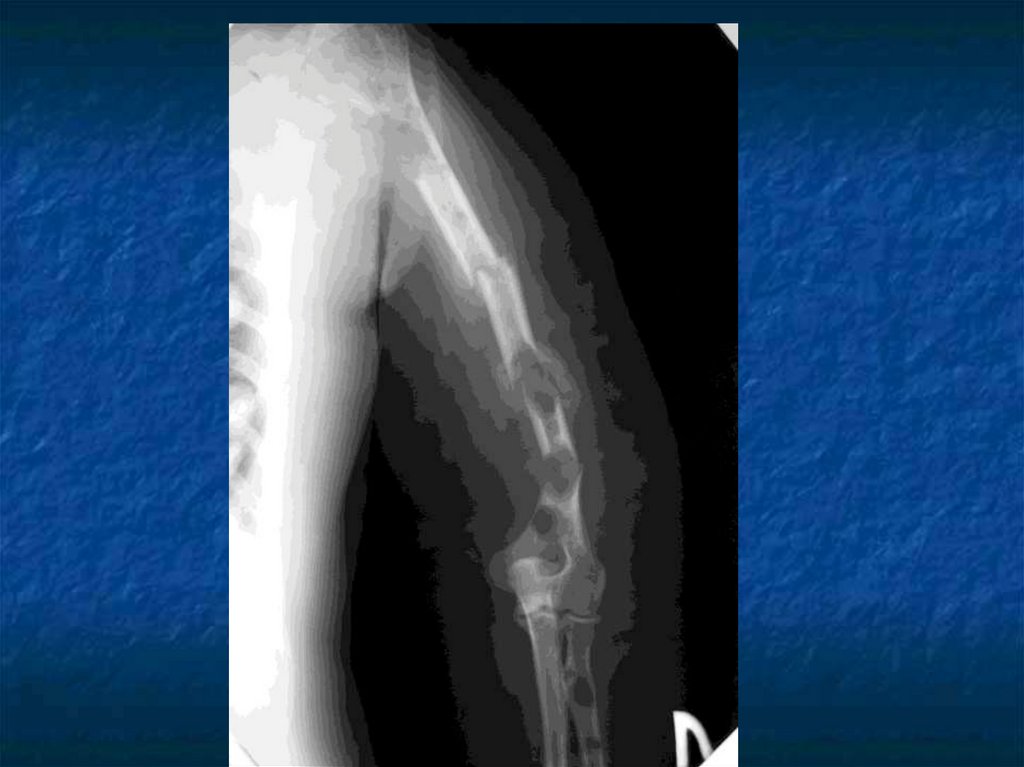
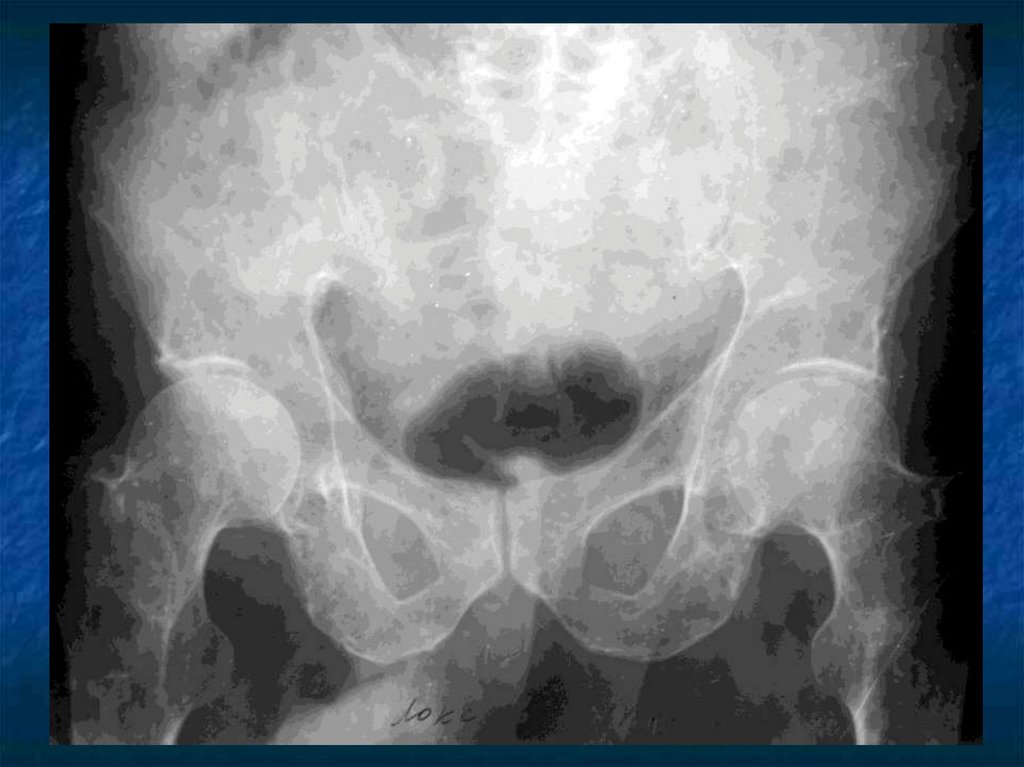
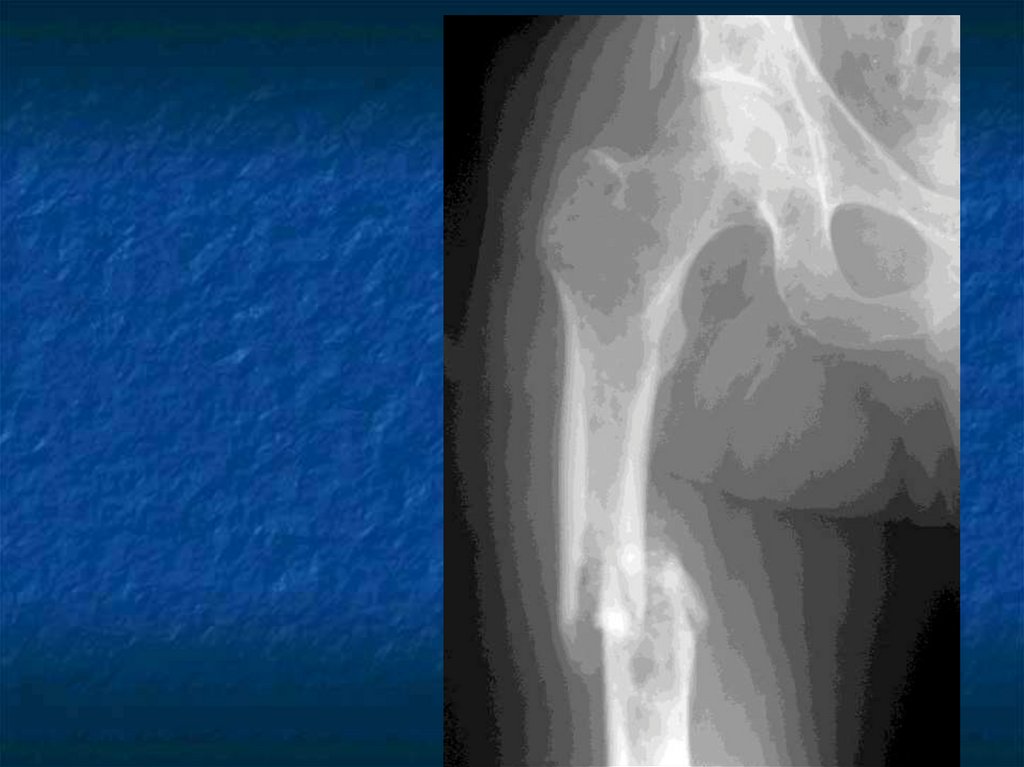
31. Косвенные признаки ММ.
Ro-логический метод выявленияостеодеструкций, но специфических
изменений скелета не существует.
Отсутствие остеодеструкций не
исключает ММ.
32.
33.
34.
35.
36.
37.
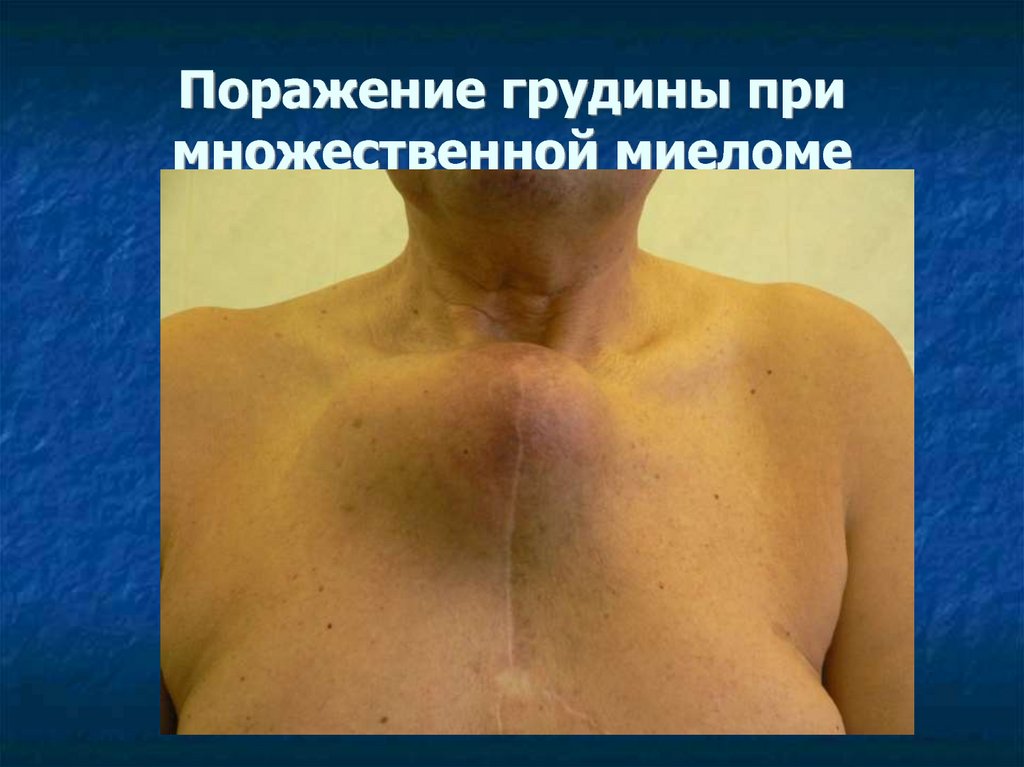
38. Поражение грудины при множественной миеломе
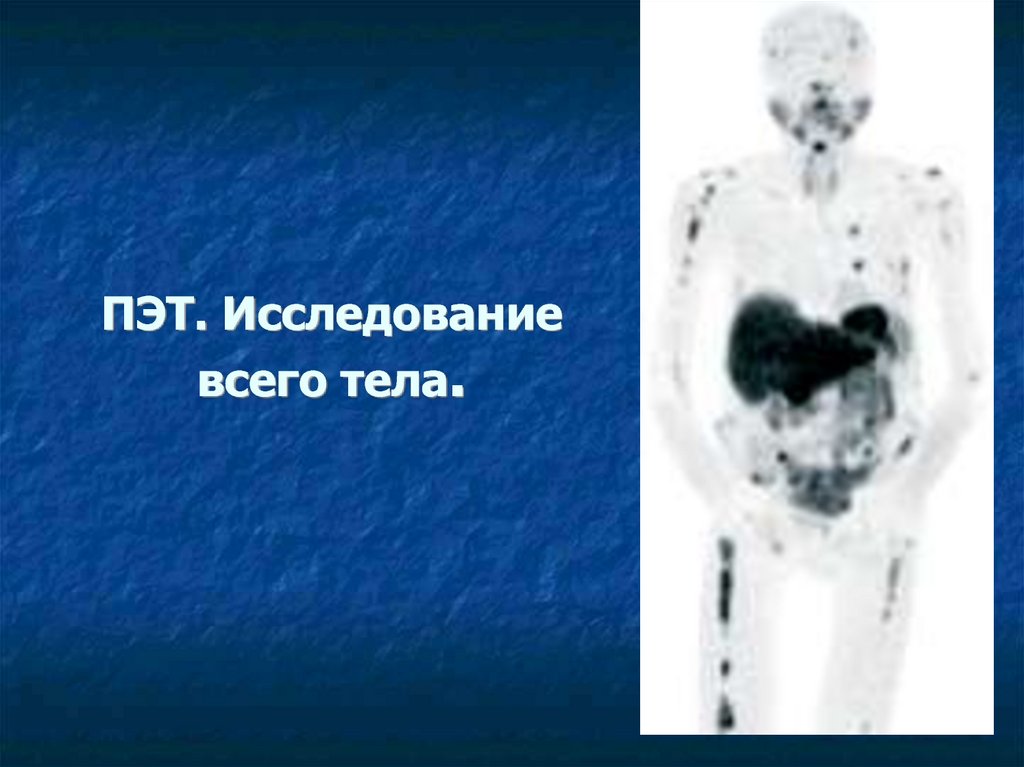
39. ПЭТ. Исследование всего тела.
40.
Показания к лечениюКритерием к началу проведения
системной терапии у пациентов с
множественной миеломой является
признаки прогрессирования
заболевания с появлением
органных поражений
41.
Принципы и цели терапииПринципы лечения
-Подавление роста опухоли
-Улучшение качества жизни
-Увеличение общей выживаемости
Цели терапии
Быстрый контроль заболевания и лечение
осложнений, связанных с заболеванием (анемия,
гиперкальциемия, поражение почек)
Хорошая переносимость с минимальной и
контролируемой токсичностью
Снижение риска ранней смертности
Сохранение возможности для заготовки стволовых
клеток крови, если планируется проведение
аутологичной трансплантации.
42. Лечение ММ
Химиотерапия: используютсяпротоколы: МР, СР, МСР, СVD, VAD;
Сопроводительная терапия.
Трансплантация костного мозга,
43. Иммуномодулирующая терапия ( талидомид, леналидомид).
Механизмы действияподавление адгезии, продукции
цитокинов, ангиогенеза
увеличение пролиферации Т-клеток,
клеточную цитотоксичность,
Побочные эффекты
Тератогенный эффект (Т)
Периферическая нейропатия (Т)
Седация, слабость (Т)
Венозные тромбозы ( Т, Л)
Миелосупрессия (Т,Л ( нейтропения))
44.
Критерии отбора пациентов натрансплантацию
Возраст:
менее 70 лет для аутологичной
трансплантации
Соматический статус: статус по
Карновскому более 70%, фракция выброса
левого желудочка более 40%, клиренс
креатинина более 50мл/мин, ОВФ1 более
40%, удовлетворительная функция печени.
Ответ на индукционную терапию:
оптимальное время для проведения заготовки
стволовых клеток после 4-6 курсов
индукционной терапии. Отсутствие ответа на
индукционную терапию не является
противопоказанием для проведения
45.
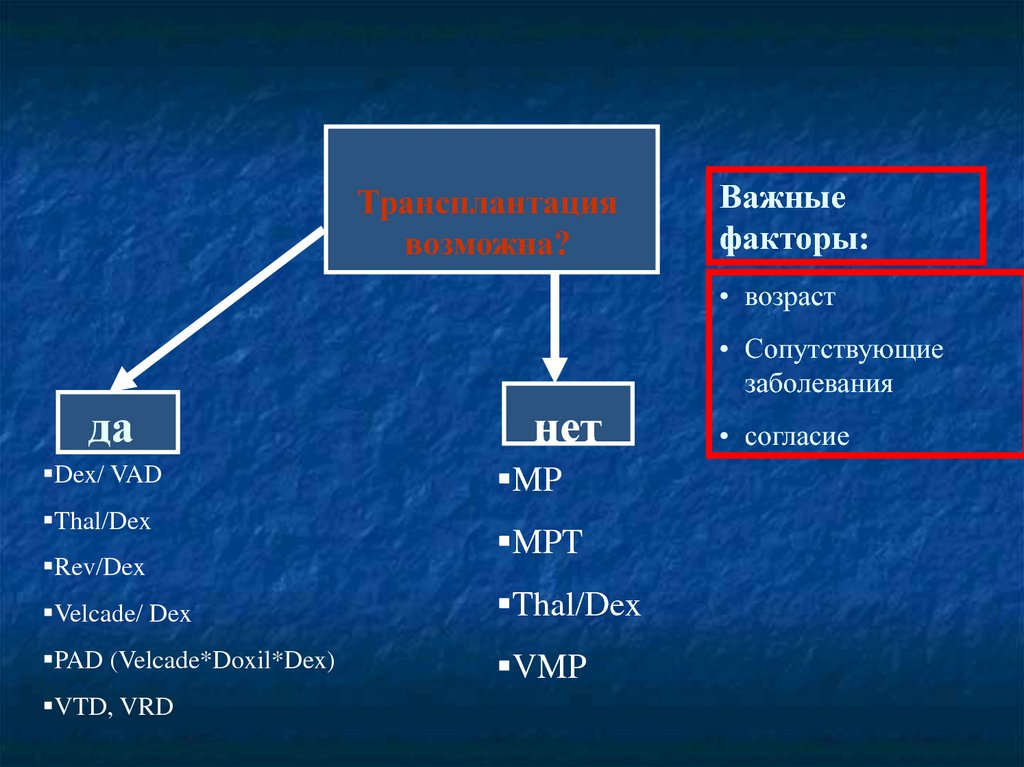
Трансплантациявозможна?
Важные
факторы:
• возраст
• Сопутствующие
заболевания
да
Dex/ VAD
Thal/Dex
Rev/Dex
нет
MP
MPT
Velcade/ Dex
Thal/Dex
PAD (Velcade*Doxil*Dex)
VMP
VTD, VRD
• согласие
46. Лимфогранулематоз
гемобластоз с первичным поражениемлимфоидной ткани, в основе которого
лежит опухолевая пролиферация
лимфоидных клеток с образованием
специфической гранулемы.
Впервые описан как самостоятельное
заболевание в 1832 г., английским
врачом Ходжкиным, с 1965 г.
заболевание называется болезнью
Ходжкина.
-
47.
ЭпидемиологияЗаболеваемость в России - 2,3 на
100000 населения.
Болеют лимфомой Ходжкина люди
любого возраста.
Мужчины заболевают чаще, чем
женщины.
Отмечается два пика заболеваемости в
зависимости от возраста.
-большинство пациентов заболевают на
третьем десятилетии жизни,
-другой небольшой подъем заболеваемости отмечается около 55 лет.
48.
ЭтиологияПричины возникновения болезни в
настоящий момент окончательно не
установлены. Описаны редкие случаи
заболевания лимфомой в одной семье.
Больные, перенесшие инфекционный
мононуклеоз, заболевают ЛГМ в
несколько раз чаще, чем
бессимптомные носители.
49.
Морфология опухолевых клеток при ЛХОпухолевым субстратом ЛХ
являются клетки БерезовскогоШтернберга и их варианты,
расположенные среди реактивного
клеточного компонента,
составляющего до 99% клеточной
популяции, включающей лимфоциты,
гистиоциты, нейтрофильные и
эозинофильные лейкоциты,
плазмоциты, фибробласты.
50. Патогенез
Клетки Березовского-Штернберга и клеткиХоджкина происходят из генетически
измененных В-лимфоцитов зародышевого центра,
утративших способность к апоптозу и синтезу Ig.
Эти генетически измененные клеточные элементы
являются мишенями иммунной атаки со стороны
нормальных Т-лимфоцитов, которые составляют
основную клеточную популяцию пораженных
лимфоузлов и, возможно, сдерживают
опухолевый рост. Истощение пула Т-лимфоцитов
по мере развития лимфогранулематоза
сопровождается ослаблением клеточного
иммунного ответа и прогрессирующим ростом
опухоли
51. Классификация.
Лимфоцитарный с преобладаниемлимфоидной ткани.
Нодулярный (узловатый) склероз;
Смешанно-клеточный;
С подавлением лимфоидной ткани
(лимфоцитарное истощение).
52. Стадии болезни.
I стадия- поражение одной или двухсмежных групп лимфоузлов,
расположенных по одну сторону
диафрагмы, или поражение одного
внелимфатического органа.
II стадия- поражение двух или более
несмежных групп лимфоузлов,
расположенных по одну сторону
диафрагмы ;
53. Стадии (продолжение)
Стадии (продолжение)III стадия- поражение лимфоузлов любых
областей по обе стороны диафрагмы,
сопровождаемое локализованным
поражением одного внелимфатического
органа.
IVстадия- диффузное поражение одного или
более внелимфатических органов (печень,
легкие, костный мозг) с поражением
лимфоузлов или без такового.
54. Клиническая картина.
Триада симптомов-профузные ночныепоты, лихорадка, генерализованный
кожный зуд.
Похудание на 10% и более за 6 мес.
Лимфаденопатия (лимфоузлы плотноэластической консистенции, спаянные
между собой с образованием
конгломератов – «мешок с
картошкой»).
55.
Клиническая классификация (по стадиям)Стадия I - поражение одной
лимфатической зоны или одного
лимфоидного органа (селезенка, тимус,
Вальдейрово кольцо) или одного
нелимфоидного органа
Стадия II - поражение 2 и более
лимфатических зон с одной стороны
диафрагмы (поражение воротных
лимфоузлов с обеих сторон диафрагмы
относят ко II стадии);
56.
Стадия III - поражениелимфатических зон с обеих сторон
диафрагмы (III), которое может
сопровождаться поражением селезенки
(IIIs) или локальным поражением по
протяжению только одного
нелимфоидного органа/ткани или и того
и другого (IIISE);
Стадия IV-диффузное или диссеминированное поражение нелимфоидного
органа (или ткани), с поражением
лимфоузлов или без него
57. Прогностические факторы.
Неблагоприятные:-
-
Наличие крупных более 5 см.
лимфоузлов, образующих
конгломераты;
Массивное поражение селезенки;
Ускоренная СОЭ- более 30 мм\ч;
Повышение фибриногена более 5 г\л;
Повышение гаптоглобина более 1,5
мг\%;
Повышение церуплазмина более 0,4 ед.
Возраст старше 50 лет.
58. Лабораторная диагностика:
Гемограмма- нейтрофильный лейкоцитозсо сдвигом влево;
Лимфоцитопения;
Ускоренная СОЭ;
Миелограмма или трепанат костного
мозга- клетки Березовского- Штернберга.
БАК- увеличение фибриногена,
гипогаммаглобулинемия.
Гистологическое исследование
лимфоузла- выявление клеток
Березовского-Штернберга.
59.
ДиагностикаБиопсия лимфатического узла
Рентгенограмма легких в 2
проекциях
Компьютерная томография
органов шеи, ОГК, ОБП, ОМТ
Сканирование костей и при
показаниях – рентгенография
костей.
ПЭТ
60.
ЛечениеЛимфома Ходжкина – одна из немногих
болезней, смертность от которой была
существенно снижена в последние
десятилетия.
Достижения:
1) Вылечивается 85 – 90% всех больных
со всеми стадиями.
2) Не вылечивается 10 – 15%
3) Лечение приводит к развитию
вторичных опухолей у 5 – 10% больных
61. Лечение:
Химиотерапия.Лучевая терапия.
Хирургический метод.
62.
НаблюдениеФизикальное обследование и лабораторные
анализы выполняются :
-каждые 3 месяца в течение 1 года,
- раз в полгода до 3 лет наблюдения
-далее – ежегодно.
КТ необходима для подтверждения полной
ремиссии, дополнительные КТ не рекомендуются,
за исключением исследований, необходимых для
оценки резидуальной болезни.
После радиотерапии с вовлечением ткани
молочной железы, женщины старше 40 лет
должны проходить стандартный скрининг
(клинический + маммография) для исключения
развития вторичного рака молочной железы















































 medicine
medicine








