Similar presentations:
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
1. ОБ ИЗУЧЕНИИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В ШКОЛЬНОМ КУРСЕ ХИМИИ
ОБ ИЗУЧЕНИИОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫХ
РЕАКЦИЙ В ШКОЛЬНОМ
КУРСЕ ХИМИИ
Махонина
Вера Ивановна,
учитель химии МБОУ СОШ
№66 г.Пензы
Симонова Ольга Юрьевна,
учитель химии МБОУ
гимназии №42 г.Пензы
2.
3. Степени окисления атомов и формулы веществ
Степень окисления атома – условный зарядатома, вычисленный из предположения,
что все связи атома ионные
Пользуясь
значениями
ЭО,
обозначь
стрелкой
направление смещения электронной плотности и
рассчитай степени окисления атомов:
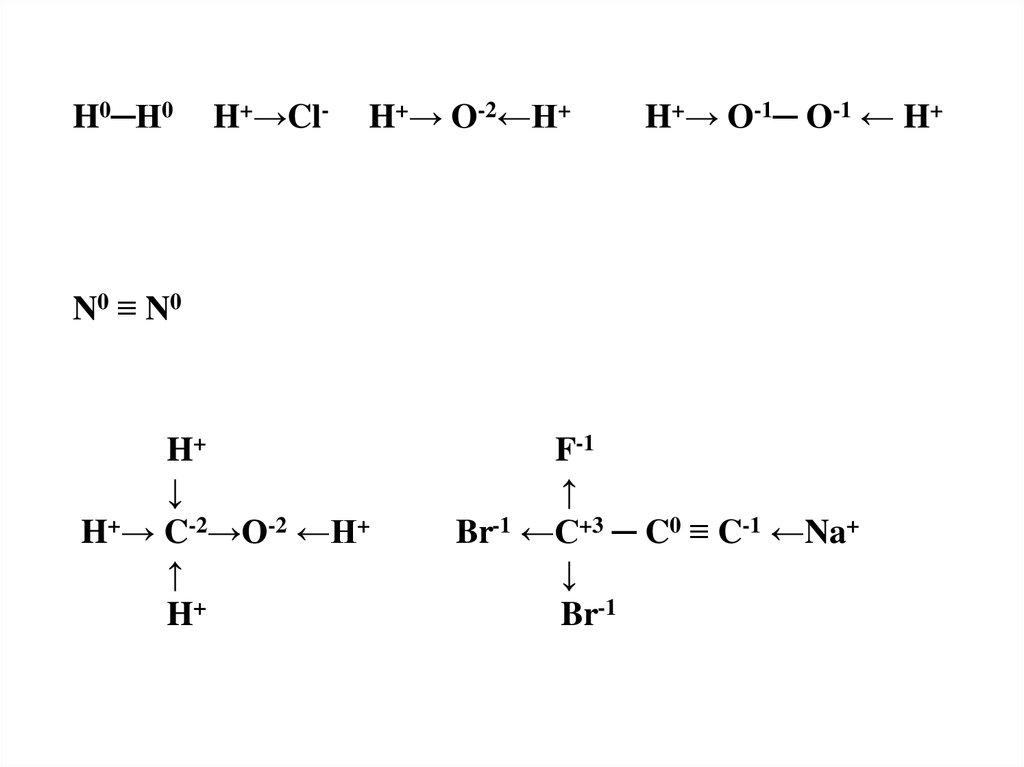
H─H H ─ Cl H ─ O ─ H
H ─ O─ O ─ H
H
F
│
│
H─C─O─H
Br ─ C ─ C ≡ C ─ Na
│
│
H
Br
N≡N
4.
H0─H0H+→Cl-
H+→ O-2←H+
H+→ O-1─ O-1 ← H+
N0 ≡ N0
H+
↓
H+→ C-2→O-2 ←H+
↑
H+
F-1
↑
Br-1 ←C+3 ─ C0 ≡ C-1 ←Na+
↓
Br-1
5. Упражнения:
• Чему равна степень окисления атома,если:
А) две связи с более ЭО атомами и одна – с
менее ЭО атомом?
Б) число связей с менее ЭО атомами на три
больше числа связей с более ЭО атомами?
А)+1
Б) -3
6. Определение степени окисления
• В соединении А у атомов кислорода такая же степеньокисления, как у кальция в бинарном соединении Б.
Запиши формулы А и Б, если сумма их относительных
молекулярных масс равна 110.
• В соединении А у атомов фтора такая же степень
окисления, как у водорода в соединении Б. Приведите
примеры А и Б с минимальными молярными массами.
• Известно, что у кислорода в соединении А такая же
степень окисления, как и у водорода в соединении Б, а
у водорода в соединении А такая же степень
окисления, как у кислорода в соединении В. Запиши
формулы А, Б, В, если в состав одного из них входит
натрий.
OF2 и CaO
HF и LiH
H2O2 NaH O2F2
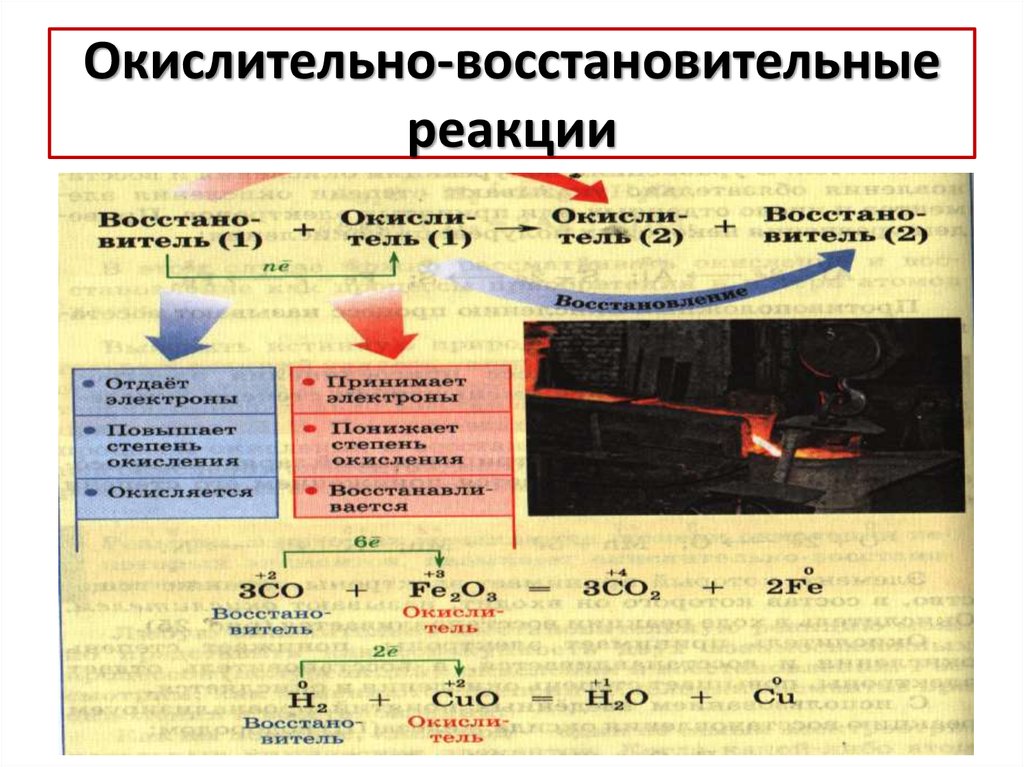
7. Окислительно-восстановительные реакции
8.
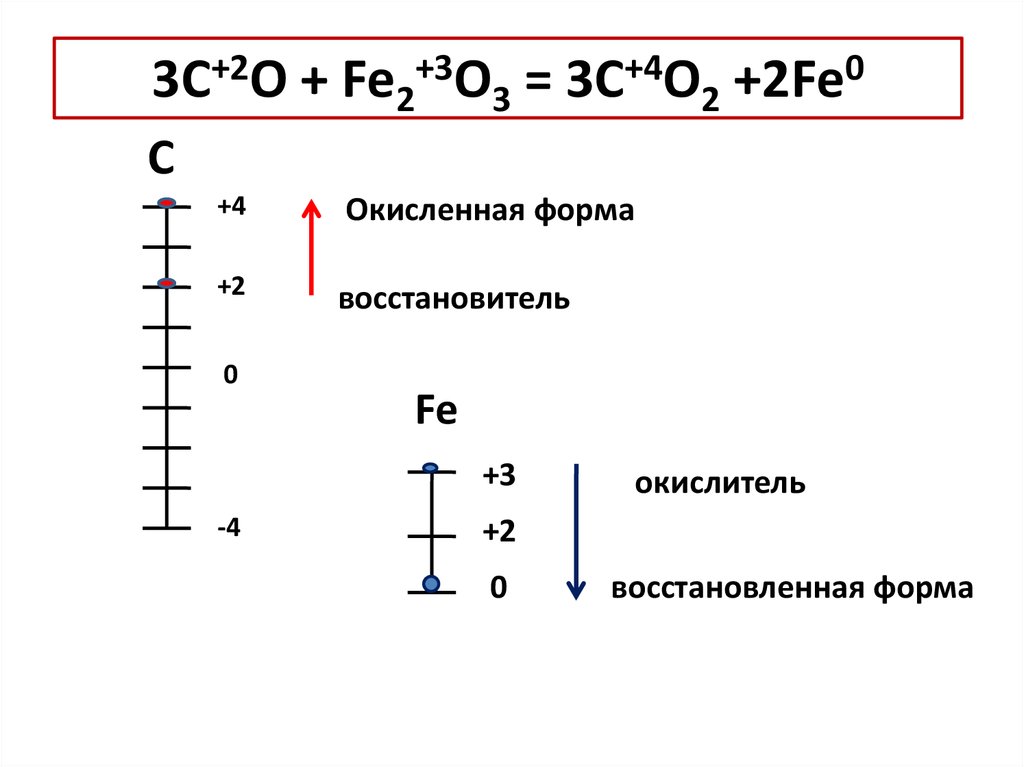
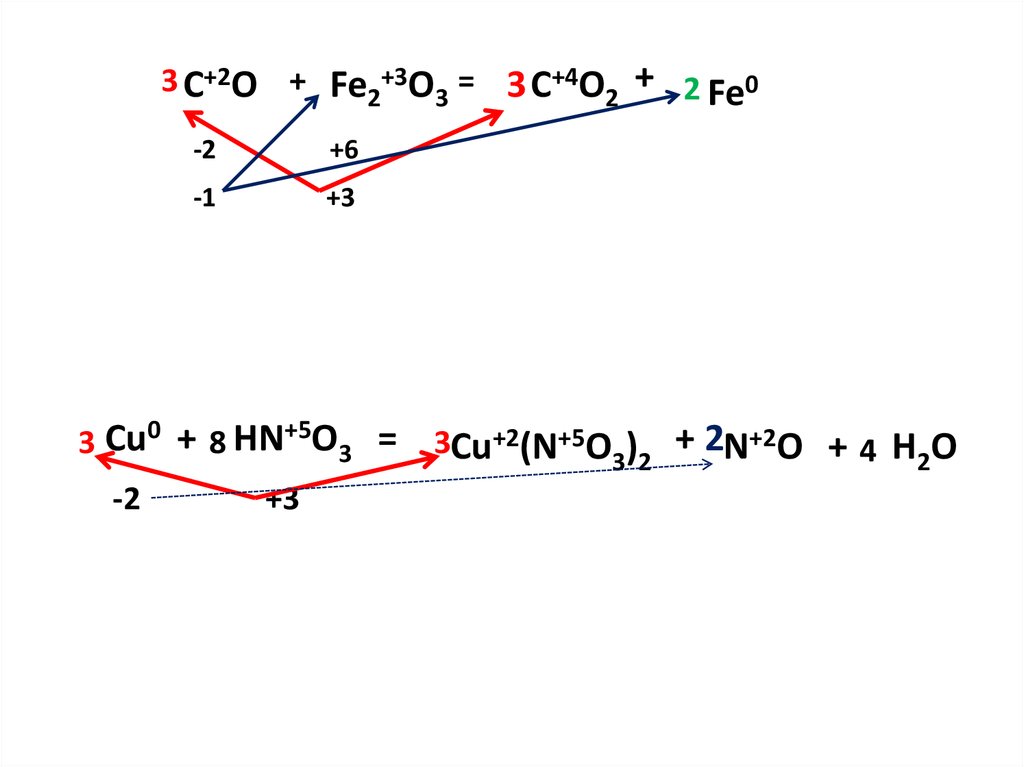
3C+2O + Fe2+3O3 = 3C+4O2 +2Fe0С
+4
Окисленная форма
+2
восстановитель
0
Fe
+3
-4
окислитель
+2
0
восстановленная форма
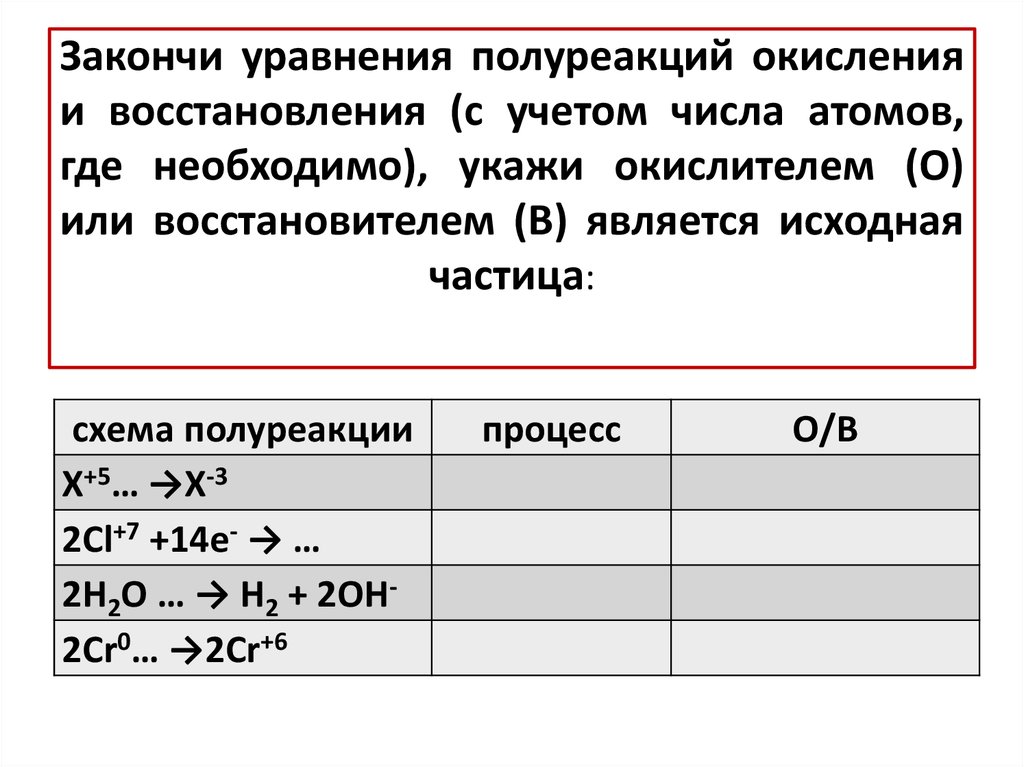
9. Закончи уравнения полуреакций окисления и восстановления (с учетом числа атомов, где необходимо), укажи окислителем (О) или
восстановителем (В) является исходнаячастица:
схема полуреакции
X+5… →X-3
2Cl+7 +14e- → …
2H2O … → H2 + 2OH2Cr0… →2Cr+6
процесс
О/В
10.
• определение степеней окисления элементов,• записывание под формулами основных
участников ОВР (веществ, в составе которых
имеются элементы, изменившие степени
окисления) числа отданных и принятых
электронов (сократив до минимальных целых
чисел),
• расстановка предварительных коэффициентов,
уравнивая число атомов окислителя и
восстановителя,
• расстановка коэффициентов с помощью стрелок
крест-накрест перед окислителем и
восстановителем, а также перед их
восстановленной и окисленной формами
соответственно.
11.
3 C+2O + Fe2+3O3 = 3 C+4O2 + 2 Fe0-2
+6
-1
+3
3 Cu0 + 8 HN+5O3 =
-2
+3
3Cu+2(N+5O3)2 + 2N+2O + 4 H2O
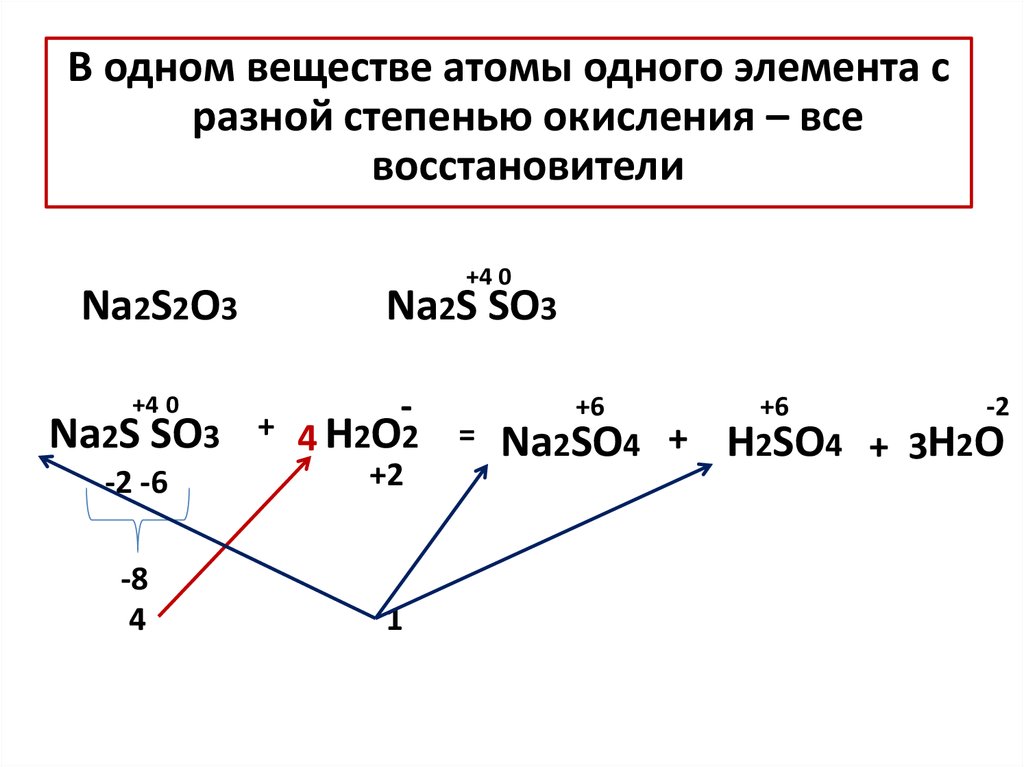
12.
В одном веществе атомы одного элемента сразной степенью окисления – все
восстановители
Na2S2O3
+4 0
Na2S SO3
-2 -6
-8
4
+4 0
Na2S SO3
-
+ 4 H2O2
+2
1
=
+6
+6
-2
Na2SO4 + H2SO4 + 3H2O
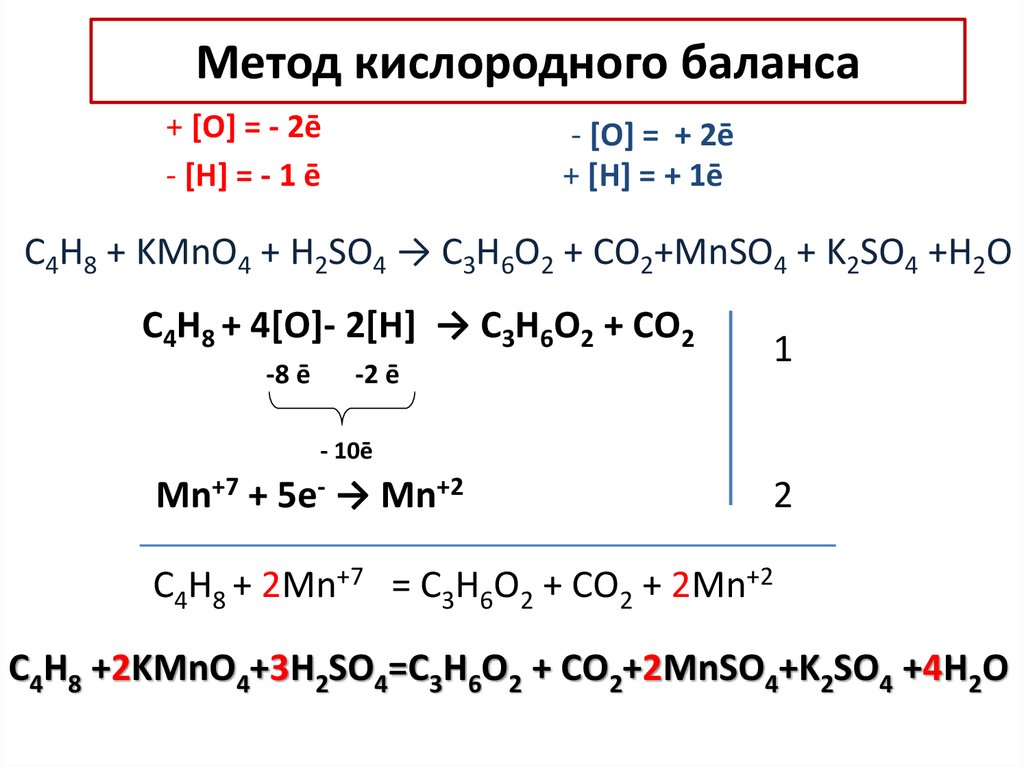
13. Метод кислородного баланса
+ [O] = - 2ē- [Н] = - 1 ē
- [O] = + 2ē
+ [Н] = + 1ē
C4H8 + KMnO4 + H2SO4 → C3H6O2 + СO2+MnSO4 + K2SO4 +H2O
C4H8 + 4[O]- 2[H] → C3H6O2 + СO2
-8 ē
Mn+7 +
-2 ē
- 10ē
5e- →
Mn+2
1
2
C4H8 + 2Mn+7 = C3H6O2 + СO2 + 2Mn+2
C4H8 +2KMnO4+3H2SO4=C3H6O2 + СO2+2MnSO4+K2SO4 +4H2O
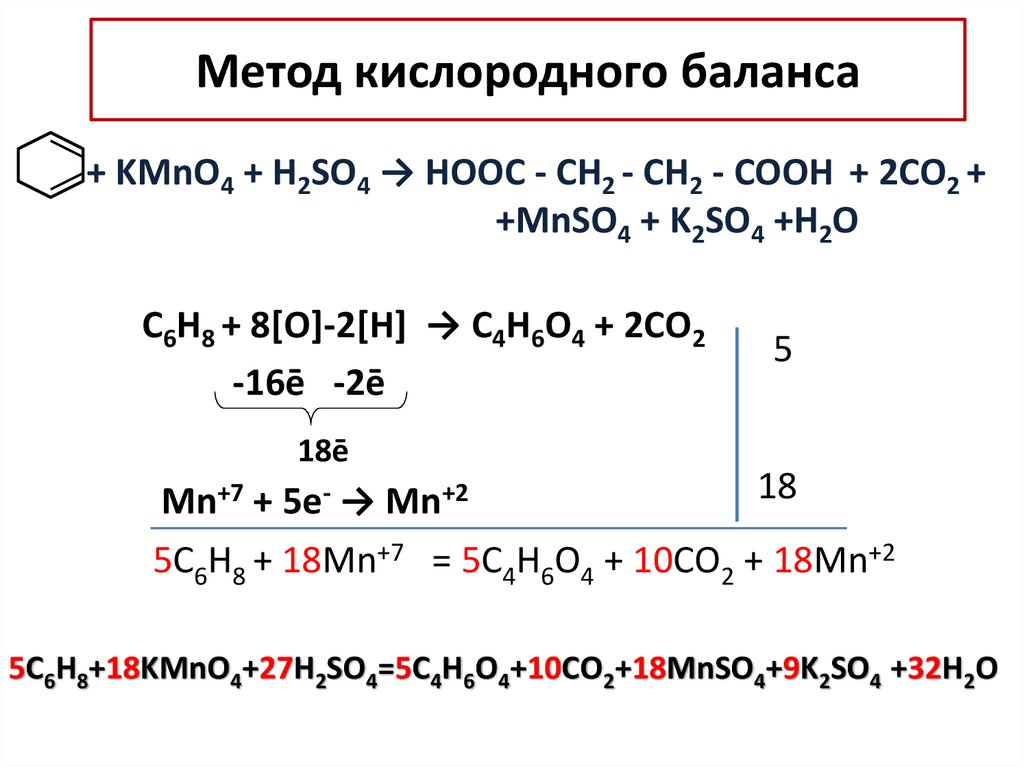
14. Метод кислородного баланса
+ KMnO4 + H2SO4 → НООC - СН2 - СН2 - СООН + 2СO2 ++MnSO4 + K2SO4 +H2O
C6H8 + 8[O]-2[H] → C4H6O4 + 2СO2
-16ē -2ē
5
18ē
18
Mn+7 + 5e- → Mn+2
5C6H8 + 18Mn+7 = 5C4H6O4 + 10СO2 + 18Mn+2
5C6H8+18KMnO4+27H2SO4=5C4H6O4+10СO2+18MnSO4+9K2SO4 +32H2O





 chemistry
chemistry








