Similar presentations:
Озон. Доля в расходовании озона различных химических семейств на разных высотах
1.
В ионосфере на высотах 90-200 км основными первичными ионами являютсяионы N2+, O2+, O+, образующиеся в результате поглощения нейтральными
частицами N2, O2, и O наиболее коротковолнового излучения (80-135 нм) с
последующей ионизацией.
Заряженные частицы в ионосфере
диссоциативной рекомбинации:
N2+ + ē → N + N
O2+ + ē → O + O
NO+ + ē → N + O
исчезают
в
результате
реакций
Основной вклад в процессы на высоте менее 90 км вносят отрицательные ионы и
гидрат-ионы H+(H2O)n, n = 1, 2, 3.
2.
Рис. 4. Изменение содержания озона в атмосферном воздухе в зависимости отвысоты над поверхностью Земли
3.
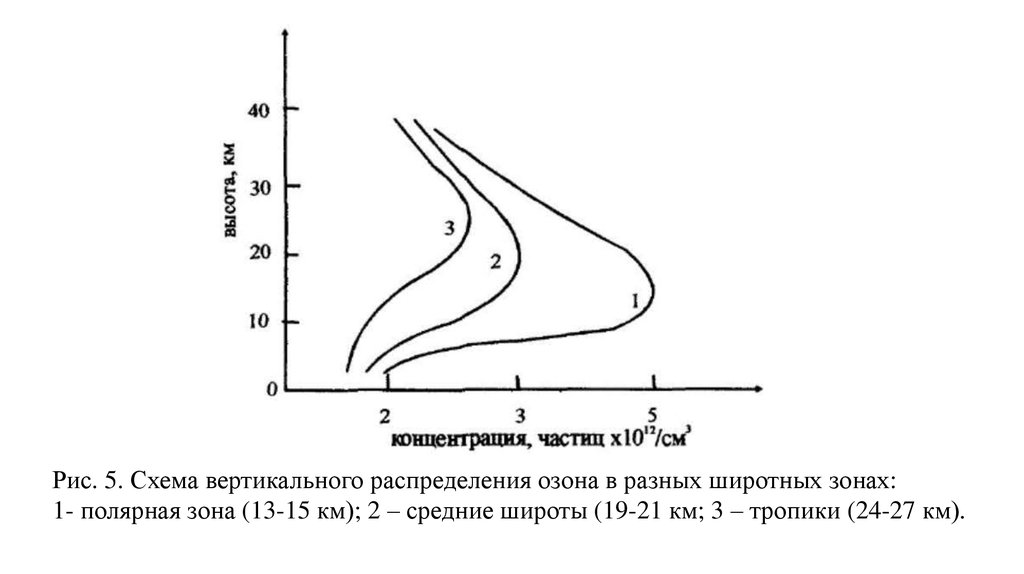
Рис. 5. Схема вертикального распределения озона в разных широтных зонах:1- полярная зона (13-15 км); 2 – средние широты (19-21 км; 3 – тропики (24-27 км).
4.
В стратосфере, на высотах менее 50 км, происходит образование озона пореакции:
2 + O(3P) → O3*
O3*+ M → O3 + M* + 107 кДж
Наряду с процессом образования озона в атмосфере происходит его
расходование в реакции взаимодействия с атомарным кислородом:
O3 + O → 2O2 + 391кДж
и в результате фотохимического разложения:
O3 + hν → O2 + O (λ = 310 нм)
Реакции
O2 + O(3P) + M → O3 + M*
O3 + hν → O2 + O(3P)
называют нулевым циклом озона.
5.
Основной вклад в его образование гидроксильного радикала дают реакции сучастием тропосферного озона, образующегося в результате фотохимических
реакций с участием оксидов азота:
NO2 +hν → NO + O (λ< 400 нм)
O + O2 + M → O3 + M
О3 + hν → О2 + О, (λ =310 нм)
О + Н2О → ОН + ОН
6.
Впервые цепочку образования и распада озона предложил Сидни Чепмен(1930).
Сначала под воздействием солнечной радиации происходит
фотодиссоциация кислорода:
О2 + hν → 2О
Затем молекулярный кислород взаимодействует с атомарным кислородом с
образованием озона:
О2 + O → О3
Далее при взаимодействии с ультрафиолетовым излучением Солнца
происходит фотолиз молекул озона с образованием молекул и атомов
кислорода:
О3+ hν → О2+ О
7.
Реакции азотного цикла с участием оксида азота (II):NO + O3 → NO2 + O2
O + NO2 → NO + O2
O3 + O → 2O2
Оксид NO в стратосфере образуется из оксида азота (I) по реакциям
N2O + hν → N2 + O (λ = 230 нм) N2O + O → 2NO
Водородный цикл – реакции разложения озона с участием гидроксильных
радикалов, которые образуются при фотохимическом разложении молекул
воды под действием излучения с длиной волны менее 240 нм:
H2O + hν → OH + H, а также при взаимодействии молекул воды и метана с
возбужденным атомом кислорода:
O(1D) + H2O → 2OH
O(1D) + CH4 → CH3 + OH
Реакции водородного цикла:
OH + O3 → HO2 + O2
HO2 + O → OH + O2
O3 + O → 2O2
8.
CFCl3 + hν → CFCl2 + ClЭто дает толчок к хлорному (бромному) каталитическому циклу. Таким образом, в
реакциях хлорного цикла
Cl + O3 → ClO + O2
O + ClO → Cl + O2
O3 + O → 2O2
и бромного цикла
Br + O3 → BrO + O2
2
BrO + BrO → 2Br + O2
O3 + O → 2O2
2
Взаимодействие хлора и метана приводит к образованию хлороводорода:
Cl + CH4 → HCl + CH3
Гидроксил может реагировать с диоксидом азота:
OH• + NO2 + M → HNO3 + M
9.
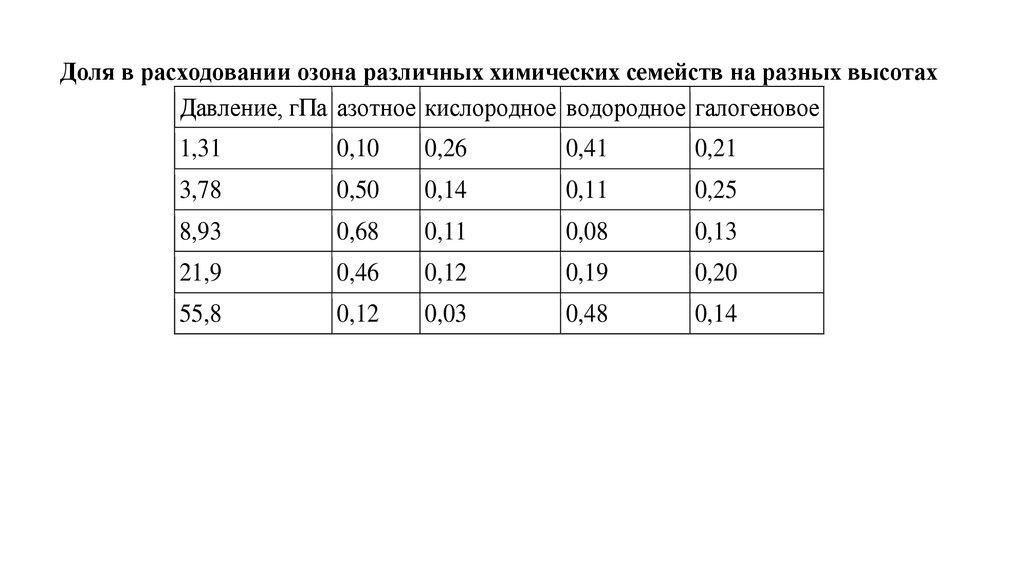
Доля в расходовании озона различных химических семейств на разных высотахДавление, гПа азотное кислородное водородное галогеновое
1,31
0,10
0,26
0,41
0,21
3,78
0,50
0,14
0,11
0,25
8,93
0,68
0,11
0,08
0,13
21,9
0,46
0,12
0,19
0,20
55,8
0,12
0,03
0,48
0,14
10.
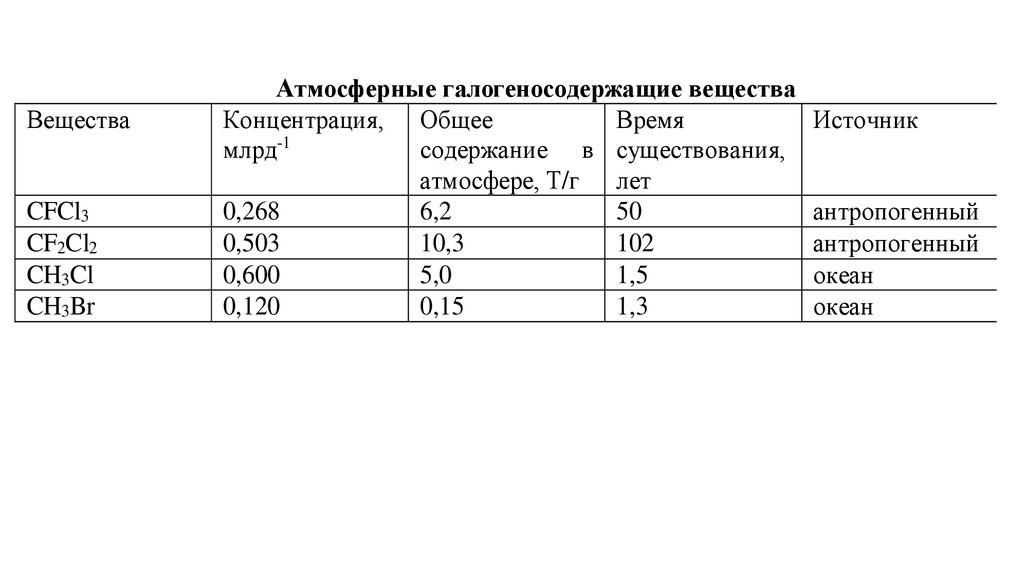
ВеществаCFCl3
CF2Cl2
CH3Cl
CH3Br
Атмосферные галогеносодержащие вещества
Концентрация, Общее
Время
млрд-1
содержание в существования,
атмосфере, Т/г лет
0,268
6,2
50
0,503
10,3
102
0,600
5,0
1,5
0,120
0,15
1,3
Источник
антропогенный
антропогенный
океан
океан
11.
В загрязненной оксидами азота атмосфере метан вступает в сложнуюцепочку превращений с участием кислорода и паров воды:
CH4 + 4O2 → HCHO + H2O + 2O3.
Основными положениями Монреальского протокола были определены
следующие действия, которые обязались предпринять подписавшие его
страны:
1) производство фреонов 11, 12, 113, 114, 115 заморозить на уровне 1986 г. и,
начиная с 1992 г., начать сокращение его производства;
2) производство галлонов (бромированных галогеналканов для тушения
пожаров) ограничить на уровне 1986 г
12.
В 1990 г. Монреальский протокол был вновь пересмотрен. Страны, егоподписавшие, взяли на себя следующие обязательства:
1) производство фреонов:
- сократить до 50 %, начиная с 1995 г.;
- сократить до 15 %, начиная с 1997 г.; - прекратить полностью к 2000 г.;
2)
производство
тетрахлорметана
(четыреххлористого
углерода,
используемого в качестве растворителя):
- сократить до 15 %, начиная с 1995 г.;
- прекратить полностью к 2000 г.;
3)
производство
1,1,1-трихлорэтана
(используемого
в
качестве
растворителя):
- сократить до 70 %, начиная с 1995 г.;
- сократить до 30 %, начиная с 1997 г.;
- прекратить полностью к 2005 г.
13.
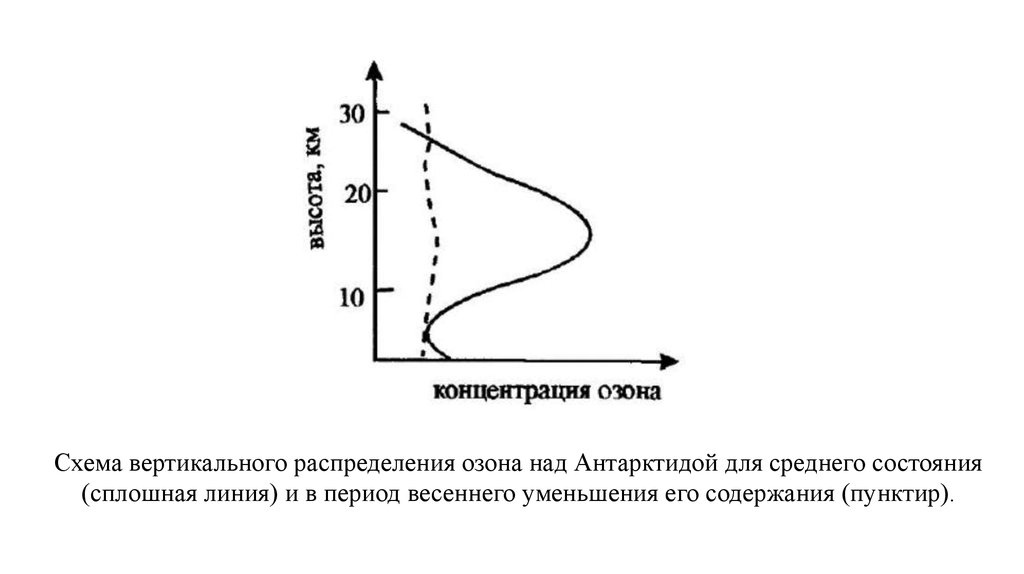
Схема вертикального распределения озона над Антарктидой для среднего состояния(сплошная линия) и в период весеннего уменьшения его содержания (пунктир).
14.
Причина образования озоновой дыры над Антарктидой комплексная:увеличение
поступления
хлорфторуглеводородов
в
атмосферу
(антропогенный фактор).
специфика движения воздушных масс в стратосфере высоких широт
(полярный вихрь).
Последствия полярного вихря:
прекращение обмена воздухом с другими областями стратосферы;
сток озона в тропосферу;
снижение температуры воздуха внутри вихря до –70…–80 °С;
появление устойчивых аэрозольных образований - серебристых облаков,
состоящих из аэрозолей - кристаллов льда и капель переохлажденной
жидкости.
15.
Образование хлористого нитразила:ClO + NO2 → ClONO2
Гетерогенные химические процессы на поверхности кристаллов льда:
ClONO2 + Н2О = НОСl + НNO3 или ClONO2 + НCl = Сl2 + НNO3
Распад продуктов реакций под воздействием видимого излучения:
НОСl + hν = Cl + OH; Сl2 + hν = 2Cl.
Особую роль в разрушении озона над Антарктидой играют димеры оксида хлора.
Эти соединения неустойчивы и при воздействии излучения разлагаются:
(ClO)2 + hν = Сl + ClOO; ClOO = Сl + O2.
Суммируя все уравнения реакций димерного цикла, получим
2O3 + hν = 3O2.











 ecology
ecology








