Similar presentations:
Применение ЛС в особых группах пациентов (дети, пожилые люди, беременные женщины)
1.
ПРИМЕНЕНИЕ ЛС В ОСОБЫХГРУППАХ ПАЦИЕНТОВ
(ДЕТИ, ПОЖИЛЫЕ ЛЮДИ,
БЕРЕМЕННЫЕ ЖЕНЩИНЫ)
2.
Особенности приёма ЛС у беременныхНе менее 3% всех врождённых пороков развития связано с
приёмом ЛС. Это связано с тем, что тератогенные эффекты ЛС у
человека трудно предсказать на основании доклинических
исследований на животных (например, не было выявлено
тератогенности талидомида). В настоящее время около 60-80%
беременных принимают ЛС (противорвотные, анальгетики,
снотворные, седативные средства, диуретики, антибиотики,
антациды, антигистаминные, отхаркивающие и др.). В ряде
случаев имеет место полипрагмазия (в среднем беременная
принимает четыре ЛС, не считая поливитаминов и препаратов
железа). Кроме того, выявление побочных эффектов ЛС
затруднено наличием других возможных причин аномалий
развития плода (вирусные инфекции, профессиональные
вредности, алкоголизм и др.).
3.
На основании данных клинических и экспериментальныхисследований ЛС по степени риска для плода подразделяют на
категории от А (нет доказательств риска) до D (риск доказан),
выделяют также категорию Х (абсолютно противопоказанные
беременным).
4.
ЛС категории Х5.
ЛС категории D6.
ЛС категории D (продолжение)7.
ЛС категории D (окончание)8.
Во внутриутробном развитии выделяют критические периоды:• Начальный период внутриутробного развития – с момента
оплодотворения до имплантации бластоцисты (конец 1 – начало 2
нед). Максимальный риск эмбриотоксического действия ЛС,
проявляющегося чаще всего в гибели зародыша.
• Период эмбриогенеза (с 16 дня после оплодотворения и до конца 8
нед). Период закладки органов эмбриона. Неблагоприятное действие
ЛС проявляется тератогенностью и эмбриотоксичностью, при этом
возможно возникновение врождённых пороков развития, гибель
эмбриона, самопроизвольный выкидыш, преждевременные роды.
Критические периоды поражения разных органов отличаются из-за
временных различий в дифференцировке тканей.
• Период фетогенеза (с 9 недели до родов): специфические эффекты
нельзя полностью исключить ЛС, поскольку развитие глаз, ушей,
зубов, ЦНС занимает по времени значительную часть фетального
периода. Воздействие ЛС или других веществ во время фетального
периода может оказывать отдалённое влияние на поведенческие
реакции и психическое развитие ребёнка.
9.
Особенности фармакокинетики ЛС у беременныхОсобенности всасывания. Во время беременности снижены
сократительная и секреторная функции желудка, что приводит к
замедлению всасывания ЛС, плохо растворимых в воде. В то же время
всасываемость хорошо растворимых в воде ЛС может быть повышена.
Особенности распределения.
• Увеличение объёма внеклеточной жидкости, циркулирующей крови,
почечного кровотока и клубочковой фильтрации у беременной, а также
поступление ЛС в организм плода и амниотическую жидкость приводят
к снижению концентрации некоторых ЛС в плазме крови беременных
(по сравнению с небеременными).
• Во время беременности и в ранний послеродовой период (с 15 недели
беременности до 2 недели после родов) отмечено уменьшение
связывания ЛС с альбумином ввиду снижения его количества (на 1530%) и конкуренции за связывание с ненасыщенными жирными
кислотами, концентрация которых во время беременности значительно
возрастает. В результате концентрация свободной фракции ЛС
значительно повышается (например, диазепама – более чем в 3 раза).
10.
Особенности метаболизма. Во время беременности отмечаютразнонаправленное изменение активности многих печёночных
ферментов, участвующих в метаболизме ЛС, причём для ряда
ферментов эта активность варьирует в зависимости от сроков
беременности (например, активность изофермента цитохрома
Р-450 3А4 повышена в течение всего срока беременности).
Снижение же активности изофермента цитохрома Р-450 1А2
приводит к прогрессивному увеличению периода
полувыведения кофеина (в I триместре беременности он равен
5,3 ч, во II – 12 ч и в III – 18 ч).
Особенности выведения. В результате значительного
увеличения скорости клубочковой фильтрации у беременных (на
≥70%) и снижения степени связывания ЛС с белками плазмы
крови элиминация ЛС возрастает.
11.
Транспорт лекарственных средств в плацентеСкорость переноса через плаценту зависит главным образом от
концентрации неионизированной формы ЛС при данном
значении pH крови, жирорастворимости и от размера молекул.
Жирорастворимые вещества в неионизированной форме легко
диффундируют через плаценту в кровь плода (феназон,
тиопентал). ЛС с молекулярной массой более 500 Дальтон часто
не полностью проходят через плаценту (например, различные
гепарины). Различие между pH плода и матери влияет на
соотношение концентраций плод/мать для свободной фракции
ЛС. В обычных условиях pH плода практически не отличается от
материнского pH. Во время родов pH плода может значительно
снижаться, в результате чего уменьшается элиминация основных
ЛС от плода к матери (например, концентрация лидокаина у
плода выше, чем в материнской крови, что может вызывать
нежелательные эффекты у плода или новорождённого).
12.
Особенности фармакокинетики лекарственных средств у плодаОсобенности всасывания. Обмен ксенобиотиками между матерью и
плодом происходит через плаценту. Кроме того, ЛС абсорбируются
через кожу плода или через пищеварительный тракт из проглоченной
амниотической жидкости (в конце беременности – 5-7 мл/ч).
Конъюгаты, экскретируемые почками плода, могут реабсорбироваться,
что приводит к рециркуляции ЛС и удлинению их действия на плод.
Особенности распределения. В крови плода содержание белков
меньше, чем в крови беременной/новорождённого. Кроме того,
отмечается снижение белковосвязывающей способности плазмы крови
беременной. Это ведёт к увеличению содержания свободной фракции
ЛС и повышает риск их воздействия на плод. После прохождения через
плаценту ЛС попадают в пупочную вену, 60-80% крови из которой
проходит в печень через воротную вену, а около 20-40% попадает через
шунт (венозный проток) в нижнюю полую вену, минуя печень. ГЭБ у
плода развит не полностью, поэтому концентрация ЛС в СМЖ и в
головном мозгу может быть такой же, как и в плазме крови.
13.
Особенности метаболизма.Метаболизм ЛС у плода медленнее, чем у взрослых.
Активность ферментов, участвующих в микросомальном окислении
ЛС, обнаруживают уже в конце I триместра, однако они более
активны в отношении эндогенных веществ. В процессе метаболизма
некоторые ЛС окисляются до эпоксидов, обусловливающих
тератогенное действие. Разные изоферменты цитохрома Р-450
приобретают функциональную активность в различные сроки
внутриутробного развития плода, что служит причиной
неодинаковой окислительной способности в отношении различных
ЛС, относимых иногда к одной группе веществ. Например,
теофиллин подвергается метаболическим превращениям раньше и
быстрее кофеина. Обнаружена уникальная способность тканей
печени плода метилировать теофиллин, превращая его в кофеин.
Другие ферменты и ферментативные процессы у плода отстают в
функциональной активности. Биотрансформация ЛС путём
связывания с глюкуроновой кислотой ограничена, её дефицит
частично компенсирует сульфатирование.
14.
Особенности выведения. Низкая степень функциональнойзрелости почек в фетальном периоде приводит к их отличиям от
функции почек взрослых людей в отношении экскреции
большинства ЛС. Вследствие значительно сниженного кровотока у
плода скорость фильтрации и активная канальцевая секреция
невелики. ЛС, попадающие в амниотическую жидкость, могут
попасть в ЖКТ плода и реабсорбироваться в кишечнике. Главный
экскреторный орган для большинства ЛС – плацента.
Особенности фармакодинамики лекарственных средств у плода
Вопрос о чувствительности рецепторов организма плода к ЛС
изучен недостаточно. Существует мнение, что уже на самых ранних
стадиях развития плода появляются рецепторы, чувствительные к
действию ЛС. Созревание рецепторов в органах плода происходит
на разных сроках внутриутробного развития. Например, на сроке
гестации 12-24 нед функционируют β-адренорецепторы, а αадренорецепторы ещё неактивны.
15.
Антимикробные препараты. Средняя частота назначенияантимикробных препаратов у беременных составляет 12,3%.
Большинство антимикробных препаратов имеют низкую
молекулярную массу и легко проникают через плаценту,
создавая терапевтические концентрации в крови плода,
сопоставимые с концентрациями препарата в крови матери.
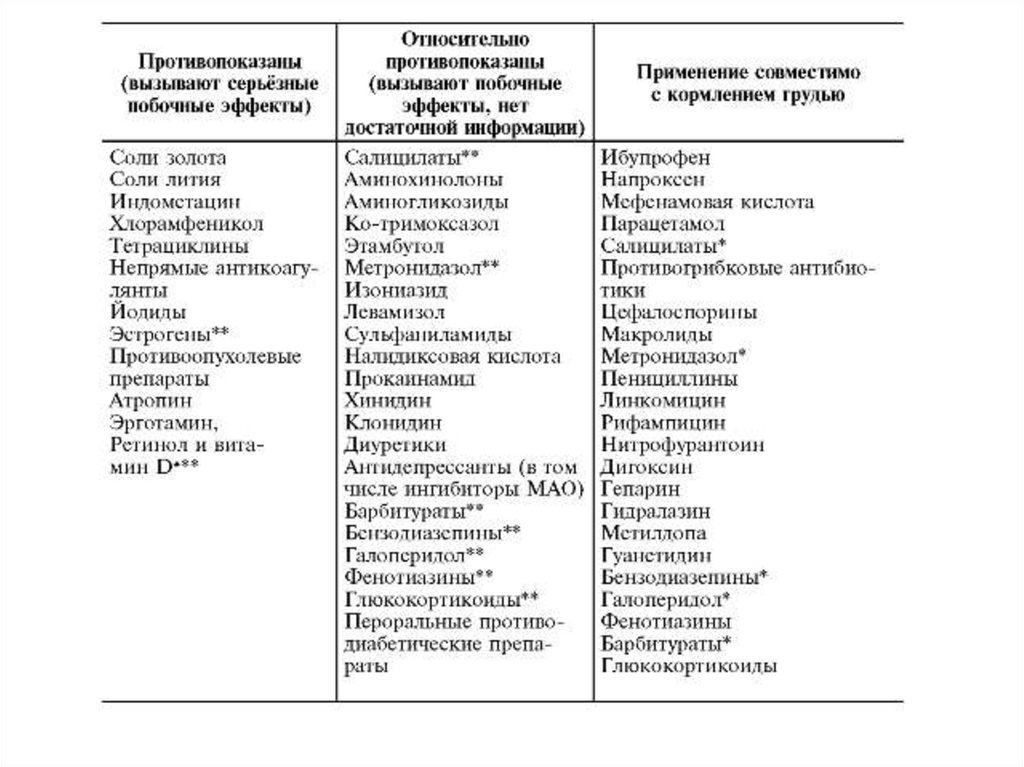
Классификация антимикробных препаратов
по категориям безопасности применения у беременных
16.
Пенициллины (особенно полусинтетические) и цефалоспориныпроникают через плаценту, создавая в тканях плода
терапевтическую концентрацию (токсического действия на плод
обычно не оказывают).
Макролиды (эритромицин, рокситромицин, азитромицин)
плохо проникают через плаценту и создают низкие
концентрации в системе кровообращения плода. В отношении
изученных макролидов не выявлено повышения частоты
встречаемости аномалий развития плода при их использовании
у беременных.
Аминогликозиды быстро проходят через плаценту (их
концентрация в крови плода ≈50% содержания в крови
беременной) и могут оказывать нейротоксическое (в том числе
ототоксическое) действие, вызывать различные нарушения в
строении костного скелета.
17.
В последнем триместре беременности не следует назначатьсульфаниламиды (особенно длительного действия), так как они
интенсивно связываются с белками плазмы, вытесняют билирубин и
могут вызвать желтуху новорождённых. Ко-тримоксазол может
нарушить обмен фолиевой кислоты как у матери, так и у ребёнка.
Метронидазол и триметоприм не применяют в I триместре
беременности из-за высокого риска эмбриотоксического действия.
Противовоспалительные средства при необходимости рекомендуют
применять в малых дозах и кратковременно. При использовании НПВС
на поздних сроках беременности вследствие угнетения синтеза
простагландинов и ослабления родовой деятельности возможны
осложнения в виде переношенной беременности, кровотечений у
плода и беременной, преждевременного закрытия боталлова протока
с формированием лёгочной гипертензии. Последнее чаще вызывают
сильные НПВС, например индометацин и диклофенак.
18.
19.
Противорвотные ЛС. Симптомы раннего гестоза обнаруживают у 80%беременных в виде тошноты и рвоты в утренние часы. Эти симптомы
возникают на 4-й нед беременности и исчезают (чаще всего
самопроизвольно) на 12-14-й нед. Около 20% беременных
продолжают испытывать тошноту и рвоту на всём протяжении
беременности. Обычно необходимости в лекарственной терапии этого
состояния не возникает. Метоклопрамид (10 мг в/м или 5 мг в/в
каждые 6 ч) назначают преимущественно при неукротимой рвоте и,
как правило, лишь на поздних сроках беременности.
Нейролептики и транквилизаторы. Нейролептики фенотиазинового
ряда (например, аминазин) проникают через плацентарный барьер
(концентрация их в крови плода составляет около 50% содержания в
крови матери), тератогенного действия не оказывают, однако могут
оказать гепатотоксическое действие, вызвать ретинопатию.
Транквилизаторы бензодиазепинового ряда (например, диазепам)
беременным можно назначать по показаниям в умеренных дозах,
однако на последних неделях беременности их не применяют (могут
вызвать угнетение дыхания у новорождённого).
20.
Антигипертензивные ЛС. Пропранолол у беременной может повыситьтонус матки, снизить сердечный выброс, вызвать гипотрофию
плаценты, а у плода обусловить брадикардию, гипоксию,
гипогликемию, гипербилирубинемию, снизить компенсаторную
тахикардию в ответ на гипоксию. Введение парентерально магния
сульфата беременной перед родами может привести к появлению у
новорождённого снижения тонуса скелетных мышц и выраженной
заторможенности. Тиазидные диуретики способны вызвать
тромбоцитопению, нарушения электролитного баланса.
Гормональные препараты. Нельзя применять эстрогены и прогестины в
первые 4 мес беременности из-за риска нарушения развития сердца и
конечностей и возможности возникновения псевдогермафродитизма у
плодов мужского пола. Тератогенное действие гормональных
противозачаточных средств описано как синдром VАСТЕRL
(вертебральные, анальные, кардиальные, трахеальные, эзофагальные, ренальные
аномалии и аномальное строение конечностей). Тератогенное действие
глюкокортикоидов проявляется развитием катаракты, гипоплазии
надпочечников, однако риск их побочного действия для плода
несравнимо меньше пользы для беременной при тяжёлых СБСТ или БА.
21.
Препараты для наркоза, наркотические анальгетики, снотворные.Эфир диэтиловый, галотан, азота закись, проникая через плаценту,
могут вызвать угнетение дыхательного центра у плода, в связи с чем
их не рекомендуют использовать для обезболивания родов и
кесарева сечения. Опиоиды, барбитураты, бензодиазепины быстро
проходят через плацентарный барьер, угнетают дыхательный центр
плода (концентрация их в ЦНС плода выше, чем у беременных).
Антикоагулянты. Гепарин не проникает через плаценту и
рекомендован для применения у беременной при необходимости.
Непрямые антикоагулянты проникают через плаценту в
неизменённом виде и могут вызвать кровоизлияние у плода даже
при отсутствии проявлений геморрагического синдрома у
беременной. В I триместре беременности непрямые
антикоагулянты могут оказать эмбриотоксическое и тератогенное
действие (гипоплазия носа, укорочение рук, короткопалость,
атрофия глаз, катаракта, аномалии развития костей).
22.
Витамины и препараты растительного происхождения. Избытоквитамина С может привести к прерыванию беременности.
Лекарственные растения. Не рекомендуют применять беременным в
связи с содержанием алкалоидов пирролизидина, обладающих
тератогенным действием, барбарис, дымянку аптечную,
можжевельник обыкновенный, ламинарию морскую, полынь
обыкновенную, мяту болотную.
Противоэпилептические ЛС. Применение противоэпилептических ЛС
во время беременности увеличивает частоту развития врождённых
аномалий у плода в 2-3 раза (аномалии ЦНС, сердца и половых
органов, задержка внутриутробного развития, различные нарушения
строения лицевого черепа – короткий, седловидный нос).
Противоэпилептическую терапию во время беременности следует
проводить одним препаратом, в минимально эффективных дозах, при
постоянном контроле развития плода. Рекомендуют профилактический
приём фолиевой кислоты (профилактика дефектов нервной трубки
плода) и витамина К в течение месяца перед родами (профилактика
геморрагического синдрома новорождённого).
23.
Гипогликемические препараты.При беременности разрешён приём инсулина.
Производные сульфонилмочевины безопаснее бигуанидов. Их
приём, однако, должен быть прекращен за 4 дня до
предполагаемых родов во избежание развития у
новорождённого гипогликемии. Пероральные
гипогликемические ЛС у беременных применяют, если они были
эффективны до беременности, если гипергликемия развилась
при сахарном диабете, контролируемом ранее соблюдением
диеты, а также если гипергликемия впервые выявлена во время
беременности и не контролируется соблюдением диеты.
24.
Принципы фармакотерапии беременных• Ни одно ЛС не следует считать абсолютно безопасным для
плода, т.к. через плаценту проходит большинство ЛС.
Проницаемость плаценты возрастает к 32-35 нед беременности.
Стресс, гестозы могут повышать проницаемость плаценты.
• Потенциальная польза от применения ЛС должна превышать
потенциальный риск для беременной и плода от их побочных
эффектов.
• Должна учитываться взаимосвязь между стадией
беременности и действием ЛС.
• Некоторые ЛС могут оказывать отсроченное неблагоприятное
действие на плод.
• Изменение фармакокинетики ЛС у женщин во время
беременности определяет необходимость коррекции разовой
дозы, кратности назначения и пути введения ЛС.
25.
• Длительность действия ЛС у плода (в том числе и нежелательныхэффектов) существенно больше, чем у женщины, что связано с
низкой скоростью их инактивации и выведения.
Особенности клинической фармакологии у кормящих женщин
Большинство ЛС, принимаемых кормящей матерью, выделяются с
молоком. Для уменьшения поступления ЛС в организм ребёнка с
молоком матери рекомендовано делать большой перерыв между
приёмом ЛС и кормлением грудью. Поступающее в организм
новорождённого вместе с молоком количество ЛС составляет
обычно 1-2% дозы, принятой матерью, поэтому относительно
безопасно для ребёнка. Существуют ЛС, противопоказанные
кормящим матерям, при необходимости их назначения кормление
грудью следует прекратить. Некоторые сульфаниламидные
препараты выделяются с молоком в незначительных количествах,
но могут вызвать гемолитическую анемию у новорождённых с
дефицитом глюкозо-6-фосфат-дегидрогеназы.
26.
27.
28.
29.
30.
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ У ДЕТЕЙ ИНОВОРОЖДЁННЫХ
В фетальном периоде системы метаболизма и выведения ЛС
недостаточно совершенны, достигая взрослого уровня
функционирования лишь после рождения.
Всасывание. У новорождённых, особенно недоношенных,
значительно снижена секреция соляной кислоты, скорость
опорожнения желудка замедлена и достигает зрелости только к
6-8 мес. Интенсивность перистальтики непредсказуема и только
у незначительной части новорождённых зависит от характера
вскармливания. У новорожденных и грудных детей (до 1 года)
наблюдается повышенная проницаемость кожных покровов,
поэтому местное применение ЛС или их случайное попадание
на тело ребенка могут вызвать системные и токсические
эффекты (борная кислота, входящая в состав многих присыпок;
производные анилина, которыми иногда окрашивается бельё,
могут вызвать метгемоглобинемию).
31.
Распределение лекарственных средств.Различия в распределении ЛС у детей разных возрастных групп
зависят от относительного содержания воды (у недоношенных
– 86% массы тела, у доношенных – 75%, к концу 1-го года жизни
– около 65%). У новорождённых объём внеклеточной жидкости
составляет примерно 45% (у недоношенных – до 50%) массы
тела, в то время как у детей в возрасте 4-6 мес – 30%, 1 года –
25%; отмечают также её интенсивный суточный обмен (у
грудного ребенка обменивается 56% внеклеточной жидкости, у
взрослого – лишь 14%). В то же время у новорождённых
снижено количество жира: оно составляет примерно 3% общей
массы тела у недоношенных, 12% – у доношенных детей (по
сравнению с 30% у детей в возрасте 1 года и 18% у молодых
здоровых людей). Проницаемость гематоэнцефалического
барьера для большинства ЛС значительно повышена.
32.
Связывание с белками плазмы крови.У новорождённых по сравнению со взрослыми связывание ЛС с
белками плазмы крови меньше (поэтому выше концентрация
свободной фракции ЛС), так как у них меньше количество белков
плазмы крови (в частности, альбумина), а также высокие
концентрации свободных жирных кислот, билирубина и гормонов,
конкурирующих с ЛС за связь с белками плазмы. Содержание
альбуминов и их связывающая способность достигают уровня
взрослых к концу 1-го года жизни. Сами ЛС могут нарушать
связывание эндогенных веществ с белками. Салицилаты и
большинство сульфаниламидов, активно связываясь с альбуминами
плазмы, вытесняют билирубин. При повышении концентрации
неконъюгированного билирубина в плазме крови возникает
желтуха, билирубин легко проникает через ГЭБ (особенно на фоне
ацидоза, гипотермии, гипогликемии). Это взаимодействие может
увеличивать риск развития билирубиновой энцефалопатии у
новорождённого. Аналогично влияют на связь билирубина с
белками плазмы водорастворимые производные витамина K.
33.
Наоборот, степень связывания бензодиазепинов с белкамиплазмы крови у детей (особенно новорождённых и
недоношенных) существенно ниже, чем у взрослых. Если
назначить ребёнку до 4-х лет диазепам во «взрослой» дозе,
рассчитанной в соответствии с его массой тела, но не учитывать
его низкого связывания с белками плазмы, то можно получить
концентрацию свободного препарата, которая в пять раз
превысит концентрацию у взрослых при той же суммарной
(связанный плюс несвязанный препарат) концентрации в крови.
Такая доза может с самого начала оказаться токсичной, поскольку
именно свободное (несвязанное с белками плазмы крови) ЛС
оказывает фармакологическое действие.
34.
Метаболизм лекарственных средствСущественно более медленный, чем у взрослых. Могут
образовываться нетипичные метаболиты (теофиллин → кофеин).
Как и у взрослых, основной орган, ответственный за метаболизм ЛС
у новорождённых, – печень. Поскольку система цитохрома Р-450
становится полноценно развитой лишь к моменту рождения, она
функционирует медленнее, чем у взрослых. Реакции
метилирования также снижены при рождении. Активность
большинства ферментов достигает взрослого уровня к 6 мес,
алкогольдегидрогеназы – к 5 годам. Незрелость путей
глюкуронирования может привести к развитию «серого синдрома»
у новорождённых, получающих хлорамфеникол. Недоношенные и
доношенные новорождённые погибают от этого синдрома из-за
развития анемии и сосудистого коллапса вследствие высокой
концентрации неконъюгированного хлорамфеникола, период
полувыведения которого составляет у этих пациентов 26 ч, по
сравнению с 4 ч у детей старшего возраста.
35.
Окислительное гидроксилирование у новорождённых (особенно унедоношенных) протекает замедленно, в связи с чем экскреция
фенобарбитала, лидокаина, фенитоина и диазепама резко
снижена. Так, период полувыведения диазепама уменьшается с
возрастом (38-120 ч у недоношенных, 22-46 ч у доношенных
новорождённых и 15-21 ч у детей в возрасте 1-2 лет). В связи с
этими особенностями фармакокинетики у новорождённых
отмечают значительное накопление диазепама и его метаболитов
при назначении его беременным незадолго до родов. Активность
эстераз у новорождённых также снижена, чем объясняют
угнетение дыхания и брадикардию у новорождённых при
использовании для обезболивания родов местных анестетиков.
Период полувыведения большинства ЛС удлинён в раннем
детском возрасте, что определяет необходимость снижения
дозы ЛС или увеличения интервала между введениями.
36.
Выведение. Скорость почечного кровотока, клубочковая фильтрацияи канальцевая секреция у детей снижены, поэтому кратность
режима дозирования, особенно у новорождённых менее 3-4 нед,
должна быть уменьшена. Так, аминогликозиды назначают каждые 8
ч детям старшего возраста, каждые 12 ч доношенным и каждые 24 ч
недоношенным новорождённым. Скорость клубочковой фильтрации
доношенных детей составляет около 50% взрослого уровня, достигая
его к 1 году жизни. Канальцевая секреция и реабсорбция достигают
взрослого уровня к 7 годам жизни. Применение электролитов,
особенно гидрокарбоната натрия, должно быть ограничено, так как
у новорождённых экскреция натрия снижена. Рекомендуют избегать
введения натрия в первые 3 дня жизни, а введение калия допустимо
лишь при нормальном функционировании почек. Для оказания
диуретического эффекта дозу тиазидных диуретиков приходится
повышать по сравнению с дозами у взрослых. У новорождённых
период полувыведения фуросемида в 8 раз больше, чем у взрослых,
и составляет 4-9 ч (у взрослых – 30-70 мин).
37.
Одним из факторов, влияющих на изменение дозировокпрепаратов, назначаемых детям, является постоянное
изменение их массы тела. Поправка на каждый год жизни
ребенка составляет примерно 1/20 дозы взрослого.
Нет никаких универсальных правил расчета дозы, которые
могли бы гарантировать эффективность и безопасность
применения лекарств у детей, особенно новорожденных!!!
Рациональный подход заключается в расчете дозировки на
основе знаний фармакокинетики детского организма с
поправкой на ожидаемую ответную реакцию и индивидуальные
особенности каждого ребенка.
38.
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ ЛС УПОЖИЛЫХ ЛЮДЕЙ
Гериатрическая фармакология – раздел клинической
фармакологии, изучающий принципы дозирования и
особенности взаимодействия ЛС у пациентов пожилого и
старческого возрастов, а также пути повышения устойчивости их
организма к нежелательному воздействию ЛС. Фармакотерапия
пациентов этой возрастной группы осложнена наличием
нескольких заболеваний, и, соответственно, применением
разнообразных ЛС, повышением риска возникновения
нежелательных лекарственных реакций (у пациентов старше 60
лет их отмечают в 1,5 раза чаще, чем у молодых), изменениями
фармакокинетики и фармакодинамики ЛС пожилых людей.
Возникновение нежелательных лекарственных реакций ЛС
может быть также связано с тем, что больной перепутал ЛС,
принял лишнюю дозу и т.д.
39.
Особенности фармакокинетики лекарственных средств упожилых людей
Всасывание.
Для пожилых людей характерна прогрессирующая гипокинезия
желудка и кишечника. Снижение эвакуаторной функции желудка
приводит к более медленному поступлению ЛС в тонкий
кишечник. Снижение скорости всасывания может быть
обусловлено также атрофическими изменениями слизистой
оболочки желудка и кишечника, снижением кровотока в ЖКТ. У
пожилых пациентов часто возникает ахлоргидрия, что может
обусловить уменьшение растворимости некоторых ЛС, например,
тетрациклинов, и опосредованно снизить их биодоступность.
Уменьшение всасывания ЛС наблюдают и при внутримышечном
введении, что может стать причиной снижения скорости
наступления терапевтического эффекта. Причинами этого могут
быть уменьшение кровотока в скелетных мышцах и снижение
физической активности пожилых пациентов.
40.
Распределение.Гипоальбуминемия, уменьшение количества белков,
связывающих ЛС, снижение мышечной массы, увеличение
жировой массы, уменьшение воды в тканях изменяют
фармакокинетику ЛС у пожилых. Также имеет значение
возрастное уменьшение (↓ около 20%) концентрации
альбуминов вследствие снижения скорости их печёночного
синтеза. Эти изменения вызывают повышение концентрации
свободной фракции ряда препаратов, обладающих большой
связывающей способностью (фенитоин, варфарин, промедол и
др.), что может приводить к развитию побочных эффектов при
назначении стандартных доз. Снижение скорости распределения
большинства ЛС происходит вследствие ухудшения скорости
кровотока, снижения кровоснабжения различных органов и
тканей из-за склерозирования сосудов и уменьшения величины
сердечного выброса.
41.
Метаболизм.Снижение белоксинтезирующей и дезинтоксикационной функций
печени обусловливает меньшую интенсивность метаболизма ЛС у
пожилых. В тщательно контролируемом исследовании была
выявлена значительная зависимость периода полувыведения
диазепама от возраста. В возрасте 20 лет период полувыведения
составил 20 ч. Эта величина возрастала линейно и составила 90 ч у
80-летних пациентов. Эта закономерность увеличения периода
полувыведения с возрастом сохраняется для ряда ЛС.
42.
Выведение.Выделительная функция почек с возрастом ухудшается. Это
связано со снижением почечного кровотока, клубочковой
фильтрации, канальцевой секреции, а также с уменьшением
количества нефронов. Начиная с 20 лет, функция почек снижается
на 10% в течение каждых последующих 10 лет жизни. Это
необходимо учитывать при выборе режима дозирования ЛС,
которые выводят преимущественно почки. У пожилых даже
нормальная концентрация креатинина не всегда свидетельствует
о нормальной выделительной функции почек. Учитывая
неполноценность печёночного метаболизма и снижение
выделительной функции почек, начальные дозы ЛС у пожилых
следует снижать на 30-50%.
43.
Особенности фармакодинамики лекарственных средств упожилых пациентов.
У пожилых пациентов возможно развитие трудно прогнозируемых,
нетипичных, неадекватных количеству вводимого ЛС и даже
парадоксальных реакций при применении сердечных гликозидов,
глюкокортикоидов, нитратов, адреномиметиков и адреноблокаторов, некоторых антигипертензивных препаратов, анальгетиков,
барбитуратов, бензодиазепиновых транквилизаторов, противопаркинсонических и противоэпилептических ЛС. Барбитураты,
например, часто вызывают нарушение сознания или парадоксальное возбуждение, нитраты и прокаинамид – более сильное, чем у
пациентов среднего возраста, снижение АД и возможное ухудшение мозгового кровообращения, наркотические анальгетики –
более быстрое угнетение дыхательного и возбуждение рвотного
центров. Делирий и когнитивные расстройства часто встречаются у
пожилых при назначении психотропных препаратов. Риск
нежелательных лекарственных реакций кратно возрастает, когда
пациент получает несколько ЛС.
44.
45.
Атипичные реакции при применении некоторых ЛС у пожилых лиц46.
Изменение фармакокинетики некоторых ЛС у пожилых пациентов47.
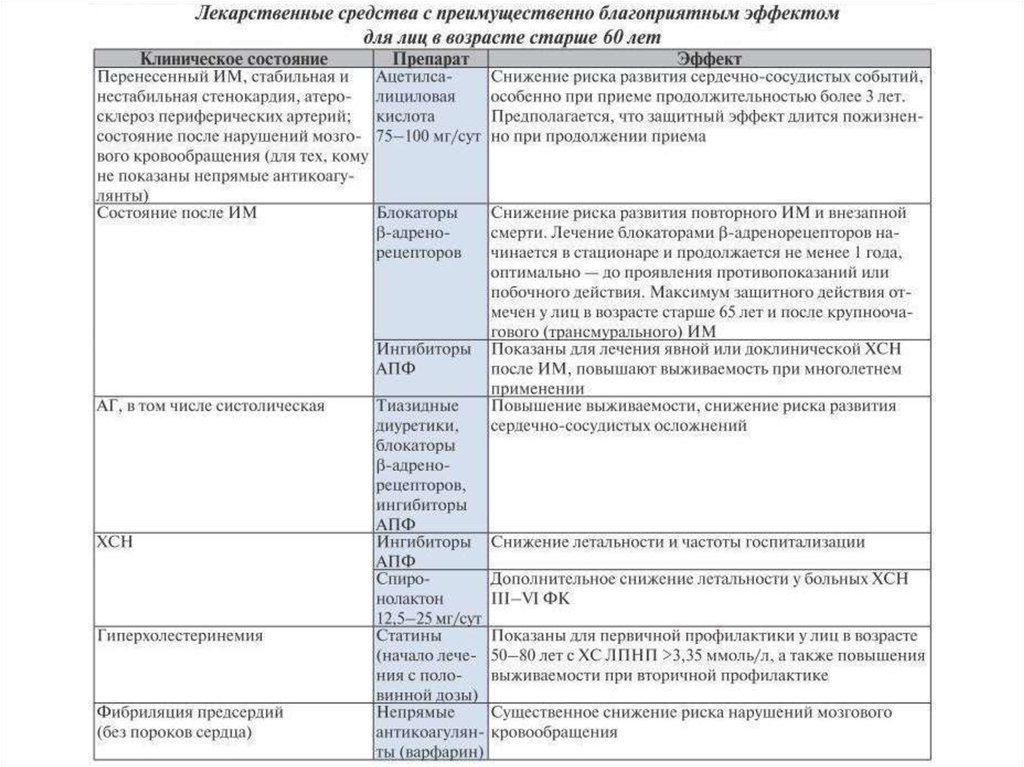
Для проведения рациональной фармакотерапии упожилых пациентов следует отдавать предпочтение
тем лекарственным средствам, которые в различных
РКИ проявили себя как эффективные и безопасные
препараты.
48.
Некоторые лекарственные средства не следует назначать людямпожилого и старческого возраста без веских оснований,
особенно для длительного применения, поскольку длительный
прием этих препаратов представляет серьезную клиническую
проблему с точки зрения обеспечения безопасности.
49.
50.
Полиморбидность, или мультиморбидность (наличиенескольких заболеваний у одного пациента) – серьезная
проблема, с которой может столкнуться врач, при лечении
больных любого возраста, однако чаще это отмечают в
геронтологии и гериатрии. Начало заболеваний, формирующих
синдромы полиморбидности, и их хронизация приходится на
молодой (30-45 лет) и средний возраст (40-60 лет), а результат их
суммарного накопления проявляется соответственно в пожилом
возрасте (61-75 лет). С возрастом увеличивается количество
заболеваний у лиц пожилого возраста. В среднем у одного
больного в возрасте 60-70 лет диагностируют 2-3
самостоятельных заболевания, а после 75 лет – уже 4-6. Другой
путь развития полиморбидности – причинно-следственная
трансформация: развившееся заболевание (или его длительная
терапия) приводит к функциональным, а затем и органическим
нарушениям в системе органов, объединенных общими
функциями, и последовательному развитию других
нозологических форм.
51.
52.
Так, показано, что у больных пожилого возраста, находящихся налечении в гастроэнтерологических отделениях, диагностируют от
5 до 8 нозологических форм одновременно. Чаще всего
гастроэнтерологическим заболеваниям сопутствуют ИБС, АГ и
дисциркуляторная энцефалопатия. Развитию полиморбидности
способствует присоединение сахарного диабета.
Желание врача назначить больному сразу несколько препаратов
возникает в том случае, если у пациента одновременно отмечают
признаки поражения нескольких органов и систем. ВОЗ не раз
объявляла, что для лечения всех известных человечеству
болезней достаточно 200 препаратов. Прежде, чем назначить
пациенту лекарственное средство, врач должен убедиться в
необходимости назначения, проверить альтернативы.
53.
Особенно неблагоприятна полипрагмазия у гериатрическихбольных, которая в психологии врача является «вынужденной».
Вследствие возрастных особенностей фармакокинетики ЛС риск
развития побочных реакций у больных пожилого возраста в 5-7
раз выше, чем у лиц молодого возраста, а при одновременном
применении ≥3 лекарственных средств – в 10 и более раз выше
(побочные реакции отмечаются в 22,6% случаев приёма ЛС).
Пациентов пожилого возраста в 2-3 раза чаще госпитализируют в
связи с тяжёлыми побочными реакциями ЛС. Эти больные могут
также принимать различные лекарственные средства
дополнительно – по собственной инициативе или по совету
окружающих. Полипрагмазию отмечают у 56% пациентов в
возрасте моложе 65 лет и у 73% – старше 65 лет.
54.
Прием 2 препаратов приводит к лекарственнымвзаимодействиям у 6% пациентов. Прием 5 препаратов
повышает их частоту до 50%. При приеме 10 препаратов риск
лекарственных взаимодействий достигает 100%.
В одном из исследований продемонстрировано, что среднее
количество препаратов, принимаемых пациентами (как
назначенных врачами, так и принимаемых самостоятельно),
составляет 10,5, при этом в 96% случаев врачи не знали точно,
что принимают их пациенты. Также побочные реакции, дающие
новую клиническую симптоматику, далеко не всегда учитывает
врач, поскольку может расценивать их как проявление одного из
факторов полиморбидности, что влечет за собой назначение
еще большего количества лекарственных средств.
55.
Принципы фармакотерапии у пожилых людей● Установить необходимость назначения лекарственного
средства:
– не все болезни лиц пожилого возраста требуют
медикаментозного лечения;
– установить точный диагноз перед началом лечения;
– по возможности избегать применения лекарственных средств,
но обязательно назначать их, если актуален вопрос
поддержания приемлемого качества жизни.
56.
● Тщательно выявить все условия применения лекарственныхсредств пожилым пациентом:
– больной может получать рекомендации и лечение от
нескольких врачей, поэтому сведения об уже проводимой
терапии позволяют избежать нежелательных лекарственных
взаимодействий;
– курение, алкоголь, употребление кофе могут привести к
усилению действия некоторых лекарственных средств.
● Хорошо знать механизм действия назначаемого препарата:
– помнить о возможности возрастных изменений в
фармакокинетике лекарственных средств;
– назначать хорошо изученные лекарственные средства.
57.
● Начинать терапию с невысоких доз лекарственных средств:– стандартная доза часто высока для пациентов пожилого
возраста;
– влияние возраста на печеночный метаболизм лекарственного
вещества в печени не всегда прогнозируемо, но почечная
экскрекция лекарств и их метаболитов с возрастом снижается;
– больные пожилого возраста более восприимчивы к
лекарственным средствам, влияющим на ЦНС.
58.
● Титровать дозы ЛС до достижения нужного терапевтическогоэффекта:
– определить достигаемый терапевтический эффект;
– в начале лечения назначить ЛС в дозе приблизительно в 2 раза
ниже, чем для пациентов среднего возраста;
– постепенно довести дозу до такой, применение которой дает
предельно возможный терапевтический результат. Если достичь
желаемого не удается, необходимо стремиться использовать
максимальную переносимую дозу (когда дальнейшее ее
повышение приводит к возникновению побочных реакций);
– в отдельных случаях комбинированная терапия более
адекватна и эффективна, чем монотерапия.
59.
● Упростить режим применения лекарственных средств, темсамым обеспечивая приверженность терапии:
– избегать сложных режимов дозирования, наиболее
приемлемый режим приёма ЛС – 1-2 раза в сутки;
– тщательно инструктировать больных и их родственников в
отношении режима приема лекарственных средств;
– объяснить, для чего выписано лекарственное средство;
– предложить вести дневник приема лекарственных средств;
– постоянно контролировать соблюдение пожилым пациентом
режима приема лекарственных веществ.
60.
● По возможности следует избегать назначения внутрь жидкихлекарственных форм, так как из-за снижения остроты зрения и
тремора рук пожилые больные испытывают затруднения при их
дозировании и приёме.
● В стационарных условиях медицинскому персоналу следует
уделять особое внимание контролю за своевременным
приёмом назначенных ЛС, поскольку больные могут забыть
принять очередную дозу препарата либо принять её повторно.
● При назначении нескольких ЛС следует учитывать, что
пожилой возраст – фактор риска опасных взаимодействий ЛС.
61.
62. Правила назначения ЛС
1Определить, в какой степени ЛС метаболизируется и
элиминируется печенью, т.е. нужна или нет коррекция дозы.
Как правило, о высоком печеночном клиренсе
свидетельствуют высокие значения показателя первого
прохождения через печень и низкая биодоступность (<40%).
К таким ЛС относятся антидепрессанты, наркотические
анальгетики, статины, антипсихотики, блокаторы медленных
кальциевых каналов, нитраты, многие β-адреноблокаторы,
поэтому, если вы встретили в инструкции к ЛС фразу
«обладает эффектом первого прохождения», дозу ЛС нужно
снизить. Однако необходимо помнить, что ЛС может
метаболизироваться в печени и не обладать «эффектом
первого прохождения». Тогда в ТКФС можно встретить
примерно следующую формулировку: «метаболизируется до
неактивных метаболитов в печени», отсюда следует, что при
патологии печени дозу такого ЛС также необходимо снизить.
63. Правила назначения ЛС
2Рассмотреть возможность использования ЛС с
аналогичными фармакологическими эффектами (из той
же фармакологической группы), не подвергающихся
метаболизму в печени. Например, если необходимо
назначить β-адреноблокатор пациенту с циррозом
печени, то в данном случае предпочтение надо отдать
препарату, который не метаболизируется в печени, т.е.
атенололу. Следует учитывать, что некоторые ЛС,
метаболизирующиеся в печени, гепатотоксичны, при
этом лучше по возможности избегать использования
подобных ЛС у лиц с патологией печени.
64. Правила назначения ЛС
3Если альтернатива невозможна, необходимо провести
коррекцию дозы ЛС. С этой целью определяют степень
снижения печеночной функции. Как было отмечено
выше, на работу печени оказывает влияние множество
различных факторов, трудно поддающихся
интегральной оценке; также необходимо помнить, что
уровень билирубина и активности печеночных
ферментов (АЛТ, АСТ) указывает на повреждение ткани
печени, а не на степень снижения ее функции. В
настоящее время не существует универсального
критерия для оценки функции печени, доступного в
клинической практике, поэтому для решения данной
задачи предлагается несколько подходов.
65. 3.1
Правила назначения ЛС3.1
Коррекция дозы ЛС при заболеваниях печени,
основанная на оценке степени нарушения ее функции
по шкале Чайлд-Пью-Туркотт
66. Шкала Чайлд-Пью
ПризнакБаллы
1
2
3
Билирубин,
мкмоль/л
Альбумин, г/л
<34
34-51
>54
>35
28-35
<28
Протромбиновое время,
% МНО
Асцит*
<4
<1,7
4-6
1,7-2,3
>6
>2,3
Энцефалопатия**
нет
нет
контролируемый1 рефрактерный2
I-II
III-IV
*По варианту ответа на медикаментозную терапию:
1) асцит, поддающийся медикаментозной терапии;
2) рефрактерный асцит – асцит, который не устраняется при терапии диуретиками
в максимальных дозах: спиронолактон – 400 мг/сут, фуросемид – 160 мг/сут.
** Критерии тяжести ПЭ по West-Haven
67. Критерии тяжести ПЭ по West-Haven
68. Шкала Чайлд-Пью-Туркотт
Сумма балловКласс
Стадия ЦП
Коррекция дозы
5-7
А
начальная стадия ЦП
не требуется
8-10
В
умеренно выраженный ЦП
снизить дозу ЛС на 25%;
11
С
терминальная стадия ЦП
снизить дозу на 50%
для ЛС без «эффекта
первого прохождения»
снизить дозу на 75%
для ЛС с «эффектом
первого прохождения»
69. 3.2
Правила назначения ЛС3.2
• Коррекция дозы ЛС при заболеваниях печени,
основанная на оценке белоксинтезирующей
функции (по уровню альбумина плазмы крови)
Если концентрация альбумина в сыворотке крови меньше,
чем 30 г/л, то дозу уменьшают на 50% для ЛС, обладающих
«эффектом первого прохождения», и на 25% для ЛС, не
обладающих «эффектом первого прохождения».
70. Пример
Необходимо рассчитатьподдерживающую дозу
метилпреднизолона для пациента 45 лет,
страдающего аутоиммунным циррозом
печени и гемолитической анемией. У
пациента при осмотре сознание ясное,
кожные покровы желтушны, умеренный
асцит. При обследовании выявлено:
гемоглобин 91 г/л, гематокрит 30%,
билирубин 60 мкмоль/л, альбумин 31 г/л,
протромбиновое время 48%.
РЕШЕНИЕ
Препарат метаболизируется в печени, а
поддерживающая доза составляет 4-12
мг в сутки, т.е. средняя поддерживающая
доза для лиц с нормальной функцией
печени - 8 мг в сутки.
Поскольку метилпреднизолон не
обладает «эффектом первого
прохождения», уменьшим дозу на
50%: поддерживающя доза = 8 мг
– (8 мг × 0,5) = 4 мг.
Определяем функцию печени по
шкале Чайлда-Пью: 10 баллов, что
соответствует классу С
(декомпенсированный цирроз).
Следовательно, среднюю
поддерживающую дозу
метилпреднизолона для лиц с
нормальной функцией печени
необходимо уменьшить на 50-75%.
71.
72. Правила назначения ЛС
Важным фармакокинетическим параметром, на которыйследует обратить внимание при расчете дозы, становится доля
препарата, выводимая почками в неизмененном виде или в
виде активных метаболитов (так называемая почечная
фракция – fu). Именно с помощью этого показателя
рассчитывается доза ЛС при почечной недостаточности, что
необходимо при применении:
• ЛС с узким терапевтическим диапазоном, которые выводятся
почками в неизмененном виде более чем на 50%;
• ЛС, не считающихся ЛС с узким терапевтическим диапазоном,
которые выводятся в неизмененном виде более чем на 75%.
Для расчета дозы ЛС в первую очередь необходимо оценить
почечную функцию.
Для этого рассчитывают показатель клиренса креатинина.
73. Способы расчёта клиренса креатинина
Оценка СКФ по клиренсу эндогенного вещества – креатинина, которыйпоступает в кровь в процессе самообновления мышечной ткани с
примерно постоянной скоростью, более удобно, хотя и менее точно,
чем по клиренсу экзогенных веществ. Проводится проба РебергаТареева, основанная на сборе мочи в течение 24 ч. Определяется объем
суточной мочи, концентрация креатинина в суточной моче и в крови,
взятой после завершения пробы. СКФ рассчитывается по формуле:
Где V – объем мочи, собранной за сутки, мл; UCr – концентрация
креатинина в суточной моче; SCr – концентрация креатинина в
сыворотке крови, взятой в конце пробы. Полученный результат
необходимо стандартизировать на площадь поверхности тела
пациента, которая может быть рассчитана по формулам Дюбуа или
Хейкока.
74. Способы расчёта клиренса креатинина
Стандартизация СКФ на площадь поверхности тела пациентаПлощадь поверхности тела пациента рассчитывают:
1) по формуле Дюбуа:
2) по формуле Хейкока:
Мтела – масса тела, кг;
Рост – рост тела, см.
Сбор суточной мочи представляет определенные затруднения для
пациентов, особенно амбулаторных. Кроме того, высока вероятность
ошибки, связанной с неправильным сбором мочи или неточным
измерением ее объема. Для точности пробы необходим достаточный
суточный диурез (не менее 1000 мл).
75. Способы расчёта клиренса креатинина
Первой формулой, получившей широкое применение в нефрологии,клинической фармакологии и других областях медицины, стала
формула Кокрофта-Голта [Cockcroft DW, Gault MH, 1976]. Она проста,
однако полученное значение желательно стандартизировать на
поверхность тела пациента, что значительно усложняет расчеты.
76. Способы расчёта клиренса креатинина
В 90-е годы группой экспертов на основании данных исследования MDRD(Modifi cation of Diet in Renal Disease) [Levey AS и соавт., 1999] были
предложены новые уравнения, более точные, чем формула Кокрофта-Голта,
и не требующие дополнительной стандартизации на поверхность тела, а
также знания антропометрических показателей, получившие название
формул MDRD. Чтобы рассчитать СКФ при помощи сокращенного варианта
формулы MDRD, достаточно знать уровень креатинина сыворотки крови,
пол, возраст и расу пациента, что делает ее очень удобной для
скрининговых исследований и амбулаторной практики. Однако формула
MDRD имеет ряд существенных недостатков. На 3-5 стадиях ХБП она
точнее отражает функцию, чем формула Cockcroft-Gault, однако при
истинной СКФ выше 60 мл/мин/1,73 м2 она даёт неточные (заниженные)
результаты. Уравнения MDRD, полученные при обследовании популяции
Северной Америки, некорректно отражают уровень СКФ у представителей
монголоидной расы и ряда этносов [Matsuo S и соавт., 2009].
77. Способы расчёта клиренса креатинина
В 2009-2011 гг. той же группой исследователей был разработан наиболееуниверсальный и точный метод расчета СКФ, работающий на любой
стадии ХБП и у представителей всех трех рас – уравнения CKD-EPI.
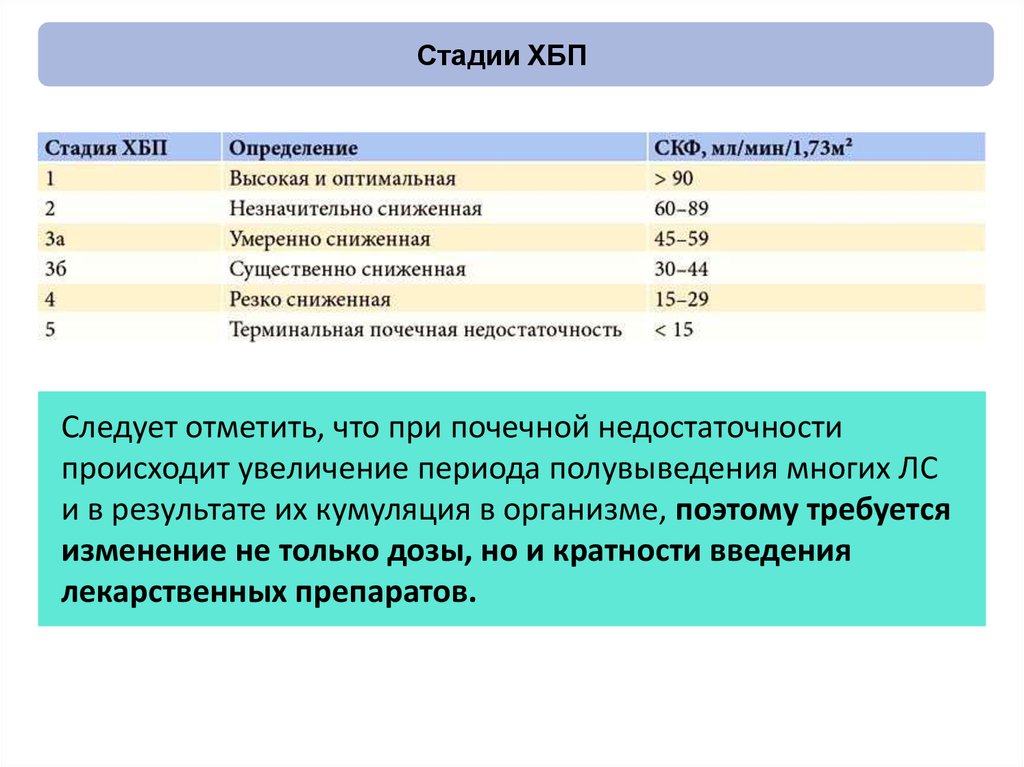
78. Стадии ХБП
Следует отметить, что при почечной недостаточностипроисходит увеличение периода полувыведения многих ЛС
и в результате их кумуляция в организме, поэтому требуется
изменение не только дозы, но и кратности введения
лекарственных препаратов.
79. Пример
Пример расчета дозы ЛС при нарушении функции почек.Необходимо определить рациональный режим дозирования
антибактериального препарата левофлоксацина для пациентки с
пневмонией и хроническим гломерулонефритом 48 лет, весом 64 кг,
концентрация креатинина – 160 мкмоль/л.
1. Обратимся к разделу «Фармакокинетика» ТКФС, откуда узнаем, что
левофлоксацин на 70-87% выводится почками в неизмененном виде,
т.е. fu составляет примерно 0,8, а средняя доза при пневмонии и
нормальной функции почек составляет 500 мг в сутки, следовательно,
при ХПН требуется коррекция дозы.
2. Рассчитаем клиренс креатинина: переведем единицы измерения –
160 мкмоль/л соответствуют 0,16 ммоль/л.
Cl креатинина, мл/с = (140 – 48) × 64 / 0,16 × 50000 × 0,85 = 0,625
Значение 0,625 мл/с соответствует 37,5 мл/мин. В данном случае у
больной имеет место умеренная почечная недостаточность.
80. Пример
3. Решим пропорцию:Доза желаемая / 500 = [(1 – 0,8) + 0,8 × 0,625] / 1,5
Доза желаемая = 266 мг.
То есть, согласно проведенным расчетам, суточную дозу необходимо
снизить вдвое.
Кроме того, рассчитав значение клиренса креатинина, можно
воспользоваться рекомендациями, приведенными в ИМП: «При
заболеваниях почек дозу снижают в соответствии со степенью
нарушения функции: при клиренсе креатинина 20-50 мл/мин – по 125250 мг 1-2 раза в сутки, 10-19 мл/мин – 125 мг 1 раз в 12-48 ч, меньше
10 мл/мин (включая гемодиализ) – 125 мг через 24 или 48 ч».
4. Определение кратности дозирования.
При ХПН период полувыведения левофлоксацина удлиняется. Для
выбора кратности режима дозирования обратимся к ИМП и, зная
клиренс креатинина (37,5 мл/мин), определим, что в данном случае
оптимальным будет назначение препарата 1 раз в сутки.













































































 medicine
medicine