Similar presentations:
Chimie anorganica
1.
2. Cuprins
TEMA: CHIMIA SISTEMATICĂ A ELEMENTELORELEMENTELE BLOCULUI s
Hidrogenul:Caracterizare generală; Întrebuinţări şi importanţă biologică; Proprietăţi fizice şi chimice;
Combinaţiile hidrogenului. Hidruri; Stare naturală şi obţinere; Întrebuinţări şi importanţă biologică
Grupa I-a principală: Stare naturală şi obţinere; Proprietăţi fizice şi chimice; Combinaţiile metalelor alcaline;
Caracterizare generală. Întrebuinţări şi importanţă biologică
Grupa a II-a principală: Caracterizare generală; Stare naturală şi obţinere; Proprietăţi fizice şi chimice;
Combinaţiile elementelor din grupa a II-a; Întrebuinţări şi importanţă biologică
ELEMENTELE BLOCULUI p
Grupa a III-a principală: Caracterizare generală; Stare naturală şi obţinere; Proprietăţi fizice şi chimice;
Combinaţiile elementelor din grupa a III-a; Întrebuinţări şi importanţă biologică
Grupa a IV-a principală: Caracterizare generală
Carbonul: Stare naturală şi obţinere; Compuşii carbonului
Siliciul: Stare naturală şi obţinere; Proprietăţi fizice şi chimice;Compuşii siliciului
Germaniul, Staniul, Plumbul; Întrebuinţări şi importanţă biologică
Grupa a V-a principală: Caracterizare generală
Azotul: Stare naturală şi obţinere; Proprietăţi fizice şi chimice; Combinaţiile azotului
Fosforul: Stare naturală, forme alotropice; Combinaţiile fosforului
Arsenul, Stibiul sau antimoniul, Bismutul; Întrebuinţări şi importanţă biologică
Bibliografie
1. Neniţescu, C. D. – Chimie generală, Ed. Did. Şi Ped., Buc., 1972.
2. Shriver, D. F., Atkins, P. W., Langford, C. H., Chimie anorganică, Ed. Tehnică, Bucureşti, 1998.
3. Gabriela Oprea, Claudia Drinkal, Chimie anorganică descriptivă. Lucrări de laborator, Editura Risoprint ,Cluj
Napoca, 2004
4. Gabriela Oprea, Chimie anorganică. Teorie şi aplicaţii rezolvate, Editura Risoprint, ,Cluj Napoca,2003
5. Beral, E., Zapan, M. – Chimie anorganică, Ed. Tehnică, Buc., 1970.
6. Stoica, Ligia – Chimie generală şi analize tehnice, Ed. Did. Şi Ped., 1991.
3.
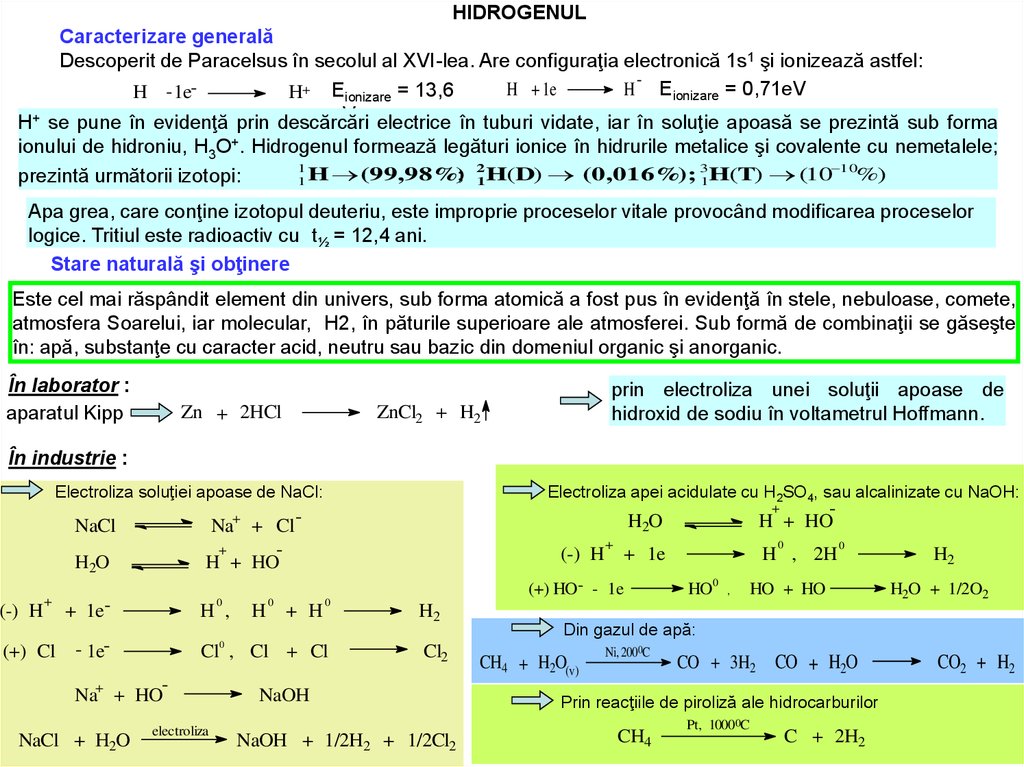
HIDROGENULCaracterizare generală
Descoperit de Paracelsus în secolul al XVI-lea. Are configuraţia electronică 1s1 şi ionizează astfel:
H + 1e
H Eionizare = 0,71eV
H - 1eH+ Eionizare = 13,6
eV; electrice în tuburi vidate, iar în soluţie apoasă se prezintă sub forma
H+ se pune în evidenţă prin descărcări
ionului de hidroniu, H3O+. Hidrogenul formează legături ionice în hidrurile metalice şi covalente cu nemetalele;
1
; 21 H(D) (0,016%); 31H(T) (10 10%)
prezintă următorii izotopi:
1 H (99,98%)
Apa grea, care conţine izotopul deuteriu, este improprie proceselor vitale provocând modificarea proceselor
logice. Tritiul este radioactiv cu t½ = 12,4 ani.
Stare naturală şi obţinere
Este cel mai răspândit element din univers, sub forma atomică a fost pus în evidenţă în stele, nebuloase, comete,
atmosfera Soarelui, iar molecular, H2, în păturile superioare ale atmosferei. Sub formă de combinaţii se găseşte
în: apă, substanţe cu caracter acid, neutru sau bazic din domeniul organic şi anorganic.
În laborator :
aparatul Kipp
Zn + 2HCl
prin electroliza unei soluţii apoase de
hidroxid de sodiu în voltametrul Hoffmann.
ZnCl2 + H2
În industrie :
Electroliza soluţiei apoase de NaCl:
Na+ + Cl +
H + HO
NaCl
H2O
+
+ 1e-
(+) Cl
- 1e-
(-) H
H2O
+
H + HO
(-) H + 1e
H , 2H
+
(+) HO- - 1e
0
H ,
H
0
+ H
0
0
Cl , Cl + Cl
Na+ + HO
NaCl + H2O
Electroliza apei acidulate cu H2SO4, sau alcalinizate cu NaOH:
electroliza
H2
Cl2
NaOH
NaOH + 1/2H2 + 1/2Cl2
0
HO
0
,
0
HO + HO
H2
H2O + 1/2O2
Din gazul de apă:
CH4 + H2O(v)
Ni, 2000C
CO + 3H2
CO + H2O
Prin reacţiile de piroliză ale hidrocarburilor
CH4
Pt, 10000C
C + 2H2
CO2 + H2
4.
Proprietăţi fizice şi chimiceFizice: este un gaz fără culoare şi fără miros, care se lichefiază greu, are densitatea mai mică decât
celelalte gaze şi viteza de difuziune cea mai mare. Este puţin solubil în lichide (H2O), dar se dizolvă
în metale la temperaturi ridicate (exemplu: Pd poate dizolva 850 volume H2 la un volum Pd).
Chimice: Hidrogenul reacţionează cu:
Halogenii
H2 + X2
2HX
oxigenul, sulful, azotul şi carbonul:
3H2 + N2
Reacţia cu fluorul are loc la întuneric, cea cu clorul la lumină, iar
cu bromul şi iodul reacţionează la temperaturi cuprinse între
350 – 400 oC. În cazul iodului, reacţia este reversibilă.
H2 + 1/2O2
Fe, 5000C,200-1000atm.
cu metalele, formând hidruri ionice:
2NH3
H2O
30000C
2C + H2
2Li + H2 uscat
lent
H2 + S
C2H2
3000C
C + 2H2
H2S
Ni, 12000C
CH4
2Li+ H -
Combinaţiile hidrogenului. Hidruri
Hidruri ionice (saline) - care conţin ionul H-
H2 + Li +OH-
LiH + H2O
(AlH3)n
LiH + AlH3
nAlH3
Li[AlH4]
4NaH + Na2SO4
1 28
;4 82
S
6+
H
-
Na2S + 4NaOH
+8e-
-2e-
2-
se reduce
S
H
+
se oxidează
5.
Hidruri covalente (moleculare)Hidrogenul formează hidruri covalente cu elementele din grupele a III-a până la a VII-a, cu
formula generală EH8-n , unde n este nr. grupei. (n = 4,5,6,7). Aceste hidruri sunt gaze (excepţie
H2O). Hidrurile elementelor din grupa a III-a şi hidrura de beriliu sunt deficitare de electroni şi pot fi
izolate sub formă de dimeri sau polimeri, (BeH2)n şi (EH3)n. Diboranul, (BH3)2 sau B2H6, conţine
legături de tip special, de trei centre. Hidrurile elementelor din grupele a IV-a – a VII-a au puncte de
fierbere scăzute, cu excepţia HF, H2O, NH3, unde apar asocieri de molecule prin legaturi de
hidrogen.11
Hidrurile acceptoare de protoni (caracter bazic):NH3 > H2O ; H2O > H2S ; NH3 > PH3
Hidrurile donoare de protoni (caracter acid): HF < HCl < HBr < HI (în grupă); SiH4 < PH3 < H2S
< HCl(în perioadă)
Hidrurile carbonului au caracter neutru şi tendinţa mare de a forma catene.
Hidruri interstiţiale
Hidrurile formate cu metalele tranziţionale sunt hidruri interstiţiale şi au o compoziţie
nestoechiometrică. Aceste hidruri sunt solide, cu caracter metalic, de exemplu: TiH1,7 ; ZrH1,8 .
Formarea lor constă în pătrunderea atomilor de hidrogen în golurile reţelei metalului. Ele sunt
utilizate în tehnologia semiconductorilor, metalurgia pulberilor, sursă de H2, ca reducători.
Hidrurile elementelor blocului f - ocupă o poziţie intermediară între cele interstiţiale şi cele
ionice.
Intrebuinţări:
în industria de sinteză pentru obţinerea amoniacului, acidului clorhidric, îngrăşămintelor chimice, la hidrogenarea
uleiurilor şi hidrocarburilor, ca reducător în metalurgie; combustibil pentru rachete sub formă de H2 lichid.
Importanţa biologică
În stare liberă nu joacă nici un rol pentru organismele vegetale, animale, sau umane. Combinat face parte din
compuşi organici fără de care viaţa nu este posibilă: protidele, lipidele şi glucidele. Abundenta este mare, dar
procentul este mic, din cauza masei atomice mici a acestuia
6.
GRUPA I-a PRINCIPALĂCaracterizare generală:
Grupa I-a principală (denumită şi grupa 1)cuprinde elementele: Li, Na, K, Rb, Cs, Fr, care se numesc şi metale
alcaline. Prezintă configuraţia ultimului strat electronic ns1. Exemplu pentru franciu: Fr, Z = 87
[Xe]54 6s2
4f14 5d10 6p6 7s1
+
-1eM
M
Energia lor de ionizare este mică şi sunt electropozitive. Se oxidează astfel:
Electropozitivitatea creşte de la litiu la franciu. Aceste elemente formează în general combinaţii ionice. Litiul
diferă prin proprietăţi de celelalte elemente, semănând cu magneziul. Franciul este radioactiv, izotopii lui prezintă o
viaţă scurtă.
Stare naturală şi obţinere
Metalele alcaline se găsesc doar sub formă de combinaţii datorită reactivităţii chimice mari. Cele mai
răspândite sunt combinaţiile pentru sodiu şi potasiu: silicaţi, halogenuri, azotaţi, sulfaţi şi carbonaţi. Litiul este puţin
răspândit, iar rubidiul şi cesiul sunt elemente rare. Combinaţii mai răspândite în natură : sarea gemă (NaCl),
salpetru de Chile (NaNO3), salpetru de India (KNO3), silvina (KCl).
Electroliza hidroxidului de sodiu topit:
2HO
Na + OH- (-) Na+
+
NaOH
1/2O2 + H2O
electroliza
2NaOH
Electroliza clorurii de sodiu topite:
2Cl
Na + Cl- (-) Na+
Cl2
Na
(+) HO
-1e-
HO
2Na + 1/2O2 + H2O
+
NaCl
+1e-
2NaCl
+1e-
0
Na
electroliza
(+) Cl
-1e-
0
Cl
2Na + Cl2
Pentru obţinerea K prin electroliză se foloseşte amestec de KCl şi KF, iar pentru obţinerea litiului topitură de
LiCl şi KCl.
Metalele alcaline se pot obţine şi prin reducerea hidroxizilor sau halogenurilor cu metale. Astfel se obţin
rubidiul şi cesiul din hidroxizii lor cu Mg, Ca, Zr, în atmosferă inertă sau vid. Pentru K se utilizează acţiunea
sodiului asupra clorurii de potasiu la 850 0C.
7.
GRUPA I-a PRINCIPALĂProprietăţi fizice
culoare alba-strălucitoare (Cs este galben-auriu); conductibilitatea electrică şi termică mare;
puncte de topire joase( Cs este 28,50C); densitatea mică (mai mică decât apa);
Vaporii lor sunt coloraţi caracteristic: roşu (Li); galben (Na); violet (K); albastru (Cs).
Proprietăţi chimice
au caracter electropozitiv accentuat şi sunt primele în seria tensiunilor electrochimice a elementelor;
Se păstrează sub petrol, ulei de parafină, toluen. Se oxidează uşor în aer, apă şi acizi.
4Li + O2
2Li2O
2M + 2H2O
2Na + O2
2MOH + H2
Na2O2 M + O2
MO2 (M: K, Rb, Cs)
2M + 2HCl
2MCl + H2
reacţionează energic cu halogenii si hidrogenul:
2M + X2
2MX
(X2: F2, Cl2, Br2, I2)
Reacţionează cu: sulful, fosforul, carbonul, azotul, amoniacul si alcoolii
2M + S
M2S 12M + P 4
2M + 2NH3
4M3P
2MNH2 + H2
2M + 2C
Na + C2H5OH
M2C2
6M + N2
C2H5ONa + 1/2H2
2M3N
8.
GRUPA I-a PRINCIPALĂCombinaţiile metalelor alcaline
Oxizi, peroxizi, superoxizi şi ozonide
Na2O2 + 2Na
tº
2KO2
O + H2O
K2O2 + O2 Na2O2 + 2H2O
KO2 + 2H2O
2HO-
2-
2Na2O
2KOH + H2O2 + O2
Na2O + H2O
2NaOH
2NaOH + H2O2 2Na2O2 + 2CO2
2Na2CO3 + O2
Ozonide, MO3:se se formează prin reacţia hidroxizilor de K, Rb, Cs cu ozonul
Hidroxizii metalelor alcaline
Hidroxizii în stare foarte pură se obţin prin reacţia metalelor cu apa.LiOH seamănă în unele privinţe cu Mg(OH)2.
Ceilalţi hidroxizi au proprietăţi fizice şi chimice asemănătoare: sunt substanţe cristaline, albe, higroscopice;
se topesc la temperaturi joase; cristalizează în reţele ionice care conţin ionii M+ şi HO - ; sunt uşor solubili
în apă cu degajare de căldură; sunt solubili în alcooli: CH3OH şi C2H5OH; sunt baze tari, a căror tărie creşte
cu caracterul electropozitiv al elementului, în ordinea:
LiOH, NaOH, KOH, RbOH, CsOH
creste bazicitatea
Sărurile metalelor alcaline
Halogenurile sunt compuşi ionici care cristalizează în reţele ionice, cubice. Cristalizează fără apă de cristalizare, cu
excepţia halogenurilor de litiu. De exemplu, LiCl, este higroscopică şi cristalizează din apă cu 1,2 sau 3 molecule de
H2O, în funcţie de temperatură. Solubilitatea în apă a NaCl variază foarte puţin cu temperatura, în schimb a KCl
variază destul de mult
Compuşi cu sulf:
Na2S + 2H2O
2NaOH + H2S
2NaCl + H2SO4
Na2CO3 + SO2 + H2O
NaHSO3 + Na2CO3
Li2CO3 + H2SO4
Na2SO4 + H2O
NaHSO3 + NaHCO3
Na2SO3 + NaHCO3
2NaHSO4
Li2SO4 + H2O + CO2
tº
-H2O
Na2S2O7
2NaHSO3
-H2O
Na2S2O5
9.
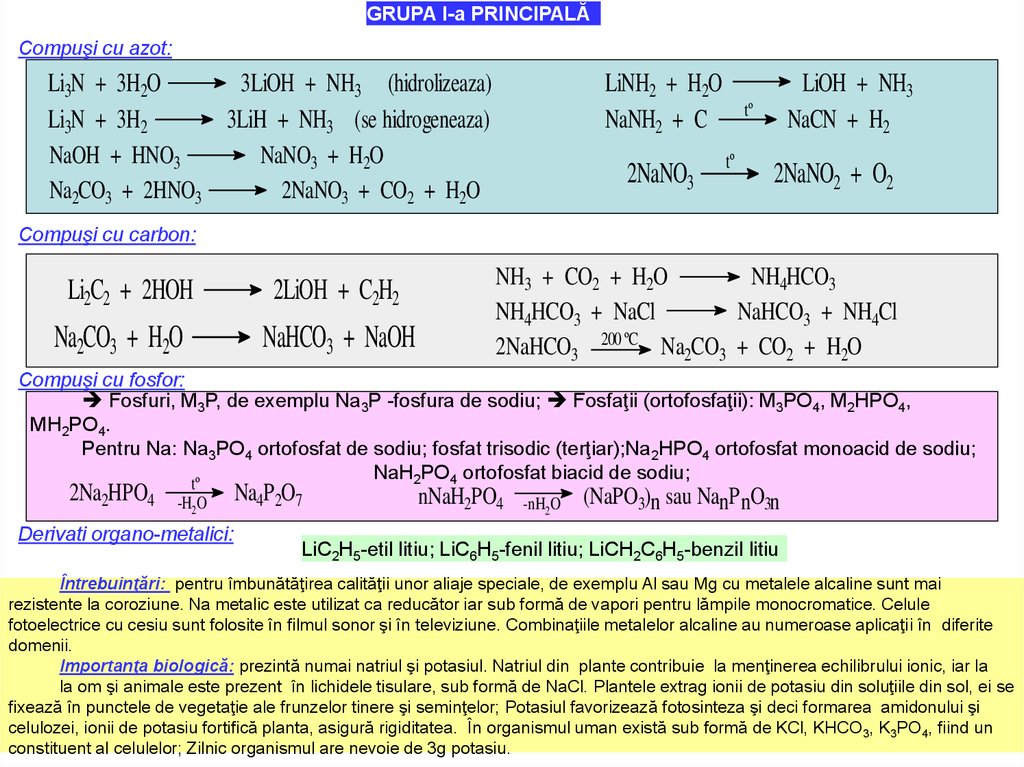
GRUPA I-a PRINCIPALĂCompuşi cu azot:
Li3N + 3H2O
3LiOH + NH3 (hidrolizeaza)
Li3N + 3H2
3LiH + NH3 (se hidrogeneaza)
NaOH + HNO3
NaNO3 + H2O
Na2CO3 + 2HNO3
2NaNO3 + CO2 + H2O
LiNH2 + H2O
NaNH2 + C
2NaNO3
LiOH + NH3
NaCN + H2
tº
tº
2NaNO2 + O2
Compuşi cu carbon:
Li2C2 + 2HOH
Na2CO3 + H2O
2LiOH + C2H2
NaHCO3 + NaOH
NH3 + CO2 + H2O
NH4HCO3
NH4HCO3 + NaCl
NaHCO3 + NH4Cl
2NaHCO3 200 ºC Na2CO3 + CO2 + H2O
Compuşi cu fosfor:
Fosfuri, M3P, de exemplu Na3P -fosfura de sodiu; Fosfaţii (ortofosfaţii): M3PO4, M2HPO4,
MH2PO4.
Pentru Na: Na3PO4 ortofosfat de sodiu; fosfat trisodic (terţiar);Na2HPO4 ortofosfat monoacid de sodiu;
NaH2PO4 ortofosfat biacid de sodiu;
2Na2HPO4
tº
-H2O
Derivati organo-metalici:
Na4P 2O7
nNaH2PO4
-nH2O
(NaPO3)n sau NanPnO3n
LiC2H5-etil litiu; LiC6H5-fenil litiu; LiCH2C6H5-benzil litiu
Întrebuinţări: pentru îmbunătăţirea calităţii unor aliaje speciale, de exemplu Al sau Mg cu metalele alcaline sunt mai
rezistente la coroziune. Na metalic este utilizat ca reducător iar sub formă de vapori pentru lămpile monocromatice. Celule
fotoelectrice cu cesiu sunt folosite în filmul sonor şi în televiziune. Combinaţiile metalelor alcaline au numeroase aplicaţii în diferite
domenii.
Importanţa biologică: prezintă numai natriul şi potasiul. Natriul din plante contribuie la menţinerea echilibrului ionic, iar la
la om şi animale este prezent în lichidele tisulare, sub formă de NaCl. Plantele extrag ionii de potasiu din soluţiile din sol, ei se
fixează în punctele de vegetaţie ale frunzelor tinere şi seminţelor; Potasiul favorizează fotosinteza şi deci formarea amidonului şi
celulozei, ionii de potasiu fortifică planta, asigură rigiditatea. În organismul uman există sub formă de KCl, KHCO3, K3PO4, fiind un
constituent al celulelor; Zilnic organismul are nevoie de 3g potasiu.
10.
GRUPA II-a PRINCIPALĂCaracterizare generală
Grupa a II-a principală (denumită şi grupa 2) cuprinde elementele: Be, Mg, Ca, Sr, Ba, Ra, care se mai
numesc metale alcalino-pământoase. Ele prezintă configuraţia ultimului strat electronic ns2.
Exemplu pentru Ba, Z=56: 1s22s22p63s23p64s23d104p65s24d105p66s2.
Beriliul prezintă abateri de la caracterele generale ale grupei; chimia lui este mult asemănătoare cu a
aluminiului. Ra este radioactiv, izotopul 226
are cel mai lung timp de înjumătăţire, de 1600 ani.
88 Ra
Stare naturală şi obţinere
Datorită reactivităţii chimice mari se găsesc doar sub formă de combinaţii; cele mai răspândite sunt ale
calciului şi magneziului, beriliul şi radiul sunt elemente rare. Radiul s-a găsit în minereurile de uraniu, ca produs de
dezintegrare. Combinaţiile mai răspândite în natură sunt: carbonaţi, cloruri sau fluoruri, silicaţi şi sulfaţi.
Exemple de combinaţii: beril (Be3Al2Si6O18), magnezit (MgCO3), calcit (CaCO3), dolomit (MgCO3 CaCO3),
gips (CaSO4 2H2O), anhidrit (CaSO4), carnalit (MgCl2 KCl 6H2O), baritina (BaSO4), witerita (BaCO3), celestina
(SrSO4), stronţianitul (SrCO3), talcul (Mg3[(OH)2Si4O10]). Metalele alcalino-pământoase se pot obţine prin
electroliza halogenurilor topite şi reducerea metalotermică respectiv silicotermică a oxizilor sau halogenurilor lor.
BeO + Mg
tº
Be + MgO
2MgO + Si
MgO + C
1200ºC, vid
2030ºC, vid
2Mg + SiO2
Mg + CO
calcinare
CaCO3
CaO + CO2
CaO + H2O stingere Ca(OH)2
Ca(OH)2 + 2NH4Cl
CaCl2 + 2NH4OH
3BaO + 2Al
1250ºC, vid
3CaO + Al 1200ºC
o
CaCl2 + 2Na t
3Ba + Al2O3
3Ca + Al2O3
Ca + 2NaCl
11.
GRUPA II-a PRINCIPALĂProprietăţi fizice
Au culoare albă-argintie în stare neoxidată (Ba este cenuşiu deschis). Be şi Mg păstrează luciul şi la
aer pentru că formează un strat protector de oxid. Be cristalizează în reţea hexagonală compactă deformată şi
are raza atomică mică. Mg cristalizează în reţea hexagonală regulată, iar Ca, Sr, Ba în reţea cubică.
Densitatea scade de la Be la Ca şi apoi creşte de la Sr la Ra. Be este mai dur faţă de celelalte elemente din
grupă şi are punctul de topire şi punctul de fierbere mai ridicate. Conductibilitatea electrică este mai mică la Be şi
mai mare la Mg şi Ca. Sărurile volatile ale Ca colorează flacăra în roşu cărămiziu, ale Sr şi Ra în roşu carmin, iar
ale Be în verde.
Proprietăţi chimice
Caracterul electropozitiv al metalelor alcalino-pământoase creşte cu numărul atomic Z, de la Be la Ra. Sunt
aşezate înaintea hidrogenului în seria tensiunilor electrochimice.
tº
2Mg + O2
M + X2
cald
2MgO
MX2
Ca + 2H2O
M + 2S
t
o
3M + N2
Mg + 2HNO3
diluat
Ca(OH)2 + H2
Mg(NO3)2 + H2
Ca + 2NH3
M + H2
1000ºC
MC2
3Be + 2NH3
1000ºC
MS2
M + 2C
tº
M3N2
Ca(NH2)2 + H2
tº
MH2
unde M: Ca, Sr, Ba
Be3N2 + 3H2
12.
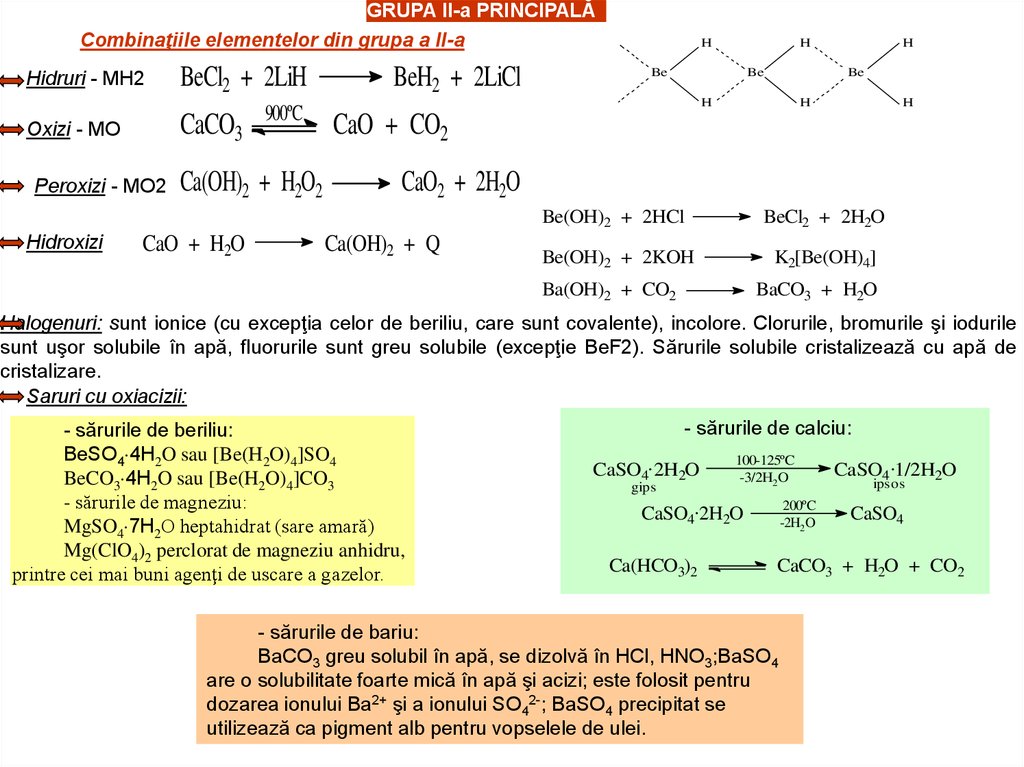
GRUPA II-a PRINCIPALĂCombinaţiile elementelor din grupa a II-a
Hidruri - MH2
CaCO3
Oxizi - MO
Peroxizi - MO2
Hidroxizi
BeCl2 + 2LiH
900ºC
Ca(OH)2 + H2O2
CaO + H2O
BeH2 + 2LiCl
H
H
Be
Be
H
Be
H
H
H
CaO + CO2
CaO2 + 2H2O
Ca(OH)2 + Q
Be(OH)2 + 2HCl
BeCl2 + 2H2O
Be(OH)2 + 2KOH
K2[Be(OH)4]
Ba(OH)2 + CO2
BaCO3 + H2O
Halogenuri: sunt ionice (cu excepţia celor de beriliu, care sunt covalente), incolore. Clorurile, bromurile şi iodurile
sunt uşor solubile în apă, fluorurile sunt greu solubile (excepţie BeF2). Sărurile solubile cristalizează cu apă de
cristalizare.
Saruri cu oxiacizii:
- sărurile de beriliu:
BeSO4 4H2O sau [Be(H2O)4]SO4
BeCO3 4H2O sau [Be(H2O)4]CO3
- sărurile de magneziu:
MgSO4 7H2O heptahidrat (sare amară)
Mg(ClO4)2 perclorat de magneziu anhidru,
printre cei mai buni agenţi de uscare a gazelor.
- sărurile de calciu:
CaSO4.2H2O
gips
100-125ºC
-3/2H2 O
200ºC
-2H2O
CaSO4.2H2O
Ca(HCO3)2
CaSO4.1/2H2O
ipsos
CaSO4
CaCO3 + H2O + CO2
- sărurile de bariu:
BaCO3 greu solubil în apă, se dizolvă în HCl, HNO3;BaSO4
are o solubilitate foarte mică în apă şi acizi; este folosit pentru
dozarea ionului Ba2+ şi a ionului SO42-; BaSO4 precipitat se
utilizează ca pigment alb pentru vopselele de ulei.
13.
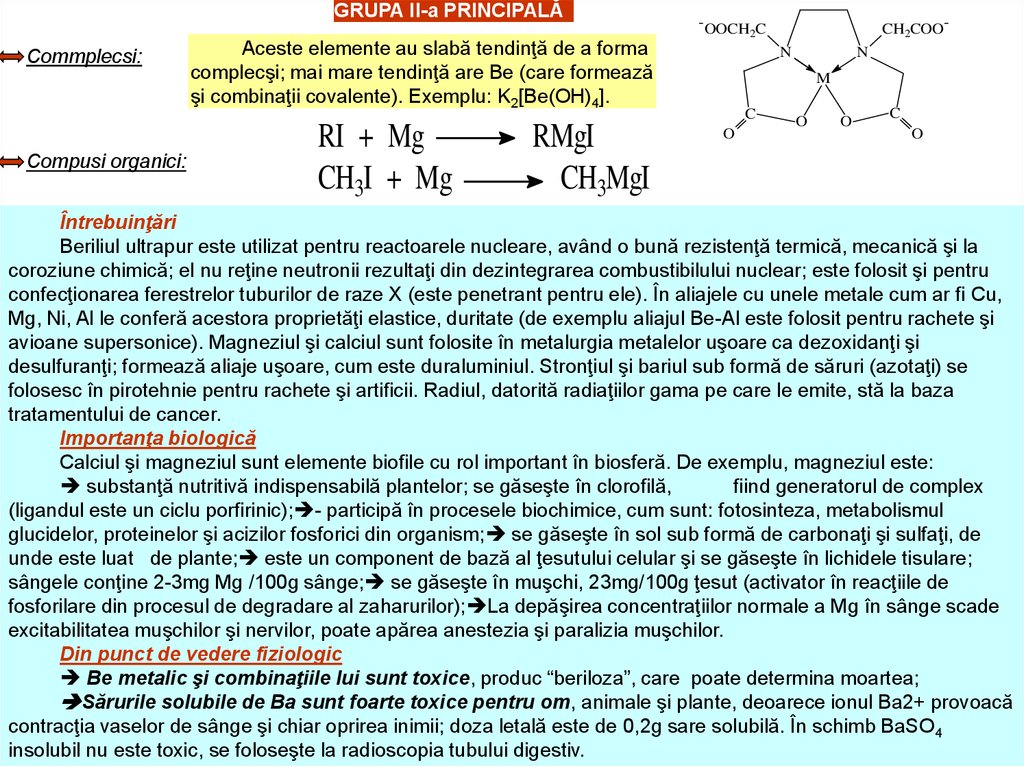
GRUPA II-a PRINCIPALĂCommplecsi:
Compusi organici:
Aceste elemente au slabă tendinţă de a forma
complecşi; mai mare tendinţă are Be (care formează
şi combinaţii covalente). Exemplu: K2[Be(OH)4].
RI + Mg
CH3I + Mg
RMgI
CH3MgI
- OOCH C
2
CH2COON
N
M
C
O
O
O
C
O
Întrebuinţări
Beriliul ultrapur este utilizat pentru reactoarele nucleare, având o bună rezistenţă termică, mecanică şi la
coroziune chimică; el nu reţine neutronii rezultaţi din dezintegrarea combustibilului nuclear; este folosit şi pentru
confecţionarea ferestrelor tuburilor de raze X (este penetrant pentru ele). În aliajele cu unele metale cum ar fi Cu,
Mg, Ni, Al le conferă acestora proprietăţi elastice, duritate (de exemplu aliajul Be-Al este folosit pentru rachete şi
avioane supersonice). Magneziul şi calciul sunt folosite în metalurgia metalelor uşoare ca dezoxidanţi şi
desulfuranţi; formează aliaje uşoare, cum este duraluminiul. Stronţiul şi bariul sub formă de săruri (azotaţi) se
folosesc în pirotehnie pentru rachete şi artificii. Radiul, datorită radiaţiilor gama pe care le emite, stă la baza
tratamentului de cancer.
Importanţa biologică
Calciul şi magneziul sunt elemente biofile cu rol important în biosferă. De exemplu, magneziul este:
substanţă nutritivă indispensabilă plantelor; se găseşte în clorofilă,
fiind generatorul de complex
(ligandul este un ciclu porfirinic); - participă în procesele biochimice, cum sunt: fotosinteza, metabolismul
glucidelor, proteinelor şi acizilor fosforici din organism; se găseşte în sol sub formă de carbonaţi şi sulfaţi, de
unde este luat de plante; este un component de bază al ţesutului celular şi se găseşte în lichidele tisulare;
sângele conţine 2-3mg Mg /100g sânge; se găseşte în muşchi, 23mg/100g ţesut (activator în reacţiile de
fosforilare din procesul de degradare al zaharurilor); La depăşirea concentraţiilor normale a Mg în sânge scade
excitabilitatea muşchilor şi nervilor, poate apărea anestezia şi paralizia muşchilor.
Din punct de vedere fiziologic
Be metalic şi combinaţiile lui sunt toxice, produc “beriloza”, care poate determina moartea;
Sărurile solubile de Ba sunt foarte toxice pentru om, animale şi plante, deoarece ionul Ba2+ provoacă
contracţia vaselor de sânge şi chiar oprirea inimii; doza letală este de 0,2g sare solubilă. În schimb BaSO4
insolubil nu este toxic, se foloseşte la radioscopia tubului digestiv.
14.
GRUPA III-a PRINCIPALĂCaracterizare generală
cuprinde elementele: B, Al, Ga, In şi Tl, care prezintă configuraţia ultimului strat electronic ns 2np1.
Exemplu pentru Tl, Z = 81: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p1.
Borul este un nemetal şi seamănă cu siliciul în proprietăţi, celelalte elemente sunt metale.
Aluminiul, galiul şi indiul formează în special ioni M3+; taliul formează ioni Tl+, iar borul nu formează ioni.
Legăurile chimice sunt tipic covalente pentru compuşii borului şi predominant ionice pentru compuşii
taliului. Aluminiul şi galiul sunt legate covalent în combinaţiile lor cu halogenii, azotul, carbonul şi electrovalent cu
oxigenul. În combinaţiile lor covalente borul, aluminiul şi galiul se caracterizează prin deficienţa în electroni la
atomul central, ceea ce determină structuri deosebite.
Starea naturală şi obţinere
Borul este puţin răspândit, se găseşte doar sub formă de combinaţii dintre care amintim: acidul boric
(H3BO3), kernitul (Na2B4O7 4H2O), din care se obţine boraxul (Na2B4O7 10H2O). În rocile magmatice este sub
formă de turmalină, aceasta prin alterare trece în soluţie ca acid boric şi boraţi, care apoi trec în roci sedimentare
de unde borul este transportat în biosferă. Aluminiul este metalul cel mai răspândit în scoarţa Pământului, al
treilea element după oxigen şi siliciu. Nu se găseşte liber ci numai sub formă de combinaţii cum sunt: silicaţii,
oxizii, hidroxizii, criolita - Na3[AlF6]. Galiul, indiul şi taliul sunt elemente rare şi disperse. Galiul însoţeşte uneori
aluminiul în bauxite; toate trei însoţesc zincul în blendă în proporţie mică.
t0C
B2I6
2B + 3I2
B2O3 + 3Mg
2B + 3MgO
3
2
BBr + 3/2H
B + 3HBr
+ sol. 40% NaOH
160-230 0C si 6-30 atm.
Na[Al(OH)4(H2O)2] + Na2SiO3
namoluri rosii care contin:
Fe2O3, TiO2, Ga2O3, NaAlSiO4
+H2O (hidroliza)
+
Al(OH)3
s palare, us care
calcinare
Al2O3
Na2Si2O5 + NaOH
(se recupereaza)
15.
GRUPA III-a PRINCIPALĂNa3[AlF6]
NaF
(-) 6Na+ + 2AlF3 (+) 6F - + Al2O3 -6e
3NaF + AlF3
Na+ + F -
2Al + 6NaF
3/2O2 + 2AlF3
Galiul se extrage din deşeurile de la fabricarea aluminei din bauxită sau din deşeurile metalurgiei Zn din
blende. Galiul metalic se obţine prin electroliza unei soluţii de Ga(OH)3 în NaOH sau prin reducerea Ga2O3 la 900
0C cu hidrogen: Ga O + 3H
2Ga + 3H2O
2 3
2
Indiul rămâne în coloana cu Pb topit la rafinarea zincului brut prin distilare. Indiul metalic se obţine prin
electroliza soluţiei de InCl3 (acidă) sau prin reducerea In2O3 cu H2, Mg sau C.
Purificarea prin procedee fizice, chimice, electrochimice.
Taliul se extrage din minereuri polimetalice de sulfuri, iar Tl metalic se obţine prin electroliza soluţiei apoase
de Tl2SO4 sau prin reducerea Tl2O3 sau Tl2O cu H2 sau CO.
Proprietăţi fizice
Borul cristalin are culoare cenuşie, aspect şi luciu metalic, este dur (9,3 pe scara Mohs) cu pt şi pf foarte
ridicate. Reţea atomică şi legături covalente între atomi. Are proprietăţi semiconductoare şi 4 modificări alotropice.
Aluminiul este un metal alb-argintiu, cristalizează în sistem cubic cu feţe centrate, maleabil, ductil. Are
conductibilitatea electrică şi termică mare după Ag şi Cu. [ pt = 660 0C; pf = 2450 0C.]
Galiul, indiul şi taliul sunt metale argintii, grele. Ga este sfărâmicios, In şi Tl sunt moi. Ga are pt foarte
scăzut, 29,8 0C şi cel de fierbere înalt, 2070 0C; se utilizează ca substanţă termometrică pentru termometre de
cuarţ (între 100-1000 0C).
Proprietăţi chimice
Borul în stare compactă reacţionează foarte greu, dar este reactiv în stare pulverizată şi la cald.
R.cu oxigenul:
4B + 3O2
2B2O3
R.cu azotul:
R.cu halogenii:
2B + 3Cl2
2BCl3
R.cu metalele:
R.cu hidroxizii alcalini:B + 3NaOH
Na3BO3 + 3/2H2
2B + N2
700 0C
Ca + 6B
R.cu acizii:
CaB6
B + 3HNO3
B
N5+
-3e +1e-
2BN
H3BO3 + 3NO2
3+
B
4+
N
oxidare
reducere
16.
GRUPA III-a PRINCIPALĂAluminiul
R.cu oxigenul:
2Al + 3/2O2
Cr2O3 + 2Al
Al2O3 3Mn3O4 + 8Al
3Fe3O4 + 8Al
2Cr + Al2O3
9Mn + 4Al2O3
+
+
+
+
3X2
3S(v)
N2
3C
2AlX3
Al2S3
2AlN
Al4C3
Al2S3 + 6H2O
AlN + 3H2O
Al4C3 + 12H2O
Al + NaOH + 5H2O
+6e+2e-3e-
2Mn 0
Mn 0
Al 3+
9Fe + 4Al2O3
R.cu acizii minerali:
R. la cald (700-2000 0C) sub formă de pulbere
cu halogenii, sulful, azotul şi carbonul
2Al
2Al
2Al
4Al
3
8
2Mn 3+
8
2+
3 Mn
Al
2Al(OH)3 + 3H2S
Al(OH)3 + NH3
4Al(OH)3 + 3CH4
2Al + 6HCl
2Al + 3H2SO4
Al2Cl6 + 3H2
Al2(SO4)3 + 3H2
Na[Al(OH)4(H2O)2] + 3/2H2
Galiul, indiul, taliul sunt metale active, în aer se acoperă cu un strat de oxid
de forma Ga2O3, In2O3, Tl2O. Toate formează combinaţii în starea de oxidare +3; galiul
poate fi şi bivalent, indiul mono- şi bivalent, iar taliul monovalent. La galiu şi indiu cea
mai stabilă este starea de oxidare +3, iar la taliu +1.
Proprietăţile chimice ale galiului şi indiului se aseamănă cu ale aluminiului.
Ga(OH)3 este amfoter, In(OH)3 este bazic. Galiul este pasivizat de acidul azotic
concentrat; taliul se dizolvă uşor în acidul azotic şi mai greu în acidul sulfuric.
17.
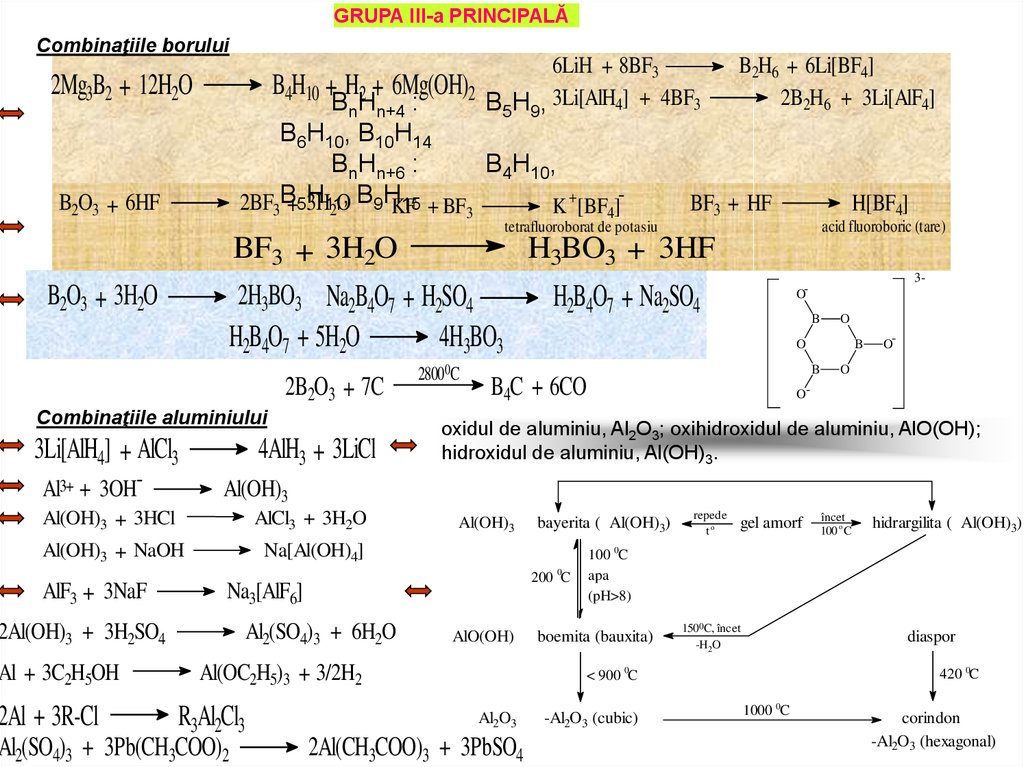
GRUPA III-a PRINCIPALĂCombinaţiile borului
2Mg3B2 + 12H2O
B4H10 + H2 + 6Mg(OH)2
BnHn+4 :
B6H10, B10H14
BnHn+6 :
B4H10,
, B H15 + BF
2BF3B+5H
3H11
K +[BF ]
2O 9 KF
B2O3 + 6HF
3
2B2O3 + 7C
Combinaţiile aluminiului
3Li[AlH4] + AlCl3
Al3+ + 3OH-
4AlH3 + 3LiCl
AlCl3 + 3H2O
Al(OH)3 + NaOH
Na[Al(OH)4]
28000C
H[BF4]
acid fluoroboric (tare)
3-
OB
O
O
B
B
B4C + 6CO
O-
O
O-
oxidul de aluminiu, Al2O3; oxihidroxidul de aluminiu, AlO(OH);
hidroxidul de aluminiu, Al(OH)3.
Al(OH)3
Al2(SO4)3 + 6H2O
AlO(OH)
Al(OC2H5)3 + 3/2H2
R3Al2Cl3
Al2(SO4)3 + 3Pb(CH3COO)2
bayerita ( Al(OH)3)
200 0C
Na3[AlF6]
2Al(OH)3 + 3H2SO4
2Al + 3R-Cl
BF3 + HF
Al(OH)3
Al(OH)3 + 3HCl
Al + 3C2H5OH
4
tetrafluoroborat de potasiu
B2H6 + 6Li[BF4]
2B2H6 + 3Li[AlF4]
BF3 + 3H2O
H3BO3 + 3HF
2H3BO3 Na2B4O7 + H2SO4
H2B4O7 + Na2SO4
H2B4O7 + 5H2O
4H3BO3
B2O3 + 3H2O
AlF3 + 3NaF
6LiH + 8BF3
B5H9, 3Li[AlH4] + 4BF3
repede
to
gel amorf
2Al(CH3COO)3 + 3PbSO4
hidrargilita ( Al(OH)3)
100 0C
apa
(pH>8)
boemita (bauxita)
150 0C, încet
-H2 O
diaspor
< 900 0C
Al2O3
încet
100 o C
-Al2O3 (cubic)
420 0C
1000 0C
corindon
-Al2O3 (hexagonal)
18.
GRUPA III-a PRINCIPALĂCombinaţiile galiului
Se cunoaşte hidrura de galiu, (GaH3)n, care probabil este un polimer. Dintre combinaţiile galiului (III) enumerăm
GaCl3, Ga(OH)3, Ga2S3, Ga2(SO4)3 18H2O şi Ga2O3, iar pentru galiu (II) GaCl2, GaO.
Combinaţiile indiului
Cele mai stabile combinaţii sunt ale indiului (III), de exemplu: InCl 3, In(OH)3, In2O3, In2S3.
2InCl2
InCl + InCl3
Combinaţiile în stările (II) şi (I) sunt instabile ceea ce rezultă din reacţiile de oxido-reducere:
3InCl
2In + InCl3
Combinaţiile taliului
Combinaţiile taliului (I) sunt cele mai stabile: TlNO3, Tl2SO4, TlX (X: Cl, Br, F şi I), Tl2S, TlOH, Tl2O.
Combinaţiile taliului (III) se reduc uşor la combinaţiile taliului (I), deci au proprietăţi oxidante: TlCl3, TlBr3,
Tl(OH)3, Tl2O3, TlH(SO4)2 4H2O.
Combinaţiile taliului sunt toxice, de exemplu Tl2(SO4)3 se foloseşte ca otravă pentru şobolani.
Întrebuinţări
Borul este un element de aliere pentru oţelurile speciale, mărindu-le rezistenţa şi duritatea. În tehnica nucleară este
folosit ca adsorbant pentru neutroni.
Aluminiul este folosit pentru cabluri şi aparate electrice, în aluminotermie pentru obţinerea metalelor şi aliajelor. Este
important ca element de aliere (exemplu: duraluminiul). Foiţa de 0,005mm este folosită pentru ambalaje.
Galiul, indiul şi taliul sunt importante elemente de aliere. Galiul şi indiul se folosesc pentru oglinzi în locul argintului.
Galiul este utilizat ca agent de transfer de căldură în reactoarele nucleare şi la confecţionarea termometrelor pentru temperaturi
înalte. Indiul ca detector de neutroni, ca aliaje şi pentru combinaţii semiconductoare. Taliul este material semiconductor.
Compuşii pentru toate aceste elemente se folosesc drept catalizatori.
Importanţa biologică
Borul este un element necesar pentru plante la dezvoltarea lor (algele marine), are rol în fotosinteză şi în formarea
florilor; absenţa lui în plante provoacă boli ale acestora. Ajută la accelerarea procesului de nitrificare în sol; absenţa lui în sol
este compensată prin îngrăşăminte care conţin bor sub formă de acid boric sau borax. Este prezent şi în organismul animal:
corali, spongieri silicioşi.
Atât borul cât şi combinaţiile lui devin toxice prin asimilare îndelungată de către organismul uman. Combinaţii
ca: boranii, fluorura de bor, acidul boric, provoacă intoxicaţii acute; de exemplu, 15-20g de H3BO3 provoacă moartea unui om
adult (acţionează asupra plămânilor şi sistemului nervos).
Aluminiul se găseşte în sol sub formă greu solubilă şi este larg răspândit în toate organismele, dar nu este un
constituent important.Este un element esenţial pentru plantele superioare, unele dintre ele îl acumulează (de exemplu: arborele
Orites excelsa conţine în tulpină succinat bazic de aluminiu), iar diatomeele descompun mineralele argiloase.













 chemistry
chemistry








