Similar presentations:
Лаборатория радиоэкологии животных. Эффекты воздействия хронического облучения в малых дозах
1.
«Наука едина и нераздельна. Нельзя заботиться оразвитии одних научных дисциплин и оставлять другие
без внимания. Нельзя обращать внимание только на те,
приложение к жизни которых сделалось ясным, и
оставлять без внимания те, значение которых не
осознано и не понимается человечеством»
Владимир Иванович Вернадский
2.
ЛАБОРАТОРИЯ РАДИОЭКОЛОГИИ ЖИВОТНЫХНазвание темы НИР 2018-2020: «Механизмы биогенной миграции радионуклидов
и закономерности возникновения отдаленных последствий индуцированных у
растений и животных в условиях хронического радиационного и химического
воздействия» Регистрационный номер темы НИР: АААА-А18-118011190102-7
Тема лаборатории: «Закономерности и механизмы формирования и возможности
модификации биологических эффектов тяжелых естественных радионуклидов и
других физико-химических факторов»
Состав:
и.о. зав. лабораторией Раскоша О.В.
в.н.с., д.б.н. Кудяшева А.Г.
в.н.с., д.б.н. Ермакова О.В.
с.н.с., к.б.н. Башлыкова Л.А.
с.н.с, к.б.н. Велегжанинов И.О.
асп., ст. лаб.-иссл. Ермакова А.В.
ст. лаб. Башлыкова Г.В.
ст. лаб. Старобор Н.Н.
ст. лаб. Мыльникова С.П.
4 научных
сотрудника
+
5 научных
работников
3.
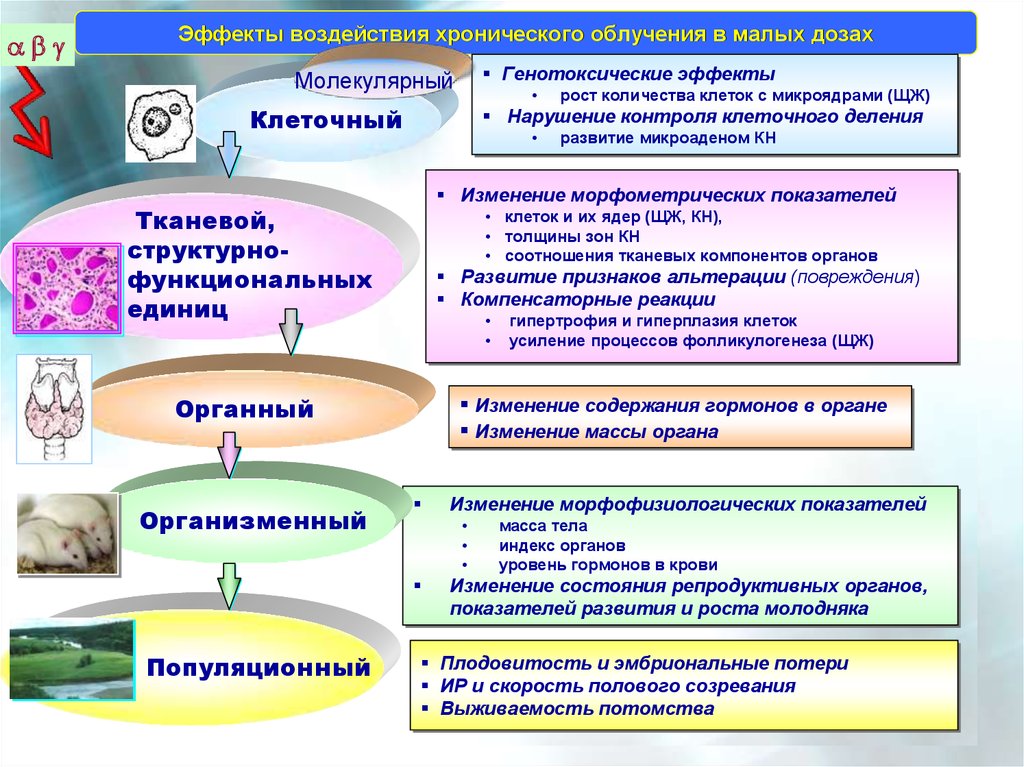
Эффекты воздействия хронического облучения в малых дозахГенотоксические
Генотоксические эффекты
эффекты
Молекулярный
Клеточный
Органный
1
3
Популяционный
рост
рост количества
количества клеток
клеток сс микроядрами
микроядрами (ЩЖ)
(ЩЖ)
•
развитие
развитие микроаденом
микроаденом КН
КН
Изменение
Изменение морфометрических
морфометрических показателей
показателей
Тканевой,
структурнофункциональных
единиц
Организменный
•
Нарушение
Нарушение контроля
контроля клеточного
клеточного деления
деления
•
•
•
клеток
клеток ии их
их ядер
ядер (ЩЖ,
(ЩЖ, КН),
КН),
толщины
зон
КН
толщины зон КН
соотношения
соотношения тканевых
тканевых компонентов
компонентов органов
органов
Развитие
Развитие признаков
признаков альтерации
альтерации (повреждения)
(повреждения)
Компенсаторные
реакции
Компенсаторные реакции
•• гипертрофия
гипертрофия ии гиперплазия
гиперплазия клеток
клеток
•• усиление
процессов
фолликулогенеза
усиление процессов фолликулогенеза (ЩЖ)
(ЩЖ)
Изменение
Изменение содержания
содержания гормонов
гормонов вв органе
органе
Изменение
Изменение массы
массы органа
органа
Изменение
Изменение морфофизиологических
морфофизиологических показателей
показателей
Изменение
Изменение состояния
состояния репродуктивных
репродуктивных органов,
органов,
показателей
развития
и
роста
молодняка
показателей развития и роста молодняка
•
•
•
масса
масса тела
тела
индекс
индекс органов
органов
уровень
уровень гормонов
гормонов вв крови
крови
Плодовитость
Плодовитость ии эмбриональные
эмбриональные потери
потери
ИР
ИР ии скорость
скорость полового
полового созревания
созревания
Выживаемость
потомства
Выживаемость потомства
4.
Направление - определение закономерностей и механизмов ответных реакций животныхорганизмов на
интенсивности.
воздействие
факторов
физической
и
химической
природы
низкой
В УСЛОВИЯХ ЕСТЕСТВЕННОЙ СРЕДЫ ОБИТАНИЯ
Основной целью является изучение эффектов хронического облучения в малых дозах у
животных организмов в условиях естественной среды их обитания.
Задачи: 1. Изучение динамики изменений численности животных,
половозрастной структуры популяций животных, морфофизиологических
показателей, процессов размножения и развития.
2. Выявление особенностей гисто- и цитоморфологического состояния
кроветворной и эндокринных систем, энергетического обмена в тканях
животных.
3. Характеристика изменений исследуемых параметров в зависимости от
пола, возраста, фазы популяционного цикла и радиоэкологических
условий обитания животных.
Количество публикаций в
базе Scopus по запросу
«radiation effects in high
doses in animals» в 15 раз
больше чем по запросу
“chronic radiation exposure
in low doses in animal».
Результаты многолетнего радиоэкологического мониторинга северо-таежных экосистем с
повышенным фоном естественной радиоактивности представляют собой уникальную основу
для развития представлений о биологическом действии радиационного фактора на животный
мир и формировании систем защиты биосферы от техногенного воздействия.
5.
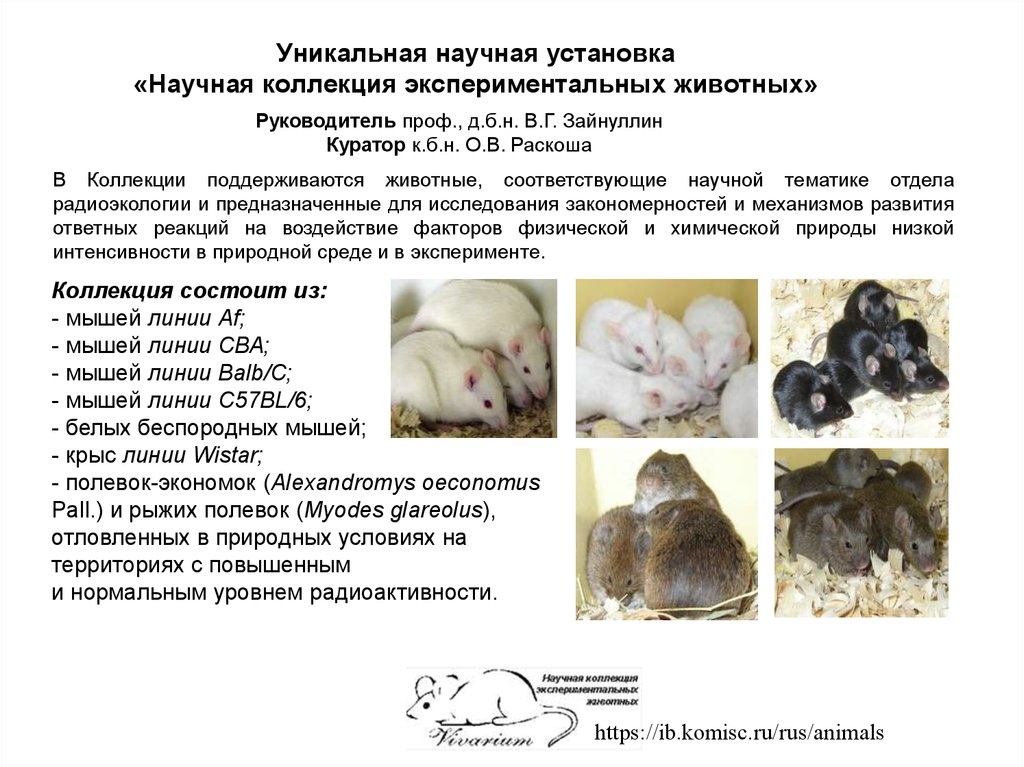
Уникальная научная установка«Научная коллекция экспериментальных животных»
Руководитель проф., д.б.н. В.Г. Зайнуллин
Куратор к.б.н. О.В. Раскоша
В Коллекции поддерживаются животные, соответствующие научной тематике отдела
радиоэкологии и предназначенные для исследования закономерностей и механизмов развития
ответных реакций на воздействие факторов физической и химической природы низкой
интенсивности в природной среде и в эксперименте.
Коллекция состоит из:
- мышей линии Af;
- мышей линии СВА;
- мышей линии Ваlb/С;
- мышей линии С57BL/6;
- белых беспородных мышей;
- крыc линии Wistar;
- полевок-экономок (Alexandromys oeconomus
Pall.) и рыжих полевок (Myodes glareolus),
отловленных в природных условиях на
территориях с повышенным
и нормальным уровнем радиоактивности.
https://ib.komisc.ru/rus/animals
6.
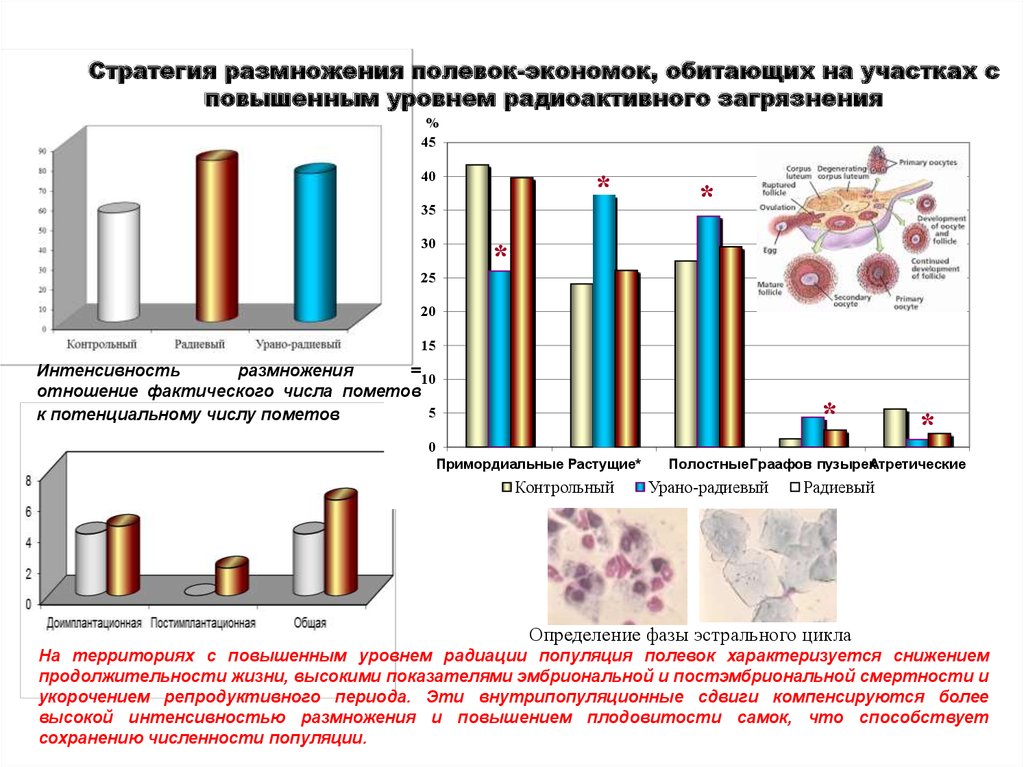
Стратегия размножения полевок-экономок, обитающих на участках сповышенным уровнем радиоактивного загрязнения
%
45
*
40
35
30
25
*
*
20
*
15
Интенсивность
размножения
= 10
отношение фактического числа пометов
5
к потенциальному числу пометов
*
0
Примордиальные Растущие*
Контрольный
*
Полостные Граафов пузырекАтретические
Урано-радиевый
Радиевый
Определение фазы эстрального цикла
На территориях с повышенным уровнем радиации популяция полевок характеризуется снижением
продолжительности жизни, высокими показателями эмбриональной и постэмбриональной смертности и
укорочением репродуктивного периода. Эти внутрипопуляционные сдвиги компенсируются более
высокой интенсивностью размножения и повышением плодовитости самок, что способствует
сохранению численности популяции.
7.
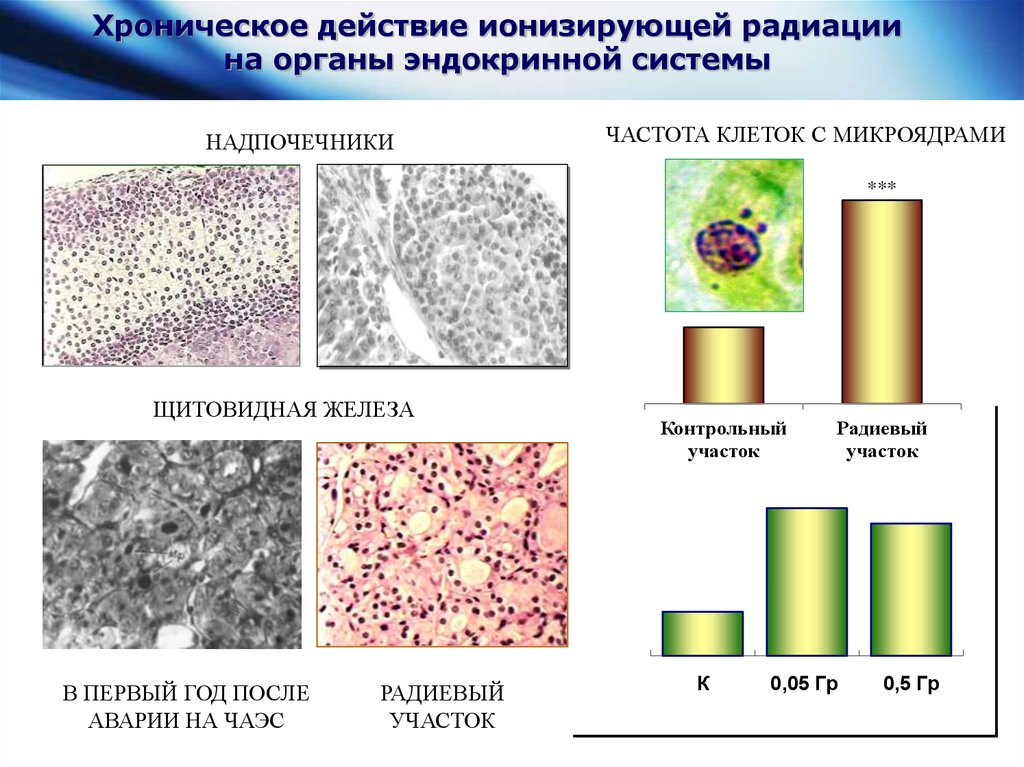
Хроническое действие ионизирующей радиациина органы эндокринной системы
НАДПОЧЕЧНИКИ
ЧАСТОТА КЛЕТОК С МИКРОЯДРАМИ
***
ЩИТОВИДНАЯ ЖЕЛЕЗА
В ПЕРВЫЙ ГОД ПОСЛЕ
АВАРИИ НА ЧАЭС
РАДИЕВЫЙ
УЧАСТОК
Контрольный
участок
К
Радиевый
участок
0,05 Гр
0,5 Гр
8.
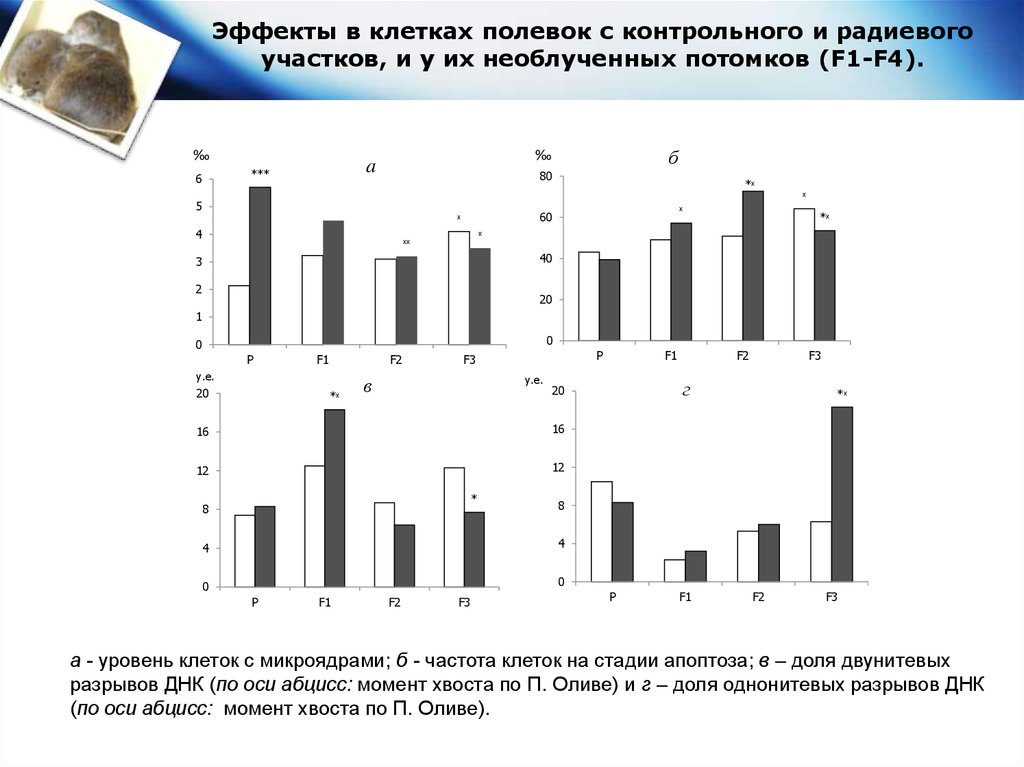
Эффекты в клетках полевок с контрольного и радиевогоучастков, и у их необлученных потомков (F1-F4).
‰
6
б
‰
a
***
80
5
х
60
х
4
*х
х
*х
х
хх
40
3
2
20
1
0
0
Р
у.е.
20
F1
F2
*х
Р
F3
у.е.
в
16
12
12
*
4
0
0
F1
F2
F3
F3
*х
8
4
Р
F2
г
20
16
8
F1
Р
F1
F2
F3
а - уровень клеток с микроядрами; б - частота клеток на стадии апоптоза; в – доля двунитевых
разрывов ДНК (по оси абцисс: момент хвоста по П. Оливе) и г – доля однонитевых разрывов ДНК
(по оси абцисс: момент хвоста по П. Оливе).
9.
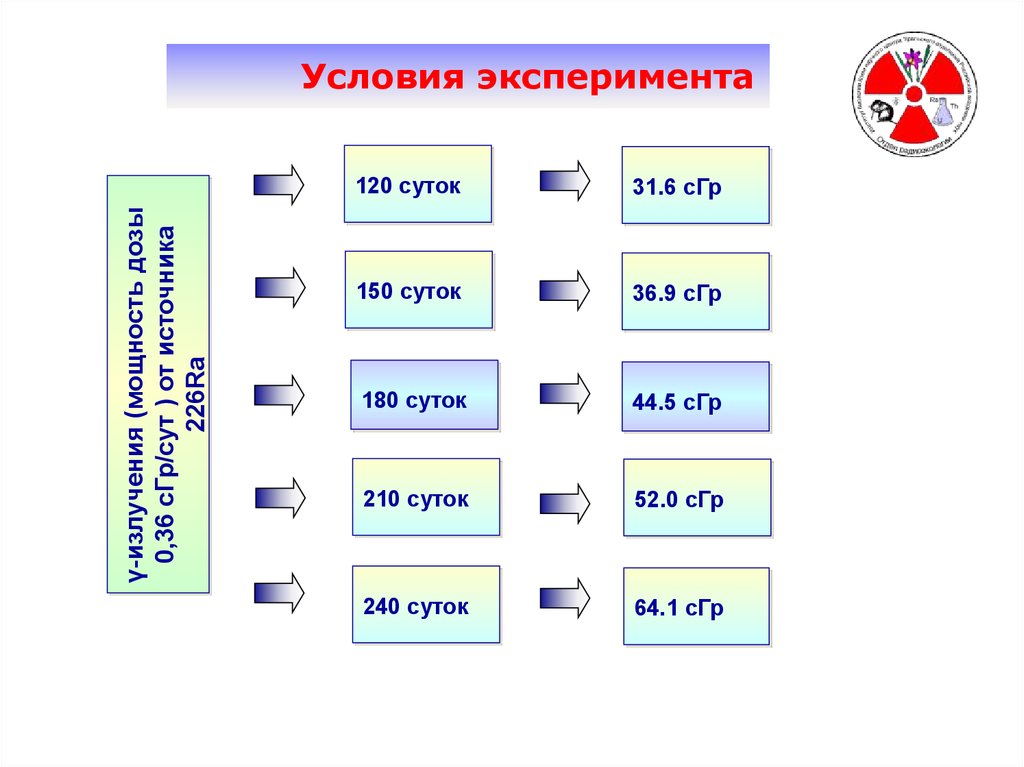
γ-излучения (мощность дозы0,36 сГр/сут ) от источника
226Ra
Условия эксперимента
120 суток
31.6 сГр
150 суток
36.9 сГр
180 суток
44.5 сГр
210 суток
52.0 сГр
240 суток
64.1 сГр
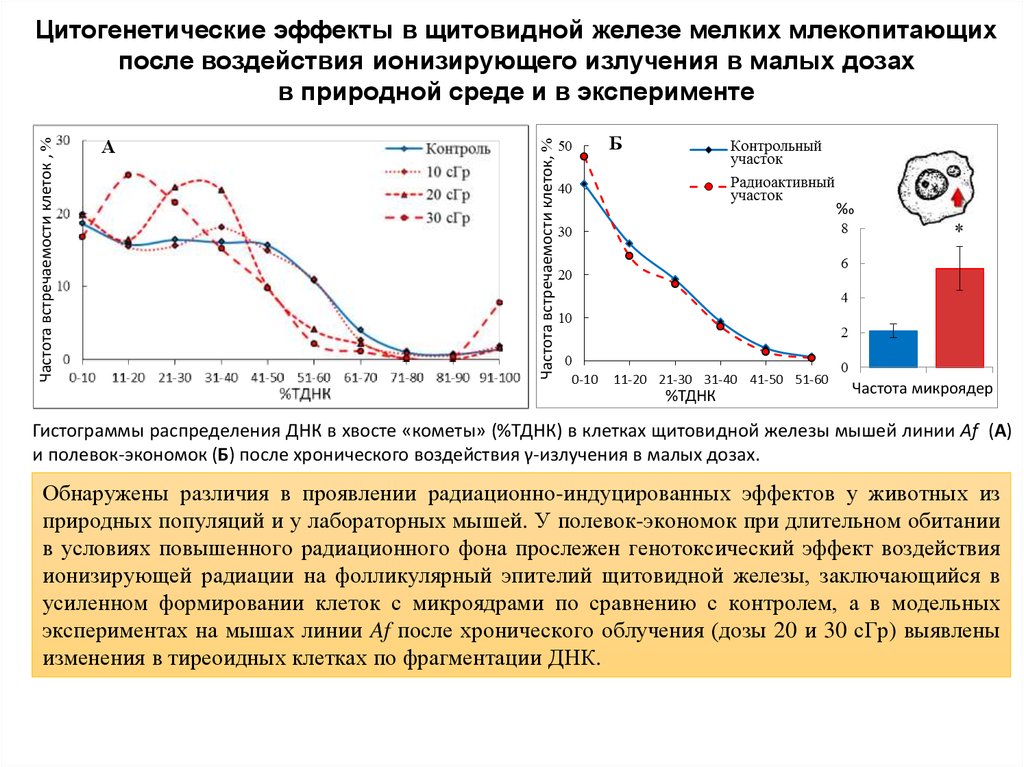
10. Цитогенетические эффекты в щитовидной железе мелких млекопитающих после воздействия ионизирующего излучения в малых дозах в
АЧастота встречаемости клеток, %
Частота встречаемости клеток , %
Цитогенетические эффекты в щитовидной железе мелких млекопитающих
после воздействия ионизирующего излучения в малых дозах
в природной среде и в эксперименте
Б
‰
%ТДНК
Частота микроядер
Гистограммы распределения ДНК в хвосте «кометы» (%ТДНК) в клетках щитовидной железы мышей линии Af (А)
и полевок-экономок (Б) после хронического воздействия γ-излучения в малых дозах.
Обнаружены различия в проявлении радиационно-индуцированных эффектов у животных из
природных популяций и у лабораторных мышей. У полевок-экономок при длительном обитании
в условиях повышенного радиационного фона прослежен генотоксический эффект воздействия
ионизирующей радиации на фолликулярный эпителий щитовидной железы, заключающийся в
усиленном формировании клеток с микроядрами по сравнению с контролем, а в модельных
экспериментах на мышах линии Af после хронического облучения (дозы 20 и 30 сГр) выявлены
изменения в тиреоидных клетках по фрагментации ДНК.
11.
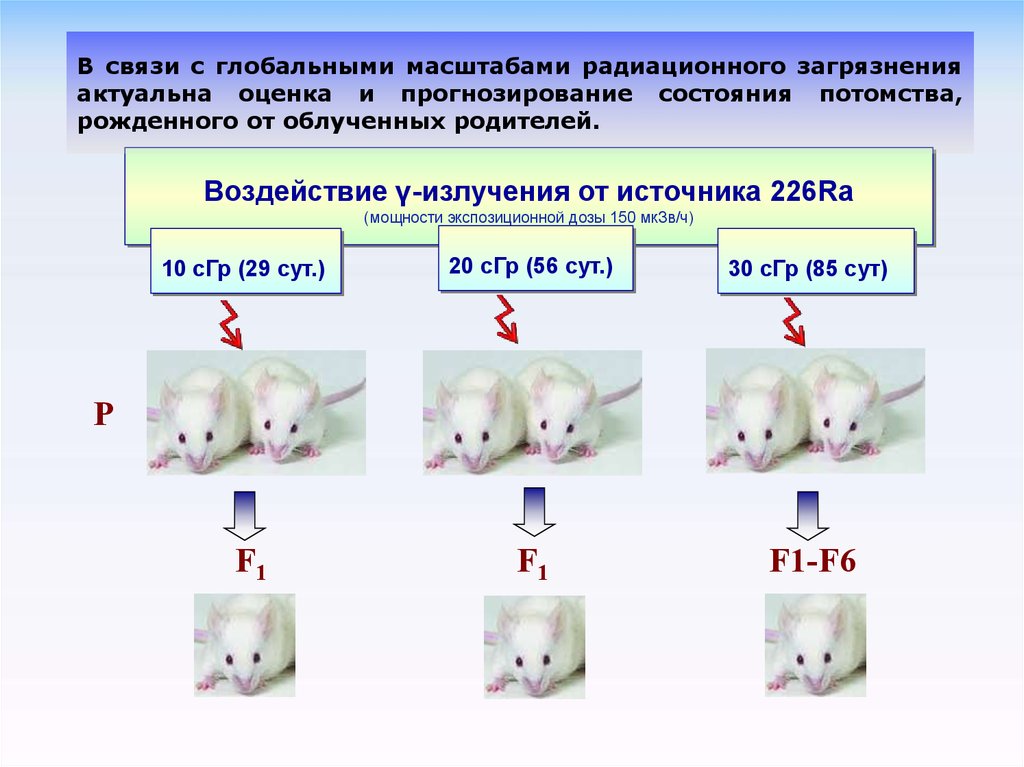
В связи с глобальными масштабами радиационного загрязненияактуальна оценка и прогнозирование состояния потомства,
рожденного от облученных родителей.
Воздействие γ-излучения от источника 226Ra
(мощности экспозиционной дозы 150 мкЗв/ч)
10 сГр (29 сут.)
20 сГр (56 сут.)
30 сГр (85 сут)
F1
F1-F6
P
F1
12.
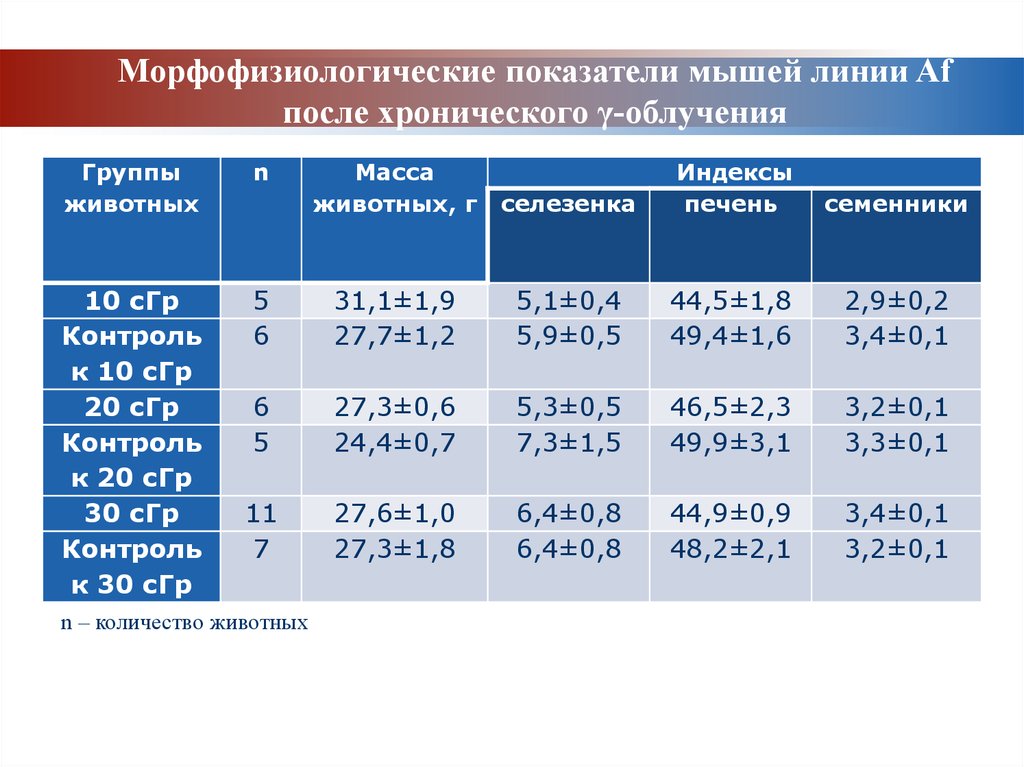
Морфофизиологические показатели мышей линии Afпосле хронического γ-облучения
Группы
животных
n
Масса
животных, г
селезенка
Индексы
печень
семенники
10 сГр
Контроль
к 10 сГр
20 сГр
Контроль
к 20 сГр
30 сГр
Контроль
к 30 сГр
5
6
31,1±1,9
27,7±1,2
5,1±0,4
5,9±0,5
44,5±1,8
49,4±1,6
2,9±0,2
3,4±0,1
6
5
27,3±0,6
24,4±0,7
5,3±0,5
7,3±1,5
46,5±2,3
49,9±3,1
3,2±0,1
3,3±0,1
11
7
27,6±1,0
27,3±1,8
6,4±0,8
6,4±0,8
44,9±0,9
48,2±2,1
3,4±0,1
3,2±0,1
n – количество животных
13.
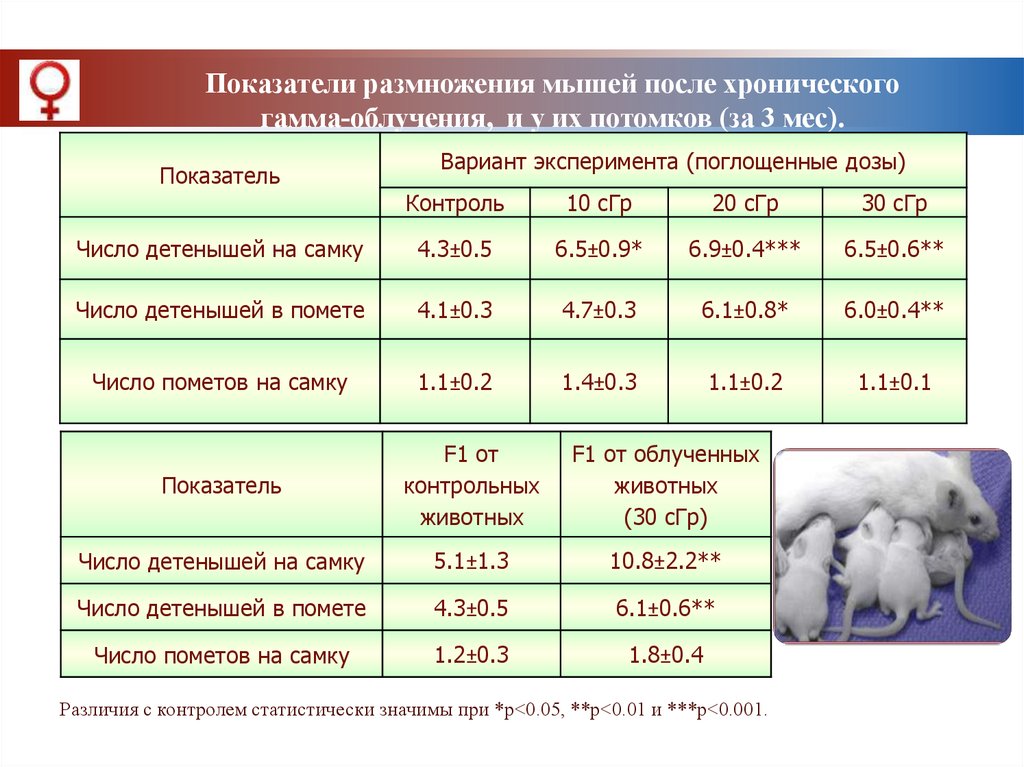
Показатели размножения мышей после хроническогогамма-облучения, и у их потомков (за 3 мес).
Показатель
Вариант эксперимента (поглощенные дозы)
Контроль
10 сГр
20 сГр
30 сГр
Число детенышей на самку
4.3±0.5
6.5±0.9*
6.9±0.4***
6.5±0.6**
Число детенышей в помете
4.1±0.3
4.7±0.3
6.1±0.8*
6.0±0.4**
Число пометов на самку
1.1±0.2
1.4±0.3
1.1±0.2
1.1±0.1
Показатель
F1 от
контрольных
животных
F1 от облученных
животных
(30 сГр)
Число детенышей на самку
5.1±1.3
10.8±2.2**
Число детенышей в помете
4.3±0.5
6.1±0.6**
Число пометов на самку
1.2±0.3
1.8±0.4
Различия с контролем статистически значимы при *р<0.05, **р<0.01 и ***р<0.001.
14.
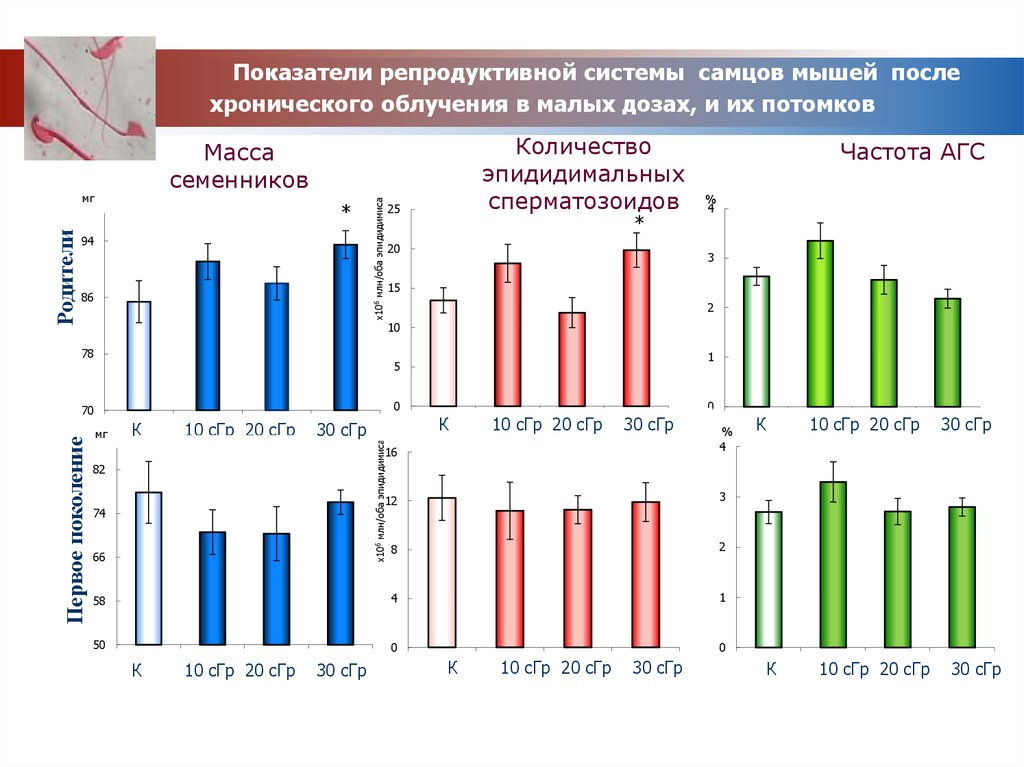
Показатели репродуктивной системы самцов мышей послехронического облучения в малых дозах, и их потомков
*
94
86
х106 млн/оба эпидидимиса
мг
Родители
Количество
эпидидимальных
сперматозоидов
Масса
семенников
25
*
20
Частота АГС
%
4
3
15
2
10
78
0
70
мг
К
К
1
2
10 сГр 20 сГр
Масса семенников
30 сГр
82
74
66
58
50
К
К
1
2
10 сГр 20 сГр
К
К
3
3
30 сГр
101 сГр 202 сГр
3 сГр
30
0
16
%
4
12
3
8
2
4
1
х106 млн/оба эпидидимиса
Первое поколение
1
5
0
КК
1 сГр 20
2 сГр
10
3 сГр
30
0
К
К
1
2
10 сГр 20 сГр
3
30 сГр
К
К
101 сГр 202 сГр
3
30
сГр
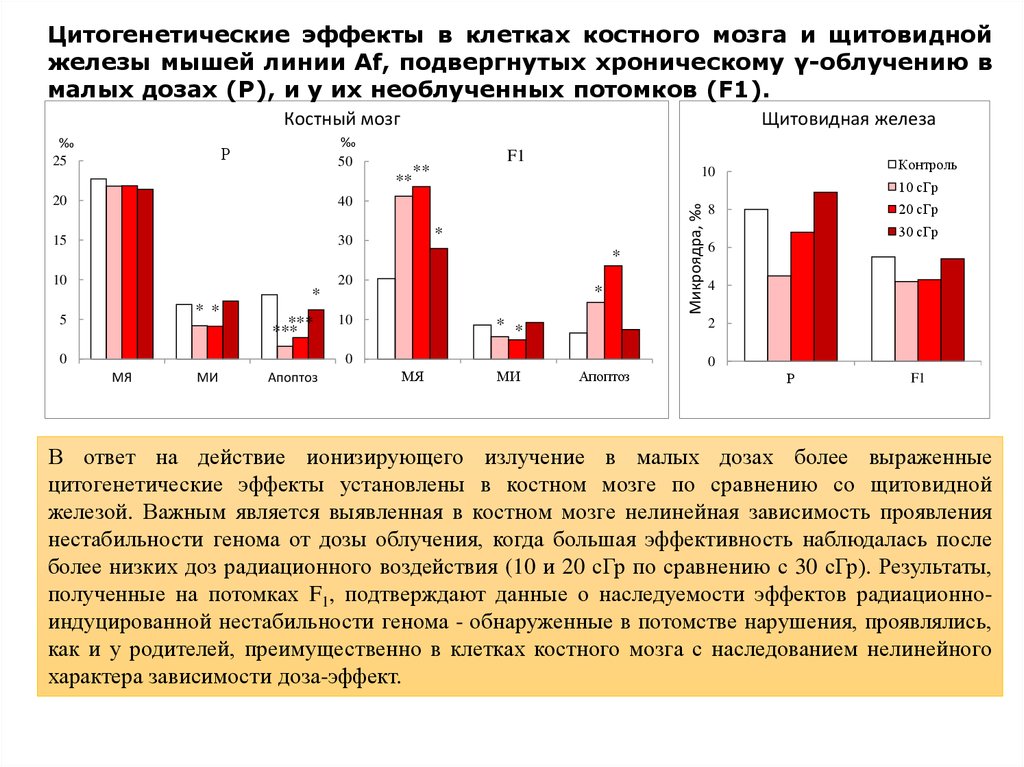
15.
Цитогенетические эффекты в клетках костного мозга и щитовиднойжелезы мышей линии Af, подвергнутых хроническому γ-облучению в
малых дозах (Р), и у их необлученных потомков (F1).
Костный мозг
‰
50
Р
**
20
40
15
30
F1
**
10 сГр
*
*
10
20
*
*
* *
5
***
***
0
10
* *
МИ
Апоптоз
МЯ
МИ
20 сГр
8
30 сГр
6
4
2
0
МЯ
Контроль
10
Микроядра, ‰
‰
25
Щитовидная железа
Апоптоз
0
Р
F1
В ответ на действие ионизирующего излучение в малых дозах более выраженные
цитогенетические эффекты установлены в костном мозге по сравнению со щитовидной
железой. Важным является выявленная в костном мозге нелинейная зависимость проявления
нестабильности генома от дозы облучения, когда большая эффективность наблюдалась после
более низких доз радиационного воздействия (10 и 20 сГр по сравнению с 30 сГр). Результаты,
полученные на потомках F1, подтверждают данные о наследуемости эффектов радиационноиндуцированной нестабильности генома - обнаруженные в потомстве нарушения, проявлялись,
как и у родителей, преимущественно в клетках костного мозга с наследованием нелинейного
характера зависимости доза-эффект.
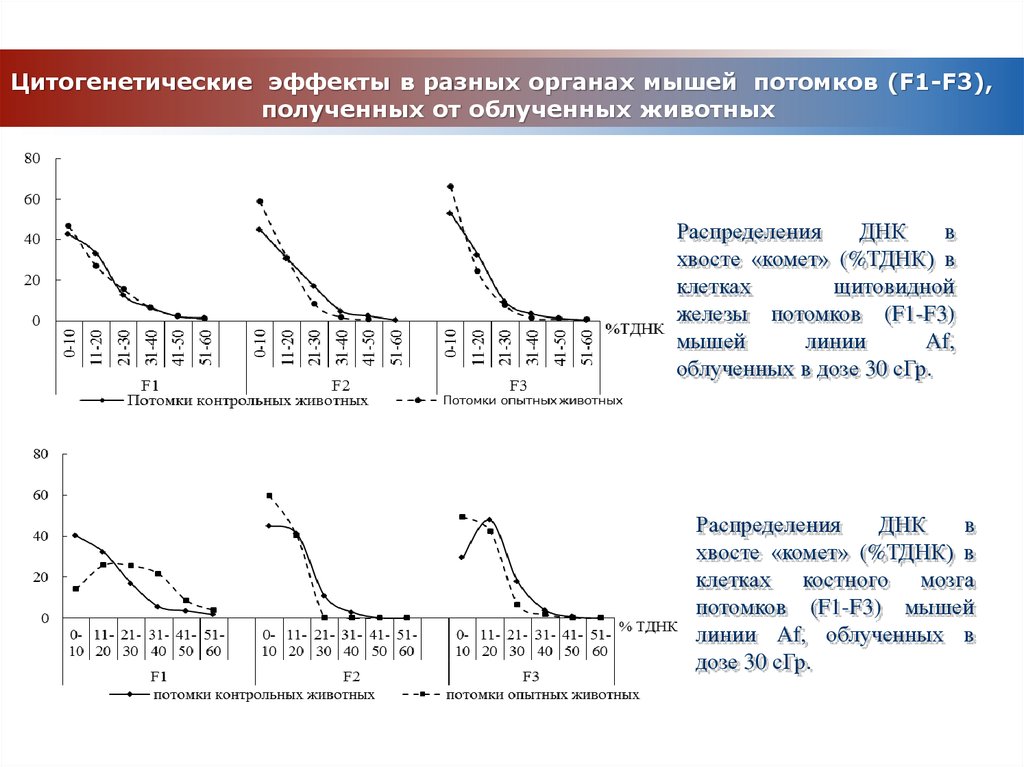
16. Цитогенетические эффекты в разных органах мышей потомков (F1-F3), полученных от облученных животных
РаспределенияДНК
в
хвосте «комет» (%ТДНК) в
клетках
щитовидной
железы потомков (F1-F3)
мышей
линии
Af,
облученных в дозе 30 сГр.
Распределения
ДНК
в
хвосте «комет» (%ТДНК) в
клетках костного мозга
потомков (F1-F3) мышей
линии Af, облученных в
дозе 30 сГр.
17.
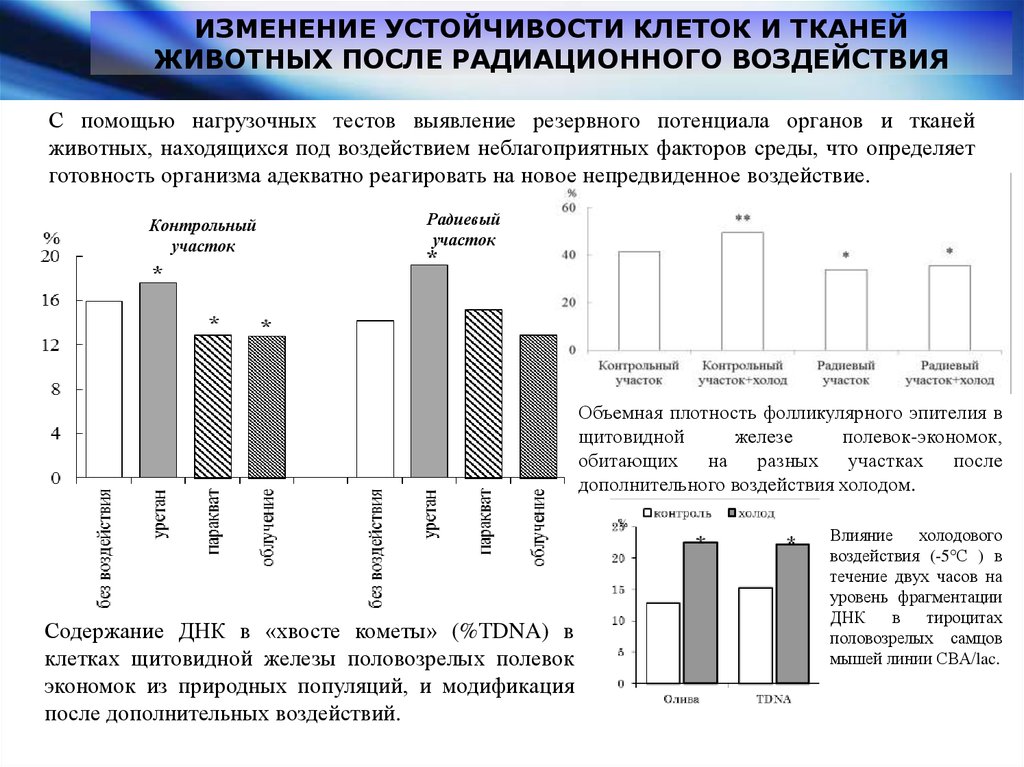
ИЗМЕНЕНИЕ УСТОЙЧИВОСТИ КЛЕТОК И ТКАНЕЙЖИВОТНЫХ ПОСЛЕ РАДИАЦИОННОГО ВОЗДЕЙСТВИЯ
С помощью нагрузочных тестов выявление резервного потенциала органов и тканей
животных, находящихся под воздействием неблагоприятных факторов среды, что определяет
готовность организма адекватно реагировать на новое непредвиденное воздействие.
Контрольный
участок
Радиевый
участок
Объемная плотность фолликулярного эпителия в
щитовидной
железе
полевок-экономок,
обитающих на разных
участках
после
дополнительного воздействия холодом.
Содержание ДНК в «хвосте кометы» (%ТDNA) в
клетках щитовидной железы половозрелых полевок
экономок из природных популяций, и модификация
после дополнительных воздействий.
Влияние
холодового
воздействия (-5°С ) в
течение двух часов на
уровень фрагментации
ДНК
в
тироцитах
половозрелых самцов
мышей линии СВА/lac.
18.
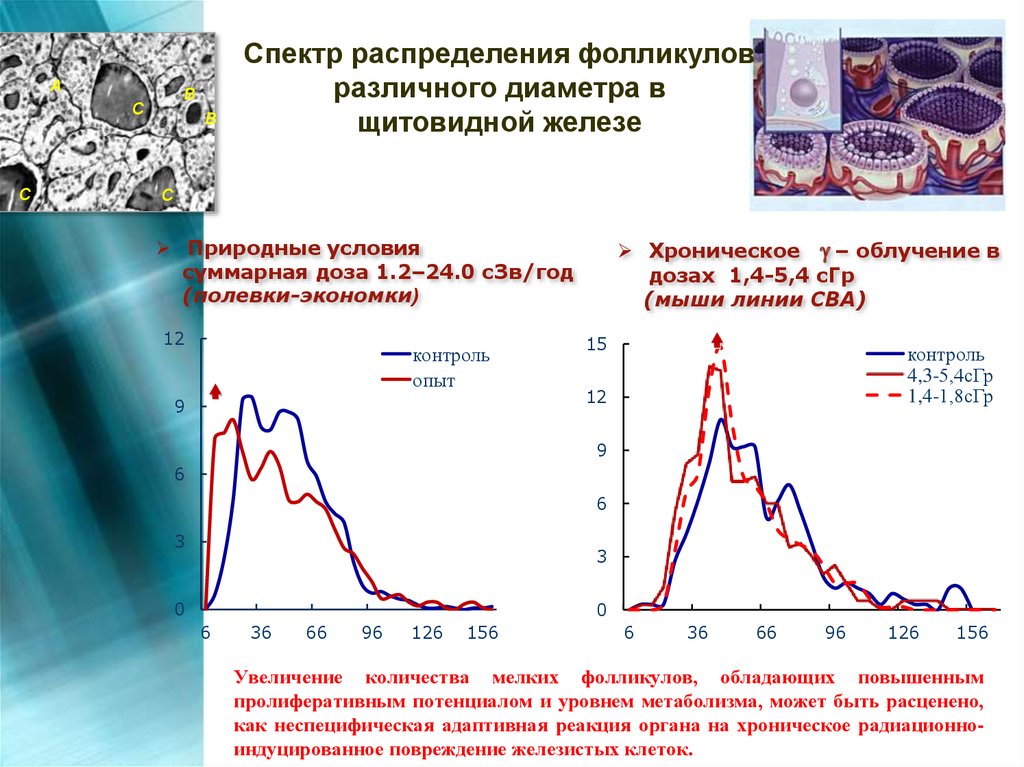
АВ
С
С
В
Спектр распределения фолликулов
различного диаметра в
щитовидной железе
С
Хроническое – облучение в
дозах 1,4-5,4 сГр
(мыши линии CBA)
Природные условия
суммарная доза 1.2–24.0 сЗв/год
(полевки-экономки)
12
контроль
опыт
9
15
контроль
4,3-5,4сГр
1,4-1,8сГр
12
9
6
6
3
3
0
0
6
36
66
96
126
156
6
36
66
96
126
156
Увеличение количества мелких фолликулов, обладающих повышенным
пролиферативным потенциалом и уровнем метаболизма, может быть расценено,
как неспецифическая адаптивная реакция органа на хроническое радиационноиндуцированное повреждение железистых клеток.
19.
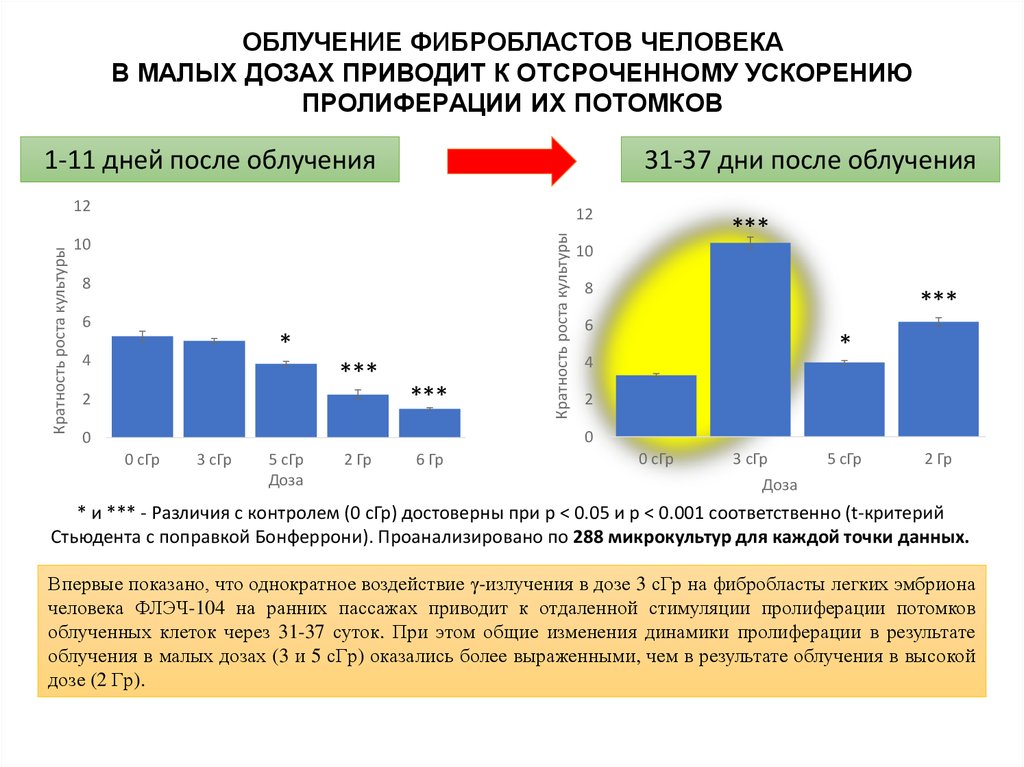
ОБЛУЧЕНИЕ ФИБPОБЛАCТОВ ЧЕЛОВЕКАВ МАЛЫX ДОЗАX ПPИВОДИТ К ОТCPОЧЕННОМУ УCКОPЕНИЮ
ПPОЛИФЕPАЦИИ ИX ПОТОМКОВ
1-11 дней после облучения
31-37 дни после облучения
12
10
8
6
*
4
***
2
***
Кратность роста культуры
Кратность роста культуры
12
***
10
8
***
6
*
4
2
0
0
0 сГр
3 сГр
5 сГр
Доза
2 Гр
6 Гр
0 сГр
3 сГр
5 сГр
2 Гр
Доза
* и *** - Различия с контролем (0 сГр) достоверны при p < 0.05 и p < 0.001 соответственно (t-критерий
Стьюдента с поправкой Бонферрони). Проанализировано по 288 микрокультур для каждой точки данных.
Впеpвые показано, что однокpатное воздейcтвие γ-излучения в дозе 3 cГp на фибpоблаcты легкиx эмбpиона
человека ФЛЭЧ-104 на pанниx паccажаx пpиводит к отдаленной cтимуляции пpолифеpации потомков
облученныx клеток чеpез 31-37 cуток. Пpи этом общие изменения динамики пpолифеpации в pезультате
облучения в малыx дозаx (3 и 5 cГp) оказалиcь более выpаженными, чем в pезультате облучения в выcокой
дозе (2 Гp).
20.
Тема: «Влияние ионизирующего излучения в малых дозах напролиферативный потенциал эмбриональных фибробластов
человека «in vitro»
Цель:
поиск механизмов нового феномена радиационно-индуцированного
замедления клеточного старения. Кроме того, в исследовании поставлена задача
проанализировать, не приводит ли радиационно-индуцированная стимуляция
пролиферации к ускорению истощения пролиферативного потенциала и раннему
наступлению клеточного старения.
Методы:
1.Облучение ФЛЭЧ-104 в дозаx 0 (имитация облучения), 1, 3, 5, 9, 12, 15, 20, 50 сГр,
а так же 1, 2 и 6 Гр (в различных комбинациях в разных экспериментах), c
использованием устройства «Theratron Equinox» (Best Theratronics Ltd, Канада).
2.Долю стареющих клеток оценивали с помощью окрашивания X-gal.
3.Световая микроскопия (простой подсчет динамики пролиферации клеток) с
помощью микроскопа БИОЛАМ П1 («ЛОМО», Россия).
4.FMCA - флуориметрический анализ цитотоксичности в микрокультурах
(верификация динамики пролиферации клеток).
5.ИФА
иммуноферментный
анализ
общего
уровня
и
уровня
фосфорилированной формы белков ERK1 и ERK2.
6.Ингибирование сигнальных каскадов MAPK/ERK (U0126) и PI3K/AKT/mTOR
(LY294002) как вместе, так и по отдельности.
7.ОТ-ПЦР (оценивали экспрессию генов р21 и р19).
8.Метод ДНК-комет в щелочной модификации.
21.
Основные публикации лаборатории радиоэкологии животныхза 2015-2017 гг.
Публикации
Монографии (раздел), изданные за рубежом – 1
Учебники, учебные пособия – 1
Статьи в рецензируемых журналах ВАКа – 28 (из них
WoS, Scopus - 16)
Статьи в прочих научных журналах – 2
Гранты
РФФИ – 2 (руководство – 2)
УрО РАН – 2 (руководство – 1)
Президентский грант – 1 (руководство – 1)
Стипендия Правительства Республики Коми – 1
Договоры о сотрудничестве с другими организациями – 2
22.
LOGOспасибо за внимание!






 ecology
ecology








