Similar presentations:
Благородные металлы
1. Благородные металлы
БЛАГОРОДНЫЕ МЕТАЛЛЫВыполнили студенты группы 77СМ: Попова Екатерина,
Караваев Денис, Сметанин Константин, Плешкова Любовь
2. Содержание
Благородные металлыЗолото
Серебро
Платиновая группа
3. Благородные металлы
К ним относятся:Золото
Серебро
Металлы платиновой группы — платина,
палладий, осмий, иридий, рутений и родий.
Благородные металлы имеют более высокую
химическую устойчивость и в первую очередь в
отношении образования кислородных соединений.
Это связано с большим разнообразием их физикохимических и механических свойств.
4.
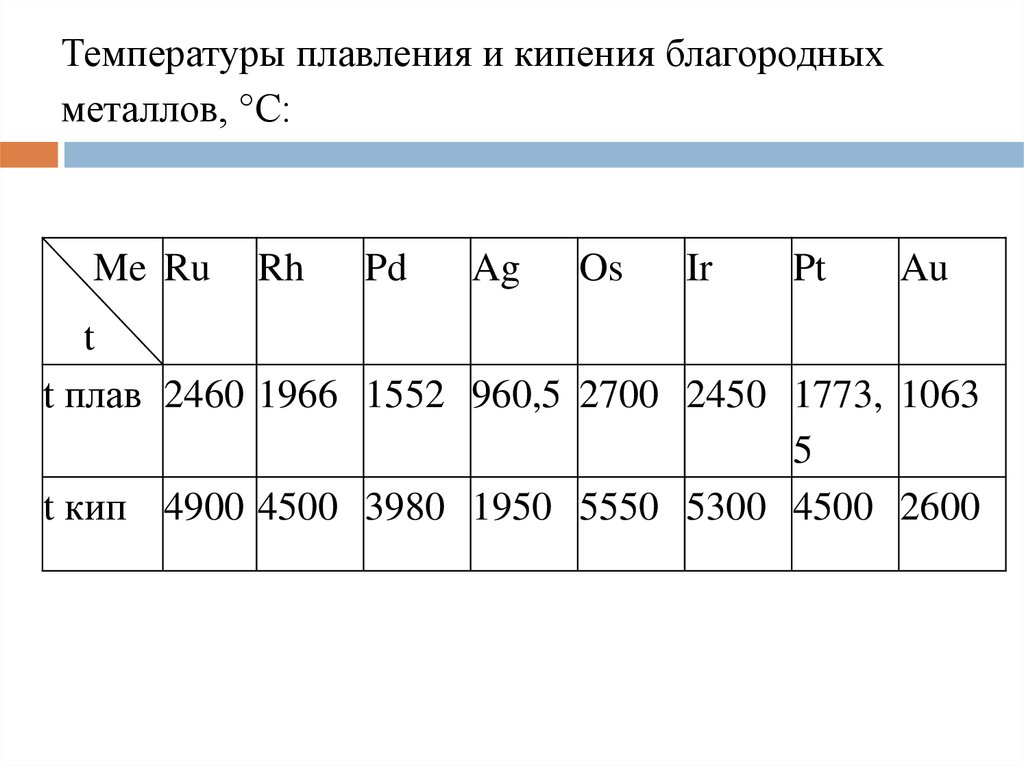
Температуры плавления и кипения благородныхметаллов, °С:
Me Ru
Rh
Pd
Ag
Os
Ir
Pt
Au
t
t плав 2460 1966 1552 960,5 2700 2450 1773, 1063
5
t кип 4900 4500 3980 1950 5550 5300 4500 2600
5. Аu Золото (сияющая заря)
Физ. Свойстваплотность
твердость (по
шкале Мооса)
Уд.
теплопроводность
Уд. теплоёмкость
Уд.
эл.сопротивление
Твердость по
Бринеллю
19,32 г/см3;
Хим.Свойства
1)Не окисляется(ни в воде, ни на
воздухе и при взаимодействии и
2,5–3;
щелочами не образует оксидов)
2)Растворяется в «Царской
311,48 Вт/м*К
водке»
132,3 Дж/кг*К
3)Степень окисления: +3, +1
(при t от 0-100ºС)
4)Способность отражать
инфракрасный свет
2,25*10-8
5)Растворяется в жидком Br и
Ом*м(при t20ºС) водном растворе цианитов (но
обязательно при наличии
180 Мн/м2
кислорода)
6)Атомная масса – 196,97
7)Электроотрицательность 2,4
8)Ковалентный радиус – 1,34
6. Область применения
Основная часть «золотой запас»- в изготовлении ювелирных изделий (50 %);
- в промышленности: золочение металлов
(гальванопластика – электролиз
комплексной солью KAu(CN2));
- радиоэлектронике;
- химической промышленности;
- производстве фарфоровых изделий в виде
краски или так называемой
«позолоты» (55 %);
- медицине – 10 % (стоматология), радиоактивное
золото (обычно198Au)
7. Ag Серебро (белый, сверкающий)
Физические свойстваХимические свойства
Плотность
10,5 г/см3
Уд.теплопроводность
429 Вт/(м·
ºС)
Пластичный
Высокая
светоотражаемость
Удельный вес
Модуль упругости
Твердость по Моосу
Твердость по Бриннелю
Уд.теплоёмкость
95%
2,7г/см3
7648 кГ/мм2
2.5
0,245
235,4
Дж/(кг·ºС)
Температура кипения 2 162°C
электросопротивление 0,015
Ом*м
Растворяется в конц-й H2SO4и в
FeCl3
Атомная масса- 107,868
Степени окисления- +2 +3
Растворяется в ртути
Одновалентно
Может быть окислено кислородной
плазмой или озоном при облучении
ультрафиолетом
При нагревании S, дает сульфид
8.
Платиновая группа:1)высокая температура плавления и кипения
2)высокие механические свойства
(твердость)
3)Так, осмий, иридий и рутений по
твердости близки к закаленной стали.
Применение:
Соединения платины используют в
медицине в качестве препаратов,
обладающих противоопухолевой
активностью.
9. Платиновая группа
10. Химические Физические
ХимическиеПри окислении металлов кислородом воздуха образуются окс
иды различного
состава:
При нагревании все
платиновые металлы
реагируют
с хлором и фтором.
Физические
Все платиновые
металлы светлосерые и тугоплавкие,
платина и палладий
пластичны, осмий и
рутений хрупкие.
Красивый внешний
вид благородных
металлов обусловлен
их инертностью.
11. М
РутенийПалладий
Родий
Осмий
Золото
Иридий
Платина
Серебро










 chemistry
chemistry








