Similar presentations:
Моделирование в среде TCAD
1.
Моделирование в среде TCADСеминар 3
2. Моделирование технологических процессов в Sentaurus Process Диффузия. Окисление.
3. Моделирование процесса диффузии
Диффузия – физический процесс,обуславливающий миграцию атомов
легирующих примесей в кристаллической
решетке кремния.
Диффузия приобретает направленное движение
под влиянием либо градиента концентрации,
либо градиента температуры
(в микроэлектронном производстве градиенты
температуры в подложке – отрицательное
явление и не используется на практике)
3
4. Основное уравнение для процесса диффузии (Sentaurus Process)
J- поток диффундирующих частиц,с – зарядовое состояние,
d – коэффициент диффузии,
A – концентрация примеси типа а,
n – концентрация электронов
4
5. Уравнение непрерывности для примеси типа a в зарядовом состоянии c
N acTR
CL
J ac Rac Rac
t
TR
ac
- вклад генерации – рекомбинации, связанный с
моделью переноса,
R
CL
ac
R
- вклад генерации – рекомбинации, связанный с
процессом кластеризации
5
6. Модели диффузии
• Модели переноса позволяют рассчитать поток частицпримеси и являются основой моделирования диффузии
в программе Sentaurus Process.
• В дополнение к расчету потоков частиц могут быть
учтены возможные реакции взаимодействия частиц в
процессе диффузии в зависимости от выбранного типа
модели.
• Модели переноса обычно используются с одной или
несколькими моделями кластеризации или активации.
Реакции взаимодействия или модели кластеризации не
модифицируют поток частиц, а добавляют в уравнении
непрерывности слагаемые к
6
7. Модель диффузии ChargedReact
• Модель диффузии ChargedReact – наиболееполная модель переноса в программе
Sentaurus Process.
• Модель включает неподвижную примесь в
замещающем состоянии и до двух
подвижных заряженных пар примесьдефект.
• Также в рассмотрение включены
подвижные заряженные точечные дефекты.
7
8. Реакции в модели диффузии ChargedReact
A – замещающиеатомы примеси
I – междоузлия
V - вакансии
8
9. Дифференциальные уравнения в модели ChargedReact
CA – концентрациязамещающих атомов
примеси
CI – концентрация
междоузлий
CV – концентрация
вакансий
CAX- концентрация
пар дефект-примесь
(I или V)
9
10. Модель ChargedReact : уравнение для заряженных пар
• Предполагается, что реакция образования пар дефектпримесь является равновесной:где X это I или V, z –
заряд примеси A
- Скорость реакции
образования пар AX
11.
• Поток пар:• Потокт дефектов:
• Скорости для всех комбинаций зарядовых
состояний:
12. Типы моделей
ChargedReact Diffusion Model
React Diffusion Model
ChargedPair Diffusion Model
Pair Diffusion Model
ChargedFermi Diffusion Model
Fermi Diffusion Model
Constant Diffusion Model
NeutralReact Diffusion Model
13. Пары дефект – примесь, участвующие в диффузии основных типов примеси
Вклад пар в диффузию можно учесть при определении эффективногокоэффициента диффузии по принципу суперпозиции, умножая каждую
составляющую на весовой коэффициент
Фосфор
Пара дефект
- примесь
Весовой
коэффициент
P +I -
P +I 0
P +I +
P+V=
1
1
1
1
Мышьяк
Пара дефект
- примесь
Весовой
коэффициент
As+I=
As+I-
As+I0
As+I+
As+V=
As+V-
As+V0
As+V+
0.2
0.2
0.2
0.2
0.8
0.8
0.8
0.8
Бор
Пара дефект
- примесь
Весовой
коэффициент
B-I-
B-I0
B-I+
B-I++
B-V-
B-V0
B-V+
B-V++
0.92
0.92
0.92
0.92
0.02
0.02
0.02
0.02
13
14. Кинетический метод Монте-Карло для расчета процесса диффузии (KMC)
15.
• Кинетический метод Монте-Карлорассчитывает траектории
индивидуальных примесей и точечных
дефектов и взаимодействие между ними.
• Метод позволяет изучать процесс
диффузии на микроскопическом уровне.
• Результаты моделирования с помощью
КМС могут быть использованы для
калибровки моделей, основанных на
решении уравнений диффузии.
16. Преимущества метода Монте-Карло
Преимущества метода МонтеКарло• Уменьшение термического бюджета в
современных технологических
маршрутах сокращает
продолжительность диффузионых
процессов, преобладают
термодинамически неравновесные
процессы и состояния.
17.
• При обычном подходе к моделированию числорешаемых уравнений быстро возрастает с
учетом всех возможных пар дефект – примесь,
переходов и состояний.
• С другой стороны, уменьшение размеров
приборов приводит к малому количеству
атомов примеси, формирующих структуру
прибора (десятки или сотни). Приближается
предел, когда такие малые дискретизованные
распределения уже не могут быть
аппроксимированы непрерывными функциями.
18. Повышение конкурентноспособности метода Монте-Карло
• С уменьшением размеров трудоемкость методаМонте-Карло снижается, т.к. уменьшается
число атомов и дефектов, вовлеченных в
процесс.
• Большое количество различных конфигураций
дефект – примесь не усложняет метод, т.к.
требует только введения значений
вероятностей для дополнительных реакций.
• Трудоемкость обычного метода
моделирования систем уравнений возрастает
из-за неравновесных процессов
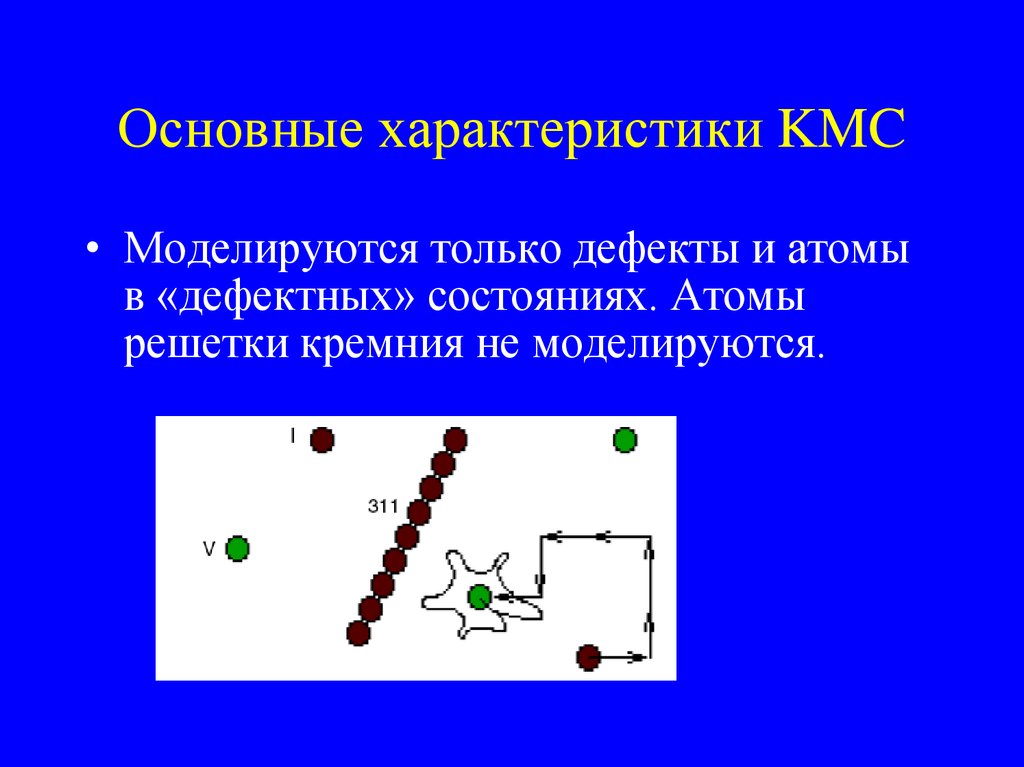
19. Основные характеристики KMC
• Моделируются только дефекты и атомыв «дефектных» состояниях. Атомы
решетки кремния не моделируются.
20. Основные характеристики KMC
• Входные параметры – энергии миграции,связи, эмиссии и др.
• По ним рассчитывается вероятность
(частота) того или иного события.
• Частицы могут также взаимодействовать
с протяженными дефектами или
двигаться вдоль них.
21. Основные характеристики KMC
• КМС (на базе программы DADOS)может работать в 2-х режимах:
– Атомистическом (наиболее точный)
– Неатомистическом, с использованием
модуля KMC для отдельных операций,
прежде всего неравновесных процессов
(RTA и др.)
22. Атомистический режим
• Распределения всех величин рассчитываютсяполностью на основе расчета траекторий
отдельных атомов
• Основные ограничения данного режима:
– Осаждение слоев возможно только без учета
примеси;
– Имплантация должна моделироваться только с
помощью Sentaurus MC
– Окисление не моделируется.
23.
• КМС использует ортогональную сетку иразбиение моделируемой области на
прямоугольные поддомены.
24. Используемые материалы
Кремний (монокристаллический)
Аморфный кремний
Диоксид кремния
Поликристаллический кремний
Нитрид кремния
Газ (внешняя среда)
25. Типы частиц
26.
• Точечные дефекты могут взаимодействоватьс соседними частицами и перемещаться на
расстояние λ в ортогональных направлениях
27.
• Атомы акцепторной или донорнойпримеси могут диффундировать в паре с
дефектом (вакансией или междоузлием)
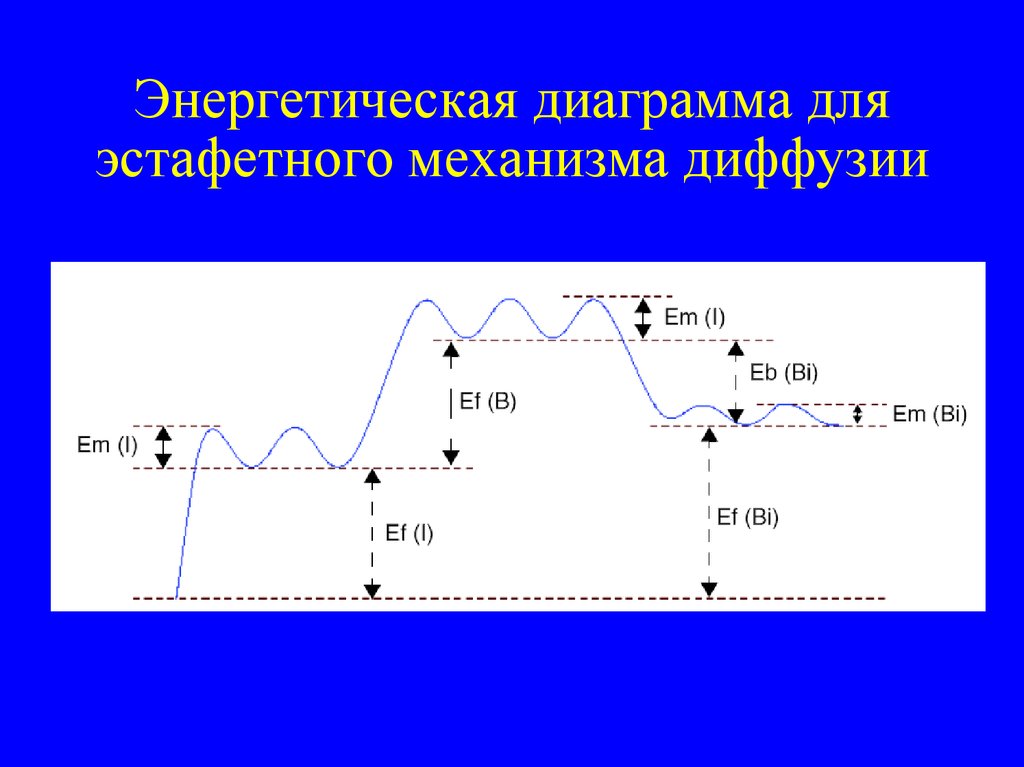
• Пара дефект – примесь может
– диффундировать
– распадаться на атом примеси в
замещаюшем состоянии (заряженный,
неподвижный) и точечный дефект
28. Энергетическая диаграмма для эстафетного механизма диффузии
29.
• Не все возможные сочетаниячастиц участвуют в реакциях.
• Возможные реакции включают
физически обоснованные типы
взаимодействий.
• Рассматриваются только обратимые
реакции, реакции со стабильными
выходными продуктами.
Например, допустимые реакции для бора:
30. Области аккумуляции дефектов
Аморфные зоны31. Протяженные дефекты
• {311} дефекты• Кольца дислокаций
• Пустоты (вакансионные кластеры)
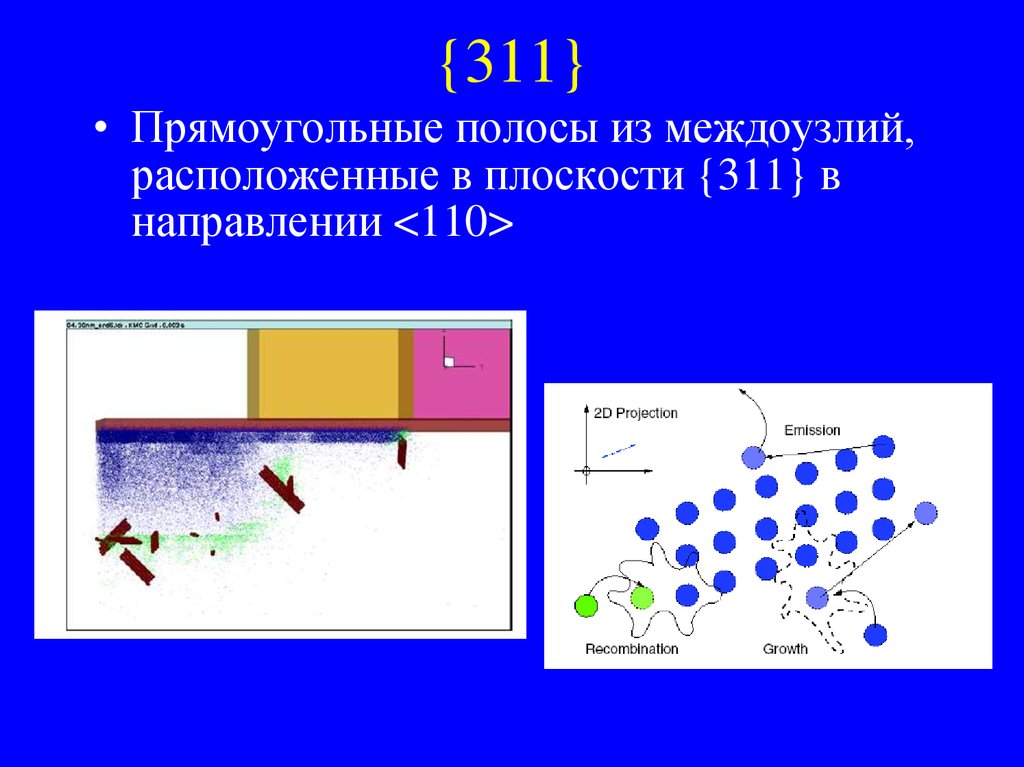
32. {311}
• Прямоугольные полосы из междоузлий,расположенные в плоскости {311} в
направлении <110>
33. Кольца дислокаций
• Тонкие круги в плоскости {111}34. Вакансионные кластеры (пустоты)
• Кластер из 654 вакансий(моделирование)
35. Кластеризация примеси
• Кластеры мышьяк – вакансии(синий-мышьяк, зеленыйвакансия)
→
36. Зарядовые состояния
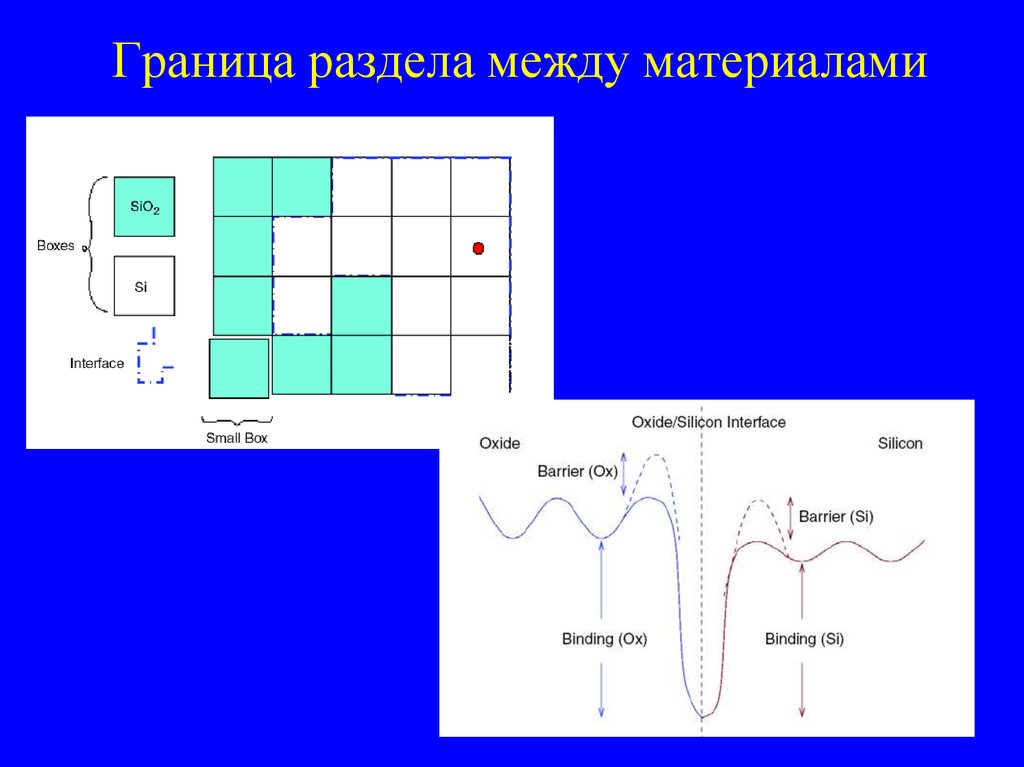
37. Граница раздела между материалами
38. Моделирование диффузии в процессе окисления
• На каждом шаге решается система уравнений длярасчета процесса окисления и механических
напряжений
• Перед запуском шага моделирования диффузии
методом КМС трансформируется сетка.
• Вновь выращенный окисел встраивается в тензорную
сетку, используемую в КМС
• Материал и свойства частиц изменяются там, где
необходимо
• Недостаток: несовершенство интерполяции при
переходе от непрерывной сетки к тензорной
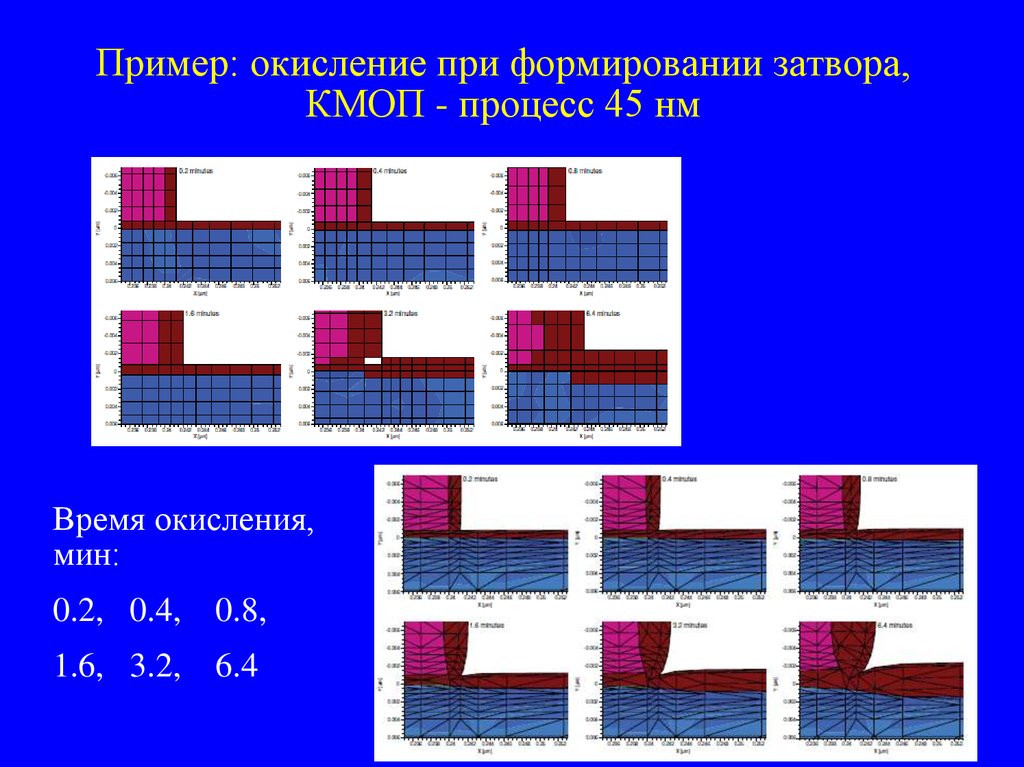
39. Пример: окисление при формировании затвора, КМОП - процесс 45 нм
Время окисления,мин:
0.2, 0.4, 0.8,
1.6, 3.2,
6.4
40.
Моделирование методом Монте-Карло имплантации P(30КэВ, 1е14) и отжига (800 С, 15 мин.)
1 эксперимент
Усреднение по 20-ти экспериментам
41.
Sentaurus ProcessKinetic Monte Carlo
• Неоднородная
тензорная сетка
• Механические
напряжения и SiGe
• Дополнительные
физические модели
МОП-транзистор:
моделирование с
помощью Sentaurus
Process KMC.
41
42.
• Полное описание см.• Sprocess
• Гл. 5 Atomistic kinetic Monte Carlo
diffusion
43. Окисление
Окислительный процесс включает триэтапа:
• Диффузия частиц окислителя (H2O, O2) от
границы раздела газ-окисел через
существующий окисел к границе раздела
кремний-окисел.
• Химическая реакция между окислителем и
кремнием с образованием нового окисла.
• Перемещение материалов и границ раздела
из-за расширения объема, вызванного
образованием оксида.
43
44.
• Уравнения химических реакций:• Диффузия окислителя описывается законом Фика
и уравнением непрерывности:
где D – коэффициент диффузии окислителя, с –
концентрация и j – поток частиц окислителя.
• Поток окислителя, поступающий из внешней
атмосферы в окисел по нормали к поверхности:
где h – коэффициент массопереноса и c* концентрация окислителя в атмосфере
45. Модель Дила - Гроува
• Скорость роста окисла в одномерном случаеможет быть описана моделью Дила – Гроува :
где xox – толщина слоя окисла.
• Уравнение может быть решено аналитически;
параметры модели: константа параболического
роста B и константа линейного роста B/A.
• Более глубокий анализ показывает связь
константы параболического роста с
коэффициентом диффузии, а константы
линейного роста со скоростью химической
реакции.
46. Вывод модели Дила - Гроува
F1 = h(C*-C0) – массоперенос черезвнешнюю границу окисла, C*, C0 –
концентрации окисляющих частиц;
F2 = D(C0 – Ci)/x – диффузия
окислителя через окисел к границе
раздела окисел/кремний.
F3 = kCi – химическая реакция на
границе раздела окисел/кремний.
В условиях равновесия
F1 = F2 = F3
F2 = F3 : Ci = C0 /(1 + kx/D)
F1 = F3 : Ci = C*/(1 + k/h + kx/D)
dx/dt = F3 /N
46
47.
F1 = F2 = F3*
dx kC/N
dt 1 k kx
h
Обозначаем:
В 2D
С*/N Тогда:
1 1
A 2D
k h
D
dx
B
dt A 2x
После интегрирования
x2 +Ax = B(t+t0)
47
48. Модель Массуда
dx
B
O
X
C
e
x
p
(
xL
/)
O
X
d
t 2
x
A
O
X
• эмпирическая модель, учитывающая ускоренный
рост окисла на начальном этапе окисления
• может рассматриваться как расширение модели
Дила – Гроува; хорошо согласуется с
экспериментом
• параметры L и C зависят от
кристаллографической ориентации и температуры
48
49.
Константы параболического и линейногороста зависят от давления и температуры
A
B
A
B
2
O
2
H
2
O
H
2
O
A
O
B
B
O
2
H
2
O
В = ВО2 + ВН2О
RP
FP
1
mO
2
O
2
A
P
O
2
O
2
RL
FL
O
2
RP
FP
1
mH
2
O
H
2
O
A
P
H
2
O
H
2
O
RL
FL
H
2
O
ВО2 = FP∙RPO2∙pO2
ВH2О = FP∙RPH2O∙pH2O
49
50. 2D и 3D окисление
• Для точного моделирования необходимопроводить расчет следующих 2D и 3D
процессов:
– Растворение окислительных реагентов на
границе газ-окисел ,
– Перенос частиц окислителя через
существующий окисел,
– Химическая реакция на границе окиселкремний.
• Растворение и химическая реакция
моделируются как граничные условия;
• Для моделирования переноса
рассчитывается уравнение диффузии
частич в слое окисла
50













































 informatics
informatics








