Similar presentations:
Хроматин, гетерохроматин, упаковка генома
1. Хроматин. Гетерохроматин. Упаковка генома.
Наука это род человеческой деятельностипо поиску порядка в природе
2.
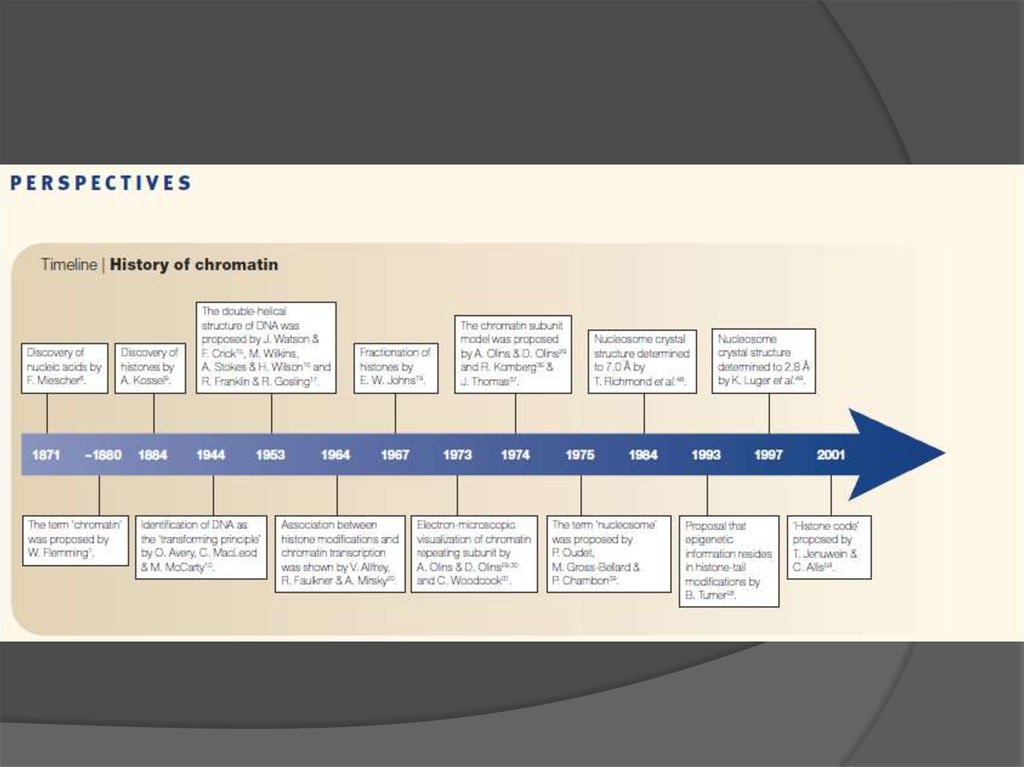
Seminars inCell & Developmental Biology 18 (2007)
3.
2 44.
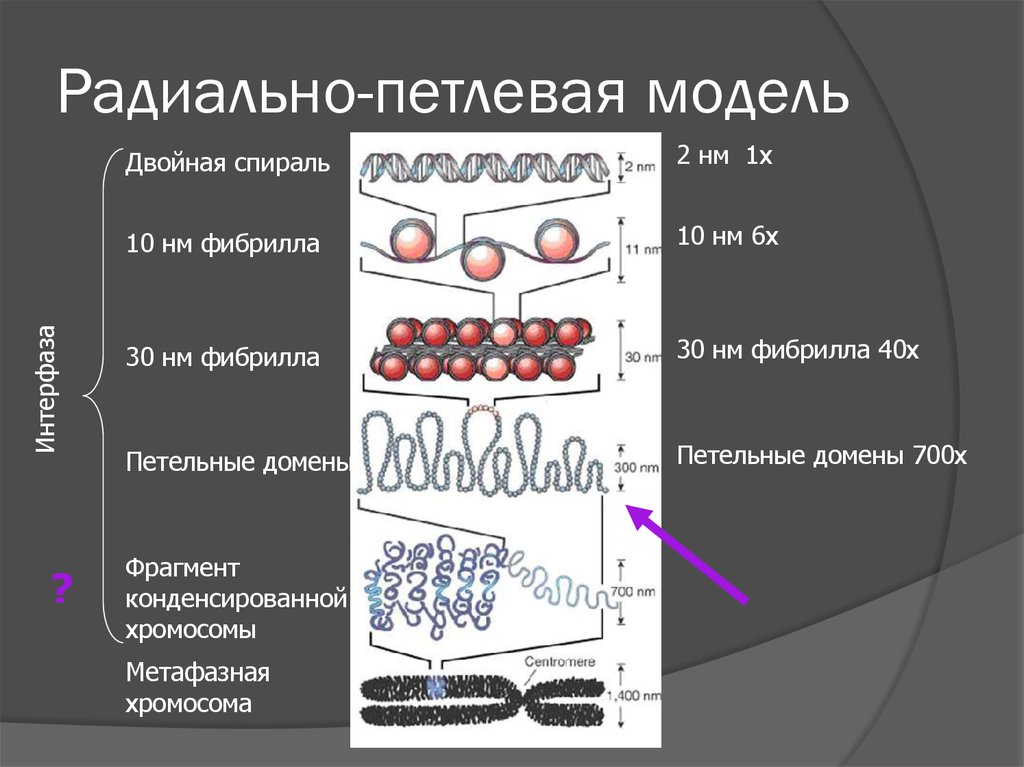
5. Уровни упаковки генома
ИнтерфазаУровни упаковки генома
?
Двойная спираль
2 нм 1х
10 нм фибрилла
10 нм 6х
30 нм фибрилла
30 нм фибрилла 40х
Петельные домены
Петельные домены 700х
Фрагмент
конденсированной
хромосомы
Метафазная
хромосома
Из статьи:
Controlling the double helix
Gary Felsenfeld and Mark Groudine
Nature 421, 448-453
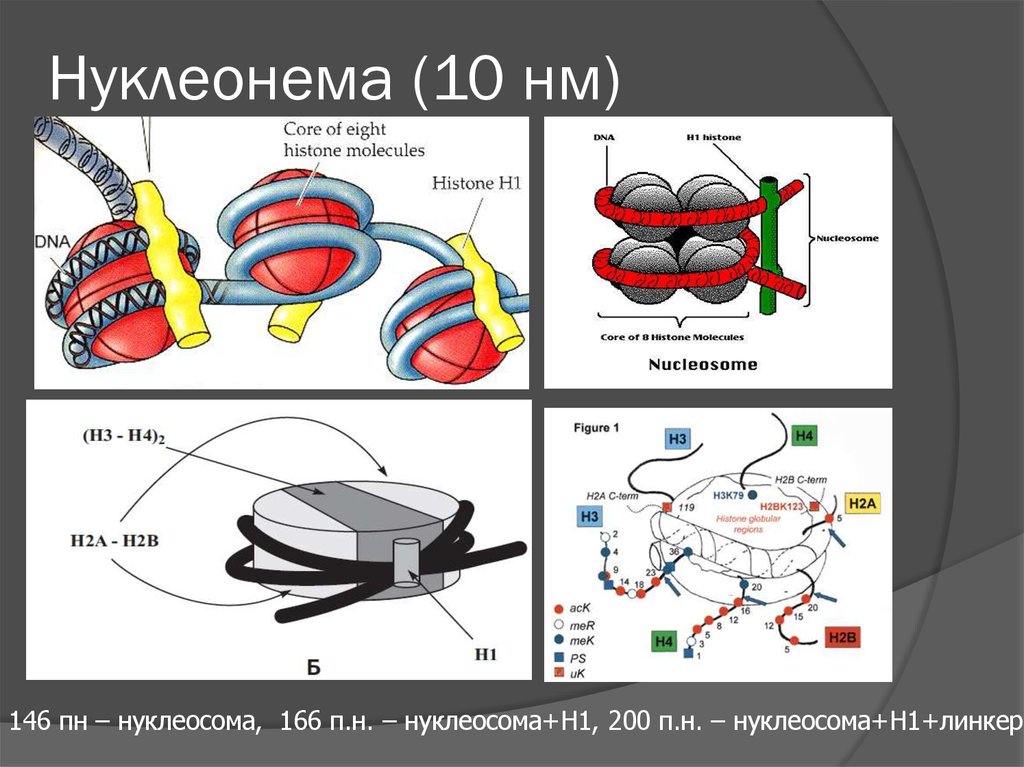
6. Нуклеонема (10 нм)
MNOlins&Olins (1974)
vanHolde (1974)
Noll (1974)
15’
12’
9’
6’
7. Нуклеонема (10 нм)
146 пн – нуклеосома, 166 п.н. – нуклеосома+Н1, 200 п.н. – нуклеосома+Н1+линкер8. Фазирование нуклеосом
Фиксированное расположение нуклеосомВирус MMTV,
Участок начала репликации SV40,
bmayor-глобиновый ген мыши,
альфоидная ДНК АЗМ
Возникает
•при наличии в определенном районе генома барьера для
распространения нуклеосом (напр. места связывания белковых факторов)
•При наличии последовательности, на которой нуклеосома располагается
с большим предпочтением (напр. Изогнутые, на которых фазированно
расположены каждые 10 пар блоки из 2-3 АТ)
9. Гистоны
Основные типы H1 (H5 у птиц), H2A,H2B, H3, H4
Обогащены лизином и аргинином,
преимущественно на C и N-концах
(хвостах)
Сходная вторичная структура
10. Вариантные формы гистонов H1, H2A, H2B, H3
Кодируются отдельным однокопийнымгеном (кроме H3.3)
•CENP-A (CiD дрозофилы, CSE4 дрожжей) = СenH3
•H3.3 – вариант транкрипционно активного хроматина
•H3.lt – вариант специфичный для семенников
•hTSH2b, H2BFWT – формы H2B. Известны только в сперматозоидах
•macroH2A – гистон неактивной X-хромосомы. 57% негомологично ни одному из
гистонов
•H2ABbd – компонент активного хроматина
•H2A.Z – компонент активного хроматина
•H2A.X – в местах репарации ДНК
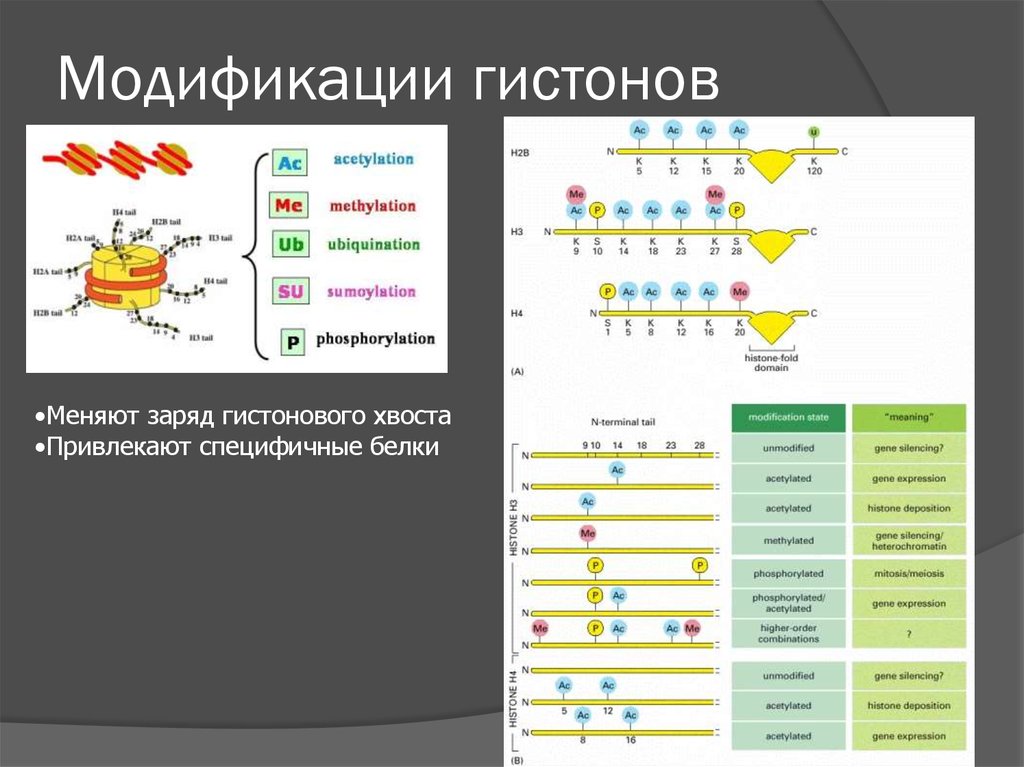
11. Модификации гистонов
•Меняют заряд гистонового хвоста•Привлекают специфичные белки
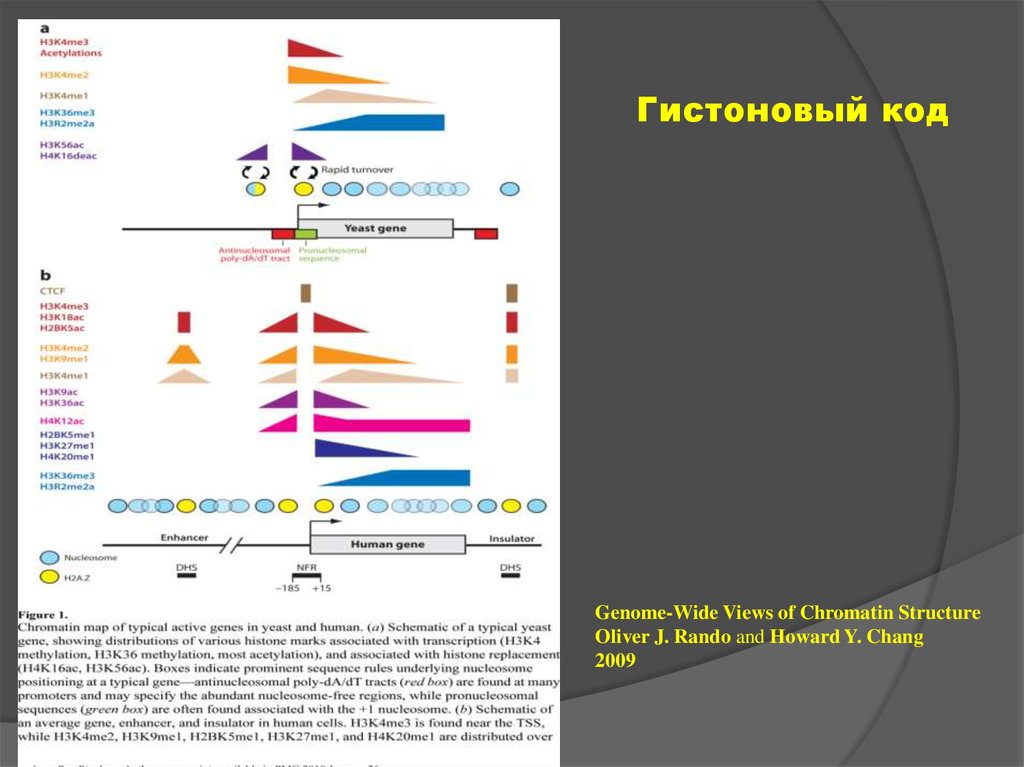
12. «Гистоновый код»
Совокупность сигналов,экспонированных на поверхности
нуклеосом (включая как присутсвие
вариантов гистонов, так и наличие
модификаций основных и вариантных
их форм)
13.
Гистоновый кодGenome-Wide Views of Chromatin Structure
Oliver J. Rando and Howard Y. Chang
2009
14. Histone 3 barcode (Hake, Allis; 2006)
15. Фибрилла 30 нм
Зиг-загСоленоид
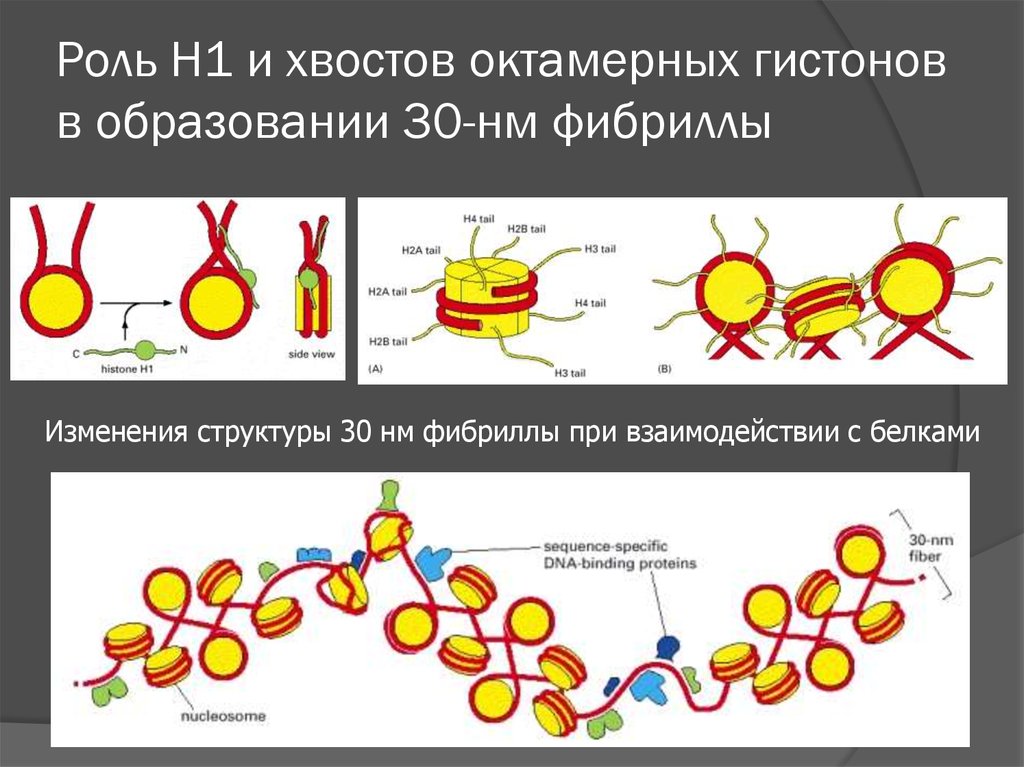
16. Роль H1 и хвостов октамерных гистонов в образовании 30-нм фибриллы
Изменения структуры 30 нм фибриллы при взаимодействии с белками17. АТФ-зависимые комплексы ремоделирования хроматина
Решают проблемы, связанные с нуклеосомной организациейПеремещение нуклеосом вдоль молекулы
ДНК и размещение нуклеосом на равном
расстоянии друг от друга
Частичная декомпактизация нуклеосом,
сопряженная с изменением спектра
контактов ДНК и гистонов
Перемещение нуклеосомных глобул с одной
молекулы ДНК на другую
Замена канонических гистонов на
вариантные
18. Принципы работы
Основные 4 группы•SWI\SNF
•ISWI
•CHD
•INO80
19. Высшие уровни упаковки хроматина
Соленоид?Латеральное взаимодействие
соседних фибрилл?
Радиально-петлевая модель ?
20. Радиально-петлевая модель
ИнтерфазаРадиально-петлевая модель
?
Двойная спираль
2 нм 1х
10 нм фибрилла
10 нм 6х
30 нм фибрилла
30 нм фибрилла 40х
Петельные домены
Петельные домены 700х
Фрагмент
конденсированной
хромосомы
Метафазная
хромосома
21.
Доменная гипотеза организации эукариотического геномаВесь геном построен из однотипных блоков - доменов, которые
могут включать один или несколько генов
Домены в целом находятся под контролем особых регуляторных
систем, которые контролируют их транскрипционный статус на уровне
упаковки (более компактной или менее компактной) всего домена в
интерфазной хромосоме
Активный домен
Неактивный домен
22. Хромосомы типа ламповых щеток
23. Хромосомный скэффолд
24.
1947. Mirsky, Ris. Фракция остаточных белковпри солевой экстракции хромосом
1948. Zbarsky, Debov. сообщили о
существовании в ядре фракции белков, не
экстрагируемых растворами солей высокой
концентрации (2 М NaCl).
1962. Zbarsky et al, 1962; Georgiev and
Chentsov, 1962 - препараты ядер,
обработанные сходным образом, сохраняют
очертания ядра и в них выявляются четко
различимые остаточное ядрышко и участки
гетерохроматина
1974. . Berezney and Coffey опубликовали
статью о биохимическом получении фракции
остаточных белков и предложили термин
“ядерный матрикс”.
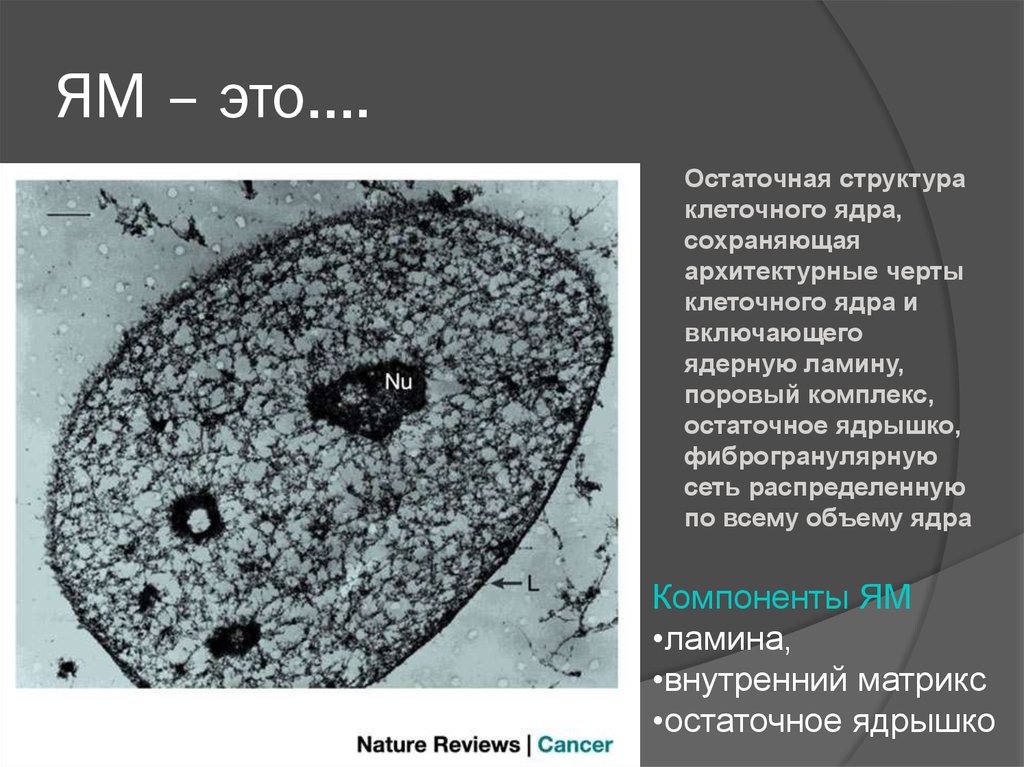
25. ЯМ – это….
Остаточная структураклеточного ядра,
сохраняющая
архитектурные черты
клеточного ядра и
включающего
ядерную ламину,
поровый комплекс,
остаточное ядрышко,
фиброгранулярную
сеть распределенную
по всему объему ядра
Компоненты ЯМ
•ламина,
•внутренний матрикс
•остаточное ядрышко
26.
Ламина (A/C, B)Поровый
комплекс
Остаточное ядрышко
Препарат ядерного матрикса
Фиброгранулярная сеть
эдектронноплотные гранулами
27.
28.
29. Непрерывный клеточный скелет
Figure 1 Transmission electron micrograph (X47,000) of a portion of nuclear matrix (left) and surroundingcytoplasm. Cytoskeletal filaments are clearly visible. The mouse fibroblast cells were extracted with
detergent to remove lipids and further treated with DNase I. In 1895, E. B. Wilson, looking through the light
microscope, reported that the nucleus was traversed by fibers that were continuous with those of the
cytoplasmic reticulum and that surrounded the chromatin. (From Capco et al., 1982; courtesy of S.
Penman.)
30. ДНК компонент ЯМ
31.
32.
SAR/MAR consensus - ?Regulating the
mammalian genome:
the role of
nuclear architecture
Ronald Berezney
(2002)
33.
Mapping of the nuclear matrix-bound chromatin hubsby a new M3C experimental procedure
Alexey Gavrilov, Sergey V. Razin, and Olga V. Iarovaia
Department of Structural and functional organisation of chromosomes
Institute of Gene Biology
Moscow
34.
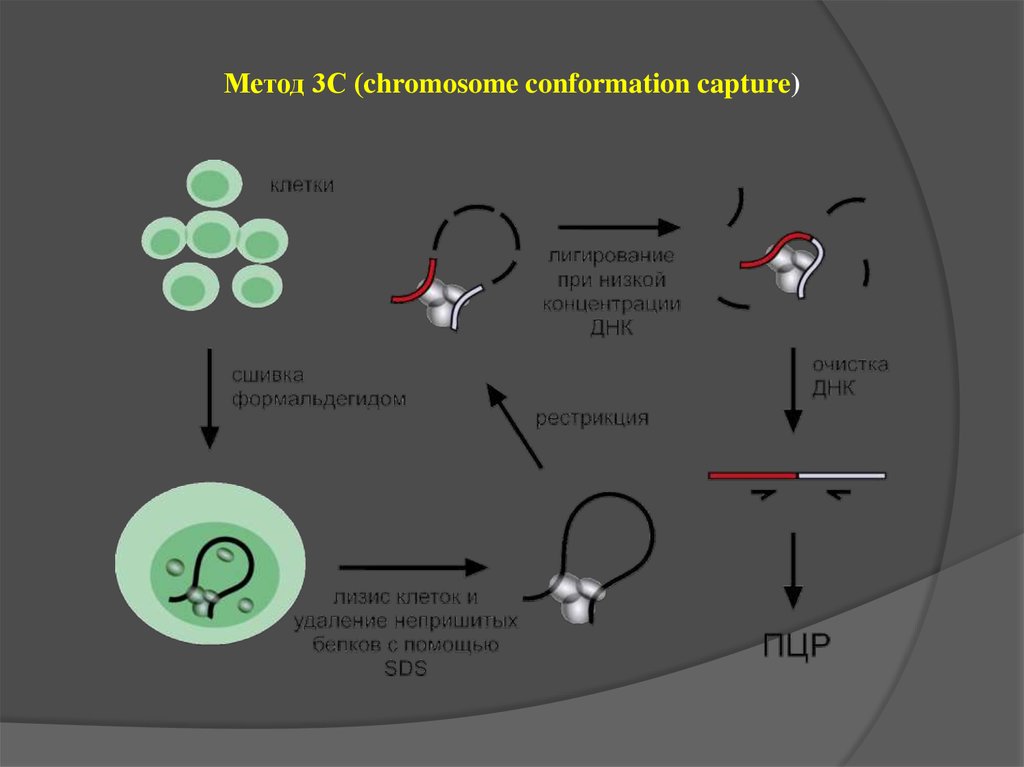
Метод 3С (chromosome conformation capture)35.
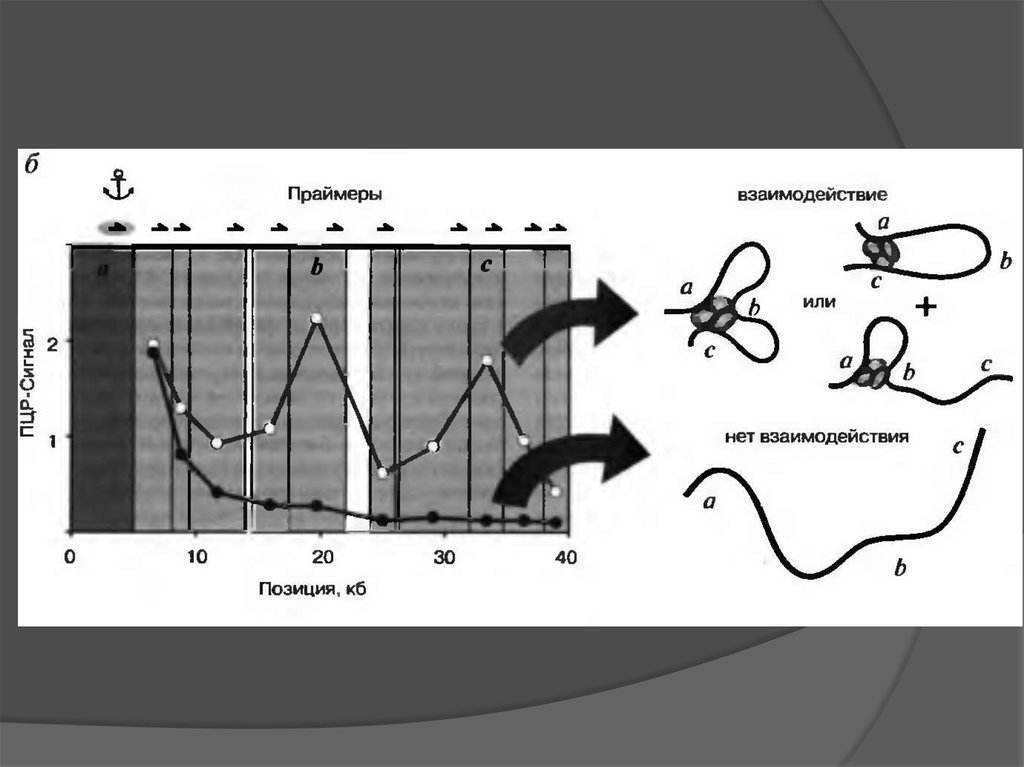
Presentation and interpretation of 3C data36.
37.
A model to test M3C approach –a fragment of chicken chromosome 14 including the -globin gene
domain
38.
Matrix 3C (M3C) –an experimental procedure to analyze the spatial proximity of nuclear
matrix-bound DNA fragments.
The protocol includes:
high salt extraction of nuclei
removal of distal parts of unfolded DNA
loops using restriction enzyme treatment
ligation of the nuclear matrix-bound DNA
fragments
analysis of ligation frequencies
39.
Chromatin hub conceptionThe chromatin hub is a spatial unit of genes and their regulatory elements
β-globin gene domain
(Tolhuis et al., 2002, Mol Cell)
α-globin gene domain
(Zhou et al., 2006, MCB)
Th2 cytokine gene domain
(Cai et al., 2006,
Nat Genet)
40.
A model:nuclear-matrix bound transcription factory
permanent compartment:
promoters of house keeping genes
“guest” compartment:
erythroid-specific elements and promoters
41.
Белки ЯМ42.
Белки ЯМ43. Белки ЯМ
(Nakayasu, Berezney, 1991)Nuclear matrins:
Identification of the major
nuclear matrix proteins
HIROSHI NAKAYASU*
AND RONALD BEREZNEYt
PNAS, 1991
Matrin 3 Binds and Stabilize
mRNA
Salton et al., 2011
44. Белки ЯМ
The Functional Levels of Higher Order ChromatinOrganization Are Associated With the Nuclear Matrix
45.
Nuclear Matrix Proteins1. The nuclear matrix is composed of a major group of ~dozen highly
conserved proteins (termed nuclear matrins: PNAS 88, 1991: 10,312)
and many other (100’s) less abundant ones including those with cell
type, tissue, species, developmental and human tumor (bladder,
breast, uterine, cervical, prostate, colon and kidney cancer) specificity.
2. Many of the nuclear matrins are pre-mRNP, RNA splicing or
transcriptional factors but many have yet to be identified.
3. Matrin 3 is an ~ 96 kDa protein that contains 2 Zn finger motifs, RNA
Recognition Motifs (RRM’s) and an acidic rich domain at the C-T
common among transcriptional activators (J Biol Chem 266, 1991: 9893)
46.
Nuclear Matrix Proteins (cont.)4. Matrin Cyp (cyclophilin) a ~88 kDa protein that contains
the complete cyclophilin protein sequence at the N-T and SR
repeats - characteristic of splicing factors – within the
carboxyl half. The protein has peptidylprolyl cis-trans
isomerase activity and co-localizes with splicing factor-rich
nuclear speckles (J. Biol Chem. 273, 1998: 8183)
5. Matrin SRm 160 (~160 kDa protein) is an exon junction
splicing factor (Mol. Cell. Biol. 22, 2002: 148).
6. Matrin 250 (~250 kDa) is the hyperphosphorylated form of
RNA pol II LS (PNAS 93, 1996: 8253).
7. Matrin SCAF 8 (140 kDa) contains SR-rich motifs and a
binding domain specific for hyperphosphorylated CTD of
RNA pol II LS (Mol. Cell Biol. 18, 1998, 2406)
47.
Nuclear Matrix Proteins (cont.)DNA (Chromatin) Loop Anchoring Proteins
or MAR/SAR Binding Proteins ????
DNA Topoisomerase
SAF-A and SAF-B (Bind both DNA and RNA)
SAT B1 – MAR protein specific for lymphocytes
What else ???? More Research is needed at the levels
of DNA (chromatin loops), multi-loop chromatin
domains ( ~1 mbp domains) and whole chromosome
territories.
48.
Saf-a/hnRNP Ua
b
c
d
Lobov et al., 2000
Lobov et al., 2000
49. Nuclear Matrix Proteins (cont.)
Saf-a/hnRNP U specifically interacts withb-actin in the nucleus
Actin and hnRNP U cooperate for productive transcription by RNA Polymerase II
Kukalev A et al., Nature, 2005
50.
Actin binds Saf-a/hnRNP U in vivo0.5 mM DSP
(dithiobissuccinimidylpropionate)
Nuclear extract
preparation
8M Urea
DNase I
Pull down
51.
Vimentin NLSReichenzeller et al., 2000
52.
53.
MA et al., JCB, 1999, Figure 1Intact Cell
DNA – rich in situ Nuclear Matrix
RNase A + 2.0M NaCl
Chromosome territories are maintained after extraction of WI-38 cells
for DNA- rich nuclear matrix, but are disrupted when RNase A digestion
precedes 2.0 M NaCl extraction
54.
MA et al., JCB, 1999, Figure 2Relationship of nuclear matrix structure to chromosome
territory disruption in NHF-1 cells
55.
MA et al., JCB, 1999, Figure 4Protocol for releasing nuclear matrix associated proteins that correlates
with disruption of chromosome territories
56.
Зависимость структуры ядерного матриксаот обработки
Действующее
вещество
Результат
ДНКаза
Нуклеаза, микрококовая
нуклеаза
Зависит количество ДНК;
Добавление соли приводит к сжатию ядра, последующие добавление
2М NaCl не изменяет морфологию ядра, отсутствие интенсивного
фиброгранулярного компонента
РНКаза в низкой ионной
силе
Образуется периферийный фиброзный слой с поровыми комплексами;
внутриядерная сеть отсутствует;
Нарушается форма; агрегация фибрил, отсутствие гранул
Детергенты
(TrtonX-100)
Вымывание мембранных и растворимых белков
Буфер низкой ионной
силы (5mM TrisHCl,
0.4mM CaCl)
Вероятно, происходит деполимеризация филаментов актина, что
способствует экстрагированию РНК
NaCl
- дегистонированные препараты
При увеличение концентрации происходит увеличение размеров ядра,
ядро окружается ореолом (halo-нити деконденсированого хроматина),
можно добится полного уничтожения фиброгранулярной сети
-удаление линкерного гистона Н1
--вымывание белков с высокой подвижностью (HMG)
Удаляет клеточные компоненты, а остаточные структура содержит
hnРНК, волокна цитоскелета прикреплены к ядерной оболочке
0.1M
0.35M
(NH4)SO4+детергент
2х валентные ионы
металлов
Изменяется конденсированность/диффузность хроматина
Дииодсалицилат Li
Уменьшает агрегацию белков вызванной оюработкой 2МNaCl
57.
MAJOR CONCLUSIONS OF MA et al., 1999Chromosome territory organization is maintained after in situ
extraction of cells with 2M NaCl for nuclear matrix preparation
(Fig 1)
Disruption of nuclear matrix organization by pre-treatment with
RNase A before 2M NaCl extraction leads to a corresponding
disruption of territorial organization (Fig 1 & 2)
The finding that extraction with ammonium sulfate at similar
ionic strength (0.65 M) as 2M NaCl following RNase does not
lead to territorial disruption (Fig 2) has led to a procedure to
isolate proteins that are released in association with disruption
of territories (Fig 4)
These released proteins comprise a distinct subset of proteins
in nuclear matrix preparations (Fig 5) and are termed CTAPs
(Chromosome Territory Anchoring Proteins)
58.
Hendzel et al (1999) – в интерхроматиновомпространстве не выявляется нуклеопротеиновая сеть
Pederson (2000) – в ядре нет места для волокон ЯМ
Misteli etal (1997) - Стационарное положение
интерхроматиновых доменов объясняется высокой
концентрацией белков и нуклеопротеинов в
интерхроматиновом пространстве.
Hancock (1999) - Анализ методик получения ЯМ
показывает, что каждый из шагов получения ЯМ
(инкубация при 37оС, обработка соединениями меди,
дийодсалицилатом лития, NaCl или (NH4)2SO4 и т.п.)
приводит к образованию артефактных белок-белковых
комплексов. Филаментная сеть, наблюдавшаяся
первыми исследователями, есть как результат
артефактной агрегации.
Tan et al. (2000) - белки рибонуклеопротеиновых
комплексов при инкубации их при 37оС и обработке
их 2-меркаптоэтанолом и высокими концентрациями
солей образуют филаменты 7-10 нм.
59.
Однако, существование одного из компонентов ядерногоматрикса – промежуточнофиламентной ламины in situ и
in vivo не подвергается сомнению (Stuurman et al., 1998;
Broers et al., 1999).
Известно, что во внутреннем пространстве ядра
располагаются белки, способные к полимеризации в
филаментноподобные структуры – ламины, ядерный
актин, NuMa, белок порового комплекса Tpr (Moir et al.,
1994; Parry, 1994; Hozak et al., 1995; Jagatheesan et al.,
1999; Pedersen, 2000).
Показано, что эти белки не принимают участия в
формировании внутриядерных филаментов in vivo (Parry,
1994; Moir et al., 1994; Hozak et al., 1995; Nickerson, 1995;
Jagatheesan et al., 1999).
Однако обсуждается возможность формирования
небольших локальных филаментных сетей (gene
expression matrices) в местах активной транскрипции
(Pedersen, 2000
60. MAJOR CONCLUSIONS OF MA et al., 1999
Структурные белки цитоплазмыПоддержание формы клетки
Локомоция
Участие в межклеточных контактах
Регуляторные функции
Опосредование вне- и
внутриклеточных сигналов
61.
Какие функции нужны в ядре?Поддержание формы клетки
Локомоция
Участие в межклеточных контактах
Регуляторные функции
Опосредование вне- и внутриклеточных
сигналов
Отделение ядерного пространства
Контроль за транспортом внутри ядра
62.
Нужен ли ядру скелет?Chr 6
MHC
CEN
63. Структурные белки цитоплазмы
Что нам осталось от концепции ЯМ1. Петельно-доменная организация генома
Figure 12. Insulator elements organize the chromatin fiber in the nucleus by establishing separate
compartments of higher-order chromatin structure. (A) Domains of open chromatin (yellow nucleosomes)
are flanked by insulators (pink, blue and green spheres) that interact together to form a loop. (B) Diagram
showing part of a nucleus with compartmentalized chromatin, anchored in part to the nuclear periphery by
interactions of the insulators with the nuclear lamina (red lines).
64. Какие функции нужны в ядре?
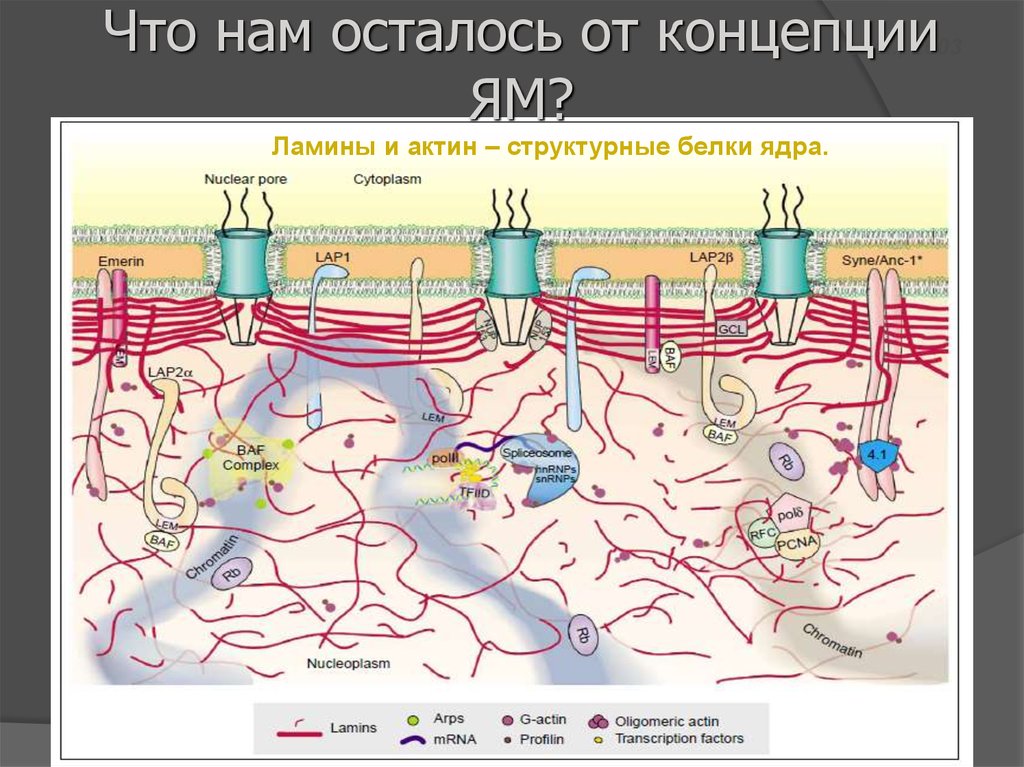
Что нам осталось от концепцииЯМ?
Schumaker et al., 2003
Ламины и актин – структурные белки ядра.
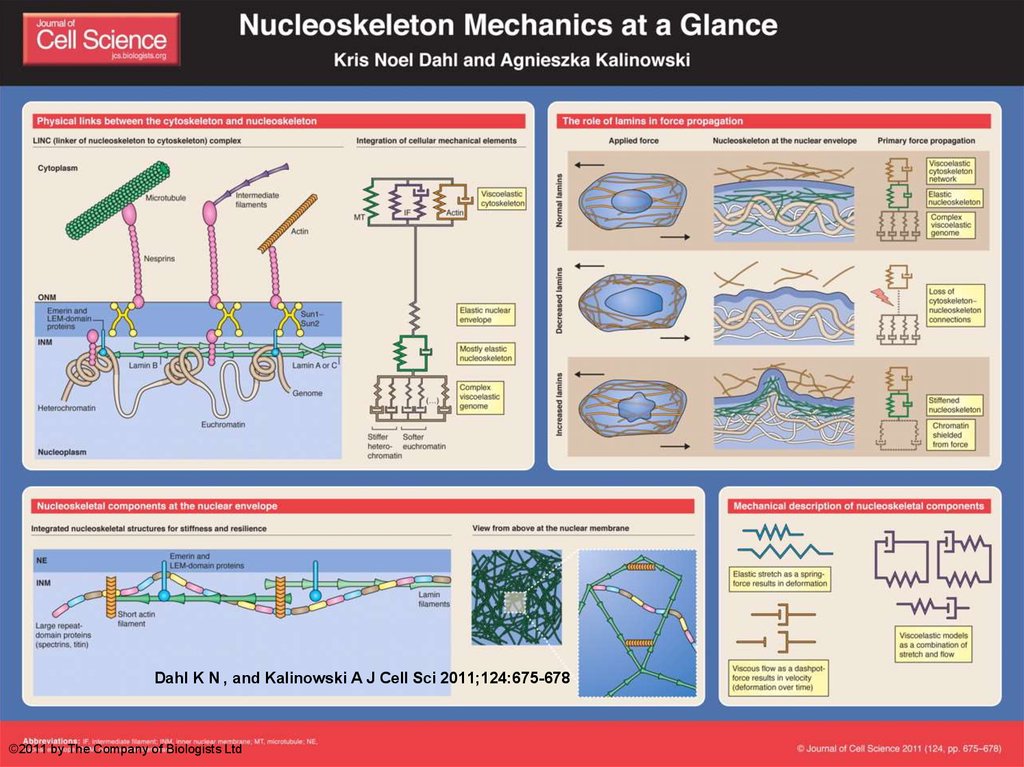
65. Нужен ли ядру скелет?
Dahl K N , and Kalinowski A J Cell Sci 2011;124:675-678©2011 by The Company of Biologists Ltd
66. Что нам осталось от концепции ЯМ
ЯМ – как сеть опорных промежуточныхфиламентов – неверная гипотеза
НО его изучение позволило открыть
сложную сеть взаимодействующих
трансляционных, регуляторных,
репликационных и т.д. комплексов и
понять механизмы пространственной
организации генома
Мы также получили удобный метод для
изучения белков, взаимодействующих с
определенной фракцией генома –
некодирующей ДНК, активно
транскрибируемой ДНК и
реплицирующейся ДНК
67.
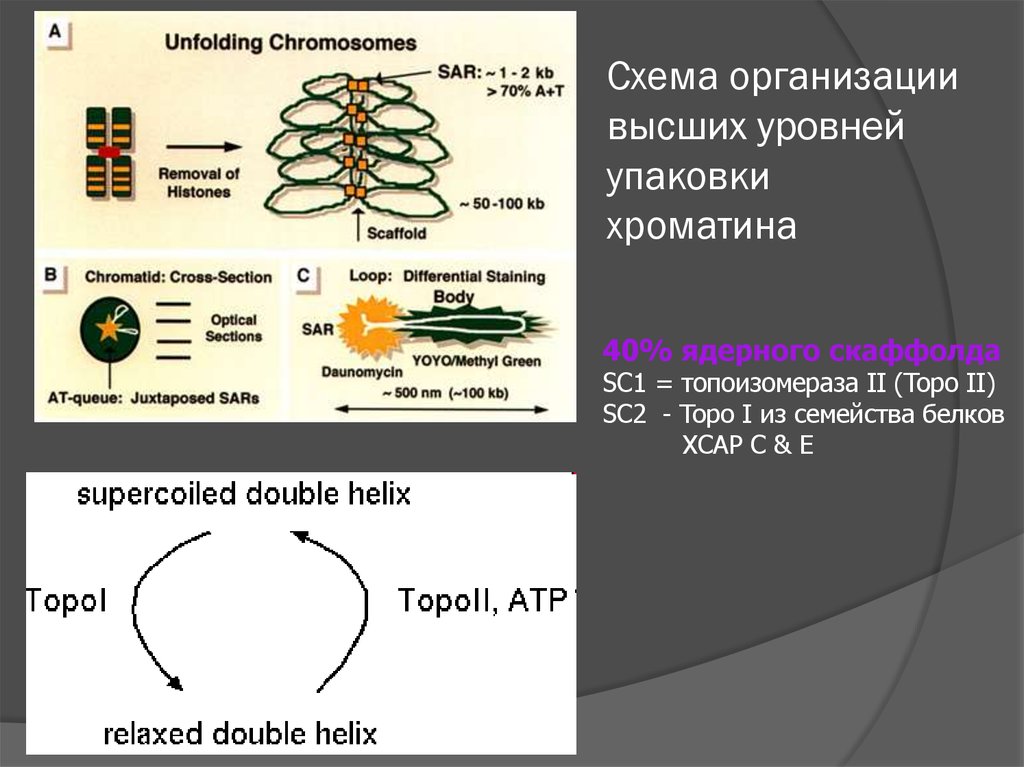
Схема организациивысших уровней
упаковки
хроматина
40% ядерного скаффолда
SC1 = топоизомераза II (Topo II)
SC2 - Topo I из семейства белков
XCAP C & E
68.
Петельные домены несомненно естьОсновные белки, участвующие в
формировании петель –
Топоизомеразы, РНП-комплексы.
Некоторые из них ассоциированы с
локальными скелетными (напр.
актиновыми) филаментами
69.
Shaping the Genome with Non-Coding RNAs. Wang et al., Current Genomics, 201170. Схема организации высших уровней упаковки хроматина
Модели высших уровней упаковкихроматина
71.
AFM72.
Хромосомные территории“Вермишель на тарелке” –
хроматиновые нити, беспорядочно
распределенные по ядру
“Клубки ниток” –
компартментализация ядра: каждая
хромосома занимает свою
«хромосомную территорию», в
которую другие хромосомы не
проникают
(Bovery, 1888,
1903; T. Cremer)
73. Модели высших уровней упаковки хроматина
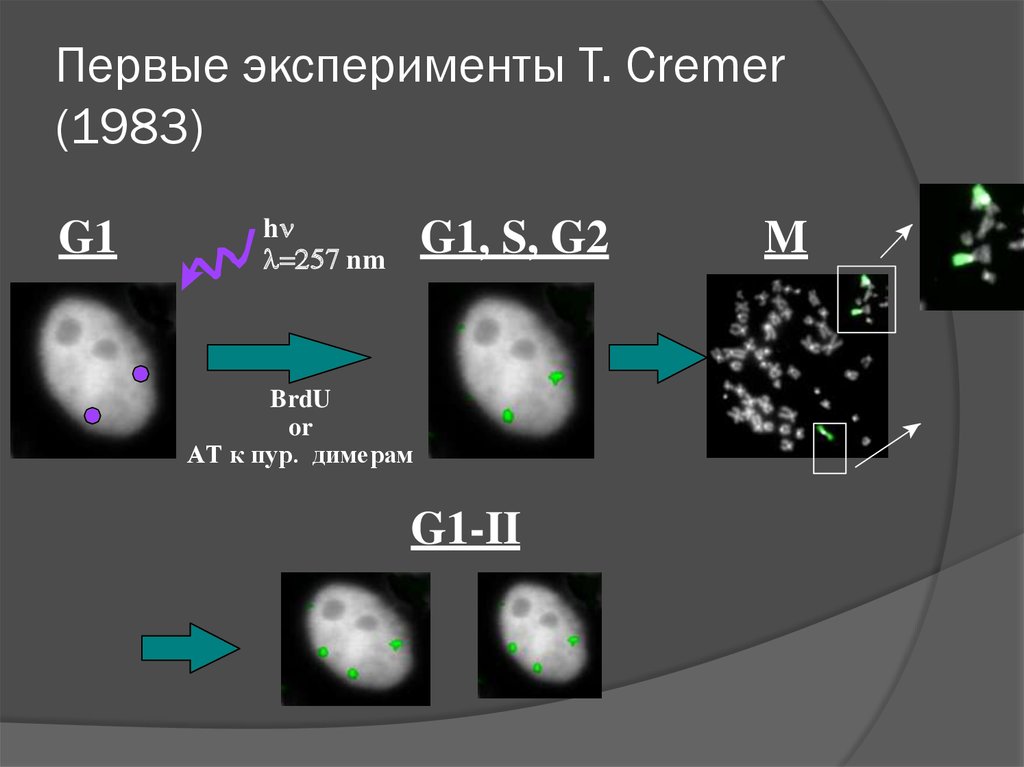
Первые эксперименты T. Cremer(1983)
G1
h
nm
G1, S, G2
BrdU
or
AT к пур. димерам
G1-II
M
74.
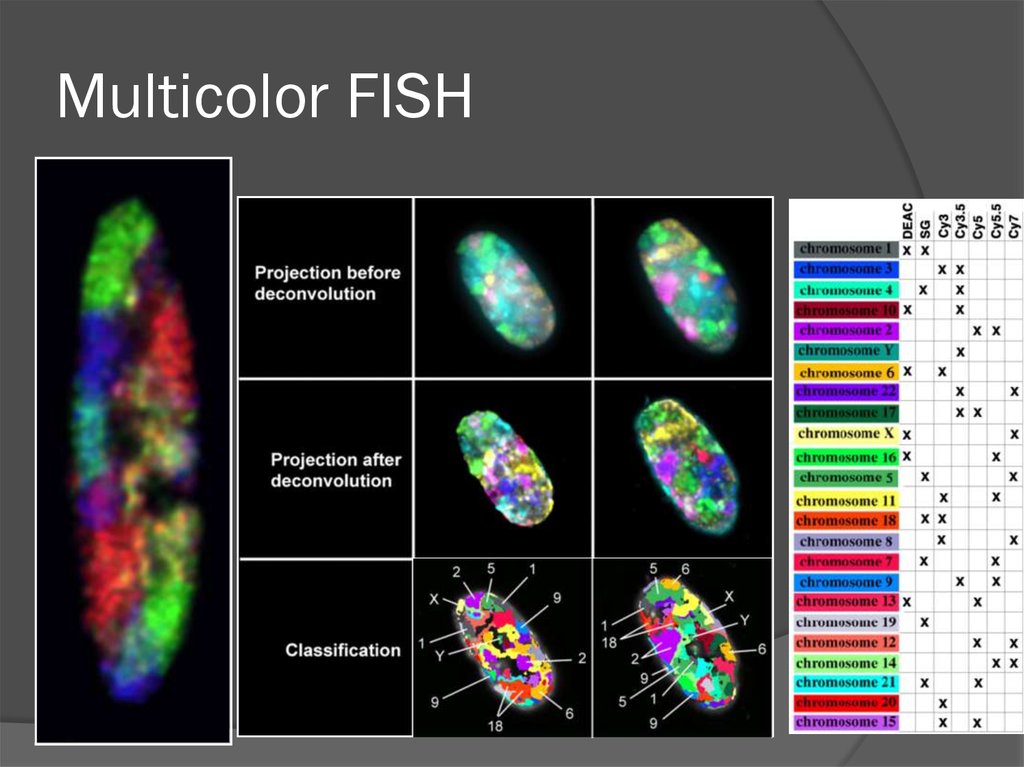
Multicolor FISH75. Хромосомные территории
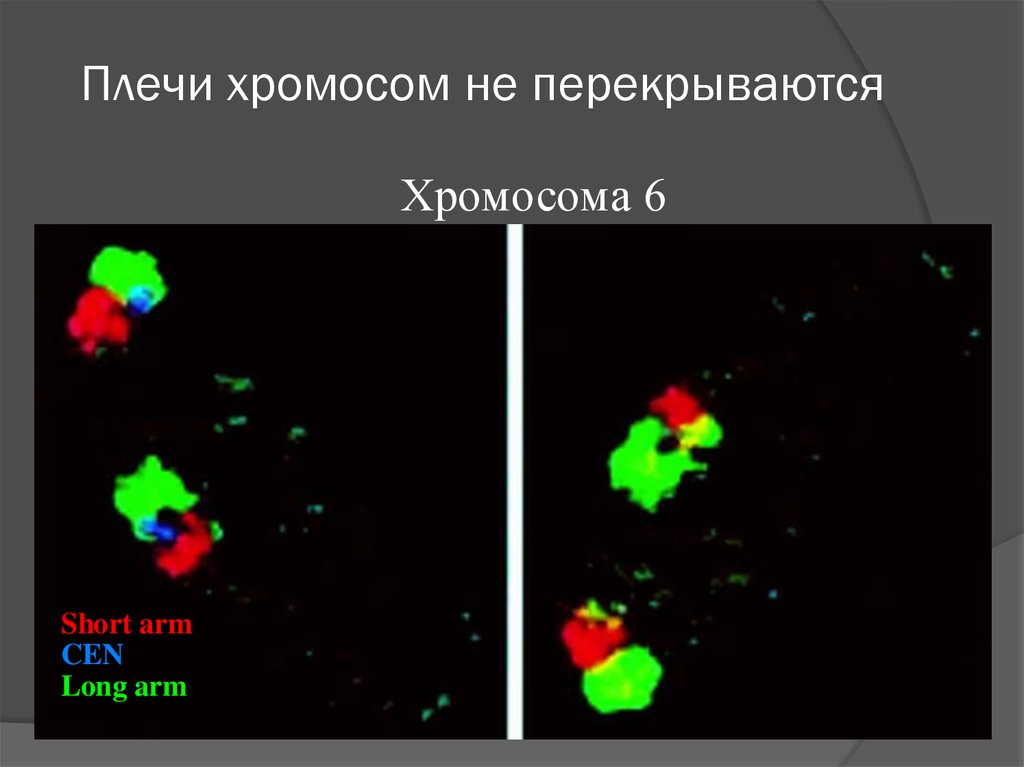
Плечи хромосом не перекрываютсяХромосома 6
Short arm
CEN
Long arm
76. Первые эксперименты T. Cremer (1983)
XiBrUTP
Xa
BrUTP
Chr 19
BrUTP
77. Multicolor FISH
Субдоменная организацияхромосомной территории
(Verschurre et al., 1999)
78. Плечи хромосом не перекрываются
Активные гены могут быть удаленыот основной части ХрТ
Mahy et al., 2002
Chevret et al., 2000
Chr 6
CEN
MMU 7
245N5
-Вся ли хромосома покрыта
пробой?
- Весь ли сигнал от ХрТ мы
видим?
-В любом случае, если это все
площадь одной хромосомы, то
хромосомы должны
перекрываться
Chr 6
MHC
MHC
79.
Сателлитная ДНК также можетпроникать в соседник ХрТ
80. Субдоменная организация хромосомной территории (Verschurre et al., 1999)
Перихроматиновыефибриллы
“Вермишель на
тарелке”
“Клубок ниток в
корзине”
Теория хромосомных территорий хорошо описывает
результаты “хромосомного окрашивания”. Но
существуют декомпактизованные хромосомные
домены, лежащие вне хромосомных территорий перихроматиновые фибриллы. В этой области
возможно перекрывание хромосомных территорий
81. Активные гены могут быть удалены от основной части ХрТ
Интерхроматиновое пространствоПерихроматиновые
фибриллы
Интерхроматиновое пространство -пространство
между хромосомными территориями, а также между
субдоменами одной хромосомной территории
82. Сателлитная ДНК также может проникать в соседник ХрТ
Естьли упорядоченность в 3-d
организации интерфазного
хроматина?
83.
Distribution of large and small chromosomes in interphasenuclei of human diploid fibroblasts
84. Интерхроматиновое пространство
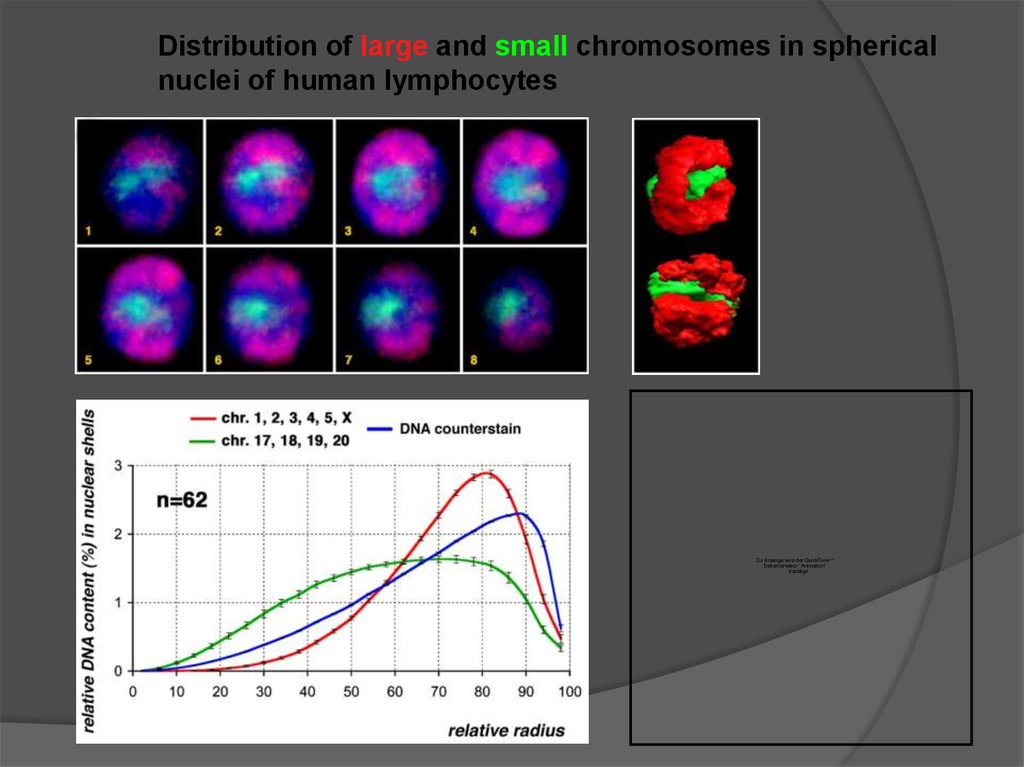
Distribution of large and small chromosomes in sphericalnuclei of human lymphocytes
Zur Anzeige wird der QuickTime™
Dekompressor “Animation”
benötigt.
85.
There is a reproducible size-correlated patternof radial chromosome arrangement:
Большие хромосомы тяготеют к периферии
ядра large chromosomes are located
towards the periphery of the nucleus
Маленькие хромосомы тяготеют к центру
small chromosomes have
a central position
86. Distribution of large and small chromosomes in interphase nuclei of human diploid fibroblasts
What determines the size-correlateddistribution of chromosomes ?
Какой механизм расставляет хромосомы по размеру?
How mobile are the chromosome territories
in the interphase nucleus ?
Насколько подвижны хромосомные
территории в интерфазе
87. Distribution of large and small chromosomes in spherical nuclei of human lymphocytes
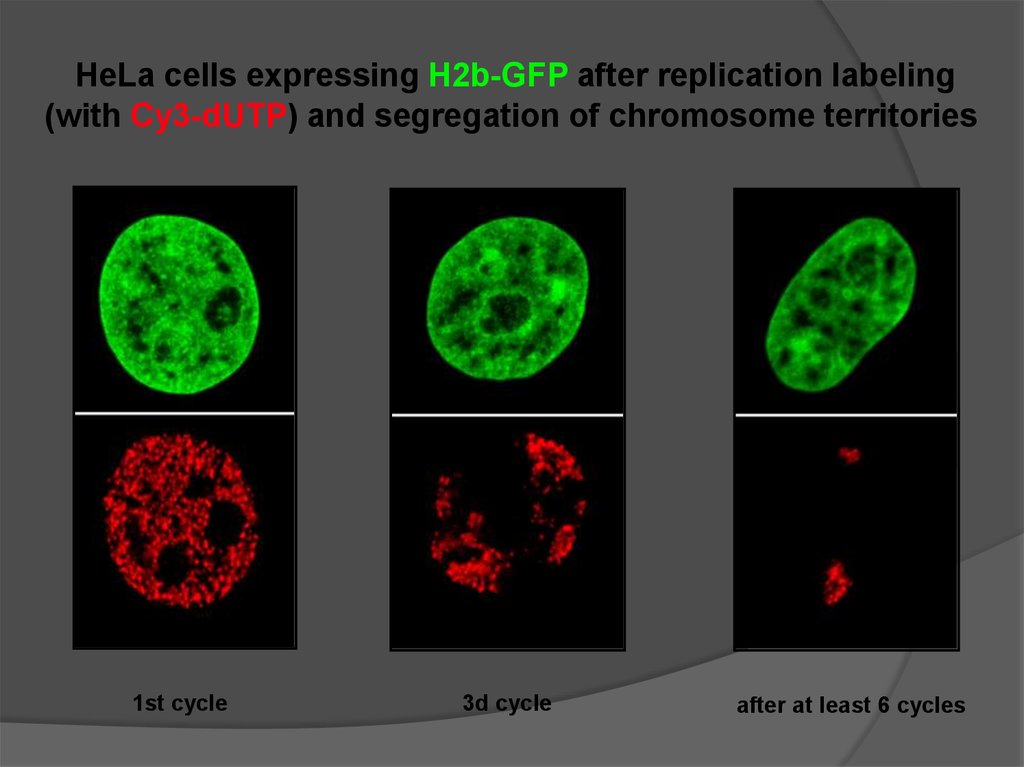
HeLa cells expressing H2b-GFP after replication labeling(with Cy3-dUTP) and segregation of chromosome territories
1st cycle
3d cycle
after at least 6 cycles
88.
Cellcycles:
.....
Labeling scheme
Observation period
89.
Chromosome territories move little,if at all, during interphase
СТ почти не двигаются в интерфазе
90.
What determines the size-correlateddistribution of chromosomes ?
We suggest that the answer to this question is
in the positioning of chromosomes in the mitotic cells.
91.
scheme showing the distribution oflarge and small chromosomes
in the prometaphase rosette
prometaphase rosette of
human fibroblast with labelled
small and large chromosomes
92. Chromosome territories move little, if at all, during interphase
We suggest that the difference in the distributionof small and large chromosomes is simply inherited
from their arrangement in mitosis
93.
Однако, это не абсолютноOne more important aspect of order
in interphase chromosomes arrangement
94.
Distribution of gene-poor chromosomesn spherical nuclei of human lymphocytes
95.
Обогащение\обедненность генами влияет напозицию хромосом в круглом ядре лимфоцитов
Gene content affects chromosome distribution
in spherical nuclei of lymphocytes
96.
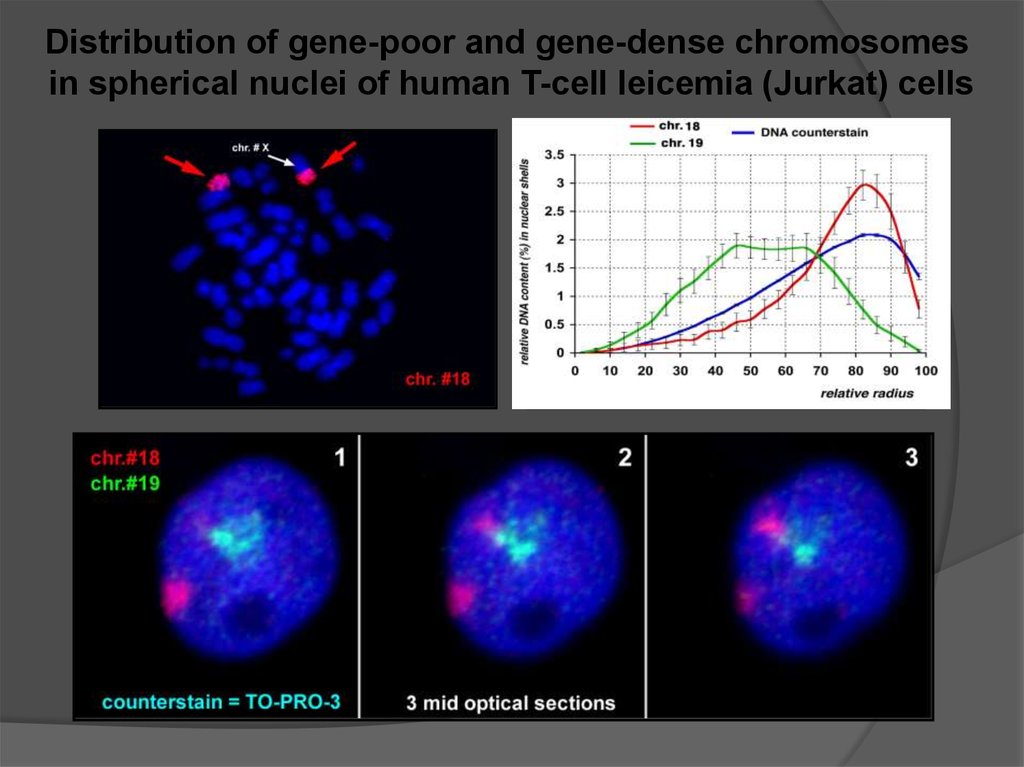
Distribution of gene-poor and gene-dense chromosomesin spherical nuclei of human T-cell leicemia (Jurkat) cells
97. Distribution of gene-poor chromosomes in spherical nuclei of human lymphocytes
matin homologous to human chromosomes #18id cells of higher primates corresponds to
romosomes in human
of karyotypes
98.
Gene density affects the distribution of interphasechromosomes: gene-poor chromosomes tend to occupy
a peripheral position, gene-dense chromosomes
are located in the interior of spherical lymphocyte nuclei
Observations on tumor cells and primates imply that
DNA sequences affect the positions of chromosomes
containing these specific sequences
99.
Различные позиции ген-бедных и ген-богатых хромосомтребует направленного движения в телофазе\начале G1
The differential positioning of gene-poor and
gene-dense chromosomes necessitates selective
movements during telophase/ beginning of G1
The forces which drive gene-poor and
gene-dense chromosomes to their specific
positions in interphase nuclei and
timing of these movements remain unknown
Механизм и время распределения хромосом неизвестны
100. The distribution of chromatin homologous to human chromosomes #18 and #19 in lymphoblastoid cells of higher primates
Для ядер характерен воспроизводимый рисунокрадиального распределения хромосом
Nuclei are characterized by a reproducible pattern
of radial chromosome arrangement
В ядрах отдельных клеток распределение хромосом
варьирует
Side-by-side chromosome arrangement varies
between nuclei of individual cells
101.
Seven chromosome territories (1- 6 and Z) in chicken fibroblastnucleus visualized by multi-colour 3D FISH
102.
24-color FISH on 3D preserved human diploid fibroblast nuc103.
Когда и как хромосомы меняют соседей?When and how do chromosomes
change their neigborhood ?
Бывают ли изменения в интерфазе?
Does this change take place during interphase ?
104.
Cellcycles:
.....
Labeling scheme
Observation period
105.
When and how chromosomeschange their neigborhood ?
СТ не перемещаются в интерфазе
Does this change take place during interphase ?
NO !
Does it take place during mitosis ?
Хромосомы меняют соседей во время митоза ?
106.
Во время какой фазы митоза хромосомы перемешиваются?What a role do different stages of mitosis play in chromosome shuffling ?
Manders et al (1999)
JCB, 144(5): 813-821
+
our observations
?
107.
Two sister nuclei of chicken fibroblasts after M-FISH108.
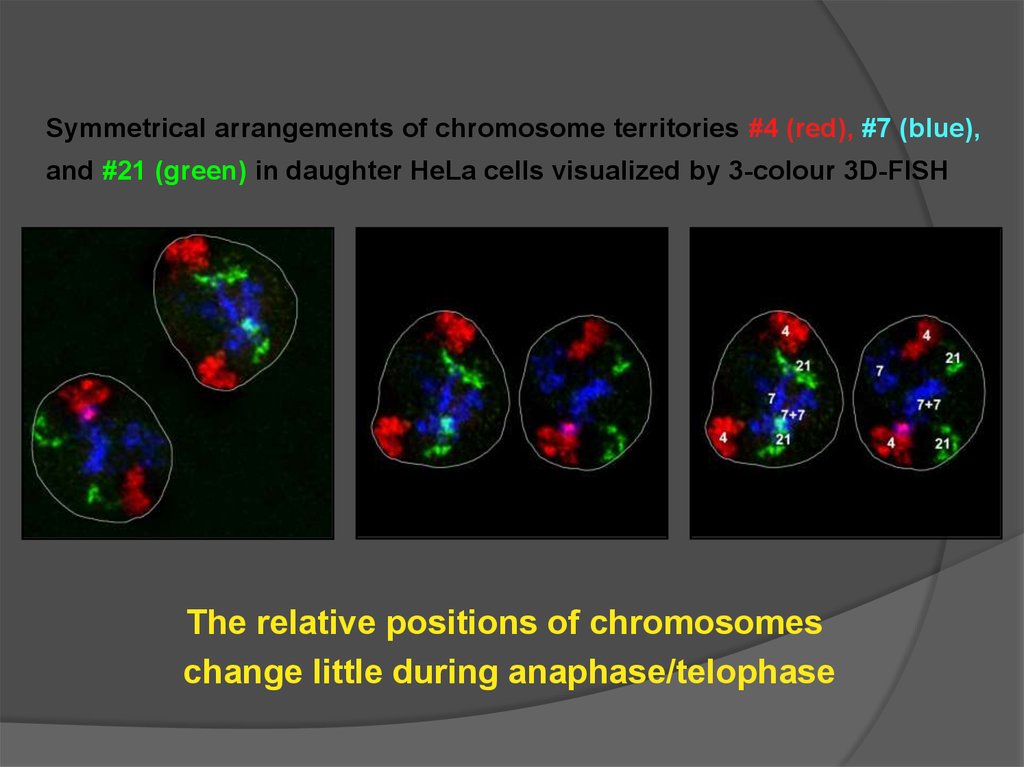
Symmetrical arrangements of chromosome territories #4 (red), #7 (blue),and #21 (green) in daughter HeLa cells visualized by 3-colour 3D-FISH
The relative positions of chromosomes
change little during anaphase/telophase
109.
What a role do different stages of mitosis play in chromosome shuffling ?110. Two sister nuclei of chicken fibroblasts after M-FISH
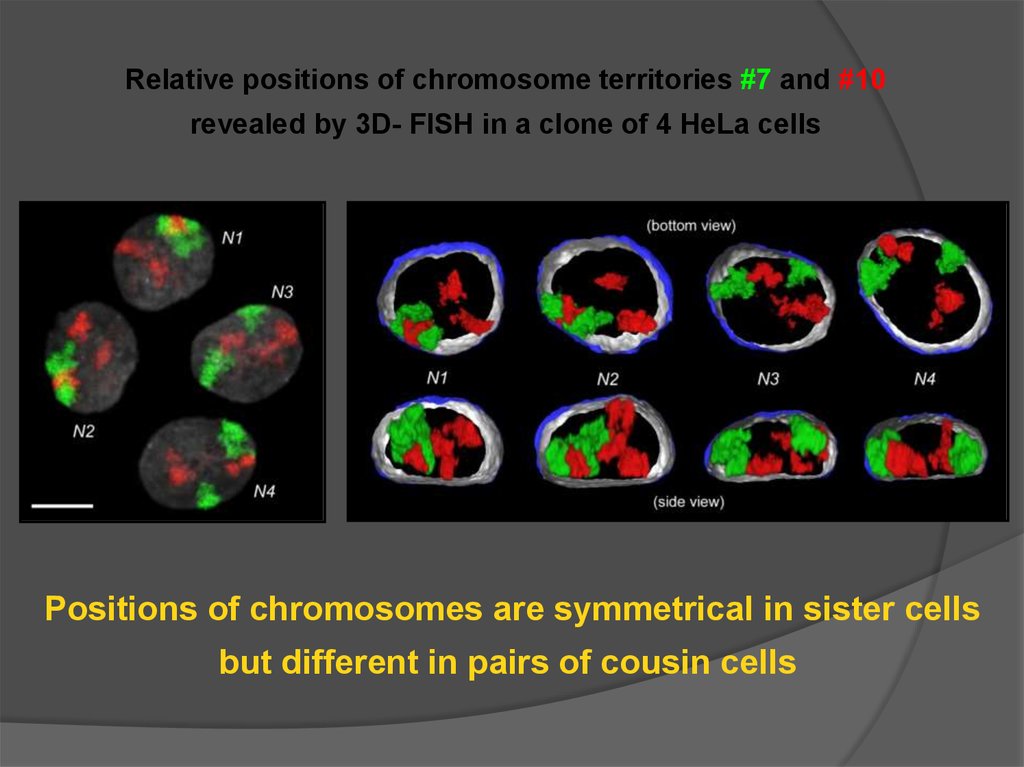
Relative positions of chromosome territories #7 and #10revealed by 3D- FISH in a clone of 4 HeLa cells
Positions of chromosomes are symmetrical in sister cells
but different in pairs of cousin cells
111. Symmetrical arrangements of chromosome territories #4 (red), #7 (blue), and #21 (green) in daughter HeLa cells visualized by
What a role do different stages of mitosis play in chromosome shuffling ?112.
Хромосомы перемещаются друг относительно друга в прометафазеShuffling of chromosomes takes place in prometaphase
Порядок хромосом в метафазе сохраняется в телофазе
During telophase, the chromosome arrangement establis
in metaphase is mainly retained
In telophase / early G1, chromosomal arrangement may b
modified by specific movements of gene-dense and
gene-poor chromosomes
Позиции хромосом могут модифицироваться в соответствии
с обогащенностью генами в телофазе\G0
113.
ConclusionsThe arrangement of chromosome territories is ordered
with regard to size and gene-content of chromosomes
Расположение СТ зависит от величины хромосомы и ее насыщенностью
генами
Chromosome territories do not move significantly
during the interphase
СТ не двигаются в интерфазе
The positions of chromosomes in the interphase nucleus are
basically predetermined by their positions in mitotic cells
Позиция хромосомы в метафазной пластине определяет позицию СТ в ядре
Neighborhoods of chromosomes are different
between individual cells. Reshuffling of chromosomes
takes place during the prophase - prometaphase transition
114.
University of MunichDepartment of Biology II
Chair of Anthropology
and Human Genetics
Thomas Cremer Laboratory:
Andreas Bolzer
Alessandro Brero
Felix Habermann
Claudia Weierich
Marion Cremer
Hide Tanabe
Michaela Neusser
Stefan Müller
Kirchhof-Institute of Physics,
University of Heidelberg
Christoph Cremer Laboratory:
Johann von Hase
Enzo Calcagno
Gregor Kreth
J.Wienberg, University of Munich (LMU)
M.Ferguson-Smith, University of Cambridge
M.Speicher, Technical University of Munich (TU)
Lothar Schermelleh
Joachim Walter
Daniela Köhler
A.Jauch, University of Heidelberg
K.Sullivan, Scripps Research Institute
W.C.Earnshaw, University of Edinburgh
115.
116. Conclusions
Cell. 2009 137(2):356-68.Nuclear architecture of rod photoreceptor cells adapts to vision in
mammalian evolution.
Solovei I, Kreysing M, Lanctôt C, Kösem S, Peichl L, Cremer T,
Guck J, Joffe B






























































































 biology
biology








