Similar presentations:
Электролиз. Электроды
1.
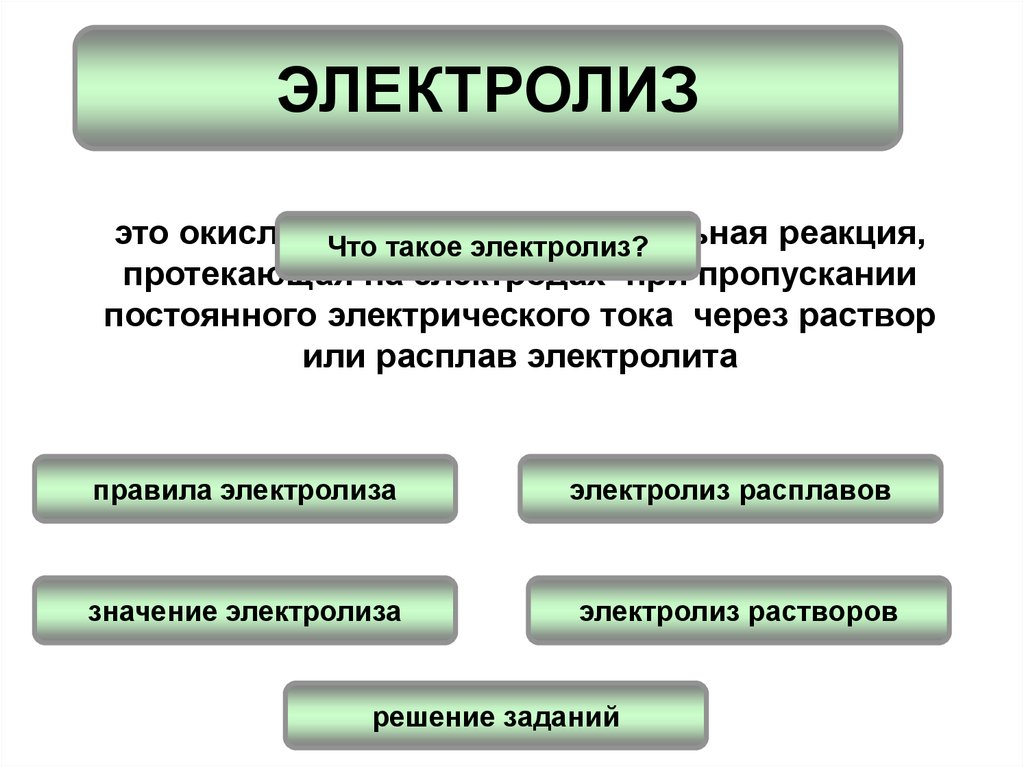
ЭЛЕКТРОЛИЗэто окислительно-восстановительная
реакция,
Что такое электролиз?
протекающая на электродах при пропускании
постоянного электрического тока через раствор
или расплав электролита
правила электролиза
электролиз расплавов
значение электролиза
электролиз растворов
решение заданий
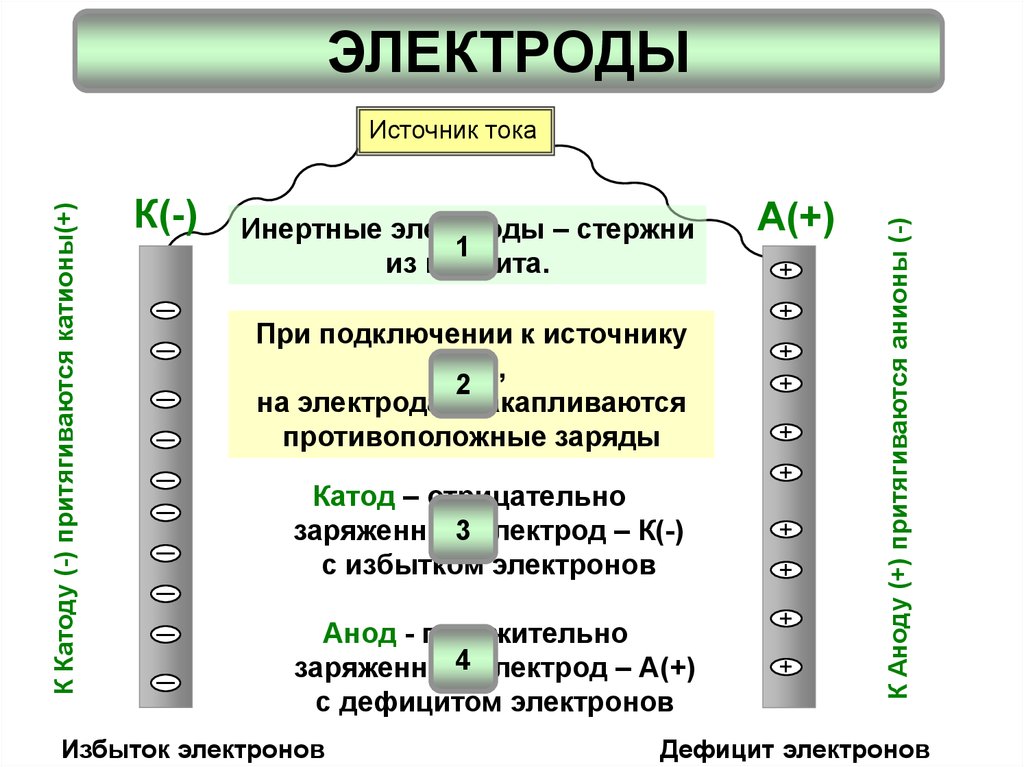
2. ЭЛЕКТРОДЫ
II
I I
+ +
I
Катод – отрицательно
заряженный3 электрод – К(-)
с избытком электронов
+ +
I
При подключении к источнику
тока,
2
на электродах накапливаются
противоположные заряды
А(+)
+ + + +
Инертные электроды – стержни
1
из графита.
I
+
I
Избыток электронов
+
I
Анод - положительно
4 электрод – А(+)
заряженный
с дефицитом электронов
К Аноду (+) притягиваются анионы (-)
К(-)
I
К Катоду (-) притягиваются катионы(+)
Источник тока
Дефицит электронов
3. правила электролиза
1. Электролизу предшествуетдиссоциация
2. На катоде К(-) протекает процесс
восстановления
3. На аноде А(+) – протекает процесс
окисления
4. электролиз расплавов
расплав NaClК(-)
В расплаве
сольэлектролиза
диссоциирует:
В Что
Что
чем
Уравнение
происходит
происходит
особенность
на
на
расплава?
катоде?
аноде?
+
NaCl
Na + Cl А(+)
I
I
I I
-
Cl
Cl
- 0
Na
-
+ +
I
Na+
+
Na+
I
I
К(-) Cl
Na
+
восстановление
-
-
0
Cl 2
+ +
-
2Cl
Na+
I
I
+
Cl
Na
А(+)2 Cl-
Cl
+ + + +
расплав NaCl состоит из ионов
I
+
I
+
I
+
Naокисление
Cl
Cl
Уравнение электролиза расплава хлорида
натрия:
+
Na
+
электролиз Na
2NaCl
(расплав)
2 Na + Cl2
5. электролиз растворов
Правила катодаПравила анода
Электролиз раствора
сульфата меди (II)
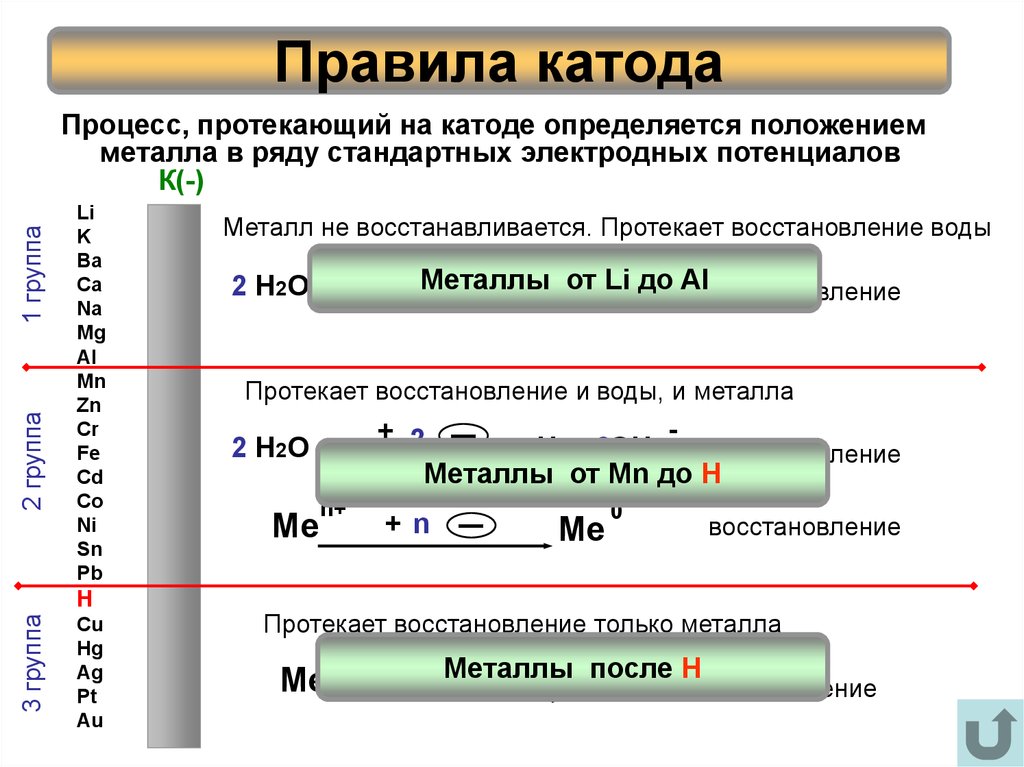
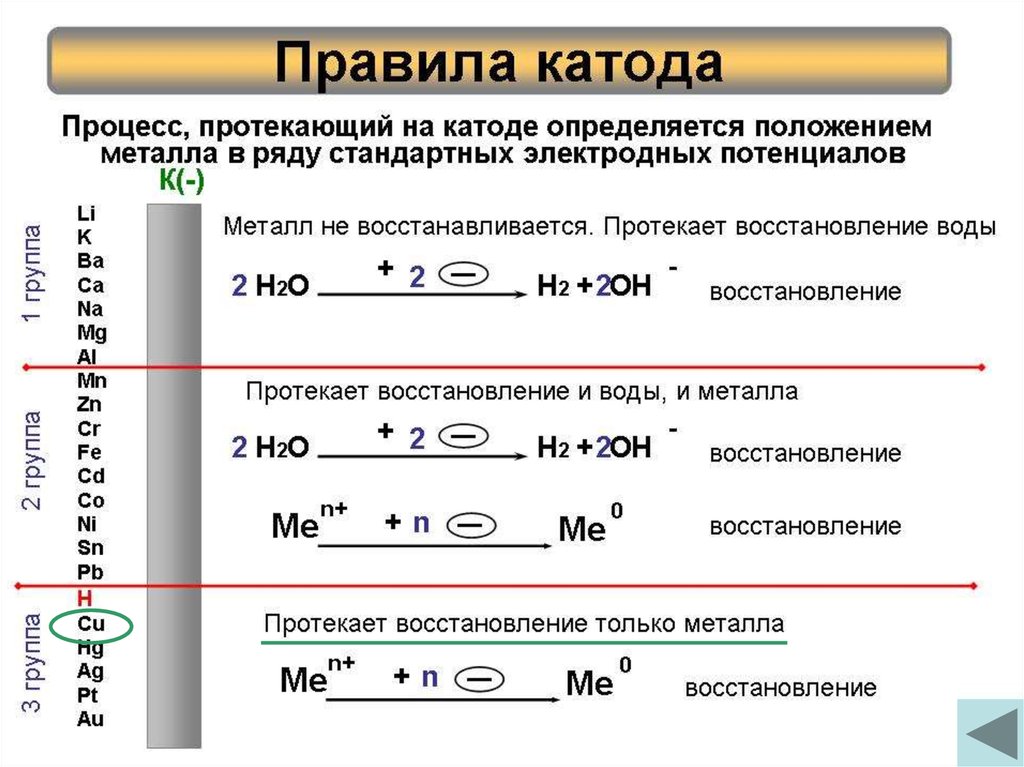
6. Правила катода
2 группа3 группа
2 Н 2О
Протекает восстановление и воды, и металла
+ 2
2 Н 2О
Н2 + 2ОН
восстановление
Металлы от Mn до H
Ме
n+
+n
Me
0
восстановление
Протекает восстановление только металла
Ме
n+
0
после
Н
+ n МеталлыMe
восстановление
I
Cu
Hg
Ag
Pt
Au
+ 2Металлы от Li до- Al
Н2 + 2ОН
восстановление
I
H
Металл не восстанавливается. Протекает восстановление воды
I
Li
K
Ba
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Cd
Co
Ni
Sn
Pb
I
1 группа
Процесс, протекающий на катоде определяется положением
металла в ряду стандартных электродных потенциалов
К(-)
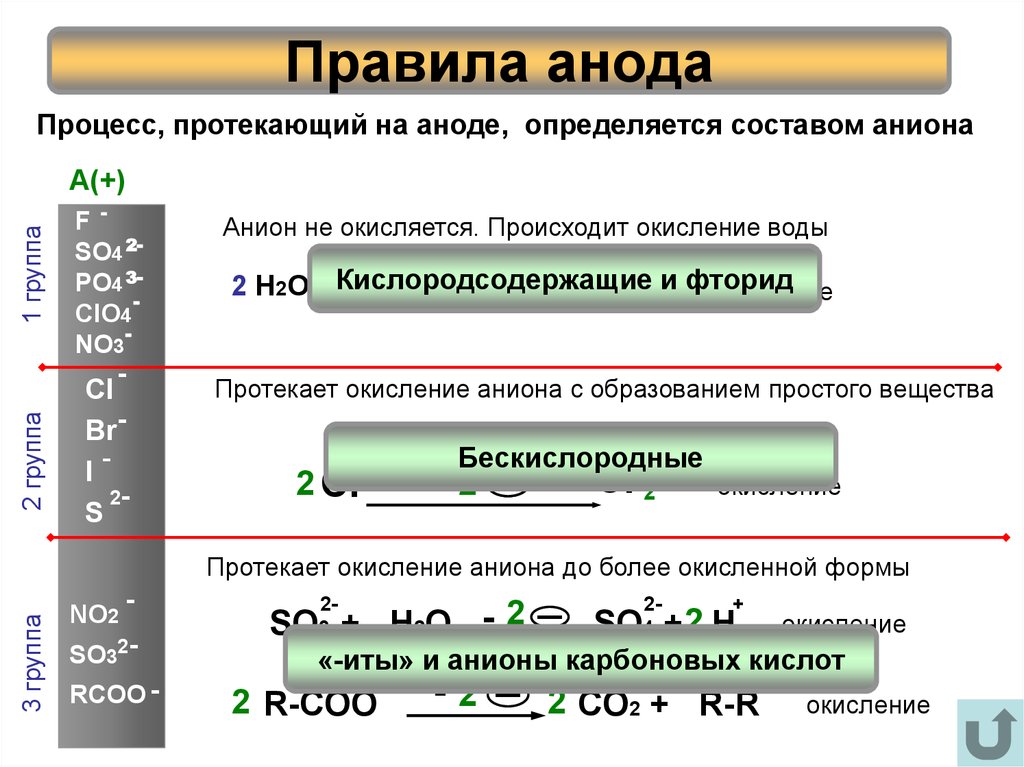
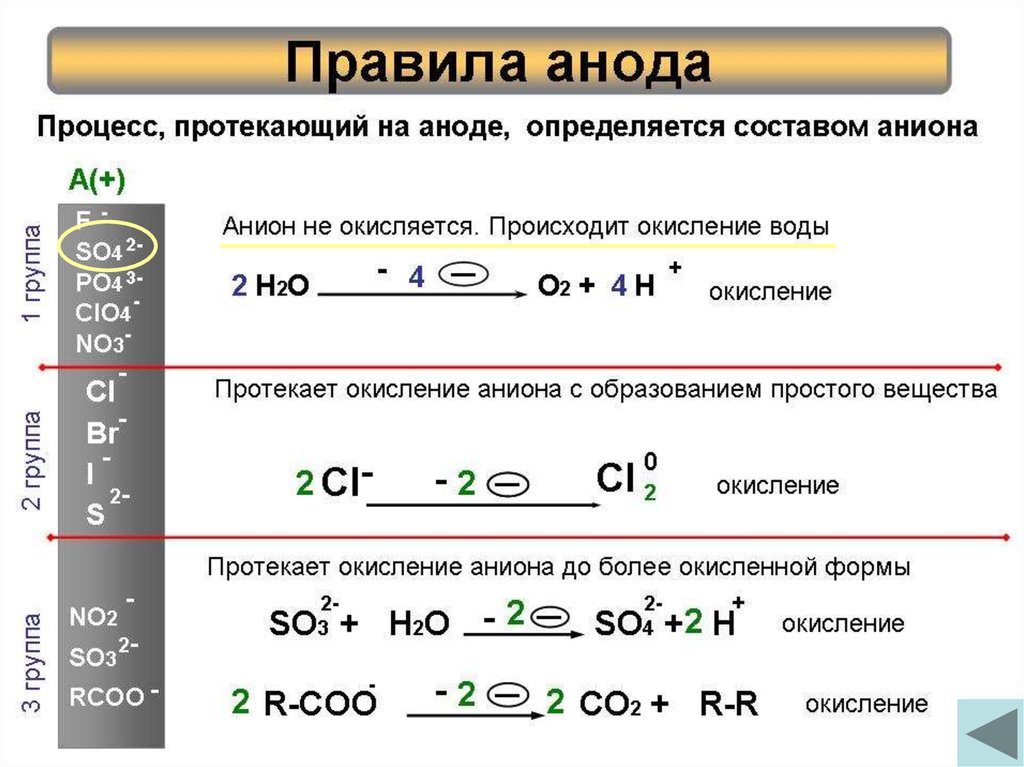
7. Правила анода
Процесс, протекающий на аноде, определяется составом анионаCl
BrI
2S
Анион не окисляется. Происходит окисление воды
+
- 4
Кислородсодержащие
и
2 Н 2О
О2 + 4 Н фторид
окисление
Протекает окисление аниона с образованием простого вещества
2 Cl-
Бескислородные
0
-2
Cl 2
I
2 группа
F SO4 2PO4 3ClO4
NO3
-
I
1 группа
А(+)
окисление
-
SO32RCOO -
23
SO + H2O - 2
I
NO2
24
+
SO +2 H
окисление
«-иты» и анионы карбоновых кислот
-
2 R-COO
-2
I
3 группа
Протекает окисление аниона до более окисленной формы
2 CO2 + R-R
окисление
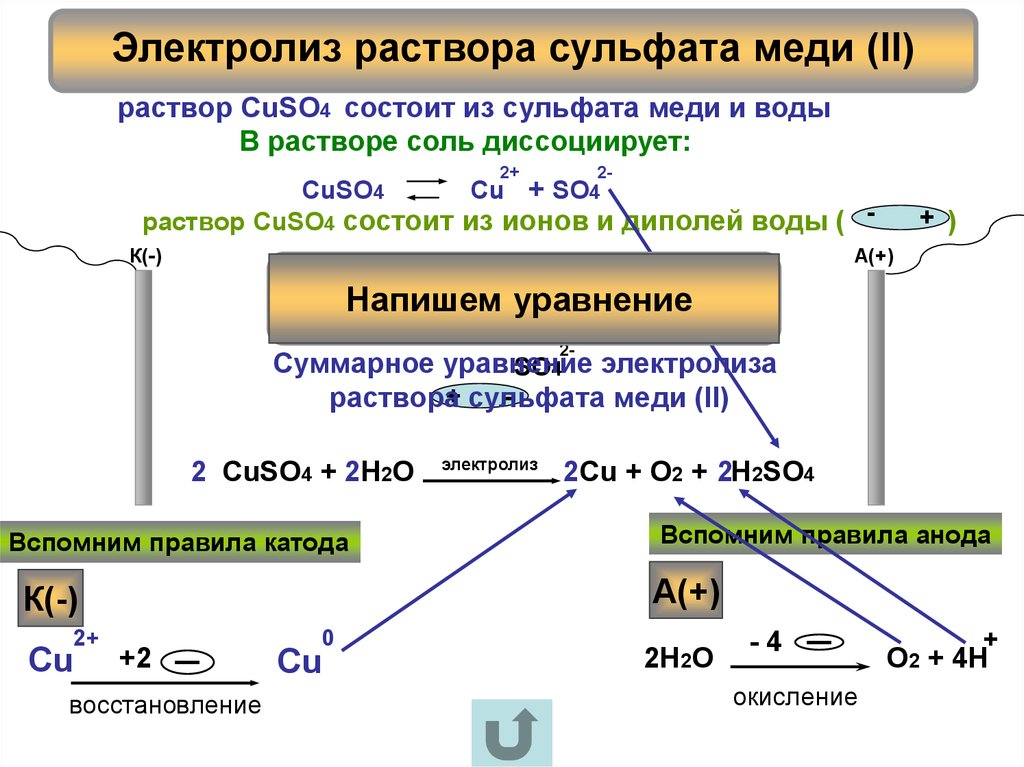
8. Электролиз раствора сульфата меди (II)
раствор CuSO4 состоит из сульфата меди и водыВ растворе соль диссоциирует:
2-
CuSO4
Сu + SO4
раствор CuSO4 состоит из ионов и диполей воды (
-
К(-)
+
2+
)
А(+)
2+
Какие частицы
будут участвовать
+ уравнение
Cu
Напишем
в окислении-восстановлении?
2-
Суммарное уравнение
SO4 электролиза
раствора+ сульфата
меди (II)
2 CuSO4 + 2H2O
Вспомним правила катода
Вспомним правила анода
восстановление
Cu
2Н2О
-4
I
+2
0
I
Cu
2Cu + O2 + 2H2SO4
А(+)
К(-)
2+
электролиз
окисление
+
О2 + 4Н
9.
10.
11. Значение электролиза
• Получение активныхметаллов (щелочных,
щелочно-земельных,
алюминия)
• Получение простых
веществ неметаллов (H2, Br2,
I2, F2, Cl2)
• Получение химически
чистых металлов
( кроме щелочных,
щелочно-земельных,
алюминия)
• Получение неметаллов
(H2, O2, Cl2)
• Получение
углеводородов (алканы)
• Получение щелочей.
12. Решение заданий
Задания по электролизу расплавов и растворовпо спецификации КИМов ЕГЭ
Блок В задание В4
13.
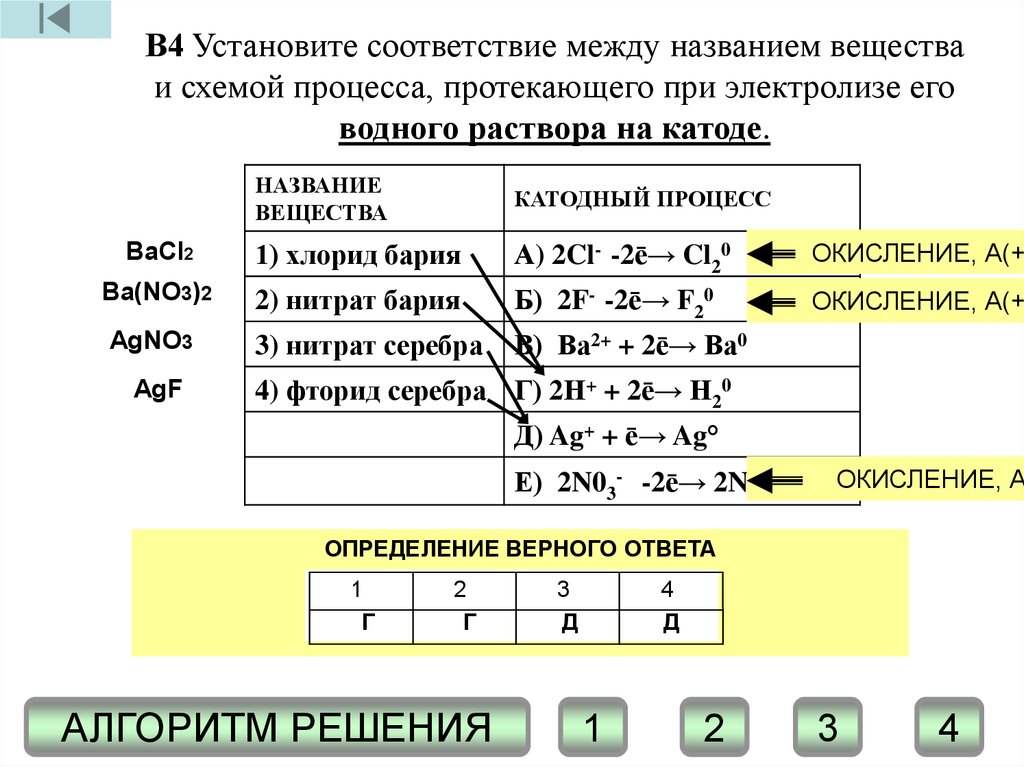
В4 Установите соответствие между названием веществаи схемой процесса, протекающего при электролизе его
водного раствора на катоде.
НАЗВАНИЕ
ВЕЩЕСТВА
КАТОДНЫЙ ПРОЦЕСС
BaCl2
1) хлорид бария
А) 2Cl- -2ē→ Cl20
ОКИСЛЕНИЕ, А(+)
Ba(NO3)2
2) нитрат бария
Б) 2F- -2ē→ F20
ОКИСЛЕНИЕ, А(+)
3) нитрат серебра
В) Ва2+ + 2ē→ Ва0
AgNO3
AgF
4) фторид серебра Г) 2Н+ + 2ē→ Н20
Д) Ag+ + ē→ Ag°
Е) 2N03- -2ē→ 2NO2 + 02 ОКИСЛЕНИЕ, А
ОПРЕДЕЛЕНИЕ
ВЕРНОГО
ОТВЕТА
1. СОСТАВЛЕНИЕ
ФОРМУЛ
ВЕЩЕСТВ
3.! ПРИМЕНЕНИЕ
НА КАТОДЕ
ПРОТЕКАЕТ
ПРАВИЛА ПРОЦЕСС
КАТОДА
ВОССТАНОВЛЕНИЯ
ПО ПОЛОЖЕНИЮ1КАТИОНА2В РЯДУ СТАНДАРТНЫХ
3
4 ЭЛЕКТРОДНЫХ
ПОТЕНЦИАЛОВ
Г
Г АНОДНОГО
Д
Д
2. ИСКЛЮЧЕНИЕ
ПРОЦЕССА
АЛГОРИТМ РЕШЕНИЯ
1
2
3
4
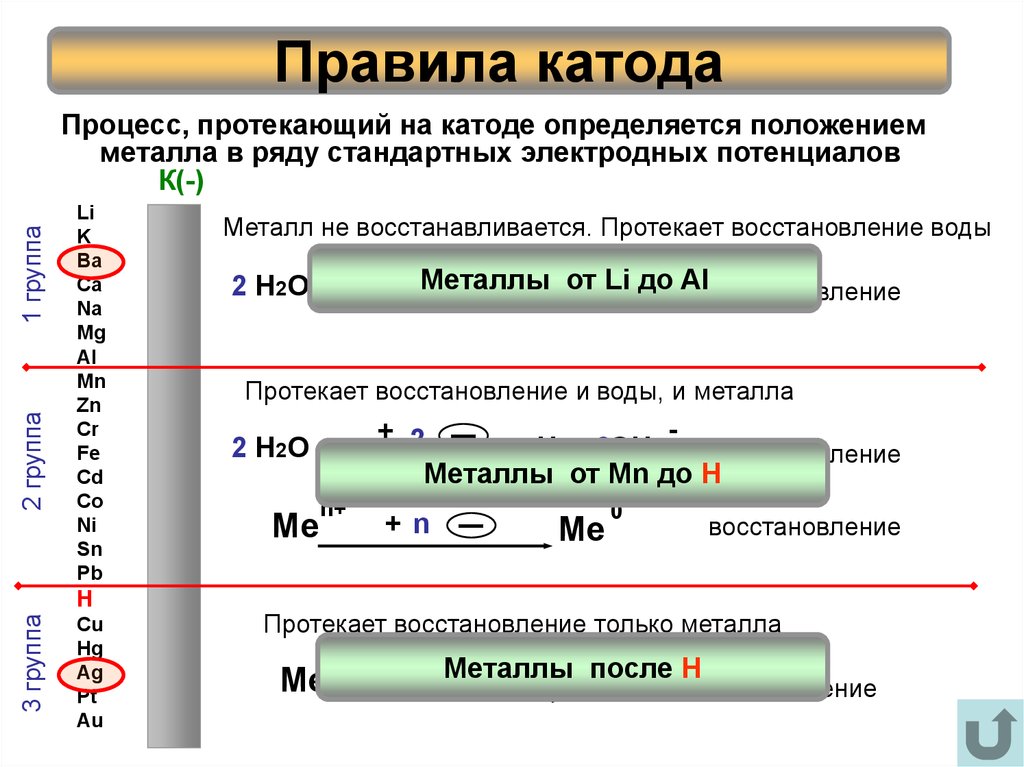
14. Правила катода
2 группа3 группа
2 Н 2О
Протекает восстановление и воды, и металла
+ 2
2 Н 2О
Н2 + 2ОН
восстановление
Металлы от Mn до H
Ме
n+
+n
Me
0
восстановление
Протекает восстановление только металла
Ме
n+
0
после
Н
+ n МеталлыMe
восстановление
I
Cu
Hg
Ag
Pt
Au
+ 2Металлы от Li до- Al
Н2 + 2ОН
восстановление
I
H
Металл не восстанавливается. Протекает восстановление воды
I
Li
K
Ba
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Cd
Co
Ni
Sn
Pb
I
1 группа
Процесс, протекающий на катоде определяется положением
металла в ряду стандартных электродных потенциалов
К(-)




 chemistry
chemistry








