Similar presentations:
Сероводородная кислота
1. Серо - водородная кислота
Алина Киналь 9П-112. История:
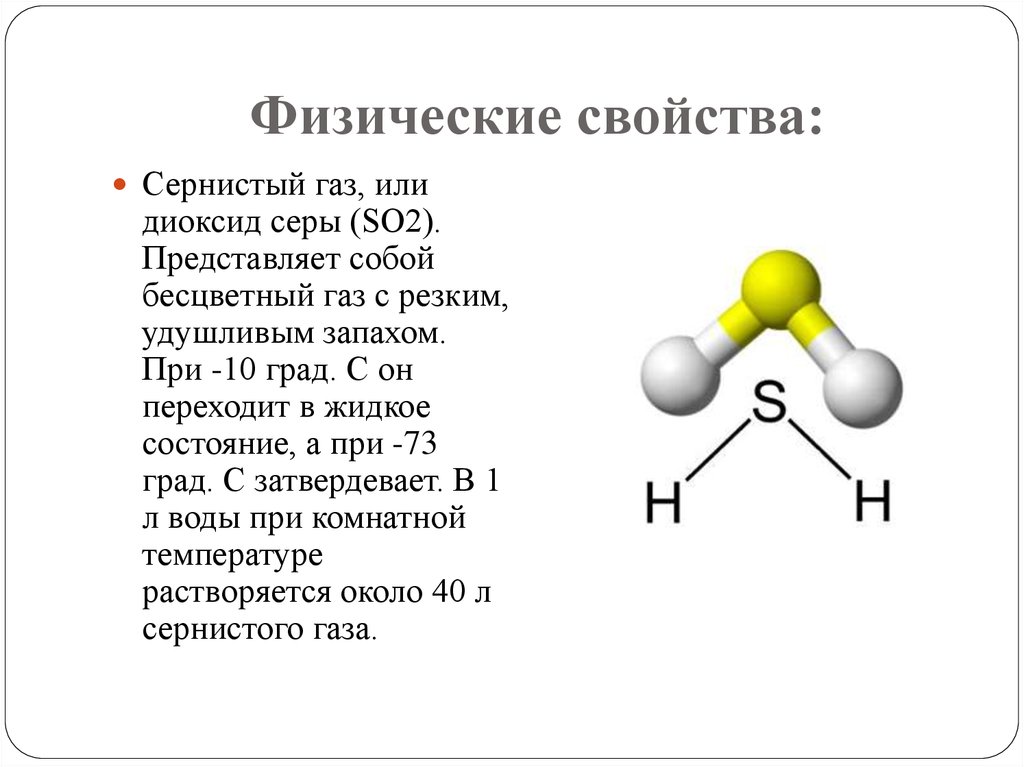
Сероводород (Н2S) -бесцветный газ с запахомтухлых яиц. При — 60 град. С он переходит в
жидкое состояние, а при — 86 град. С затвердевает.
В 1 л воды при комнатной температуре
растворяется около 2,5 л сероводорода. Он очень
ядовит. Признаки отравления сероводородом —
потеря обоняния, головные боли и тошнота.
Противоядие — свежий воздух.
3. Физические свойства:
Сернистый газ, илидиоксид серы (SO2).
Представляет собой
бесцветный газ с резким,
удушливым запахом.
При -10 град. С он
переходит в жидкое
состояние, а при -73
град. С затвердевает. В 1
л воды при комнатной
температуре
растворяется около 40 л
сернистого газа.
4. Химические свойства:
Кислота реагирует с :а) оснόвными оксидами (СаО);
б) основаниями (NaOH);
в) солями (CuSO4);
г) металлами (Са):
1) H2S + CaO = CaS + H2O;
2) H2S + NaOH = NaHS + H2O; H2S + 2NaOH = Na2S
+ H2O
3) H2S + CuSO4 = CuS↓ + H2SO4; г) H2S + Cа = CaS
+ H2
5. Получение:
Реакция разбавленной соляной кислоты ссульфидом железа (II)
FeS + 2HCl = FeCl2 + H2S
Взаимодействие сульфида алюминия с холодной
водой
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Прямой синтез из элементов происходит при
пропускании водорода над расплавленной серой:
H2 + S = H2S.
Нагревание смеси парафина с серой.
6. Применение:
В аналитической химии сероводород и сероводороднаявода используются как реагенты для осаждения
тяжёлых металлов, сульфиды которых очень слабо
растворимы.
В медицине — в составе природных и искусственных
сероводородных ванн, а также в составе некоторых
минеральных вод.
Сероводород применяют для получения серной
кислоты, элементной серы, сульфидов.
Используют в органическом синтезе для получения
тиофена и меркаптанов.
В последние годы рассматривается возможность
использования сероводорода, накопленного в глубинах
Чёрного моря, в качестве энергетического
(сероводородная энергетика) и химического сырья.






 chemistry
chemistry








