Similar presentations:
Острые и хронические эксперименты в ихтиотоксикологии
1.
4 ЛекцияОстрые и хронические эксперименты в
ихтиотоксикологии
2.
РЫБА КАК ТЕСТ-ОБЪЕКТ
Условия постановки экспериментов с рыбами
Подопытные рыбы и критерии их отбора
Наблюдения в естественных условиях
Лабораторные эксперименты
Острые опыты
Скрининг
Определение времени наступления гибели
Изучение сублетальных эффектов и обратимости действия токсикантов
Изучение влияния условий среды на токсичность вещества
Обсчет экспериментальных данных для получения величин полулетальных
концентраций (ЛК50)
Определение максимально допустимых концентраций (МДК), или предельно
допустимых концентраций (ПДК)
Определение минимальной летальной дозы вещества
Определение действия токсиканта в корме
Определение внешних симптомов токсикации
3.
ТОКСИКОМЕТРИЯ – совокупность методов иприемов исследований для количественной оценки
токсичности и опасности ядов.
Параметры токсикометрии
Первичные
(экспериментальные)
Производные
(вторичные)
4. Экспериментальные (первичные) параметры токсикометрии
5.
CL50 – концентрация средняя смертельная:вызывает гибель 50 % подопытных животных
(мыши, крысы, рыбы) при ингаляционном
воздействии в течение соответственно 2 и 4 ч и
последующем 14-дневном сроке наблюдения
(мг/м3, мг/л).
DL50 – доза средняя смертельная:
вызывает гибель 50 % подопытных животных при
однократном введении в желудок, брюшную полость
с последующим 14-дневным сроком наблю дения
(мг/кг).
6.
DL0 (CL0) – доза (концентрация) максимальнопереносимая:
наибольшее количество вредного вещества,
введение которого в организм не вызывает гибели
животных
DL100 (CL100) – доза (концентрация) абсолютно
смертельная:
наименьшее количество вредного вещества,
вызывающее гибель 100 % подопытных животных.
7.
Limac int – порог острого интегрального действия:минимальная доза (концентрация), вызывающая
изменения биологических показателей на уровне
целостного организма, которые выходят за пределы
приспособительных физиологических реакций.
Lim ac sp – порог острого избирательного
(специфического) действия:
минимальная доза (концентрация), вызывающая
изменения биологических функций отдельных органов и
систем организма, которые выходят за пределы
приспособительных физиологических реакций.
8.
Lim ch int – порог общетоксического хроническогодействия:
– минимальная доза (концентрация) вещства, при
воздействии которой в течение 4 ч по пять раз в
неделю на протяжении не менее 4 месяцев возникают
изменения, выходящие за пределы физиологических
приспособительных реакций, или скрытая (временно
компенсированная) патология.
Lim ch sp – порог отдаленных эффектов:
минимальная доза (концентрация) вещества,
вызывающая изменения биологических функций
отдельных органов и систем организма, которые выходят
за пределы приспособительных физиологических реакций в условиях хронического воздействия.
9.
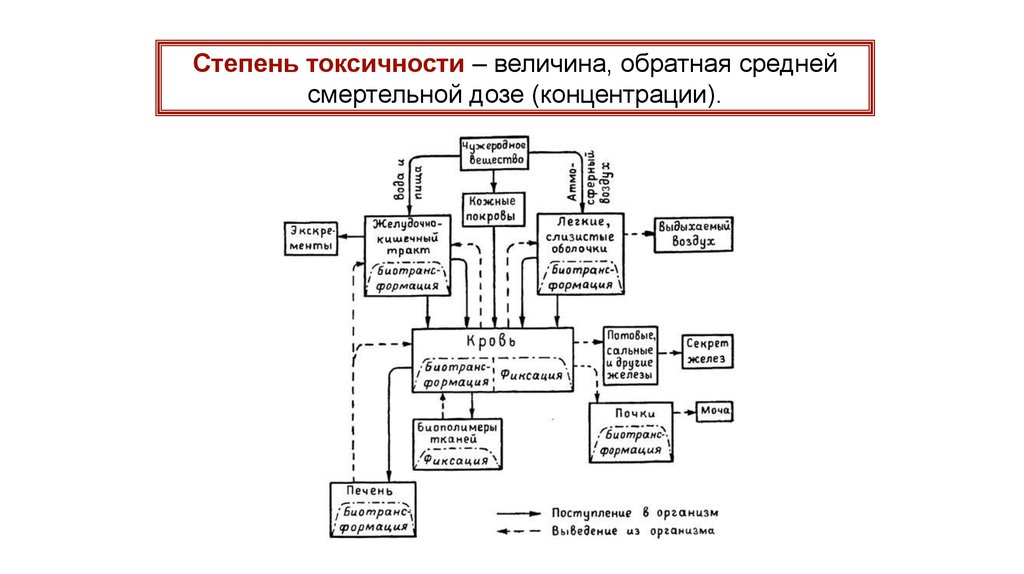
Степень токсичности – величина, обратная среднейсмертельной дозе (концентрации).
10.
вторичные(производные)
параметры
токсикометрии
11.
Полученные в острых опытах параметры токсичности(CL50 (средняя смертельная концентрация), Lim ac
inf (порог острого интегрального действия), Lim zcsp
(порог острого интегрального действия в зоне
хронического действия)) позволяют рассчитывать
зоны острого, хронического и специфического
действия, которые дают возможность оценить
опасность вещества.
Опасность оценивается двумя группами
количественных показателей:
- критерием потенциальной опасности;
- критерием реальной опасности.
12.
Потенциальная опасность определяется коэффициентомвозможного ингаляционного отравления:
КВИО = С20/СL50 ,
где С20 – насыщенная концентрация вредных веществ в воздухе при Т = 20 град. С, мг/м3.
Чем выше насыщенная концентрация вещества при комнатной
температуре и ниже средняя смертельная концентрация (знач. КВИО
больше), тем вероятнее возможность развития острого отравления.
Анализ оценки опасностей различных промышленных ядов по величине
КВИО показывает, что в ряде случаев малотоксичное, но высоколетучее
вещество в условиях производства может оказаться более опасным в
плане развития острого отравления, чем высокотоксичное, но
малолетучее соединение.
13.
О реальной опасности развития острого отравления можно судить повеличине зоны острого действия.
Зона острого действия (Zас) – это отношение средней
смертельной концентрации CL50 к пороговой концентрации Limac при
однократном воздействии:
Zас = CL50 / Limac.
Она является показателем компенсаторных свойств организма, его
способности к обезвреживанию и выведению из организма ядов и
компенсации поврежденных функций.
Чем меньше Zac, тем больше опасность острого отравления.
14.
Показателями реальной опасности развития хронической интоксикации являются значения зон хроническогои биологического действия.
Зона хронического действия (Zch) – отношение пороговой
концентрации при однократном воздействии Limac к пороговой концентрации
при хроническом воздействии Limch: Zch = Limac / Limch.
Величина Zch используется для характеристики опасности яда при хроническом воздействии. Опасность
хронического отравления прямо пропорциональна величине Zch. Зона хронического действия является
показателем компенсаторных свойств организма на низкомолекулярном уровне.
Зона биологического действия (Zbiol) – соотношение средней
смертной концентрации CL50 к пороговой концентрации при хроническом
воздействии Limch:
Zbiol = CL50 / Limch.
Чем больше значение Zbiol , тем выраженнее способность соединения к кумуляции в организме.
15.
Методики определения токсичности:ускоренный метод;
экспериментальный метод.
Scenedesmus quadricauda
Chlorella vulgaris
16.
В англоязычной литературе Zebrafish или zebra danio (рыбка-зебра),издавна использовались учеными как очень удобный модельный
объект.
Скрининг токсичности проводят с использованием как самих рыбок данио
рерио так и их эмбрионов.
Можно сказать, что данио рерио – это рыбий аналог лабораторной
белой мыши.
17. Практические использование развития Zebrafish
Быстрое развитие
Прозрачный эмбрион
Гомология развития
Легко манипулировать геномом
Недорогое обслуживание
Сотни эмбрионов
Продолжительность эксперимента: 6 дней
Из Airhart et al (2007)
Предоставлено J. Olin, A. Tennant и K. Jensen
18.
• ToxCast_320 Химические вещества• 309 химических веществ: в основном пестициды и пестицидные
метаболиты
• Внутри- и межпластинчатые дубликаты и тройные
• Многие химические вещества прошли испытания у
млекопитающих, включая контрольные тесты на токсичность
развития у крыс и / или кроликов.
(База данных ToxRef, http: //www.epa.gov/ncct/toxrefdb)
19.
Нерегулярные измененияЧастые изменения в органах
Отсутствует фин
Гранулярные органы
Замедленный фин (ы)
кровоизлияние
врожденное отсутствие
сердца Комков / Опухоли
брадикардия
Желтуха
Тахикардия
Кинк в хвосте
Увеличение сердца
лордоз
Трубное сердце
Сколиоз
брахицефалический
Eel-Like Body
Долихоцефалический / клюв
истощенный
микроцефальный
Задержка роста
микрофтальмия
Роллинг в сторону
Окулярный отек
плавучий
Недоразвитая челюсть
затрудненное дыхание
Увеличенные отолиты
Боковое положение
Дистальный торакальный регион
Не двигается / Не плавает
20.
Нормальнаяличинка
6-8 часов после оплодотворения
6 дней после оплодотворения
Патология в развитии
21. Пример кривых доза-реакция
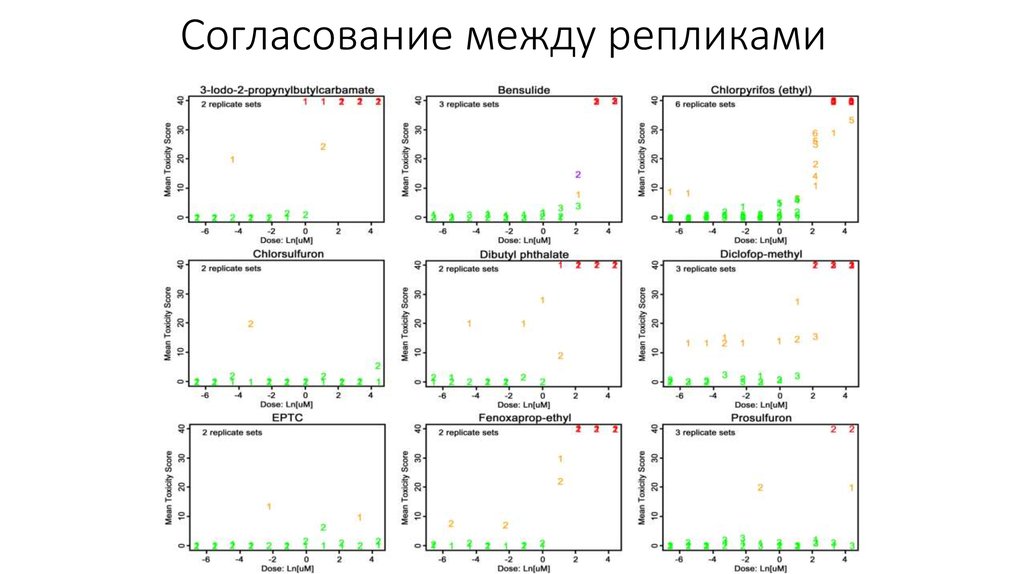
22. Согласование между репликами
23. Согласование с предыдущими данными
• Сравнение настоящих данных с данными о токсичности эмбрионов рыбокданио в базе данных ECOTOX, а также недавно опубликованные данные о
токсичности триазольных производных Hermsen, SA et al, 2011) химические
вещества, которые были положительными в базе данных ECOTOX и в
настоящем исследовании;
• Xимические вещества, которые были положительными в базе данных
ECOTOX, но отрицательные в настоящем анализе;
• Tриазольные производные, проверенные в вышеуказанных публикациях.
• Линия корреляции (пунктирная линия) соответствует положительным
химическим веществам, что приводит к наклону 1.07 и R2 = 0.79.
24.
Проявление изменений• Площадь
• P2A
• LWR
• Расстояние хвоста хвоста
• Длина позвоночника
• Ширина
• прямолинейность
• выпуклость
• искривление
25.
Ученые планировали сделать изфлуоресцирующих рыб индикаторы. По
задумке проф. Гонга они должны были
начинать светиться в присутствии
веществ-загрязнителей воды.
Кроме генетически модифицированных
данио рерио, медаки, атлантического
лосося разводят также ГМ карпов, ГМ
форель, ГМ тиляпию, ГМ канальных
сомиков, ГМ золотых рыбок.
26.
• Трансгенные данио рерио, полученные профессором Гонгом для научныхисследований
• Профессор Гонг вводил в геном данио рерио различные конструкции. В
частности, он соединял "миозиновый" промотор с GFP-геном. В этом случае
GFP синтезировался в мышечной ткани и вырастали зеленые
рыбы. Первоначально эти трансгенные рыбы использовались для
исследований по эмбриологии. В частности, выяснялась последовательность
развития в онтогенезе различных мышц.
27.
Таким образом, в геном GloFish введены сразу два трансгена. Однако взрослые рыбывыглядят просто красными, поскольку в тонком слое эпидермиса не может
накопиться GFP в количестве достаточном для того, чтобы его можно было увидеть
невооруженным глазом. При специальном освещении и при использовании
светофильтров можно обнаружить, что экспрессия GFP-гена продолжается и у
взрослой генетически модифицированной рыбки. Мышцы, где идет синтез RFP,
имеют значительный объем и в них накапливается много флуоресцентного белка,
определяющего окраску рыбы. С возрастом цвет и флуоресценция усиливаются
28.
• Аналогичные попытки использовать трансгенных светящихся даниорерио в качестве тест-организмов предпринимались сразу в
нескольких лабораториях.
• Были, например, созданы рыбки, которые действительно начинают
излучать свет в присутствии некоторых опасных загрязнителей
питьевой воды, таких как полихлорированные бифенилы (это сильные
канцерогены).
• В геном этих рыб были встроены гены светлячка связанные с
промотором, который активизирует их работу тогда, когда рыбы
испытывают стрессовое состояние.
• Разработку даже планировали внедрить в реальную практику
контроля водопроводной воды в графстве Клермонт штат Цинциннати
(США). (Источник: архив National Institute of Environmental Health
Sciences). Дело опять же окончилось ничем.
29.
• Работы по созданию быстрорастущего лосося• Предполагалась, что лососи и форели, улучшенные с помощью методов генной
инженерии, найдут народно-хозяйственное применение. Но выход на рынок генетически
модифицированных
промысловых
рыб
был
надежно
закрыт.
Однако американская фирма Aqua Bounty полна решимости не только преодолеть все
бюрократические барьеры, но добиться благосклонного отношения общественности к
своему продукту – AquaAdvantage® Salmon – очень быстро растущему
атлантическому лососю (Salmo salar), в геном которого "вставлены" гены другого
лосося – чавычи и морской холодноводной рыбы бельдюги.
• Генетически модифицированные лососи растут гораздо быстрее не модифицированных
рыб своего вида, что позволило бы снизить стоимость лососины в магазинах по
крайней мере на 30%.
30.
• Молодь атлантического лосося.Все рыбки одного возраста.
Легко узнать трансгенную
Сравнение скорости роста
генетически модифицированных
и обыкновенных лососей.
CHEMTECH , 30(6), 17-28, 1999.
31.
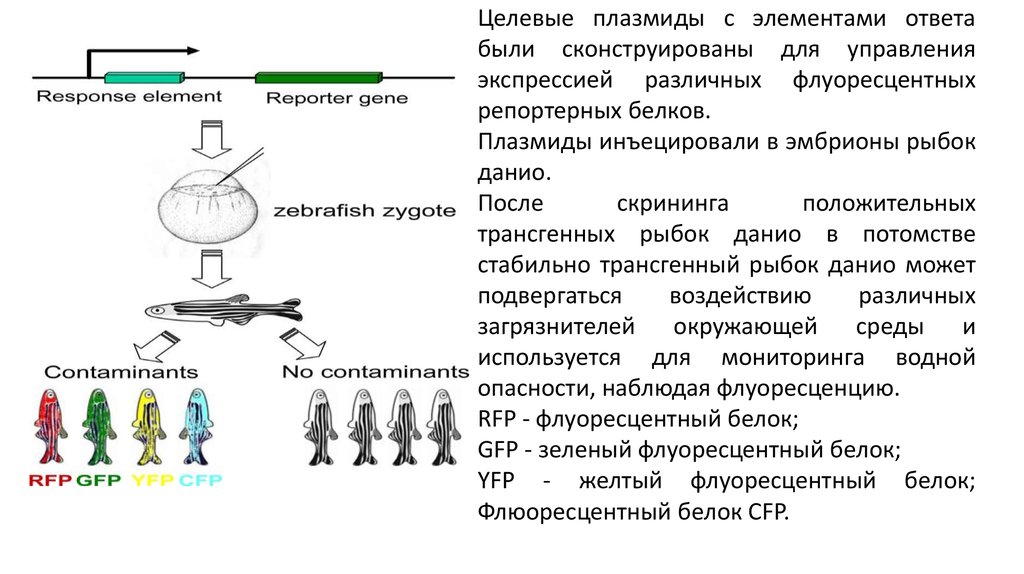
Целевые плазмиды с элементами ответабыли сконструированы для управления
экспрессией различных флуоресцентных
репортерных белков.
Плазмиды инъецировали в эмбрионы рыбок
данио.
После
скрининга
положительных
трансгенных рыбок данио в потомстве
стабильно трансгенный рыбок данио может
подвергаться
воздействию
различных
загрязнителей окружающей среды и
используется для мониторинга водной
опасности, наблюдая флуоресценцию.
RFP - флуоресцентный белок;
GFP - зеленый флуоресцентный белок;
YFP - желтый флуоресцентный белок;
Флюоресцентный белок CFP.
32.
Работа с трансгенными рыбами в лабораторияхкорпорации Тайконг – крупнейшего производителя
флуоресцирующих аквариумных рыб.
33.
34.
Трансгенные
под
данио-рерио
флуоресцентным
микроскопом.
При
освещении
светом
они
зеленым
присутствию
синим
светятся
благодаря
в
эпидермальных клетках GFP
• Эмбрионы Данио быстро развиваются и
долгое время остаются почти прозрачными.
• Bзрослые рыбы с ослабленной пигментацией
в немалой степени сохраняют это свойство.
• Поэтому, если организм трансгенной рыбы
приобретёт
способность
производить
флуоресцентный белок, то свечение легко
будет наблюдать даже в том случае, когда
экспрессия встроенного в её геном гена будет
происходить в тканях, расположенных под
кожей и во внутренних органах. Сходными
свойствами обладает и японская рисовая
рыбка – медака (Orizias latipes).
• Тайваньские и японские исследователи
получили флуоресцирующих и медак, и данио.
35.
Одна и та же пятидневная личинка, сфотографированная приосвещении белым светом (1),
синим светом (2) для выявления места экспрессии GFP-гена (кожа) и
зеленым светом (3) для выявления места экспрессии RFP-гена
(мышцы спины).
36.
Описание экспериментаРыбы:
Данио
рерио
(розовые,
флуоресцентные)
Начало
эксперимента:
08.10.15
внутримышечно капсулы с SNAF/Dextran
(9500-95000 шт. на рыбу)
+ 14.10.15 внутримышечно капсулы
6 шт. на рыбу)
Fluorescein/BSA
(2250*10
Конфокальная
Окончание эксперимента: 23.10.15
микроскопия
«лица» малька
Фиксация: формалин 10%, рН 7.5
данио рерио
Толщина срезов: 7 мкм
Окраска: гематоксилин-эозин
37.
При осмотре полученных срезов через флуоресцентный микроскоп обращает насебя внимание то, что практически все ткани рыб имеют очень яркую
флуоресценцию, с четко выраженной внутриклеточной локализацией красителя.
Особенно яркой флуоресценцией обладают эритроциты, содержимое ооцитов и
гранулы в гепатоцитах.
почка
Капилляры
с эритроцитами
х10
Флуоресценция на срезах тканей (Ex. 484-504, Em. 517-537 nm).
38.
ЭритроцитыПочечные
канальцы
х10
Почка
Мышцы
39.
ЖабрыСосуды
Жаберные
ламеллы
х10
Капилляры
ламелл
Эпителий ламелл
Пилорические
клетки
Эритроциты
х60
40.
Почках10
Почечные
канальцы
х60
эритроциты
41.
ПочкаОкрашенные
канальцы
Неокрашенные
канальцы
х20
х40
42.
Мозгх40
43.
Кишечникх20
44.
Ооцитых10
Оболочка
ооцита
Разрыв оболочки и
выход содержимого
х10
Гранулы
х60
45.
Объектов по размеру и форме похожихна капсулы (UFO) на гистологических
срезах не обнаруживается, или они
единичны
46.
МышцыUFO
х20
Мышцы (слева) и препарат капсул (справа) при одинаковом увеличении
47.
МышцыUFO
Эритроцит
х60
х60
Мышцы (сверху) и препарат капсул (снизу) при одинаковом увеличении
48.
Впечени
рыб
обнаруживается
множественное точечное свечение.
Исходя из того, что «точки», похоже,
локализованы внутри клеток паренхимы
печени и по размеру меньше капсул, это,
видимо,
включения
в
цитоплазме
гепатоцитов.
49.
Сосудх40
Гранулы
Паренхима
х60
Печень
Препарат
капсул (ув. х60 р.)
50.
паренхимах20
х40
Печеночный проток
Х60
Печень (слева, центр) и препарат капсул (справа) при одинаковом увеличении
51.
1. На гистологических срезах через 7 днейпосле введения капсул с флуоресциином
самих капсул не обнаруживается (кроме
единичных случаев, которые могут быть
артефактами).
2.
Цитоплазма
клеток,
особенно
эритроцитов, а также включения в
гепатоцитах и ооцитах демонстрируют
сильную флуоресценцию с эмиссией около
530 нм.
52.
Выводы:1. Капсулы могут теряться при нарезке тканей и
депарафинизации, а могут быть полностью
разрушены в организме.
2. Эозин обладает мощной флуоресценцией в
том же диапазоне длин волн что и
флуоресцеин, что также затрудняет поиск
капсул с флуоресцеином
3. Необходимо делать препараты каждой партии
капсул (иммобилизованные под стеклом) для
контроля
53.
54.
55.
56.
Потенциал микробиологического загрязненияQ = 4q /d,
где Q – потенциал бактериального
загрязнения, КОЕ/м3;
q – бактериальная плотность КОЕ/м2;
d – диаметр трубопровода, м.
57.
•При одной и той же концентрации выраженность и исход токсическогопроцесса меняются в зависимости от времени действия яда на организм:
• определение величины летальной или пороговой концентрации экспозиция,
т. е. время контакта рыбы с ядом, длится до появления признака (смерть
или другая патологическая реакция)
Различают:
1. кратковременные
загрязнения,
продолжительностью
1-2
ч
(кратковременный контакт рыб с ядом).
2. более длительные (несколько часов, дней, недель и т. д.)
• фактор времени приобретает особое значение при определении пороговых
и предельно допустимых концентраций токсического агента.
В опытах на уклейке с углекислым аммонием, 24 ч наблюдения, выявили
летальную концентрацию, равную 50 мг/л, по азоту [(NН4)2СО3].
Увеличение времени контакта рыб с ядом до 15 дней приводило к гибели рыб
при концентрации яда в 2 раза меньшей - 24 мг/л.
58.
• В опытах с ураном, торием и стронцием по данным М. М.Телитченко, длительное действие небольших концентраций
этих радионуклидов на дафний (Daphnia magna) приводило к
гибели или уменьшению потомства и задержке полового
созревания.
• Увеличение продолжительности опытов с 20- 40 до 400 дней
позволило выявить повреждающее действие урана на уклеек
(дегенерация яичников) даже при концентрации 1мг-ионов/л
(эта концентрация в 50-100 раз меньше, чем вызывающая гибель
рыб в течение нескольких недель).
59.
• Отмирание личинок лосося приразвитии в чистой воде и в воде,
содержащей нелетучие фенолы:
• а - температура воды в реке;
• б и в - экспериментальные данные:
• 1 - контроль, развитие в чистой воде;
• 2 - развитие в воде из р. Наровы;
• 3 - в воде, содержащей нелетучие
фенолы в концентрации 3 мг/л;
• 4 - то же, с концентрацией 6 мг/л;
• 5 - в разбавленной (1 : 1) воде из р.
Плюсса, начало опыта 9/V;
• 6 - то же, начало опыта 17/V;
• 7 - в неразбавленной воде из р.
Плюсса;
• 8 - в воде, содержащей нелетучие
фенолы в концентрации 12 мг/л;
• 9 - то же, при концентрации 15 мг/л;
• 10 - то же, при 50 мг/л (по Вернидуб,
1962).
60.
• В опытах на сеголетках (140 особей) и взрослых карасяхбыло установлено, что при температуре 13-15°С,
кислородном насыщении 5-6,5 мг/л, рН 7,3-7,6,
жесткости 9,2-10,6° за 96 ч наблюдений концентрация
фенола 25 мг/л приводила к развитию лишь некоторых
симптомов фенольной интоксикации без летального
исхода.
61.
• Увеличение продолжительности опытов до 10 суток при этой жеконцентрации яда вызвало гибель всех испытуемых рыб.
• Анализ показывает, что по мере увеличения времени контакта
рыб с ядом нарастает сила летального эффекта, проявляющаяся в
постепенном увеличении процента гибели испытуемых рыб.
• Первыми гибнут наименее устойчивые особи.
• По мере увеличения контакта рыб с ядом нарастает токсический
процесс у более выносливых рыб.
62.
• В качестве показателя токсичности того или иногосоединения и уровня устойчивости рыб используют
время их выживания в токсическом растворе.
• В ряде работ используют и другие критерии
токсичности:
• 1) время погружения, необходимое для начала
токсического процесса;
• 2) время развития токсического процесса до некоторого
хорошо заметного уровня (время опрокидывания);
• 3) минимальное время экспозиции для наступления
токсического процесса (летальное время).
63.
• Первый критерий - время погружения - весьма близок по своему содержанию кпонятию «латентный период», т. е. промежутку времени между началом контакта
рыбы с ядом и первыми признаками отравления.
• Второй критерий определяет время наступления одного из наиболее показательных
признаков отравления, потерю рефлекса равновесия, т. е. «время опрокидывания»,
именуемое также «временем проявления» (manifestation time).
• Третий критерий - «летальное время» определяется на основе измерения времени
экспозиции, приводящего к развитию полностью или частично необратимого
отравления (важно при изучении спорадических загрязнений водоема).
• Четвертый критерий - «время выживания» (survival time) время, необходимое для
развития смертельного отравления.
Время гибели является одним из наиболее полноценных критериев токсичности
различных веществ и динамики изменения токсичности в зависимости от
концентрации вещества в опытах с острым отравлением.
64.
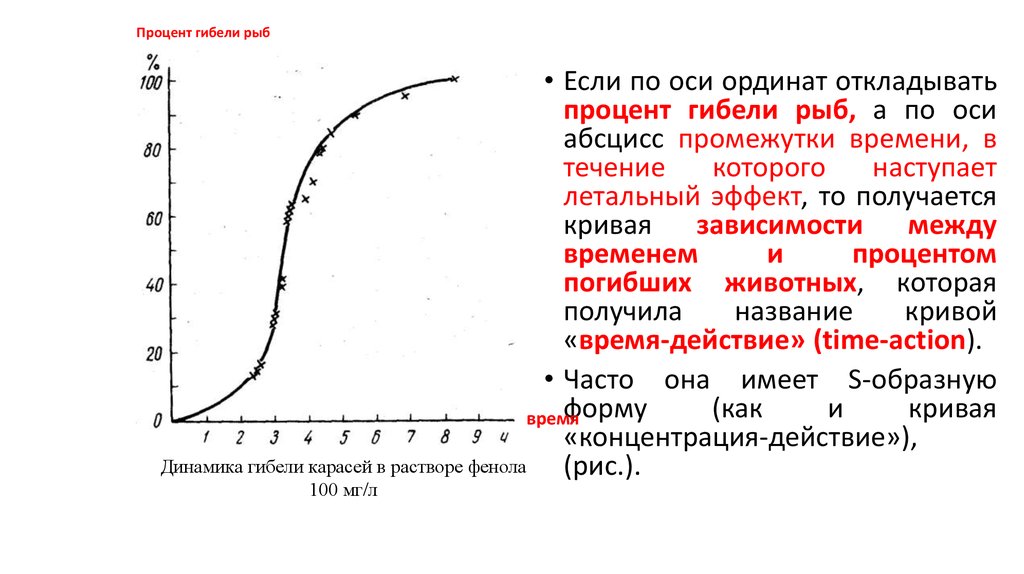
Процент гибели рыб• Если по оси ординат откладывать
процент гибели рыб, а по оси
абсцисс промежутки времени, в
течение
которого
наступает
летальный эффект, то получается
кривая зависимости между
временем
и
процентом
погибших животных, которая
получила
название
кривой
«время-действие» (time-action).
• Часто она имеет S-образную
форму
(как
и
кривая
время
«концентрация-действие»),
Динамика гибели карасей в растворе фенола
(рис.).
100 мг/л
65.
Время гибели при неизменнойконцентрации яда дает широко
рассеянный вариационный ряд.
Динамика гибели карасей в растворе фенола Распределение частот в таком ряду
200 мг/л
хотя
и
приближается
к
нормальному, однако нередко
существенно отклоняется от него.
Кривые бывают и другой формы
(рис.).
Динамика гибели сегодлеток карася в
растворе фенола 50 мг/л
66.
• Имеется несколько методов (Bliss, 1935; Litchfild, 1949), которые могут быть примененыдля исследования выпрямленных прямых и определения среднего летального времени
(LT50), а также стандартной ошибки этого показателя.
• Обычно на графике находят точки, соответствующие LT16, LT50 и LT84 (т. е. время гибели 16,
50 и 84% испытуемых животных).
• Величину стандартной ошибки в этом случае определяют либо по графику (функция
наклона прямой), либо по формуле:
67. ХАРАКТЕР ЗАВИСИМОСТИ «КОНЦЕНТРАЦИЯ-ВРЕМЯ» И НЕКОТОРЫЕ КОЛИЧЕСТВЕННЫЕ ВОПРОСЫ ТОКСИКОЛОГИИ РЫБ
Зависимость«концентрации-время»
(concentration-action)
приобрела в токсикологии рыб особое значение.
В 1917 г., Е. Пауэре (Powers) в опытах на золотой рыбке установил,
что выше определенной области концентраций время выживания
испытуемых рыб обратно концентрации и предложил формулу:
(С – a) t = K
где
С – концентрация;
а - теоретический порог;
t - время выживания;
К – постоянная
68.
Отношение между временем выживания иконцентрацией:
а – теоретический порог токсичности (по
Powers, 1917)
При нижних концентрациях, измеряемое время выживания
короче, чем это следует из уравнения, а при высоких больше,
чем теоретическая величина.
В графике, где концентрация откладывается по оси абсцисс, а
время выживания по оси ординат, то при интерполяции
экспериментальных данных кривая приобретает более или
менее сигмоидную форму и лишь средняя ее часть будет
прямой (рис.). Если продолжить эту прямую до пересечения с
осью абсцисс, то точку пересечения условно можно назвать
«теоретическим порогом токсичности».
69.
При количественной оценке полученных данныхавторы в качестве исходной использовали формулу:
Cnt = K,
где С - концентрация яда;
t - время гибели;
n и К. - константы.
Полученные экспериментальные данные не совпадали с
расчетными, вычисленными по этой формуле, поскольку фенол
(равно как и другие яды) имеет пороговую концентрацию, ниже
которой токсический эффект не проявляется, и минимальное
время отравления даже при больших концентрациях.
70.
• В связи с этим функция Сnt=K представляющая гиперболу сравноугольными асимптотами, претерпевала некоторые
изменения, если учитывалась Cs (пороговая концентрация) и
минимальное время токсического эффекта - Ts.
• С учетом этих поправок формула приобретала следующий
вид:
• (Тm – Ts) (C – Cs)n = K.
• При логарифмировании и перестановке получаем
• lg (Tm – Ts) = K – n lg(C – Cs)
71.
Отношение между временем выживания иконцентрацией яда.
По оси абсцисс - концентрация яда (в мг/л),
логарифмическая шкала;
по оси ординат - среднее время выживания рыб,
ч;
1- теоретически ожидаемая кривая;
2 - опытная кривая.
Форма кривых «концентрация время» весьма вариабильна для
различных ядов и в известной
мере зависит от механизма их
действия на организм.
Время
выживания
рыб
в
токсических растворах, вероятно,
определяется
механизмом
действия
ядов
и
большим
разнообразием других факторов.
.
72. Для определения среднего времени выживания использовали не обычную статистическую среднюю, а среднее геометрическое из периодов
выживания прикаждой концентрации яда, найденное по формуле
M. S. T. = antilog (lg T / N) ,
где М. S. T. (medial survival time) – среднее время
выживания;
Т – время выживания каждой рыбы;
N - число испытуемых рыб
73.
Рис. Отношение междуконцентрацией
цианидов и временем
выживания
радужной форели при
температуре 17,5°С
По оси абсцисс –
концентрация CN, мг/л;
по оси ординат – время
опрокидывания
(логорифмическая
шкала)
(по Herbert, Merkens,
1952)
74.
• В этом случае прямолинейная часть кривой, как и в опытах К.Вурмана и Х. Вокера (1950), могла быть представлена уравнением
Сnt=K
• В приведенных работах авторы имели дело с каким-то одним
ядом, химическая природа которого известна.
Гораздо
сложнее
рассчитывать
токсичность
различных
комбинаций ядов, встречающихся в сточных водах.
• Д. Олдердайс и Д. Бретт (Alderdice, Brett, 1957) опубликовали
результаты своих наблюдений по токсичности отходов
целлюлозного производства для молоди лосося и вывели
специальный гиперболический эквивалент для прямой линии:
U = a + βV,
• где U – обратная величина средних периодов выживания;
V – обратная величиная концентрации сточного материала.
75.
При нанесении на график логарифмов концентрации моющих средствпротив логарифмов средних периодов выживания была получена прямая
линия, выраженная уравнением:
lg T = K – n lg C,
где
Т – геометрическая средняя периода выживания;
С – концентрация активного материала, мг/л
К = 4,93;
n = 3,71.
К. Карпентер (Carpenter, 1927) выявил отличие кривой,
характеризующей форму зависимости времени гибели
испытуемых рыб от концентрации ряда тяжелых металлов, при
сопоставлении её с кривой Пауэрса. В этих опятах время
выживания (t) было свзано с концентрацией (С) уравнением:
(1/t) lg (1/C) = K,
где
К – постоянная.
76.
• Изучая зависимость токсического эффекта отконцентрации яда и времени его действия, Е. А. Веселов
(1965) пришел к выводу, что для расчета токсичности
неиспытанных концентраций (по времени гибели) может
быть использована формула Габера:
• W = Ct,
• где
W - токсический эффект;
С - концентрация яда;
t - время действия яда.
77.
Поскольку главной особенностью любой выборочнойсовокупности является наличие вариации между ее членами,
возникает необходимость измерения степени этой изменчивости.
Нередко с этой целью указывают амплитуду ряда распределения разность между наименьшей и наибольшей величинами,
получивших название лимитов ряда. Сопоставление лимитов ряда
не полностью характеризует степень изменчивости внутри
вариационного ряда. Поэтому для определения характера и степени
вариации или рассеивания используют среднее квадратическое
(стандартное отклонение)
и дисперсию
где
Σх2 - сумма квадратов отдельных
измерений;
n - число наблюдений;
М - средняя арифметическая.
78.
Cреднеквадратическоеамплитуду
абсолютную
колебаний
величину
отклонение
средней
от
(δ)
характеризует
арифметической,
средней
представляя
арифметической.
При
сопоставлении степени вариации отдельных рядов распределения
времени гибели (или другого показателя), измеренных в разных
единицах, удобнее использовать коэффициент вариации (υ),
показывающий, какую долю средней арифметической составляет
среднеквадратическое
отклонение.
рассчитывается по формуле:
Коэффициент
вариации
79.
Критерием точности средней арифметическойслужит средняя ошибка (mм) средней арифметической
представляющая
частное
от
деления
среднего
квадратического отклонения от выборочной средней на
квадратный корень из числа наблюдений в выборке.
80.
Существует несколько способов определения достоверностиразличия. Согласно одному из них различие считается достоверным,
если
Другой спосов основан на использовании так называемого
критерия t.
где
М1 и М2 – сравнимые средние арифметические; - суммы
квадратов отклонений членов вариации ряда от
их средних арифметических; n1 и n2 – количество наблюдений.
81.
Полученную величину t сопоставляют со значениемt, которое указано в строке с определенным количеством
животных, вычисленном по формуле
F = n1 + n2 - 2
по специальной таблице (Weber, 1957)
Если число испытуемых животных в двух
сопоставляемых сериях опытов одинаково, т.е.
n1 = n2, величина t может быть установлена по более
простой формуле:
82.
В тех случаях, когда характер распределения полученных экспериментальныхданных неизвестен, предпочтительнее использовать в качестве показателя
достоверности различия двух рядов распределения непарамётрйчёский критерий
Вилкоксона, основанный на числе инверсий. Для каждой пары рядов
распределения вычисляют математическое ожидание (М) числа инверсий (u):
где m и n - число наблюдений в каждом ряду, и среднее квадратическое
Приняв уровень значимости критерия q=5%, рассчитывают область больших
по абсолютной величине отклонений:
определяют положение полученного значения числа инверсий относительно
этой области.
Важное преимущество непараметрического критерия Вилкоксона состоит в том,
что он применим при обработке экспериментальных данных как
соответствующих нормальному распределению, так и отклоняющихся от него.
и















































































 biology
biology








