Similar presentations:
Репликация и экспрессии геномов ДНК-вирусов бактерий и эукариот
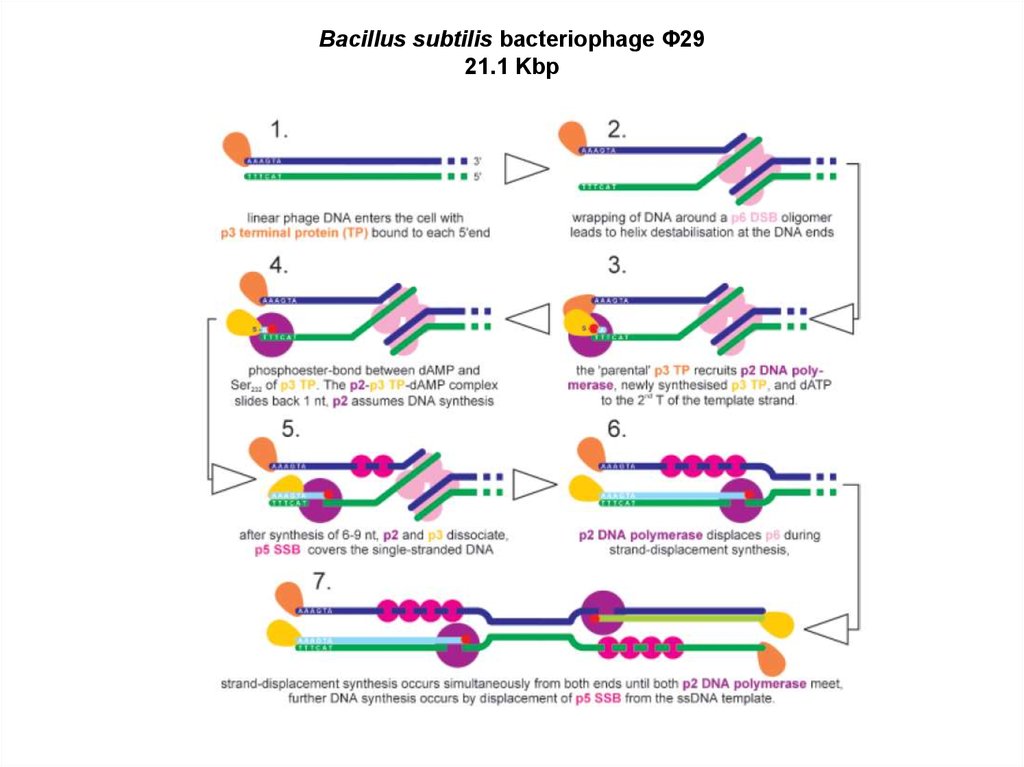
1.
Репликация и экспрессии геномовДНК-вирусов бактерий и эукариот
2.
3.
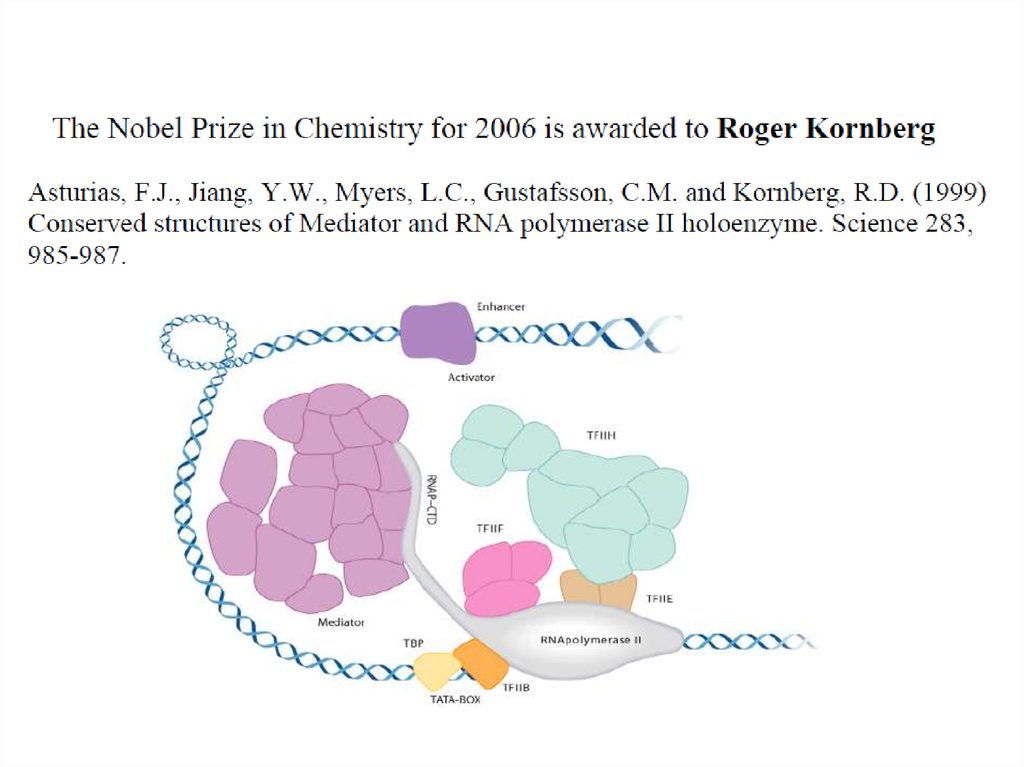
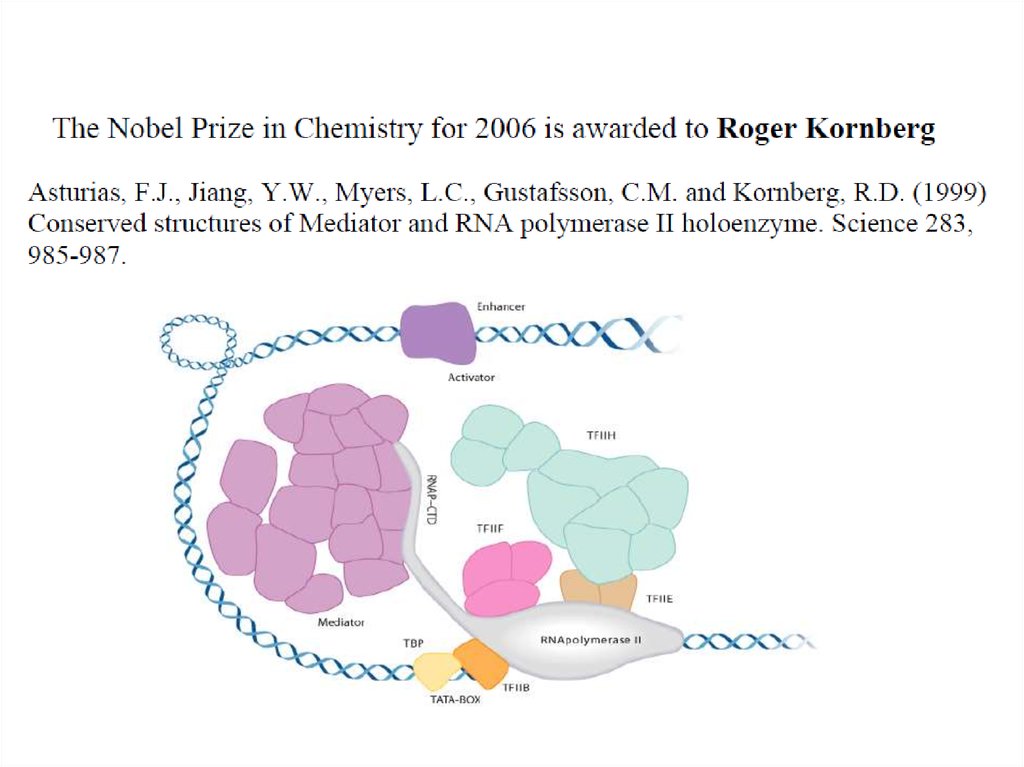
4. Роджер и Артур Корнберги
9080
70
60
50
40
30
20
10
0
1
3
кв
кв
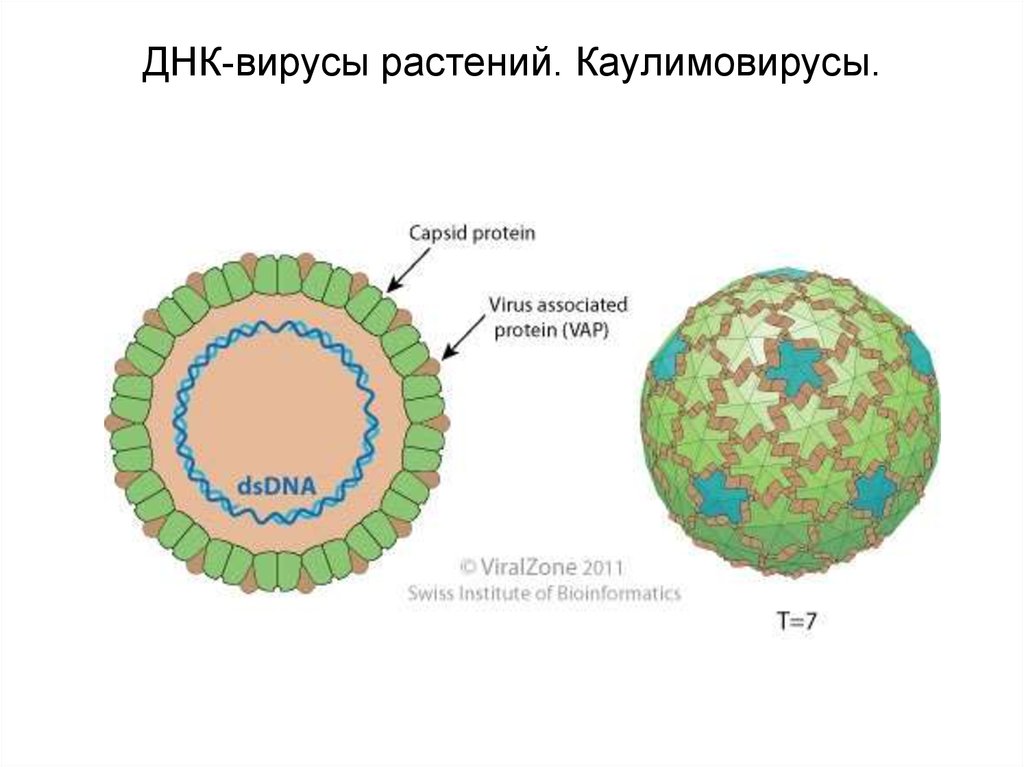
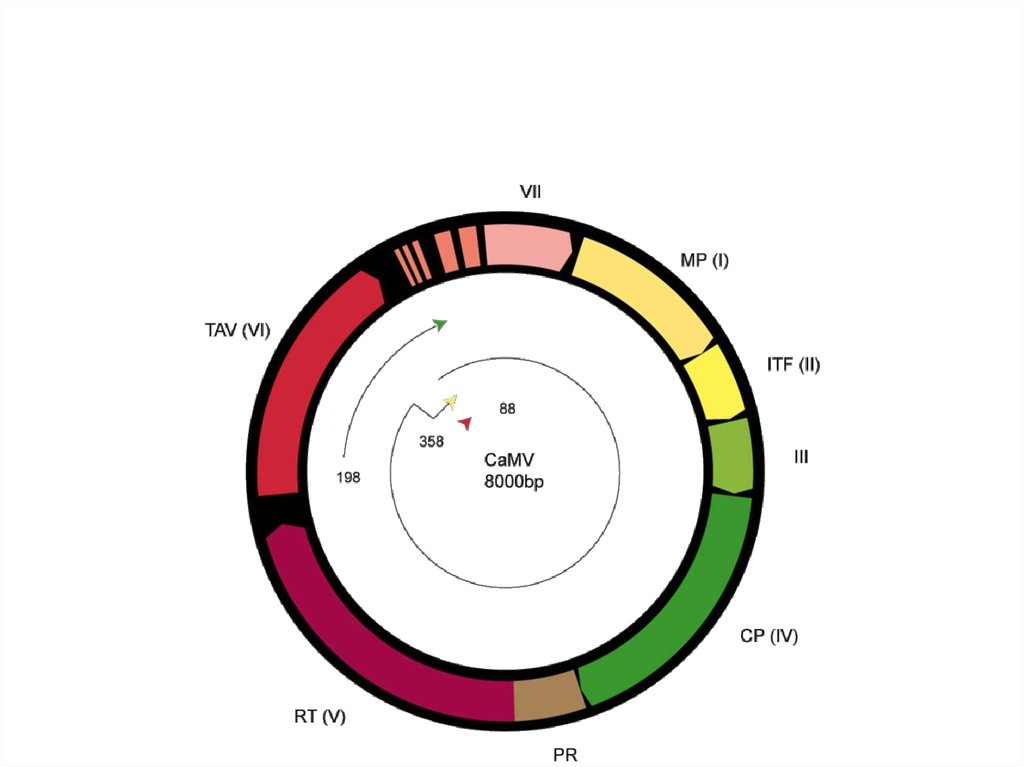
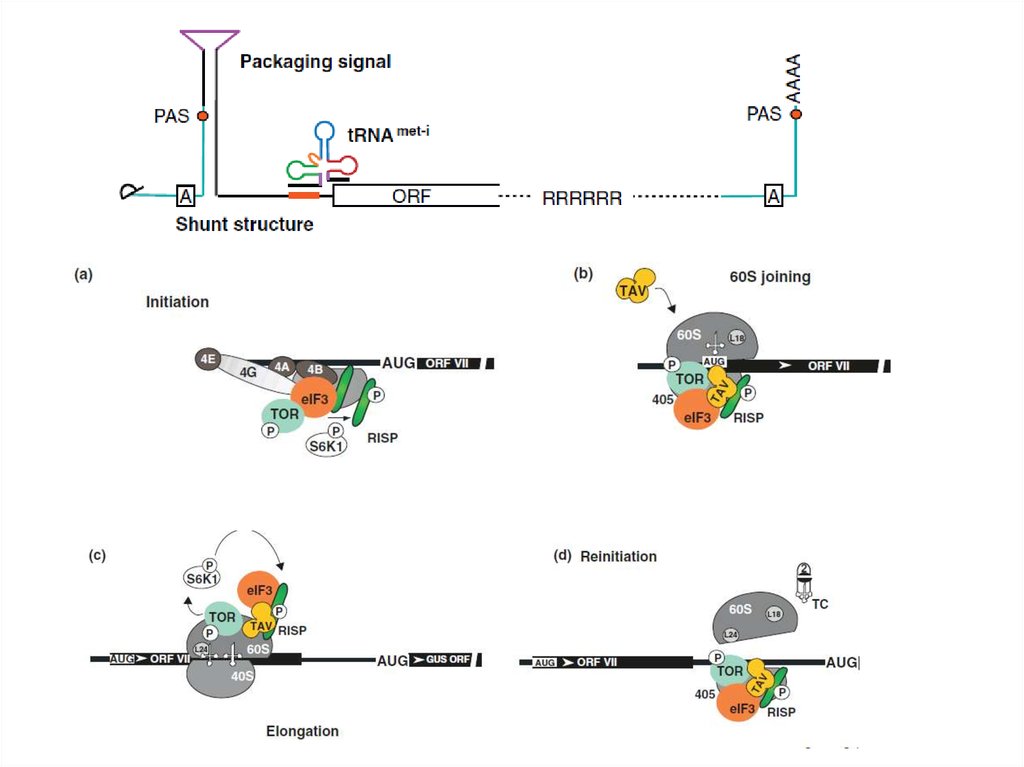
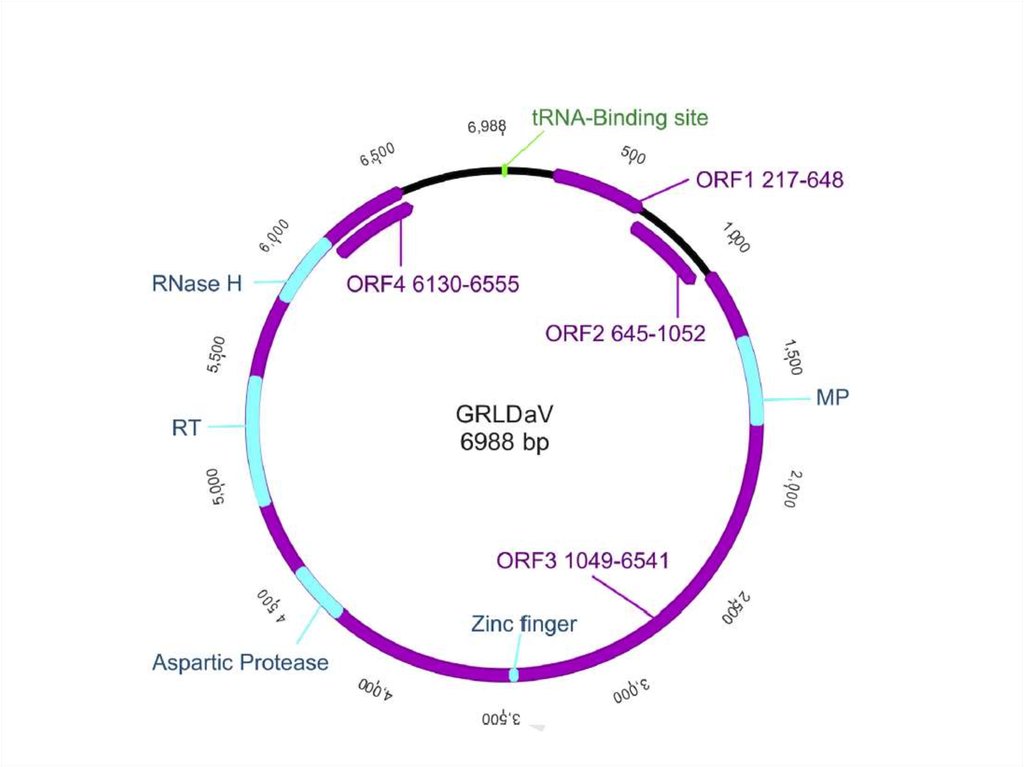
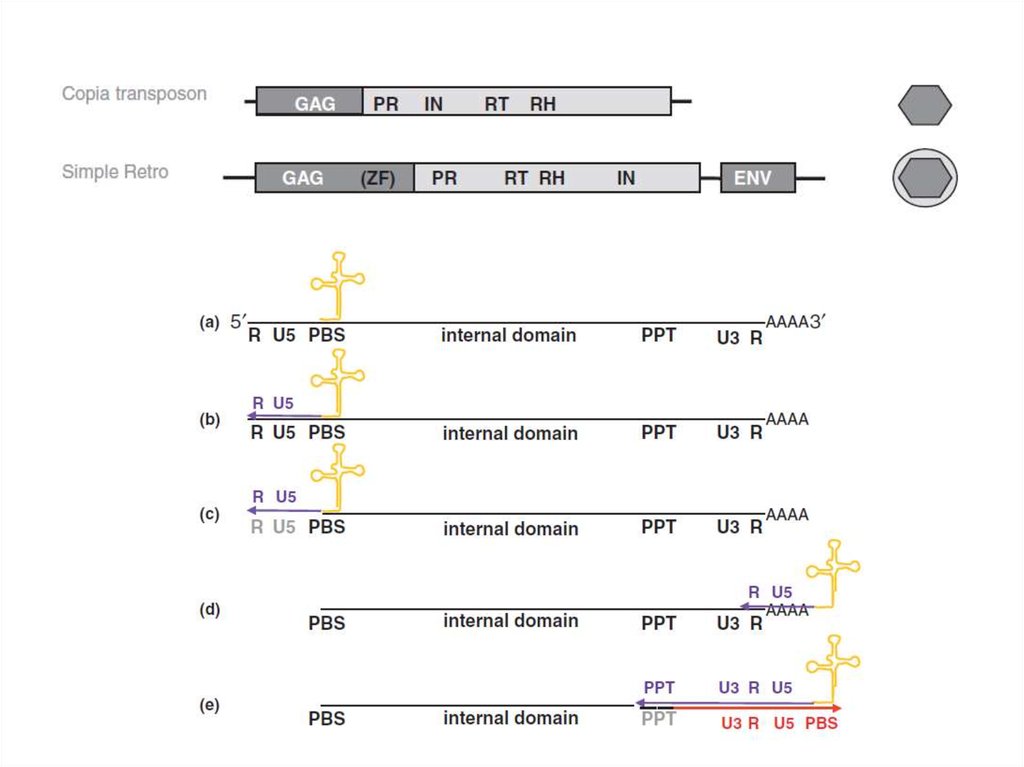
5. ДНК-вирусы растений. Каулимовирусы.
6.
7.
8.
9.
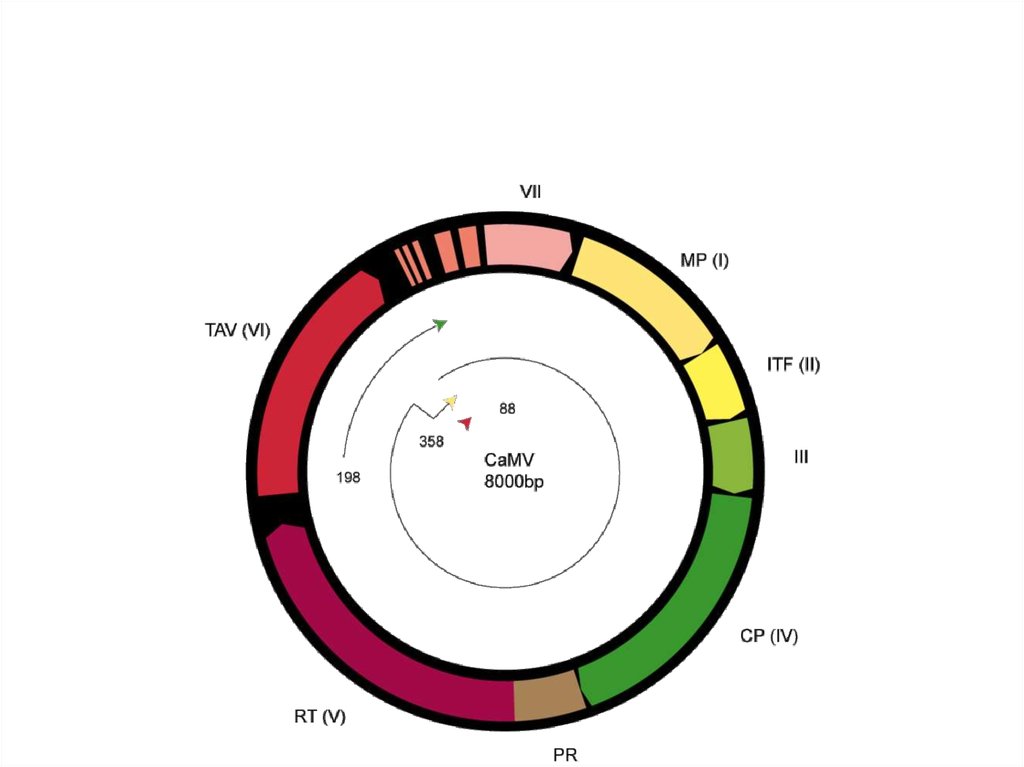
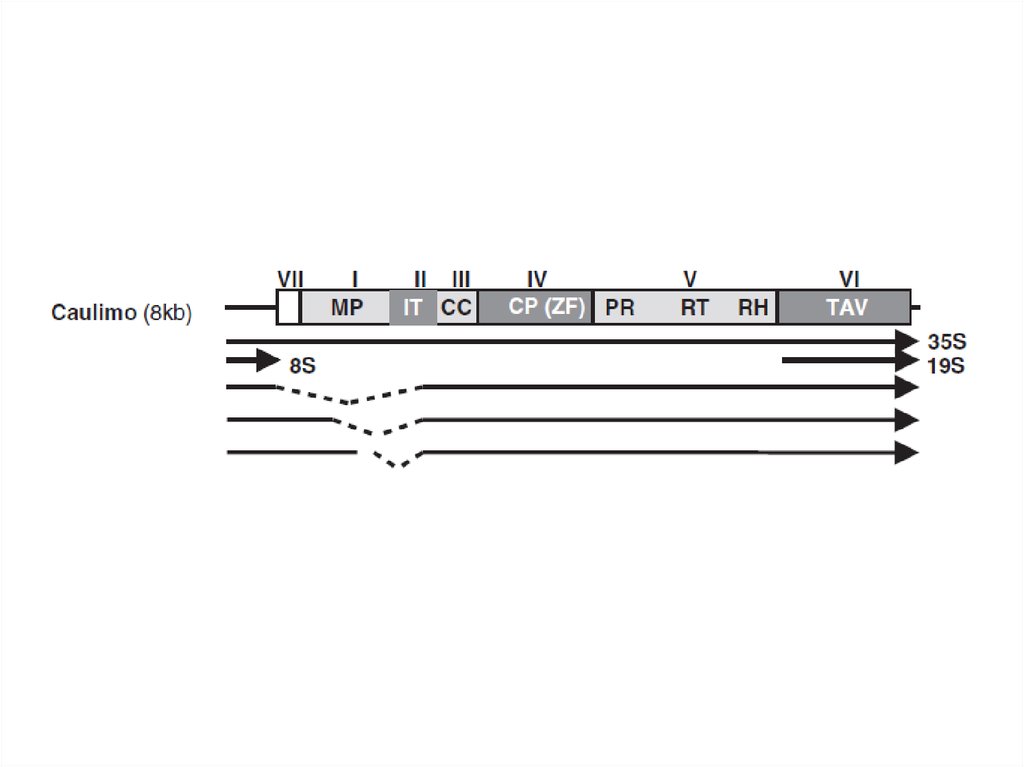
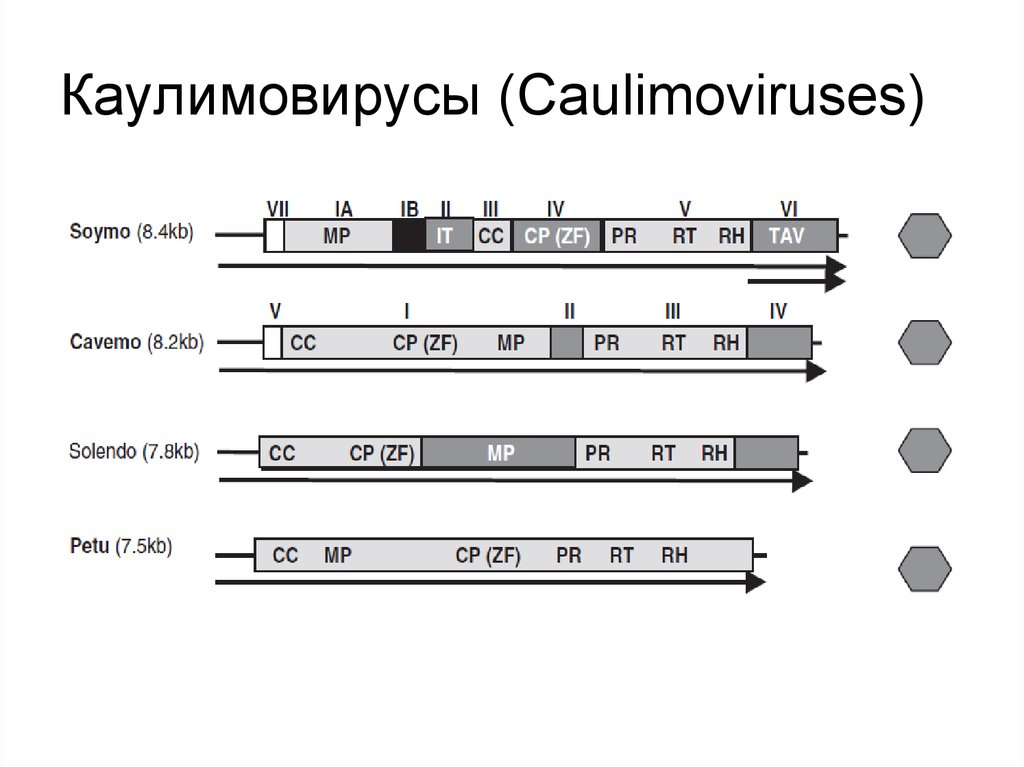
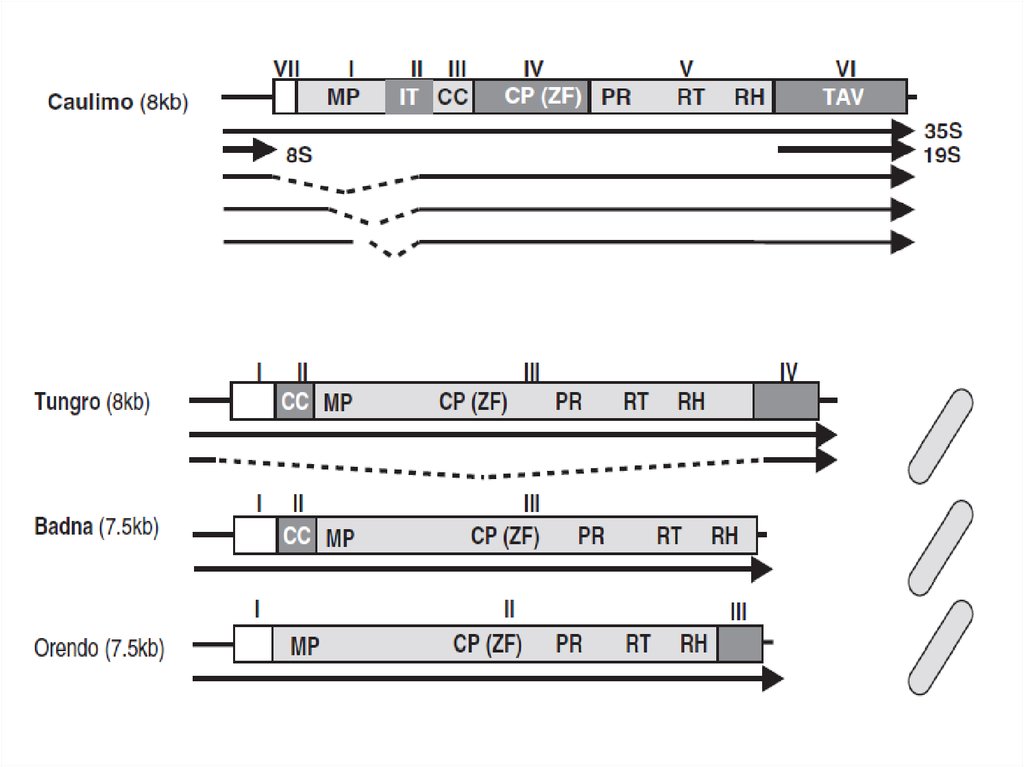
10. Каулимовирусы (Caulimoviruses)
11.
12.
13.
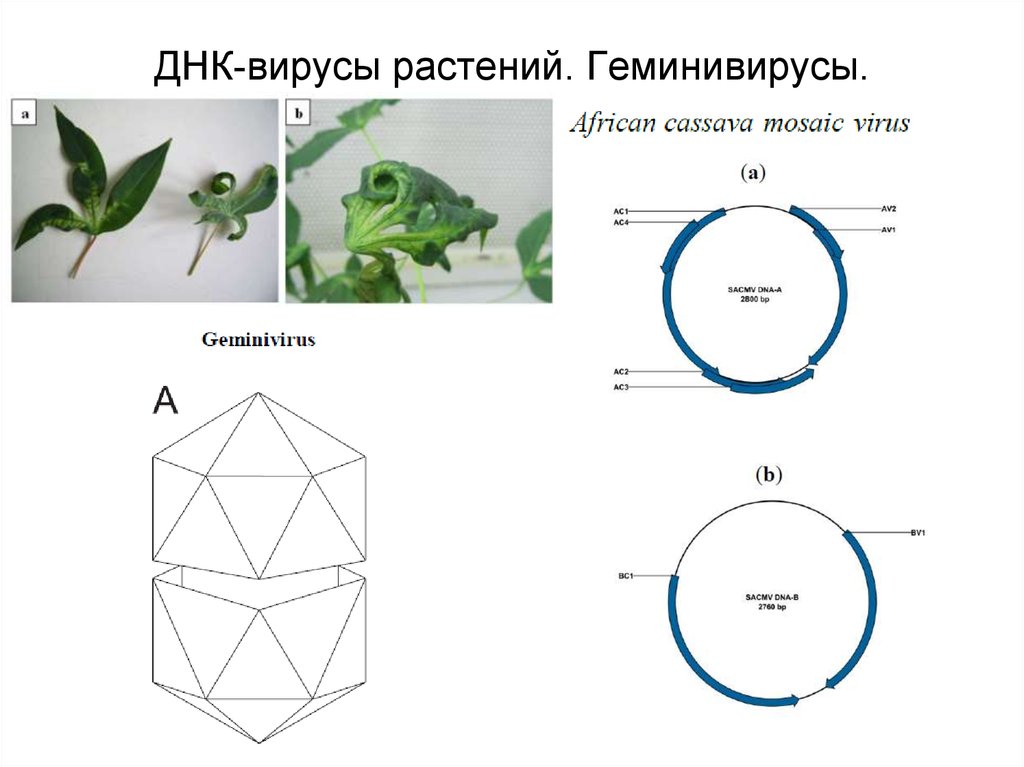
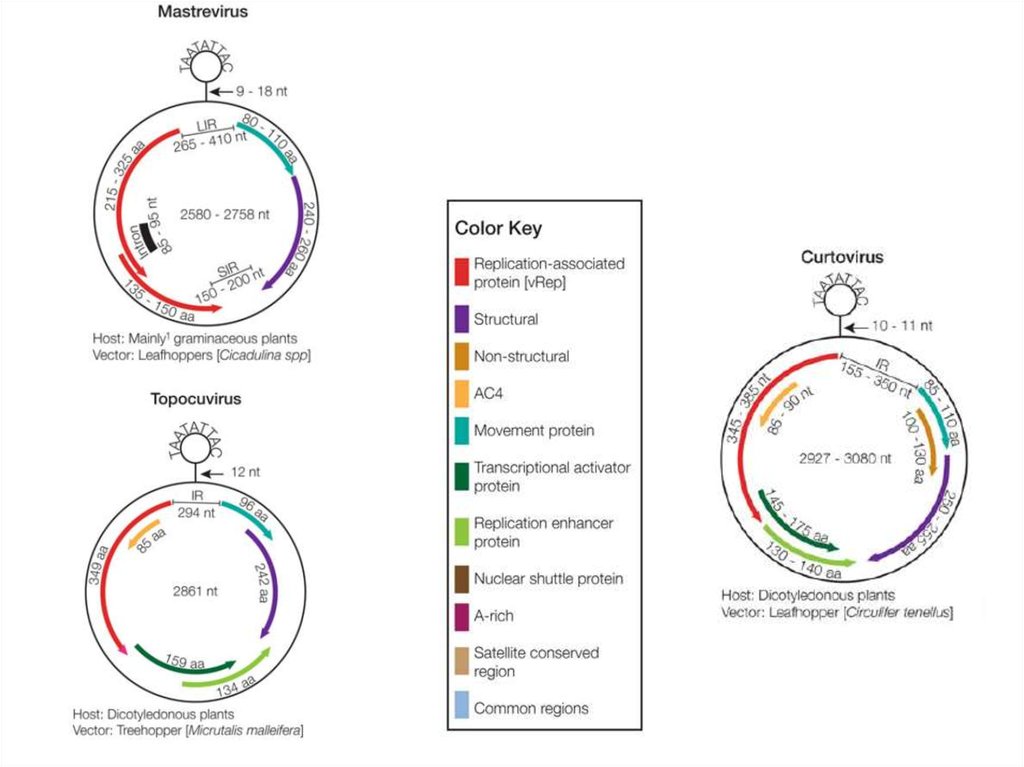
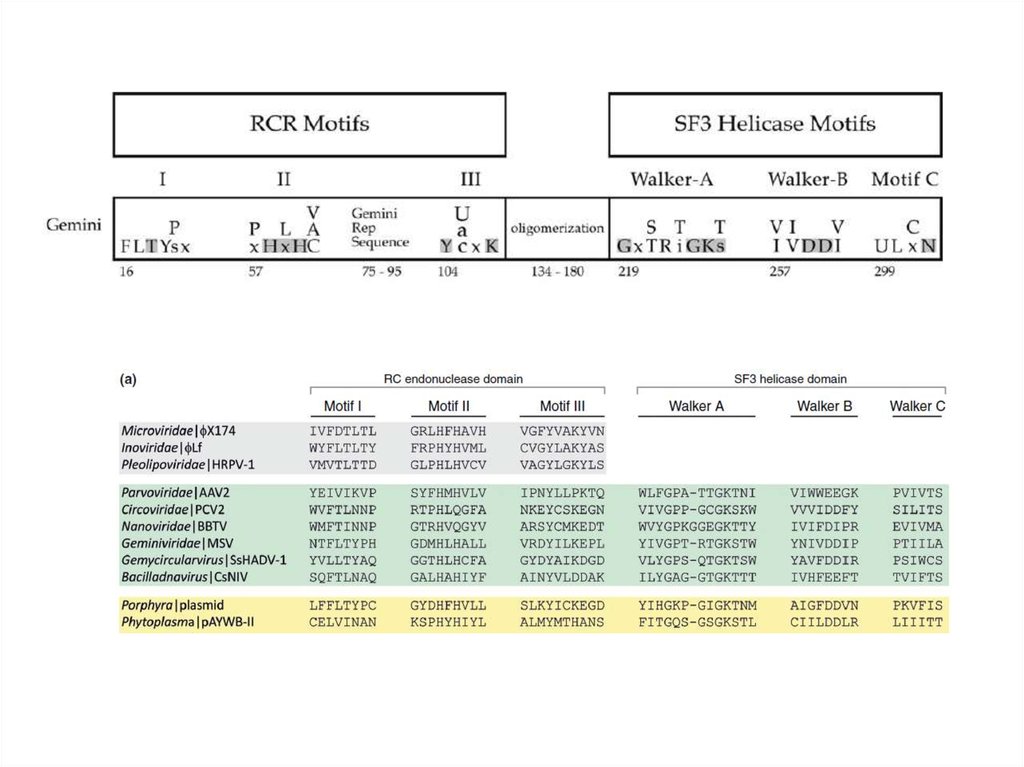
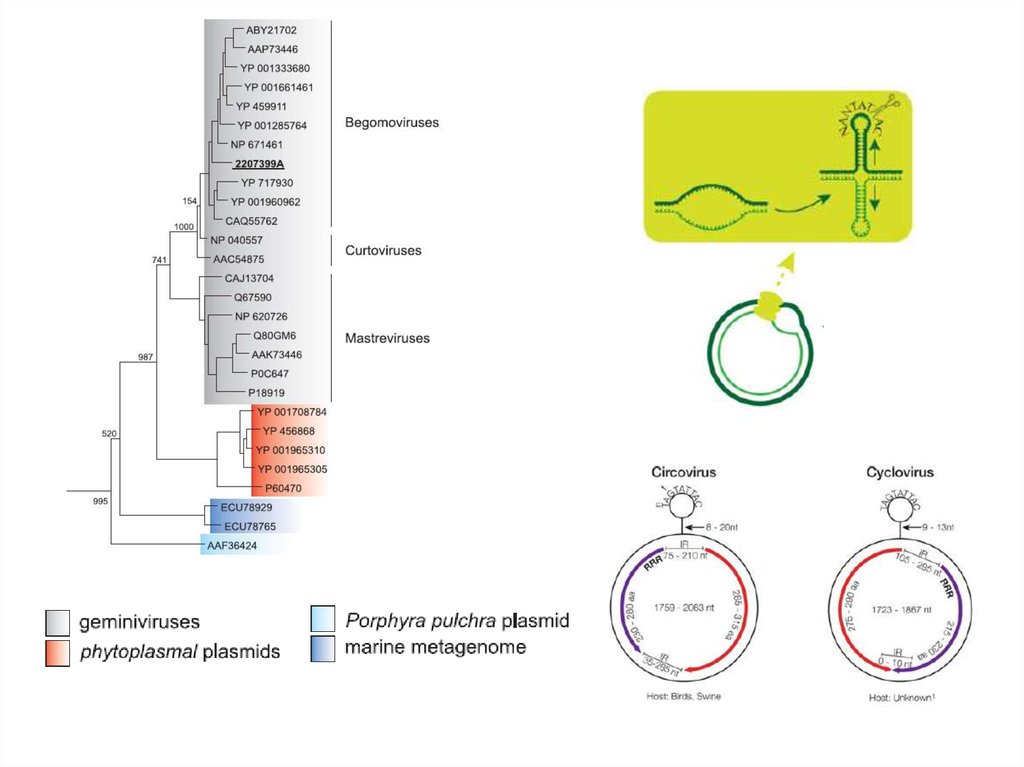
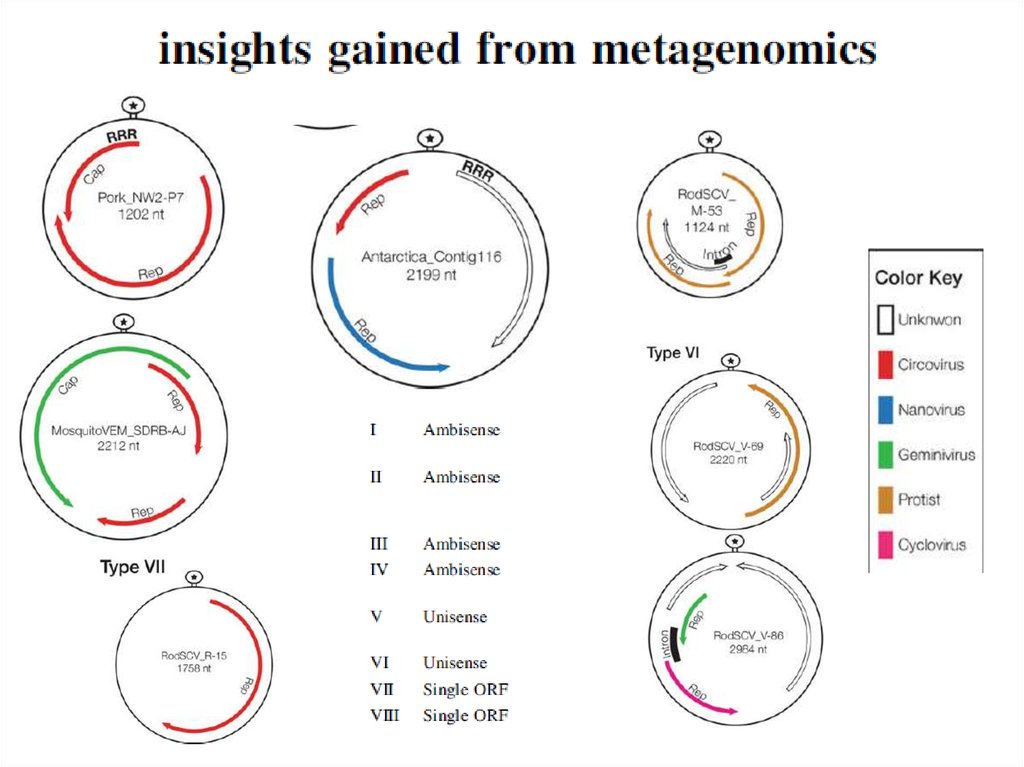
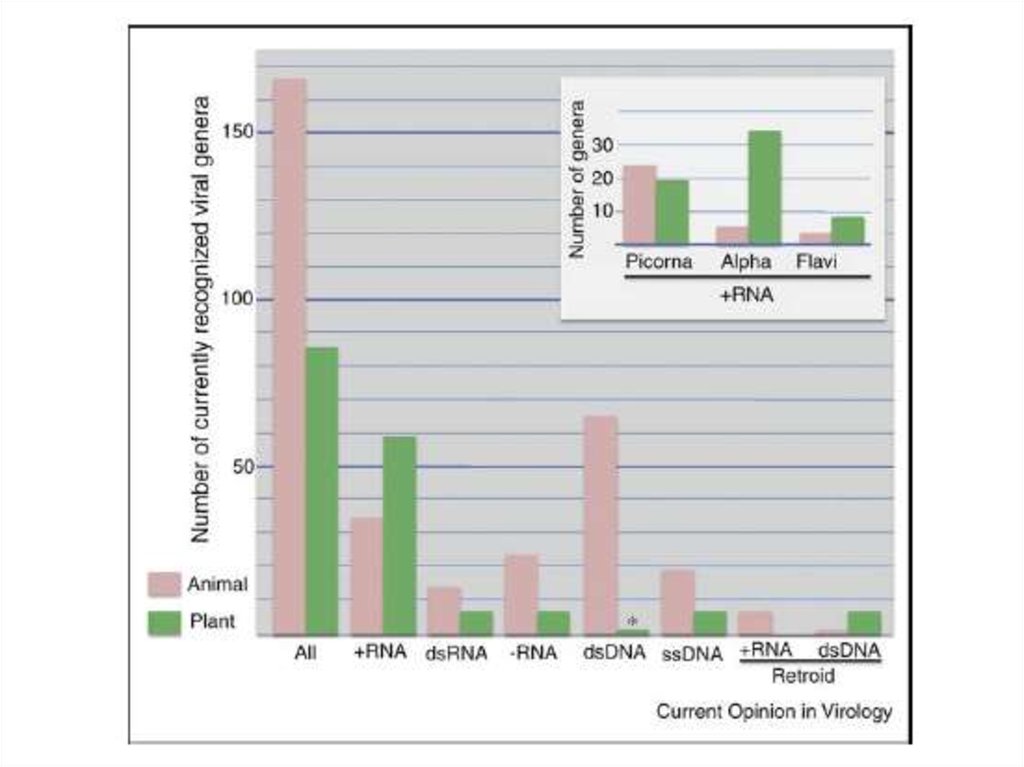
14. ДНК-вирусы растений. Геминивирусы.
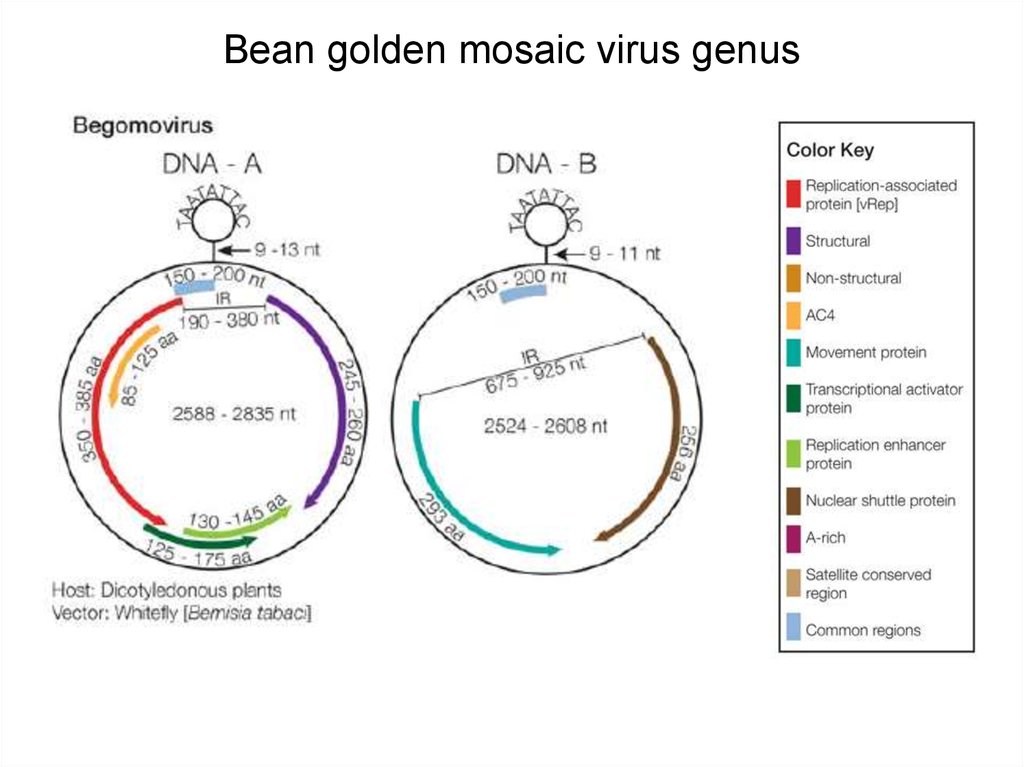
15. Bean golden mosaic virus genus
16.
17.
18.
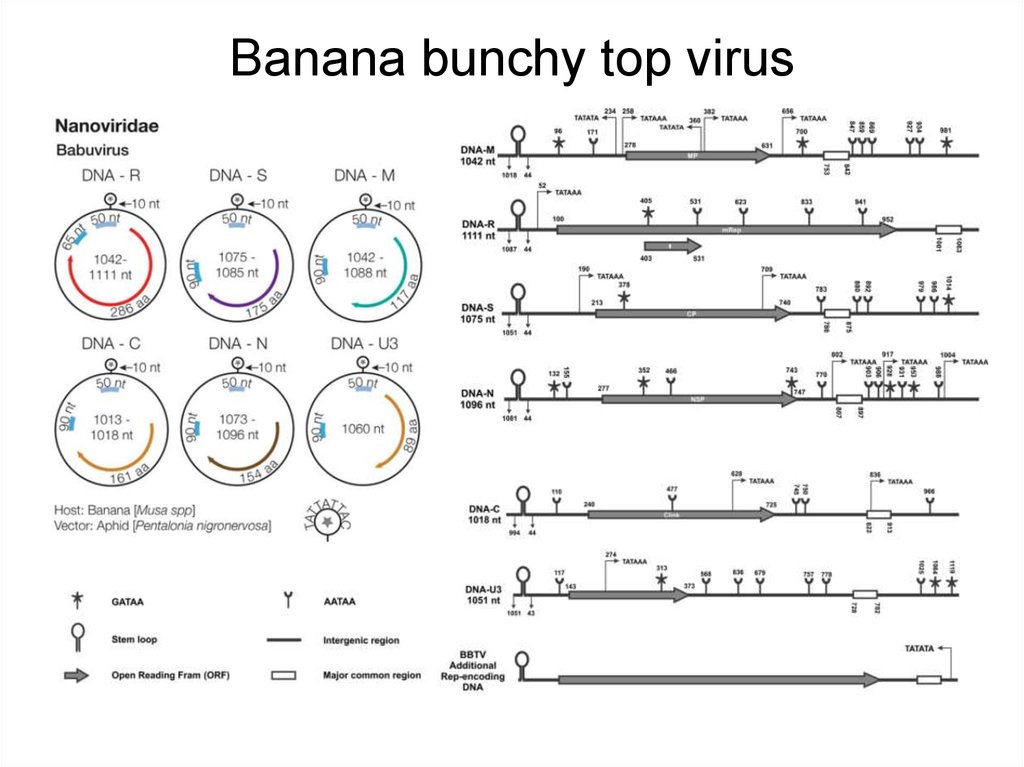
19. Banana bunchy top virus
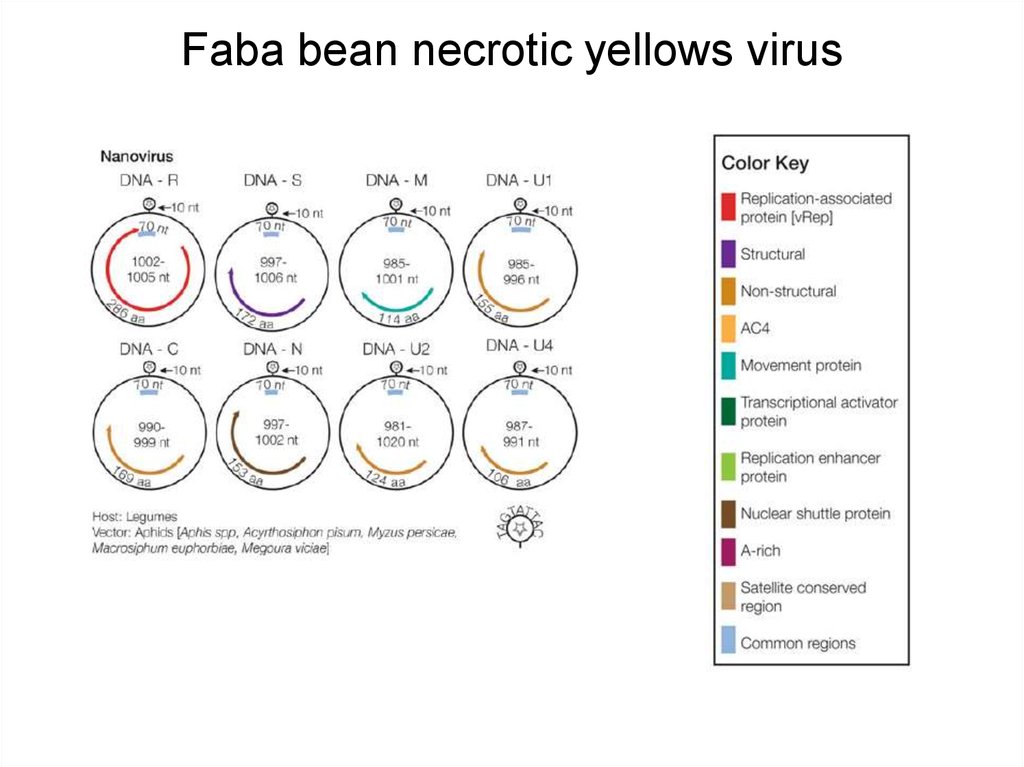
20. Faba bean necrotic yellows virus
21.
22.
23.
Репликация и экспрессии геномовДНК-вирусов бактерий и эукариот
24.
25. Роджер и Артур Корнберги
9080
70
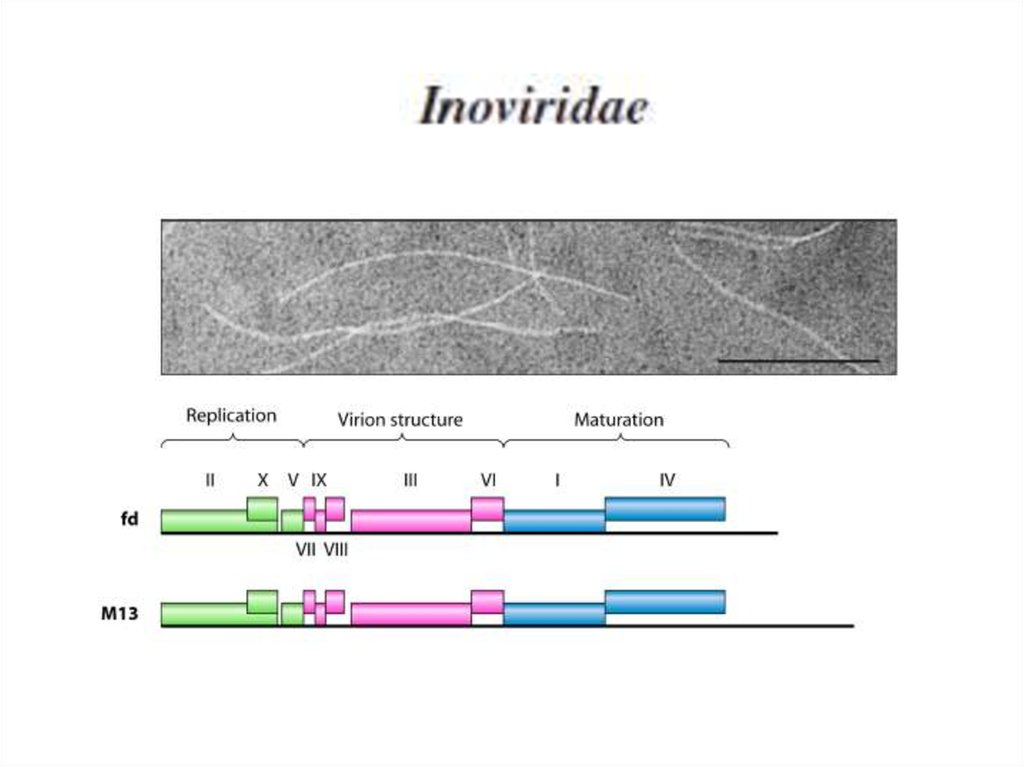
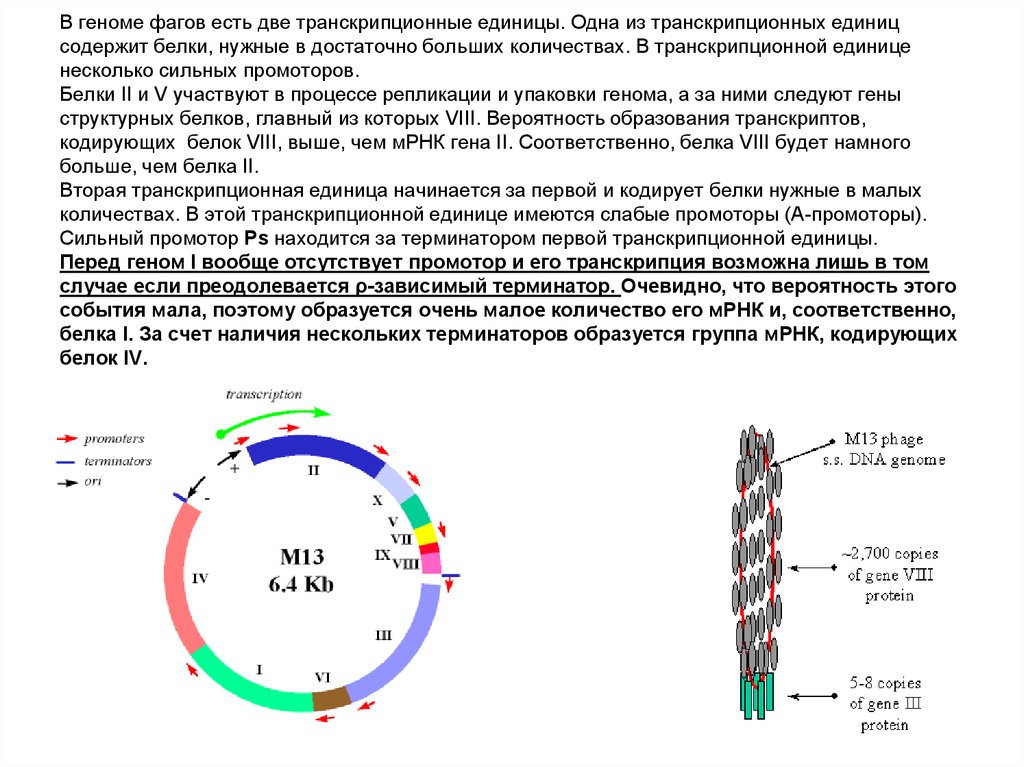
60
50
40
30
20
10
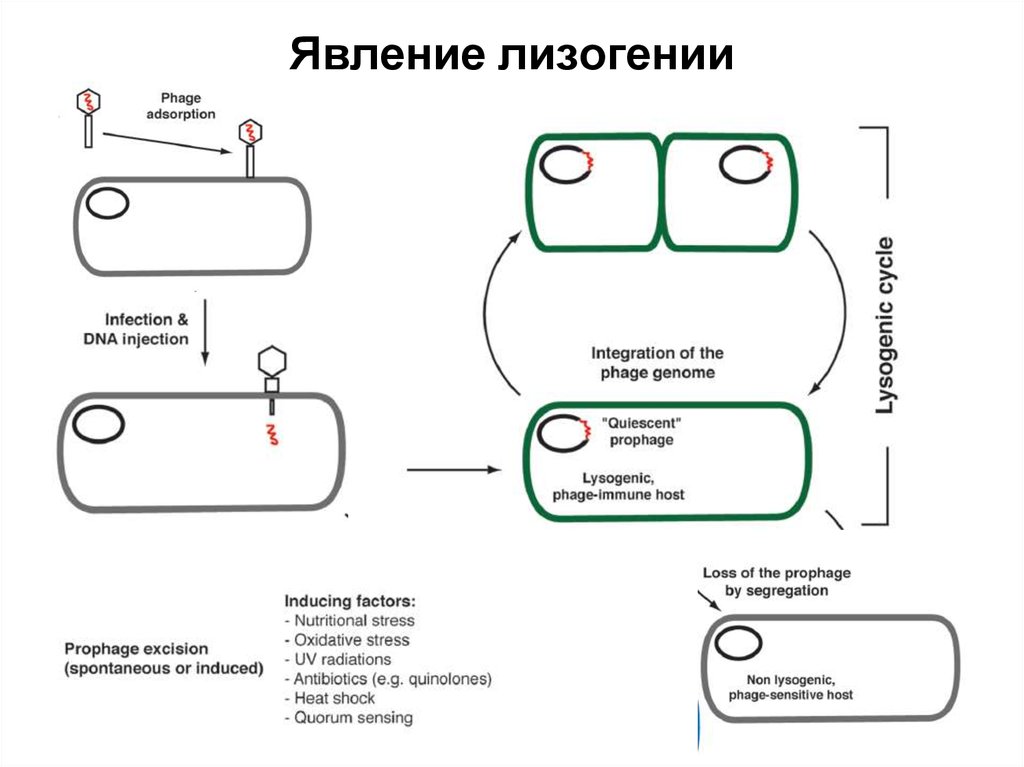
0
1
3
кв
кв
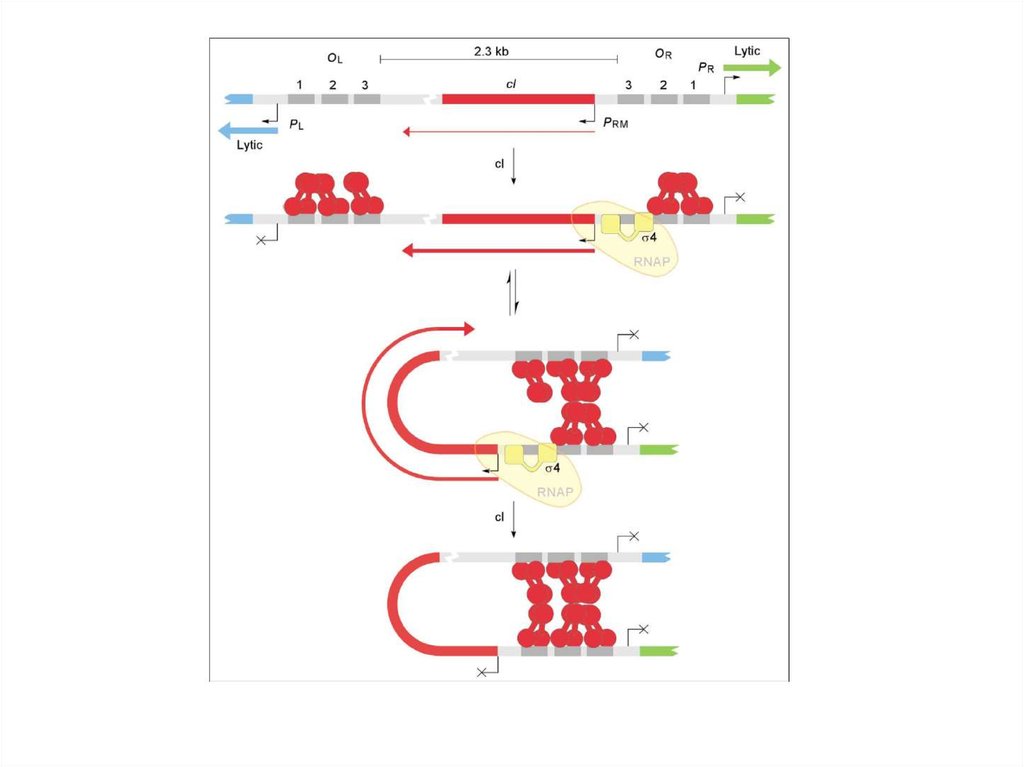
26.
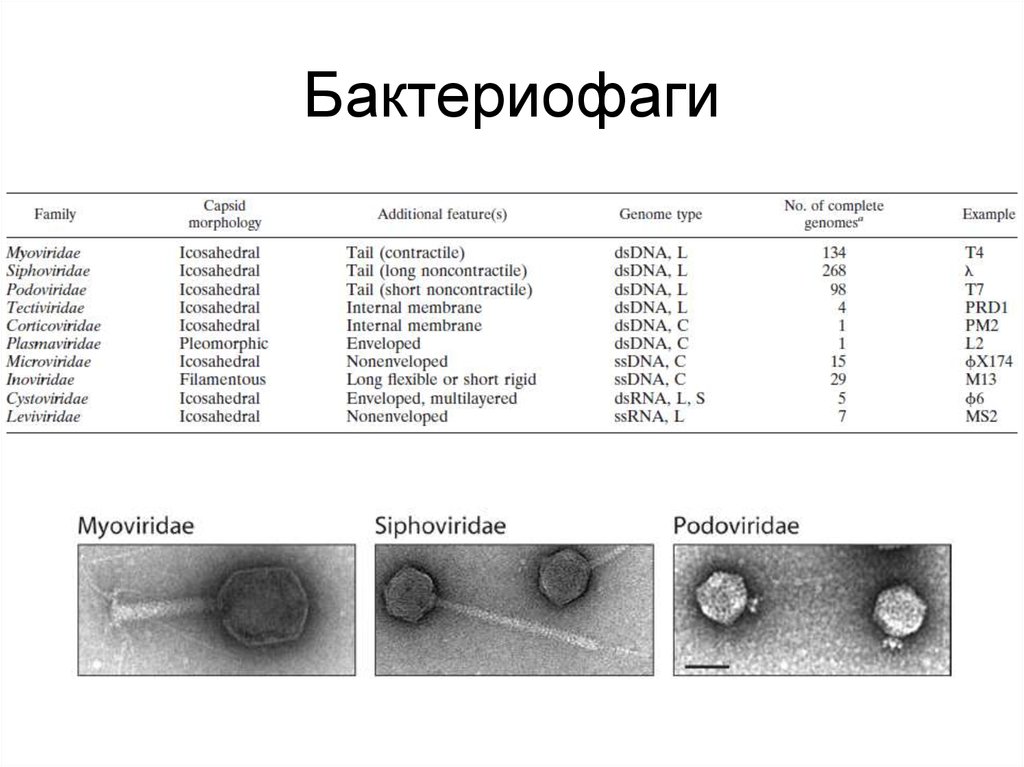
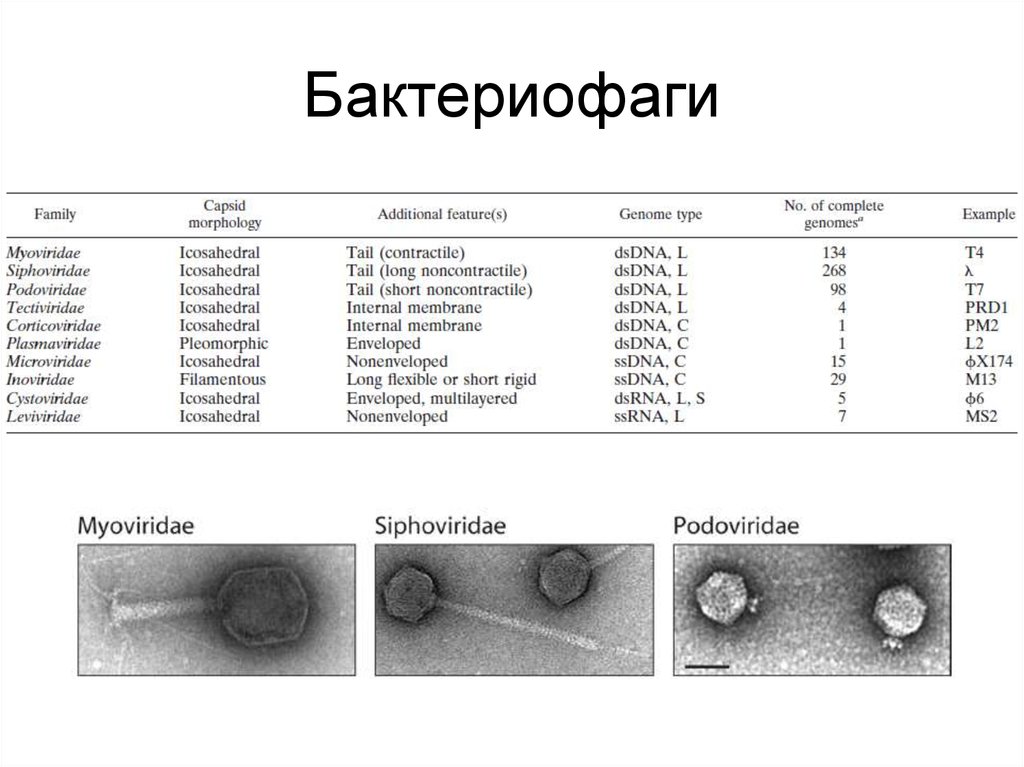
27. Бактериофаги
28. РНК-содержащие бактериофаги
29.
• Механизмы синтеза РНК довольно консервативны иоднообразны среди вирусов. Однако, большое разнообразие
наблюдается в механизмах регуляции процесса транскрипции.
• Для чего нужна регуляция транскрипции геномной ДНК?
• 1. на разных стадиях цикла репродукции требуются разные
белки.
• 2. белки нужны в разных количествах (требуется много
структурных белков и меньше энзимов).
• 3. избыток ранних белков может подавлять активность белков
поздних стадий.
• Уровни регуляции экспрессии генов:
• 1. транскрипционный
• 2. посттранскрипционный (чаще трансляционный)
30.
• Принципы регуляции транскрипции:• 1. Системность. Один механизм регуляции
транскрипции может контролировать экспрессию
группы генов.
• 2. Каскадность. Включение экспрессии одних генов
может быть связано с репрессией или активацией
других генов.
Белки вирусов условно делят на:
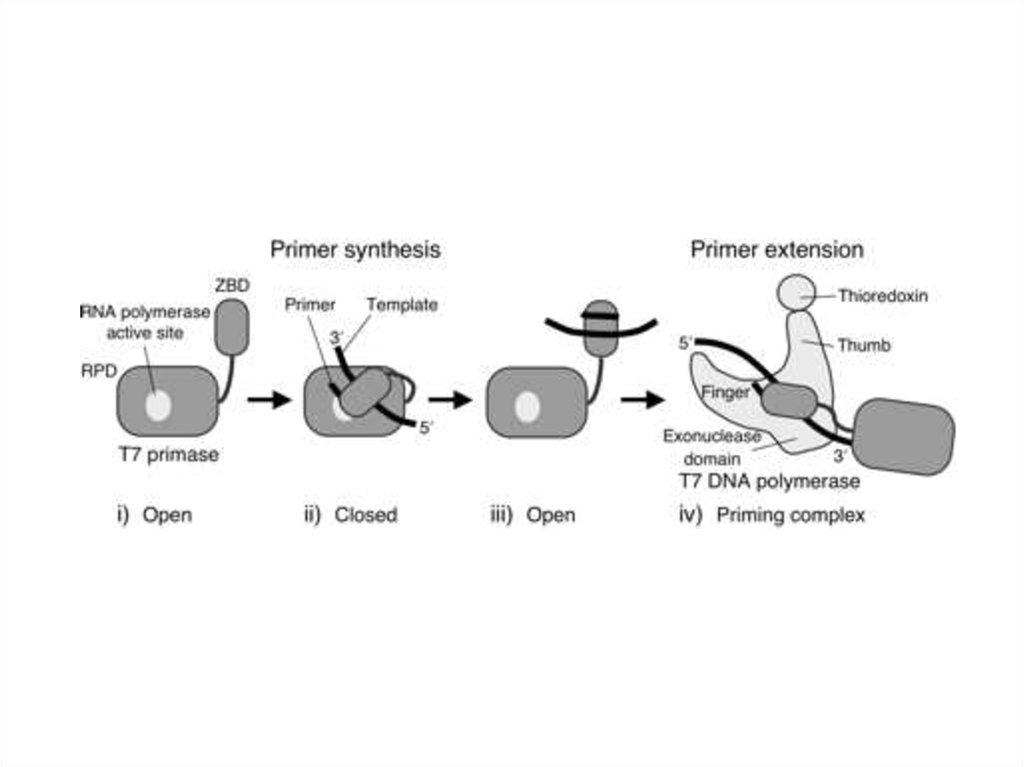
• 1. ранние (истинно ранние).
• 2. средние (отсроченно ранние).
• 3. поздние.
31.
Как правило, регулируемыми стадиями
транскрипции являются инициация и
терминация. В принципе, в некоторых
системах может регулироваться и элонгация
транскрипции.
• Выход продукта экспрессии гена зависит от:
• 1. частоты инициации транскрипции
• 2. длины гена (положение терминатра)
32.
• Можно различить несколько уровней сложностисистем транскрипции фаговых геномов в
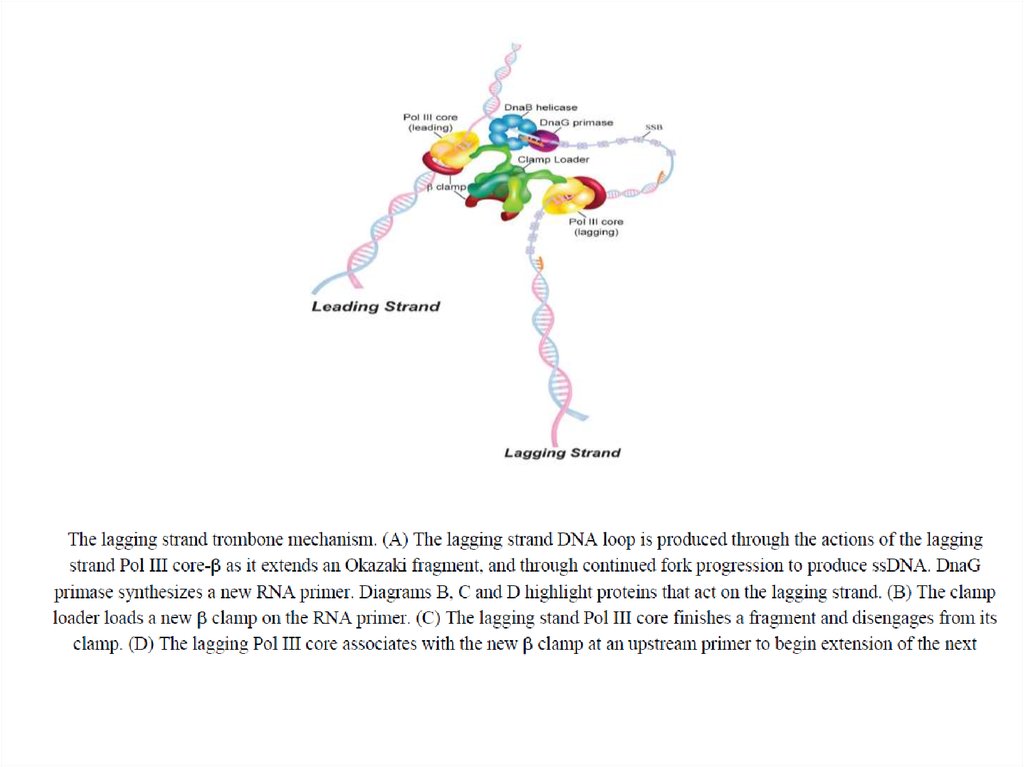
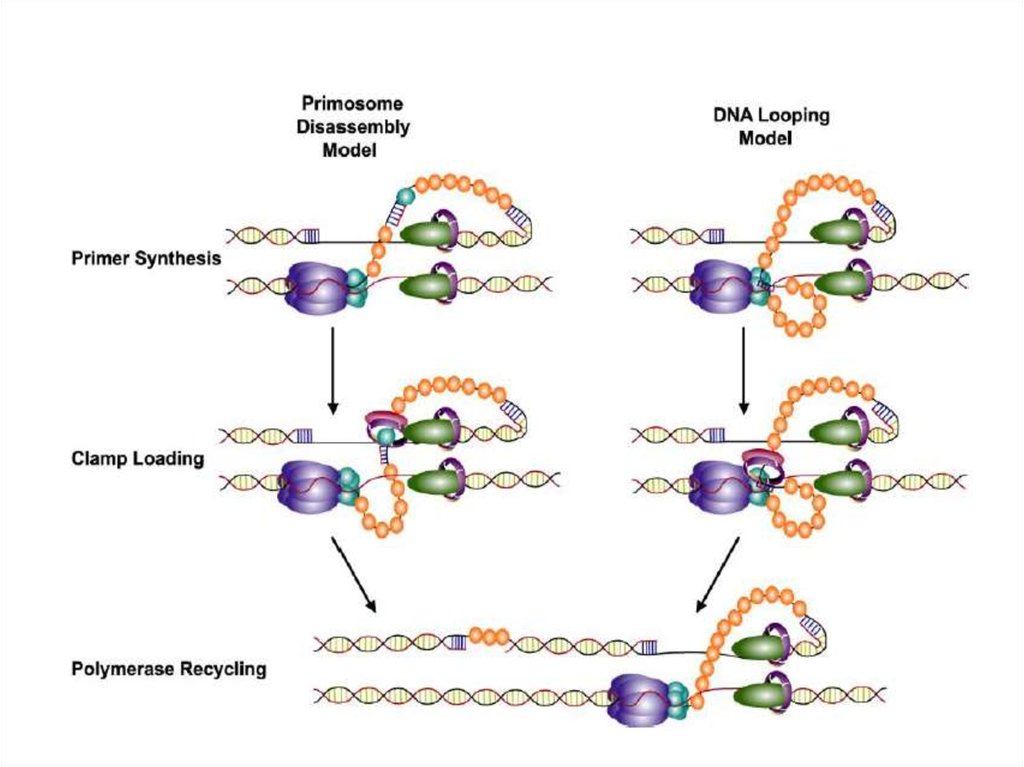
зависимости от степени модификации
транскрипционного аппарата бактерии-хозяина.
• В наиболее простых системах, когда комбинацией
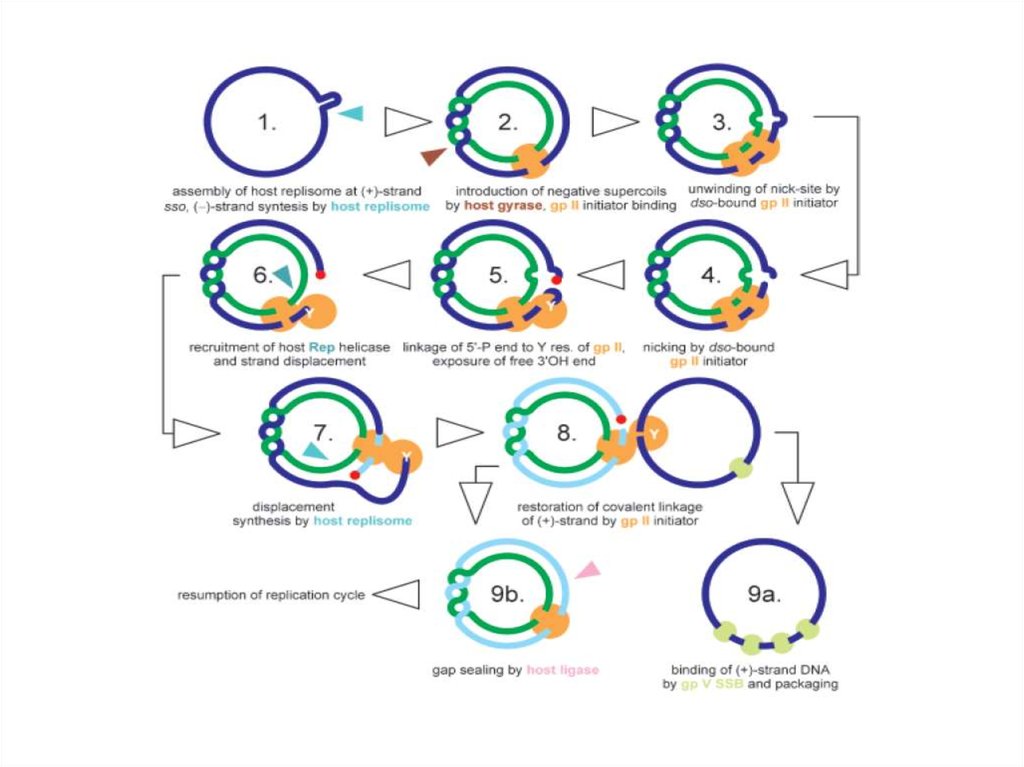
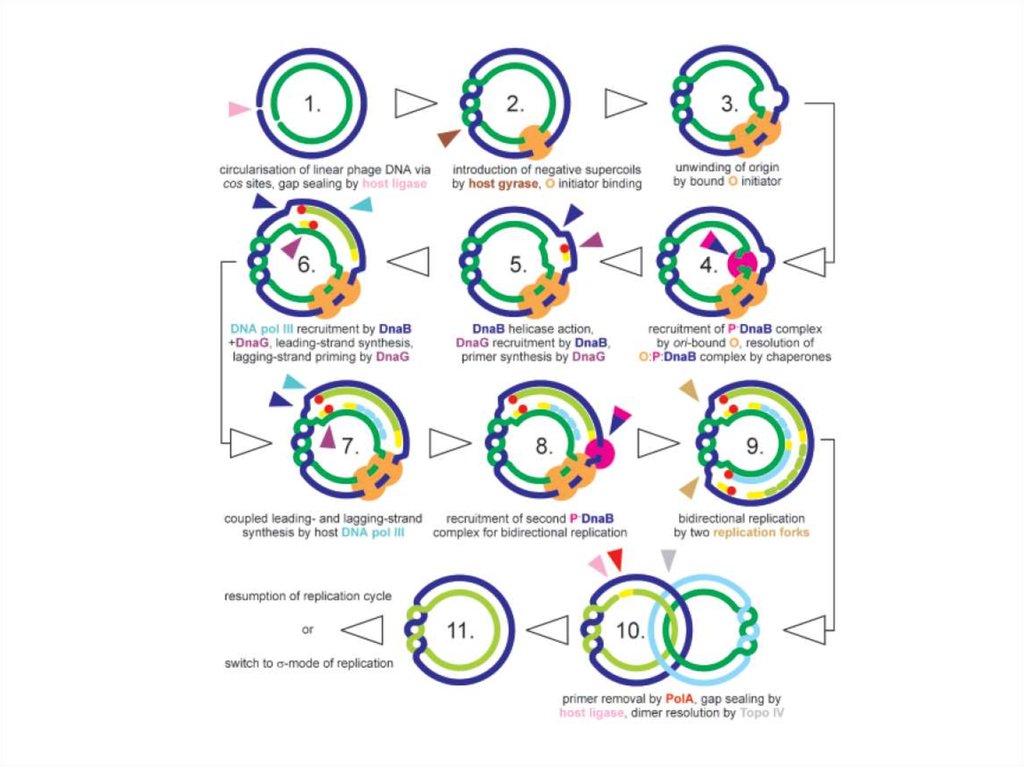
промоторов и терминаторов различной силы
регулируется количество синтезируемой мРНК,
используются лишь белки аппарата транскрипции
хозяина.
• Другие вирусы кодируют регуляторные белки
активации и репрессии транскрипции, третьи
модифицируют отдельные субъединицы хозяйской
РНК-полимеразы.
• И наконец, существуют варианты полного замещения
хозяйского аппарата транскрипции на
фагоспецифический.
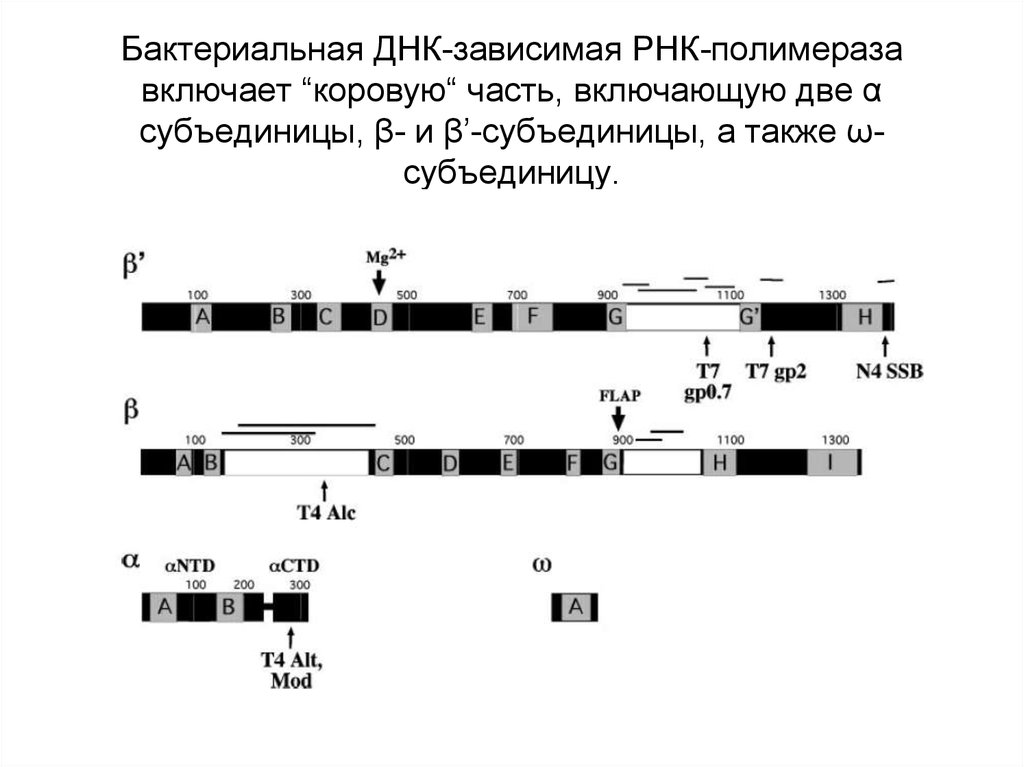
33. Бактериальная ДНК-зависимая РНК-полимераза включает “коровую“ часть, включающую две α субъединицы, β- и β’-субъединицы, а также
ωсубъединицу.34.
• Частота инициации зависит от силыпромотора. Чем сильнее промотор, тем
выше сродство к нему полимеразы, а,
значит, выше частота инициации
транскрипции.
• За узнавание промотора и определение стартовой
точки транскрипции у прокариот отвечает σсубъединица РНК-полимеразы. Основной тип σсубъединиц – это σ70, отвечающая за транскрипцию
большинства генов бактерий. Другие σ-факторы
используются лишь при специфических условиях
роста или при стрессе.
35. В комплексе с другими субъединицами σ-фактор, включающий 613 аминокислотных остатков имеет не глобулярную, а вытянутую форму.
В комплексе с другими субъединицами σфактор, включающий 613 аминокислотныхостатков имеет не глобулярную, а
вытянутую форму.
36. Домены, расположенные на дистальных концах σ-субъединицы, узнают два элемента промотора. Стандартный промотор РНК-полимеразы
Домены, расположенные на дистальных концах σсубъединицы, узнают два элемента промотора.Стандартный промотор РНК-полимеразы включает в
себя элементы находящиеся вблизи положений –10
(консенсус 5’-TATAAT-3’, узнаваемый центральным
доменом 2.4) и –35 (консенсус 5’-TTGACA-3’,
узнаваемый С-концевым доменом 4.2 длиной 88
аминокислот) от старта транскрипции
37.
• Сродство промотора и σ-субъединицы зависитпрежде всего от оптимального расстояния между
консенсусными элементами и их первичной
структуры.
• Целый ряд σ70-зависимых промоторов обладают
далеко не оптимальной для узнавания структурой –
35 элемента и, тем не менее, весьма активно
узнаются РНК-полимеразой. Такие промоторы
содержат удлиненный –10 консенсус типа 5’TGNTATAAT-3’.
• Известно, что в некоторых случаях CTD-домен αсубъединиц узнает последовательности в области от
-40 до –60 (UP элементы), что может резко
увеличивать силу промотора.
38. РНК-полимераза связывает промотор поэтапно. Сначала формируется достаточно слабый так называемый «закрытый» комплекс, который
спонтанноизомеризуется с образованием «открытого» комплекса.
В «открытом» комплексе примерно 10 нуклеотидных
пар в области старта транскрипции переходят в
одноцепочечную форму. Формирование «открытого»
комплекса у большинства промоторов необратимо
ведет (при наличии рибонуклеозидтрифосфатов) к
началу процесса транскрипции.
39.
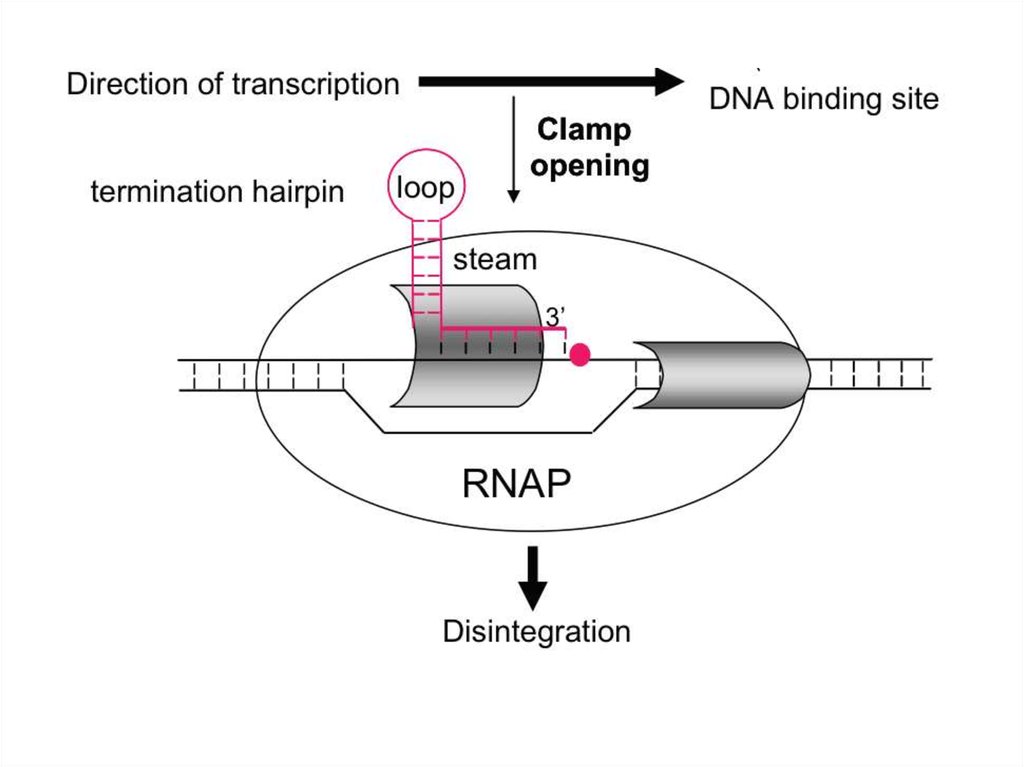
• Терминация транскрипции.• У прокариот имеется два механизма регуляции терминации
транскрипции. Это ρ (Rho)-зависимая терминация и ρнезависимая терминация.
• ρ-фактор представляет собой олигомерный белок (гексамер)
функционирующий как РНК-ДНК хеликаза (3'-5'), которая в АТФзависимой реакции расплетает гетеродуплекс РНК-ДНК.
• В ρ-независимой терминации участвуют специальные сигналы
РНК, задерживающие работу РНК-полимеразы. Чаще всего
сигналами ρ-независимой терминации являются GC-богатые
шпилечные участки мРНК, за которыми следует U-богатая
область.
В результате возможны остановки полимеразы. В момент паузы
возможен стохастический выбор между терминацией синтеза и
продолжением процесса транскрипции. Это создает возможность
снижения в той или иной степени эффективности транскрипции
отдельных генов и оперонов в зависимости от встречаемости сегментов
ДНК, способствующих паузам.
40.
41.
• Итак, комбинацией промоторов итерминаторов различной силы можно
регулировать количество синтезируемой
мРНК, а, значит, и количество белка.
• Примером простой системы, в которой
отсутствует временная, но есть
количественная регуляция транскрипции,
являются фаги с кольцевой одноцепочечной
ДНК.
42. Бактериофаги
43.
44. В геноме фагов есть две транскрипционные единицы. Одна из транскрипционных единиц содержит белки, нужные в достаточно больших
количествах. В транскрипционной единиценесколько сильных промоторов.
Белки II и V участвуют в процессе репликации и упаковки генома, а за ними следуют гены
структурных белков, главный из которых VIII. Вероятность образования транскриптов,
кодирующих белок VIII, выше, чем мРНК гена II. Соответственно, белка VIII будет намного
больше, чем белка II.
Вторая транскрипционная единица начинается за первой и кодирует белки нужные в малых
количествах. В этой транскрипционной единице имеются слабые промоторы (А-промоторы).
Сильный промотор Ps находится за терминатором первой транскрипционной единицы.
Перед геном I вообще отсутствует промотор и его транскрипция возможна лишь в том
случае если преодолевается ρ-зависимый терминатор. Очевидно, что вероятность этого
события мала, поэтому образуется очень малое количество его мРНК и, соответственно,
белка I. За счет наличия нескольких терминаторов образуется группа мРНК, кодирующих
белок IV.
45.
• Такой принцип количественнойтранскрипционной регуляции
называется каскадным (не путать с
темпоральной каскадной регуляцией).
• Возможно, еще более яркий пример
сочетания принципа каскадности на
уровнях инициации и терминации
транскрипции представляет фаг φХ174.
46.
47.
• Итак, фаг φХ174 дает нам прекрасныйпример позитивной каскадной
количественной регуляции, когда
экспрессия гена возрастает, если он
расположен в конце транскрипционной
единицы и “обслуживается” сразу
несколькими промоторами.
• С другой стороны, столь же отчетливо
наблюдается негативная каскадная
регуляция в случае, если ген отделен от
промоторов одним или несколькими
терминаторами транскрипции.
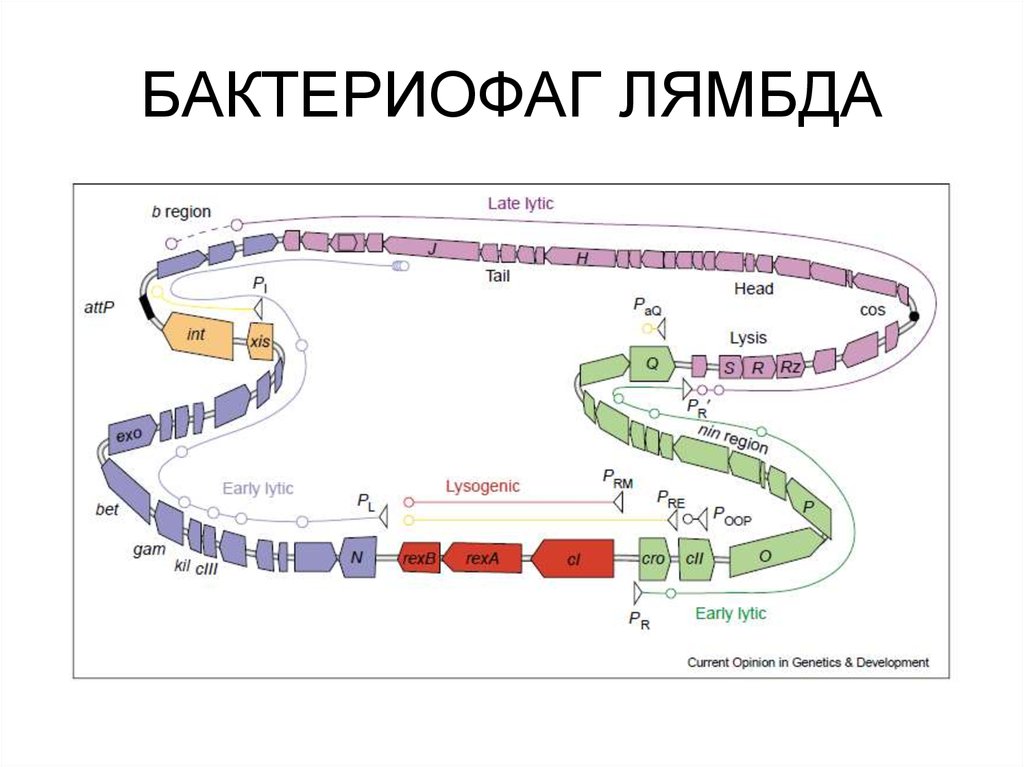
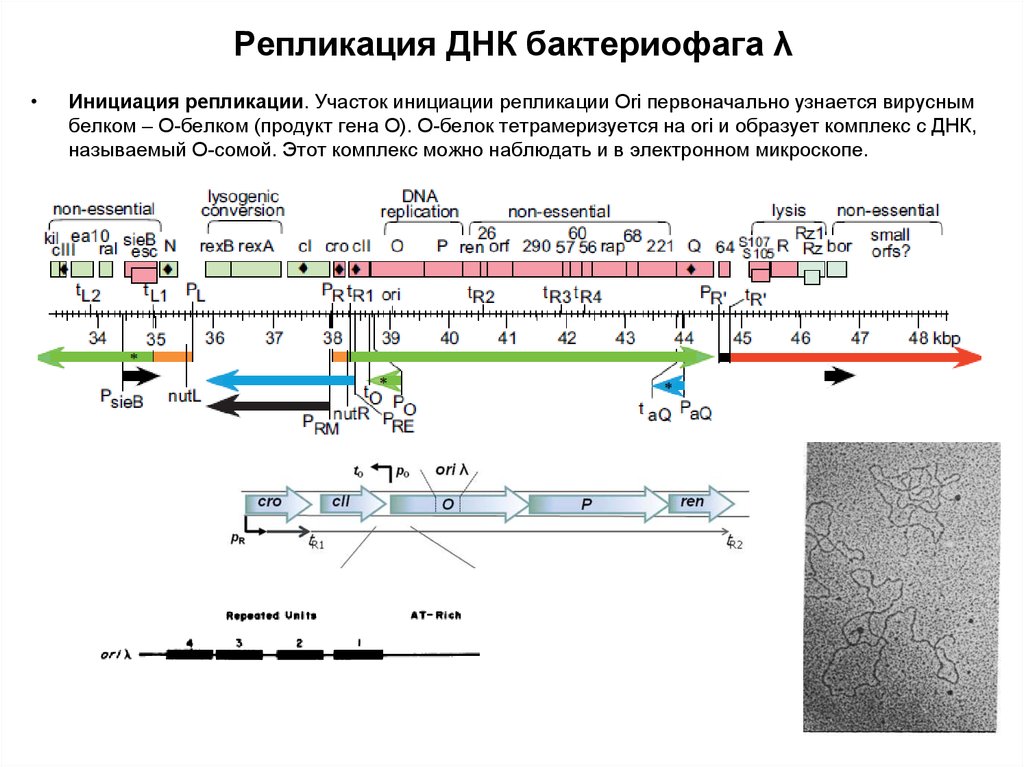
48. Регуляция экспрессии генов фага λ
• Фаг λ - Умеренный бактериофаг• 48,502 bp
• Система регуляции транскрипции фага лямбда несравненно
сложнее, чем у фагов М13 и φХ174.
49. Жизненный цикл литических фагов
50. Явление лизогении
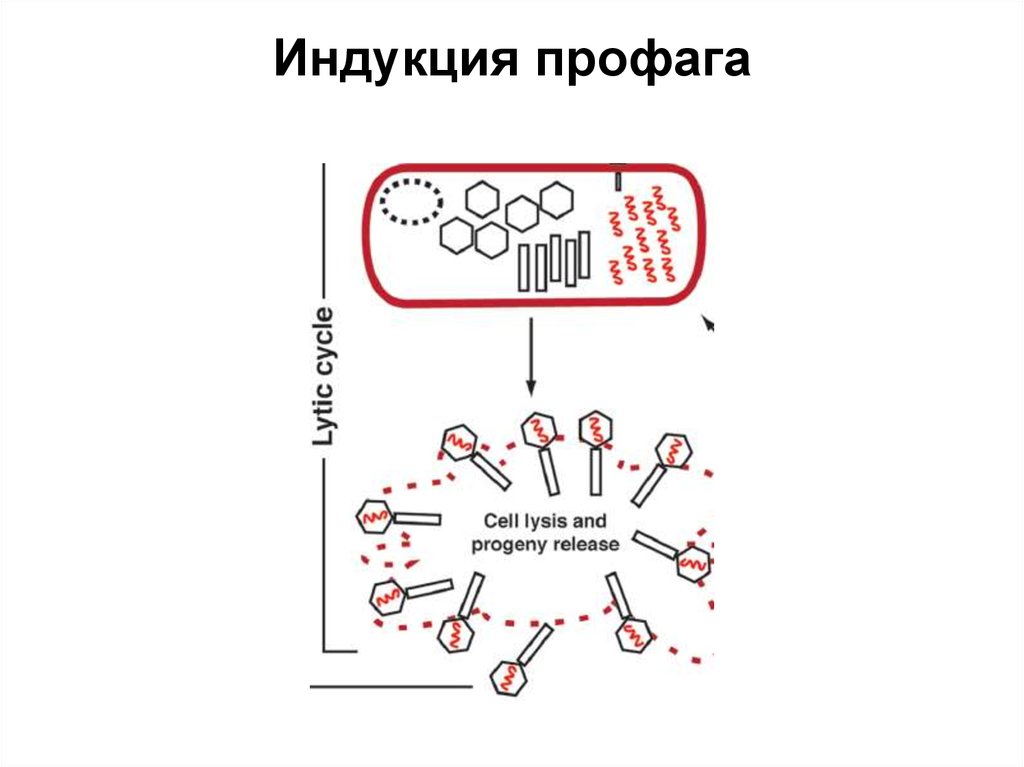
51. Индукция профага
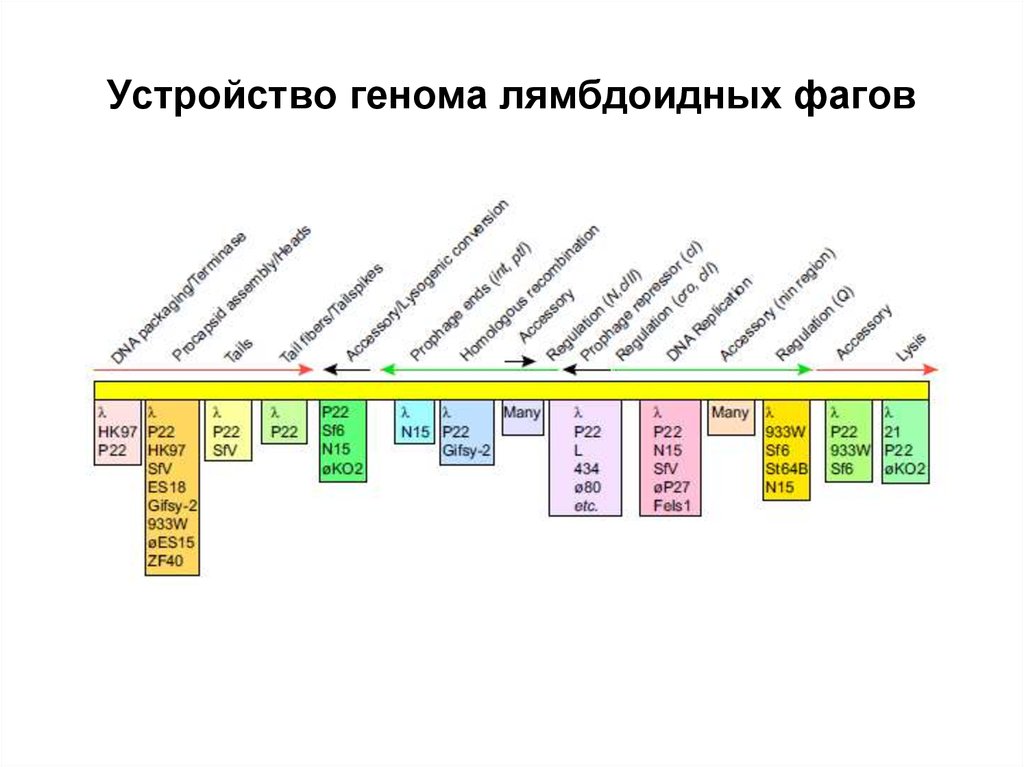
52. Устройство генома лямбдоидных фагов
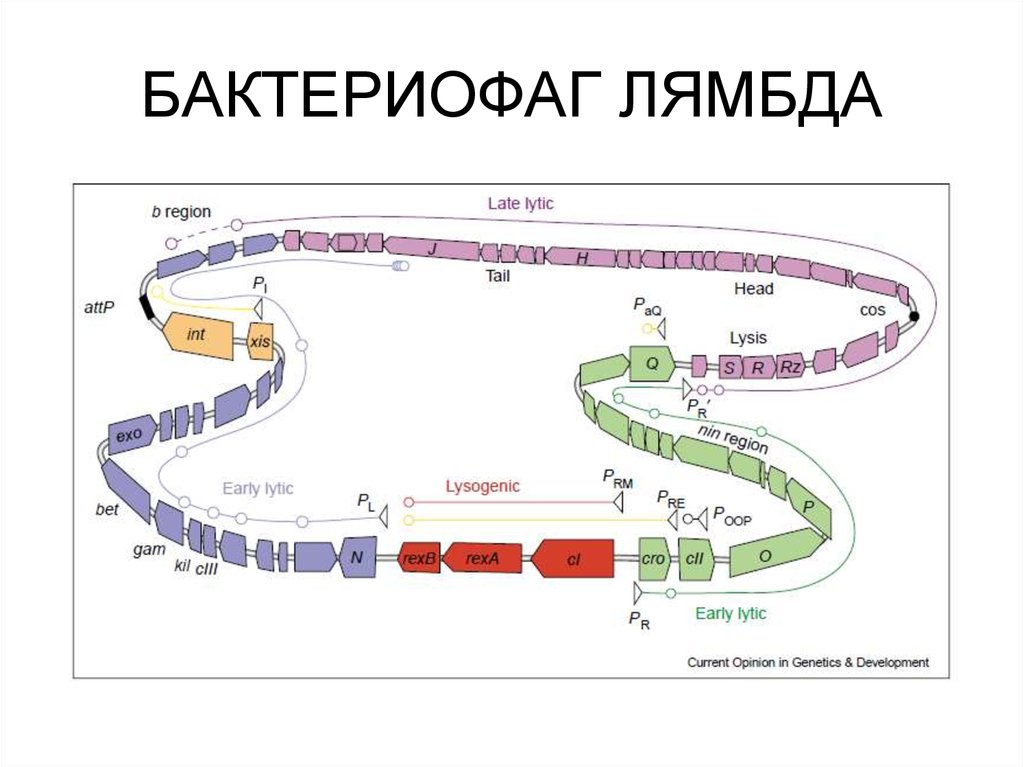
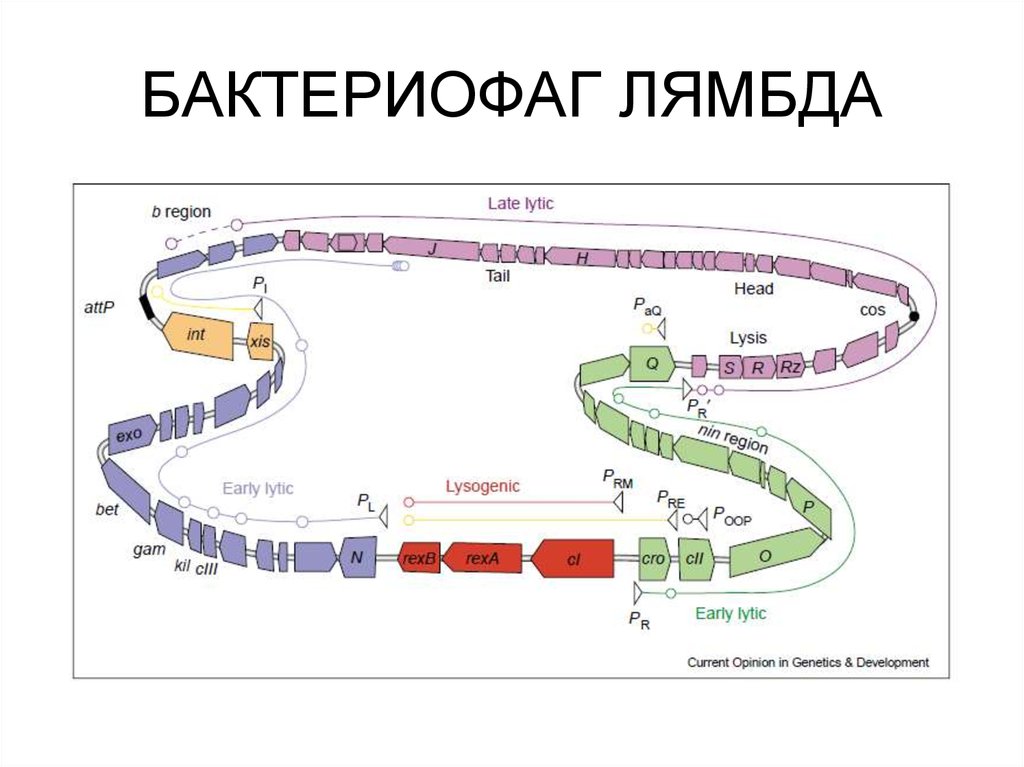
53. БАКТЕРИОФАГ ЛЯМБДА
54. На ранней стадии происходит активация транскрипции с помощью клеточных белков. Белок DnaA, участвующий в инициации репликации
бактериальной ДНК, может сильностимулировать работу промотора PR. Он кооперативно связывается с двумя участками
ДНК (DnaA box), расположенными уже после стартовой точки транскрипции на
расстоянии 20 и 200 пар нуклеотидов.
Такой тип связывания транскрипционных активаторов более характерен для
эукариотических систем.
Активация промотора вызывается взаимодействием DnaA с β-субъединицей РНКполимеразы, и это взаимодействие влияет не только на образование “закрытого“, но и
“открытого“ комплексов, что очень эффективно усиливает транскрипцию.
Учитывая, что DnaA активирует целый ряд бактериальных промоторов (polA, glpD и nrd)
можно говорить о потенциальном участии в узнавании промотора почти всех
субъединиц РНК-полимеразы.
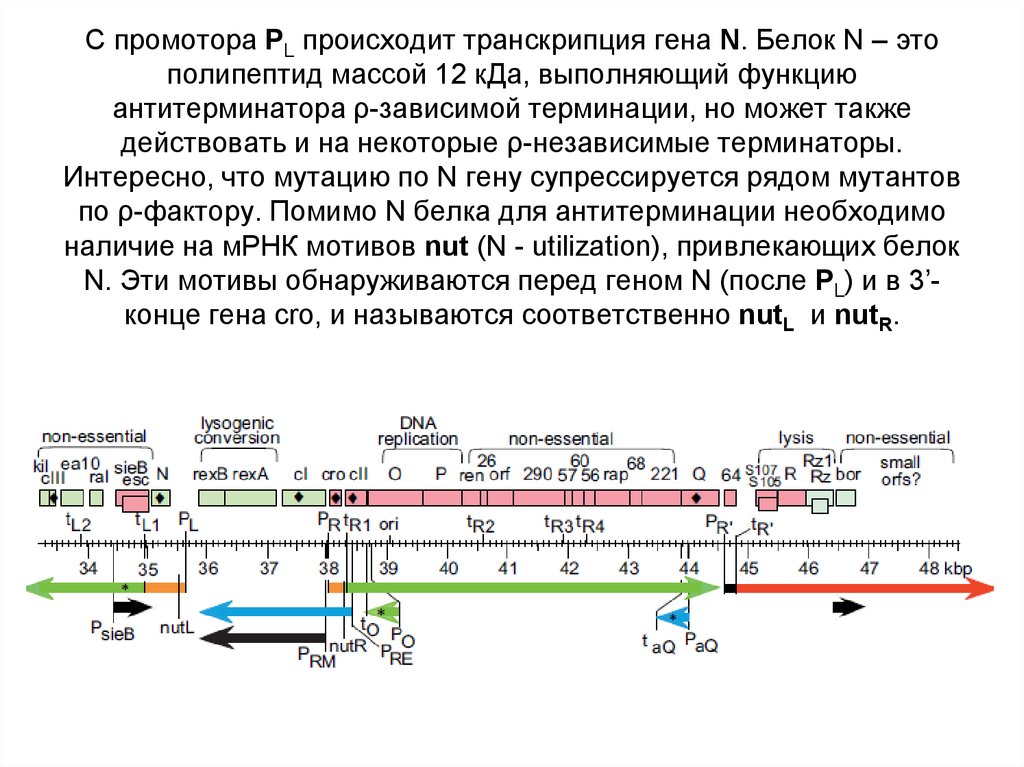
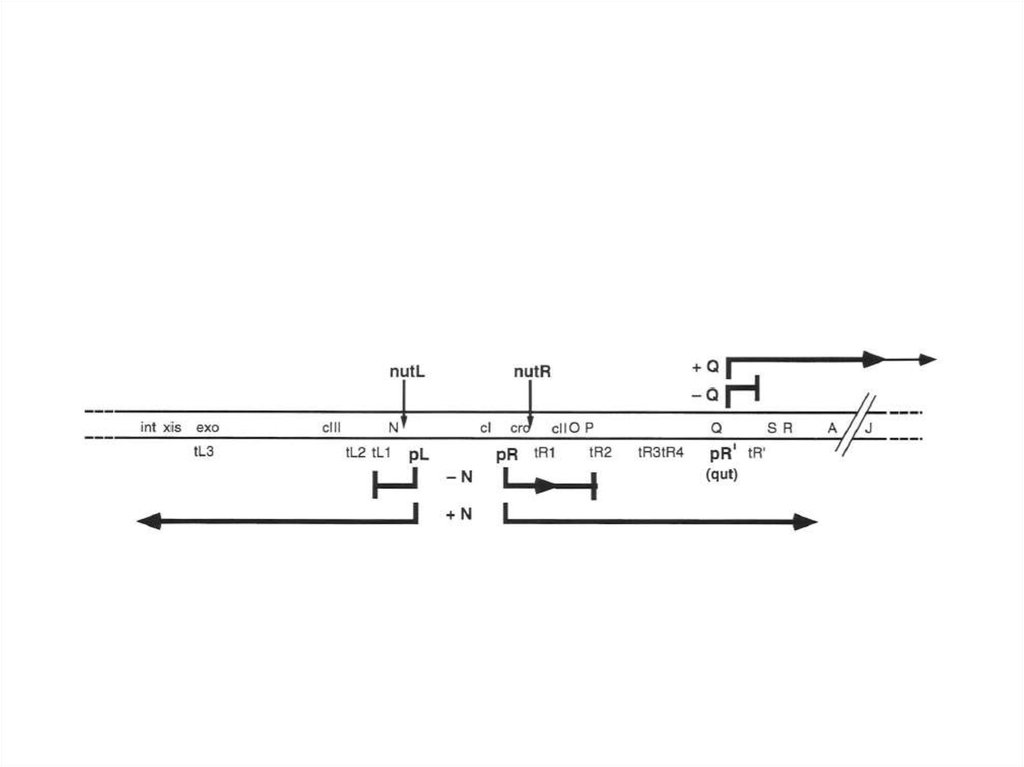
55. С промотора PL происходит транскрипция гена N. Белок N – это полипептид массой 12 кДа, выполняющий функцию антитерминатора
ρ-зависимой терминации, но может такжедействовать и на некоторые ρ-независимые терминаторы.
Интересно, что мутацию по N гену супрессируется рядом мутантов
по ρ-фактору. Помимо N белка для антитерминации необходимо
наличие на мРНК мотивов nut (N - utilization), привлекающих белок
N. Эти мотивы обнаруживаются перед геном N (после PL) и в 3’конце гена cro, и называются соответственно nutL и nutR.
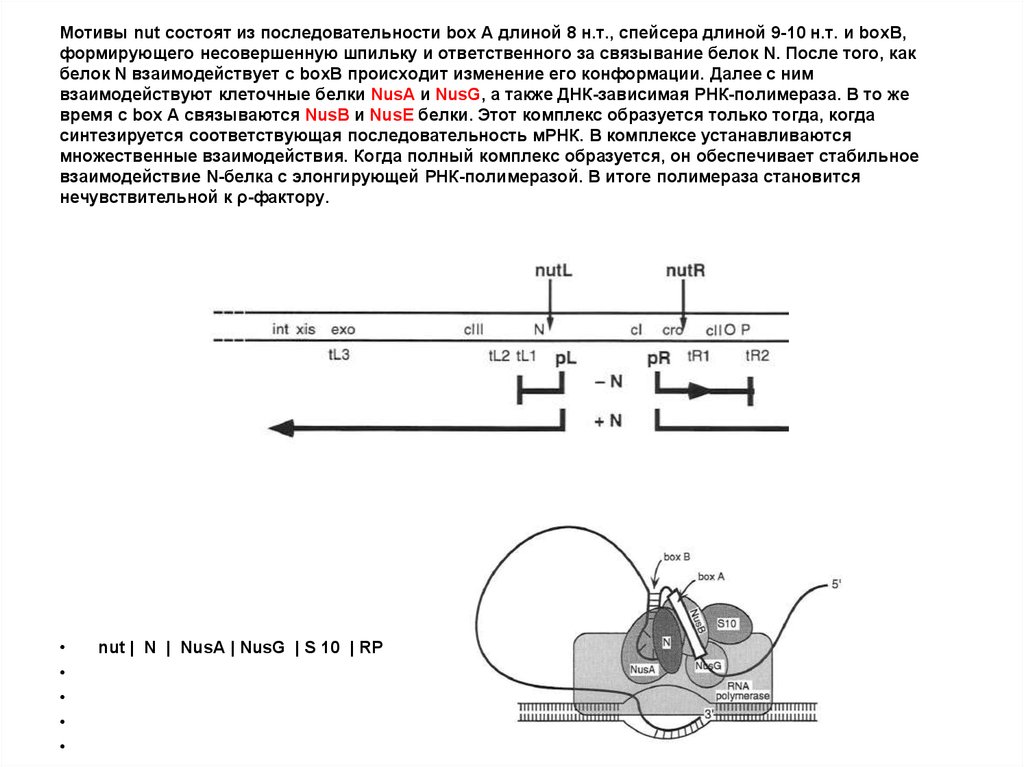
56. Мотивы nut состоят из последовательности box A длиной 8 н.т., спейсера длиной 9-10 н.т. и boxB, формирующего несовершенную
шпильку и ответственного за связывание белок N. После того, какбелок N взаимодействует с boxB происходит изменение его конформации. Далее с ним
взаимодействуют клеточные белки NusA и NusG, а также ДНК-зависимая РНК-полимераза. В то же
время с box A связываются NusB и NusE белки. Этот комплекс образуется только тогда, когда
синтезируется соответствующая последовательность мРНК. В комплексе устанавливаются
множественные взаимодействия. Когда полный комплекс образуется, он обеспечивает стабильное
взаимодействие N-белка с элонгирующей РНК-полимеразой. В итоге полимераза становится
нечувствительной к ρ-фактору.
nut | N | NusA | NusG | S 10 | RP
57.
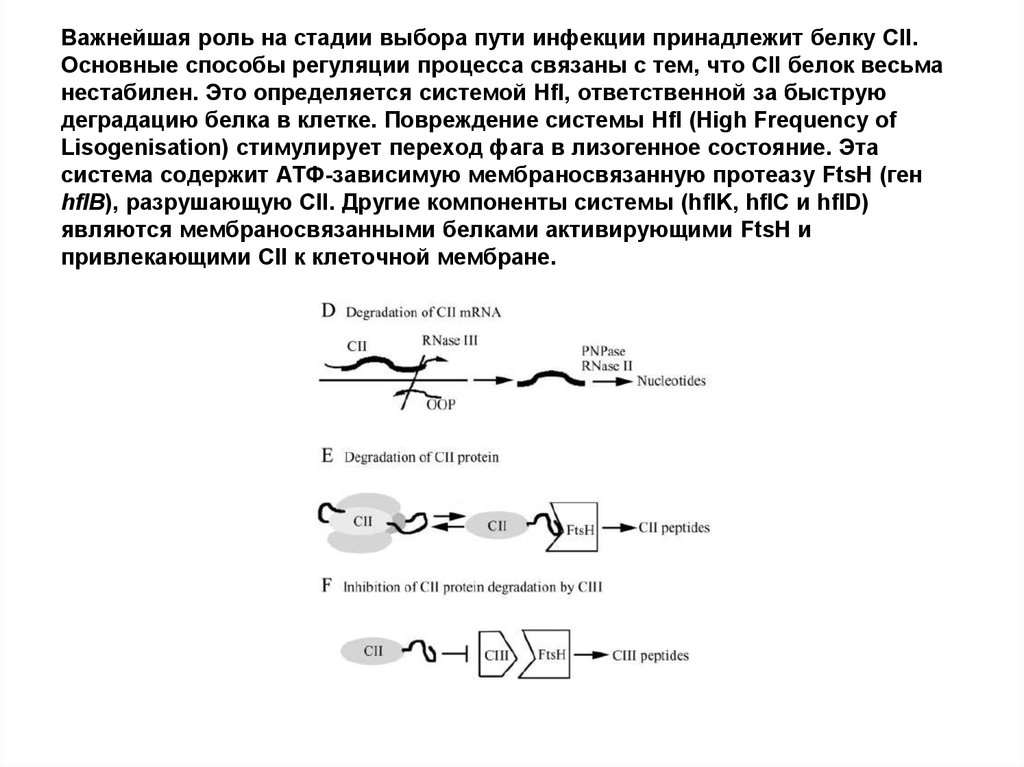
58. Важнейшая роль на стадии выбора пути инфекции принадлежит белку CII. Основные способы регуляции процесса связаны с тем, что CII
белок весьманестабилен. Это определяется системой Hfl, ответственной за быструю
деградацию белка в клетке. Повреждение системы Hfl (High Frequency of
Lisogenisation) стимулирует переход фага в лизогенное состояние. Эта
система содержит АТФ-зависимую мембраносвязанную протеазу FtsH (ген
hflB), разрушающую СII. Другие компоненты системы (hflK, hflC и hflD)
являются мембраносвязанными белками активирующими FtsH и
привлекающими СII к клеточной мембране.
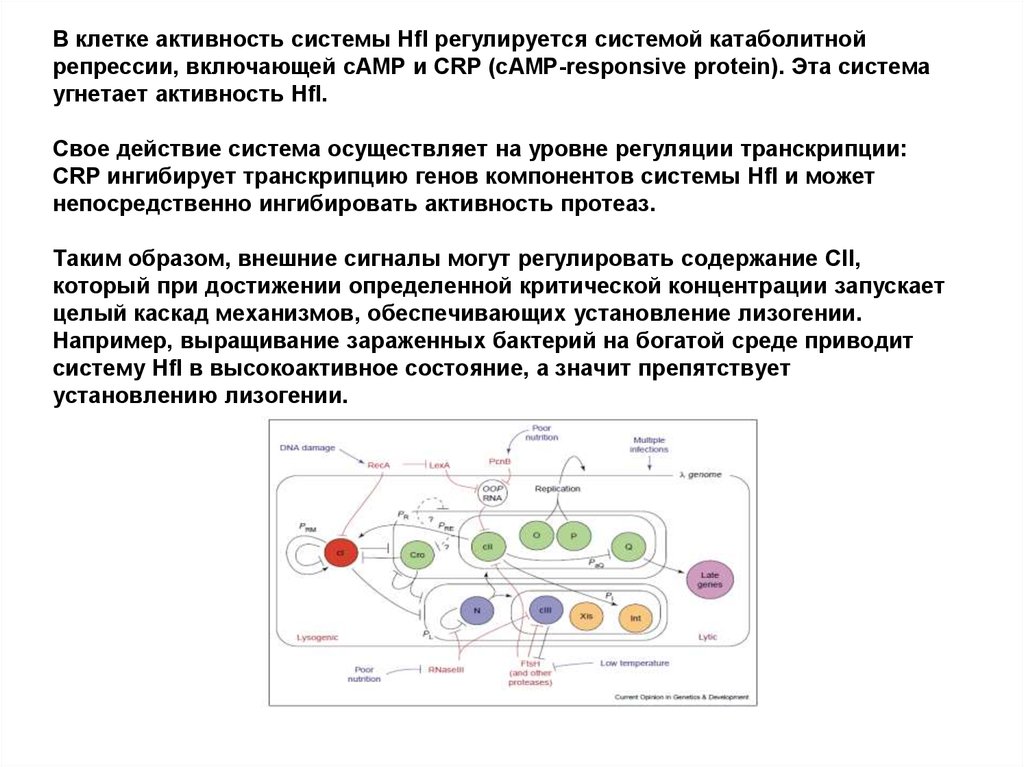
59. В клетке активность системы Hfl регулируется системой катаболитной репрессии, включающей сAMP и CRP (сAMP-responsive protein).
Эта системаугнетает активность Hfl.
Свое действие система осуществляет на уровне регуляции транскрипции:
CRP ингибирует транскрипцию генов компонентов системы Hfl и может
непосредственно ингибировать активность протеаз.
Таким образом, внешние сигналы могут регулировать содержание СII,
который при достижении определенной критической концентрации запускает
целый каскад механизмов, обеспечивающих установление лизогении.
Например, выращивание зараженных бактерий на богатой среде приводит
систему Hfl в высокоактивное состояние, а значит препятствует
установлению лизогении.
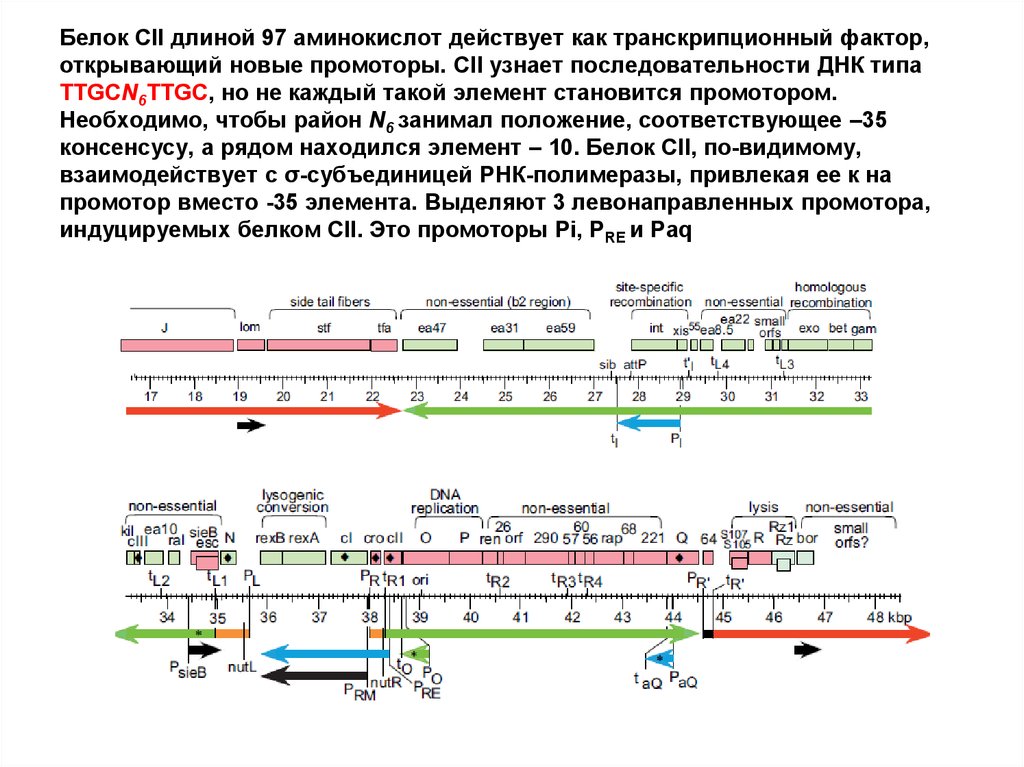
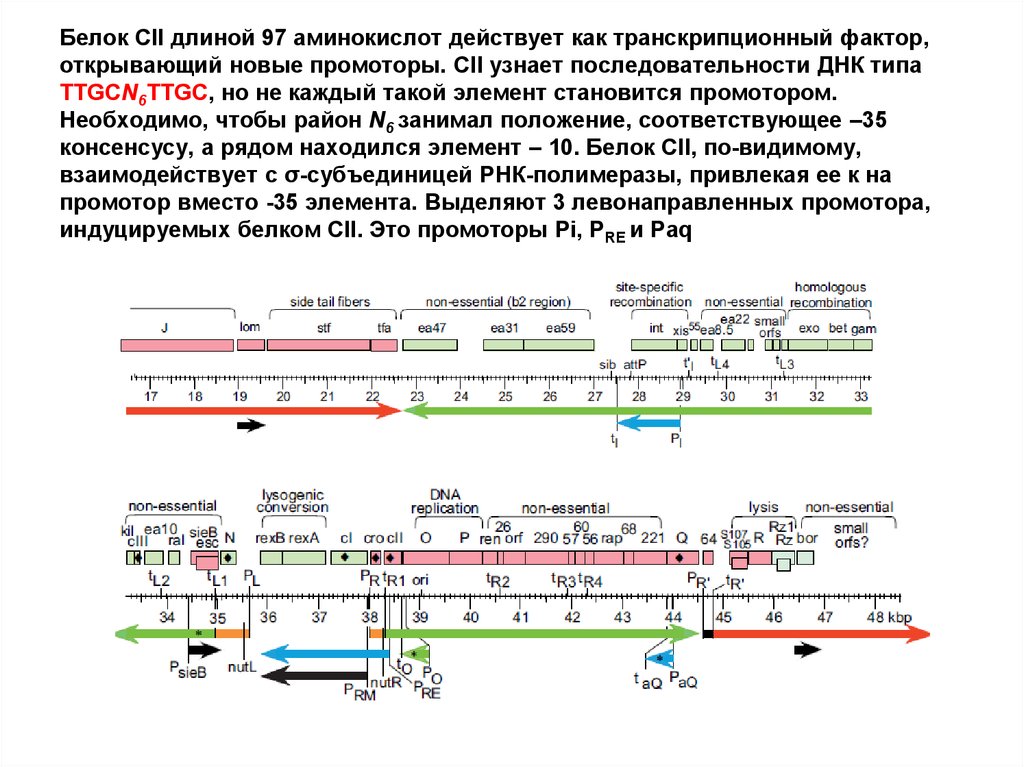
60. Белок CII длиной 97 аминокислот действует как транскрипционный фактор, открывающий новые промоторы. CII узнает
последовательности ДНК типаTTGCN6TTGC, но не каждый такой элемент становится промотором.
Необходимо, чтобы район N6 занимал положение, соответствующее –35
консенсусу, а рядом находился элемент – 10. Белок CII, по-видимому,
взаимодействует с σ-субъединицей РНК-полимеразы, привлекая ее к на
промотор вместо -35 элемента. Выделяют 3 левонаправленных промотора,
индуцируемых белком CII. Это промоторы Pi, PRE и Paq
61.
62. Белок CII длиной 97 аминокислот действует как транскрипционный фактор, открывающий новые промоторы. CII узнает
последовательности ДНК типаTTGCN6TTGC, но не каждый такой элемент становится промотором.
Необходимо, чтобы район N6 занимал положение, соответствующее –35
консенсусу, а рядом находился элемент – 10. Белок CII, по-видимому,
взаимодействует с σ-субъединицей РНК-полимеразы, привлекая ее к на
промотор вместо -35 элемента. Выделяют 3 левонаправленных промотора,
индуцируемых белком CII. Это промоторы Pi, PRE и Paq
63. БАКТЕРИОФАГ ЛЯМБДА
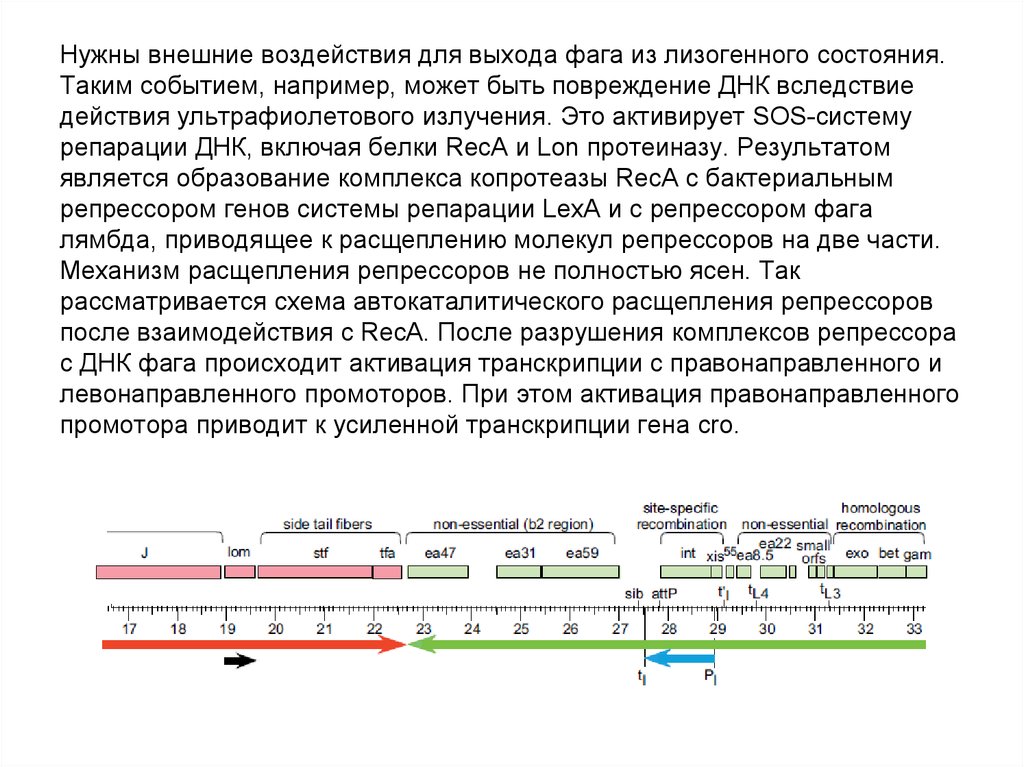
64. Нужны внешние воздействия для выхода фага из лизогенного состояния. Таким событием, например, может быть повреждение ДНК
вследствиедействия ультрафиолетового излучения. Это активирует SOS-систему
репарации ДНК, включая белки RecA и Lon протеиназу. Результатом
является образование комплекса копротеазы RecA с бактериальным
репрессором генов системы репарации LexA и с репрессором фага
лямбда, приводящее к расщеплению молекул репрессоров на две части.
Механизм расщепления репрессоров не полностью ясен. Так
рассматривается схема автокаталитического расщепления репрессоров
после взаимодействия с RecA. После разрушения комплексов репрессора
с ДНК фага происходит активация транскрипции с правонаправленного и
левонаправленного промоторов. При этом активация правонаправленного
промотора приводит к усиленной транскрипции гена cro.
65. БАКТЕРИОФАГ ЛЯМБДА
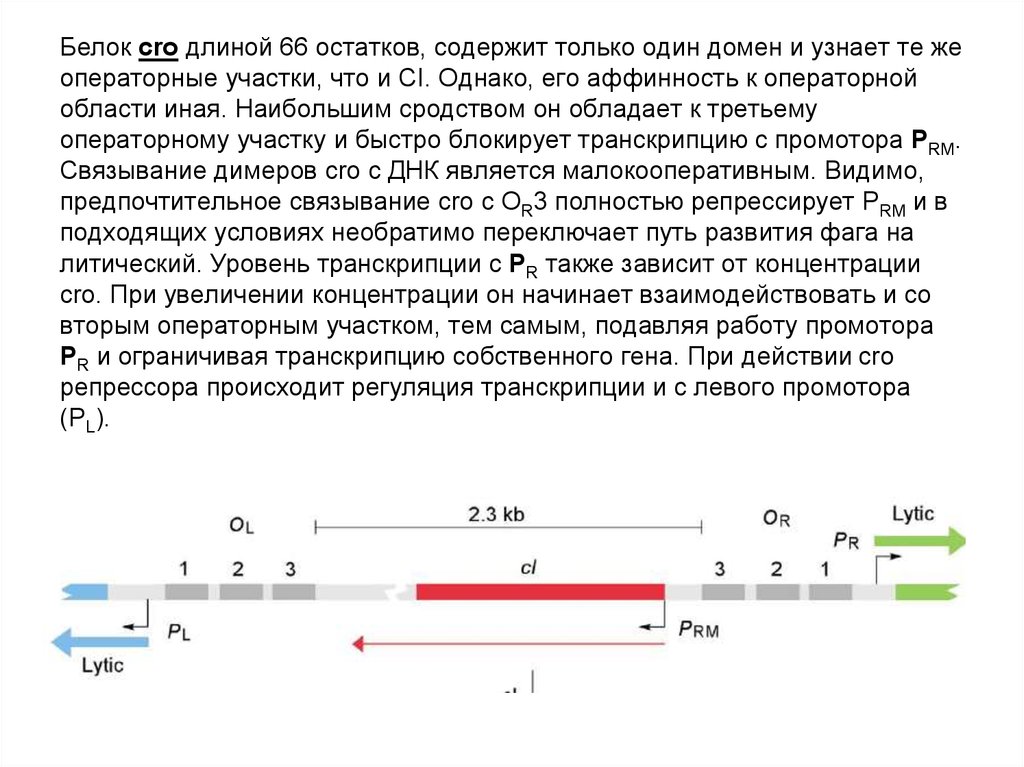
66. Белок cro длиной 66 остатков, содержит только один домен и узнает те же операторные участки, что и CI. Однако, его аффинность к
операторнойобласти иная. Наибольшим сродством он обладает к третьему
операторному участку и быстро блокирует транскрипцию с промотора PRM.
Связывание димеров cro с ДНК является малокооперативным. Видимо,
предпочтительное связывание cro с ОR3 полностью репрессирует PRM и в
подходящих условиях необратимо переключает путь развития фага на
литический. Уровень транскрипции с PR также зависит от концентрации
cro. При увеличении концентрации он начинает взаимодействовать и со
вторым операторным участком, тем самым, подавляя работу промотора
PR и ограничивая транскрипцию собственного гена. При действии cro
репрессора происходит регуляция транскрипции и с левого промотора
(PL).
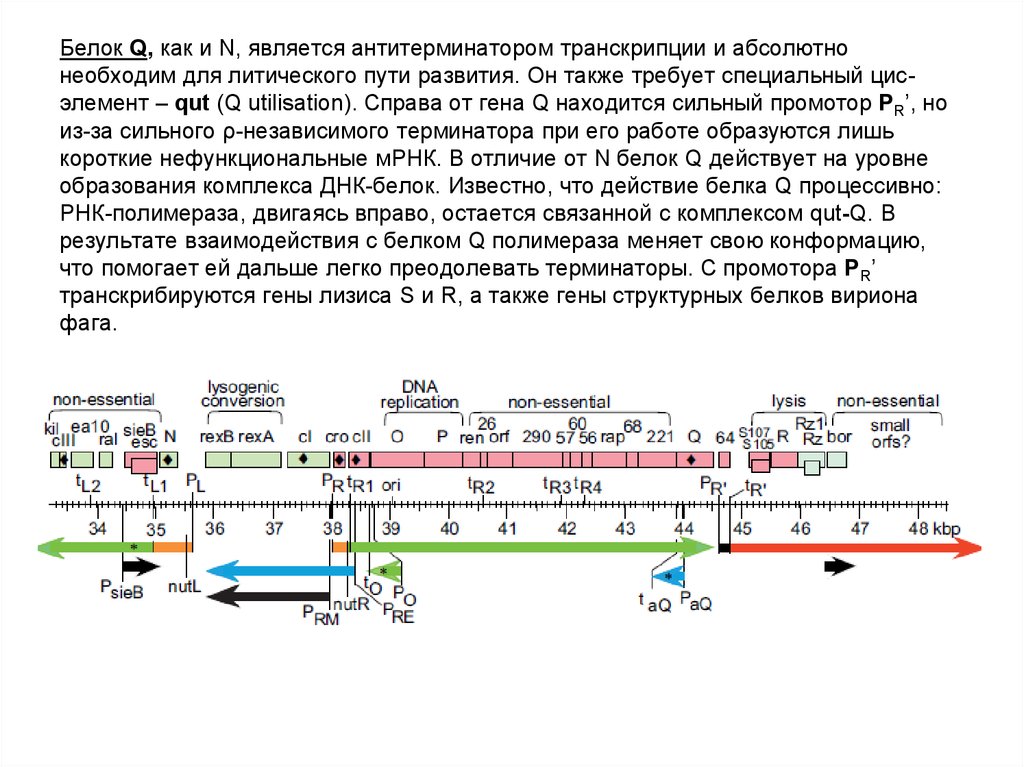
67. Белок Q, как и N, является антитерминатором транскрипции и абсолютно необходим для литического пути развития. Он также требует
специальный цисэлемент – qut (Q utilisation). Справа от гена Q находится сильный промотор PR’, ноиз-за сильного ρ-независимого терминатора при его работе образуются лишь
короткие нефункциональные мРНК. В отличие от N белок Q действует на уровне
образования комплекса ДНК-белок. Известно, что действие белка Q процессивно:
РНК-полимераза, двигаясь вправо, остается связанной с комплексом qut-Q. В
результате взаимодействия с белком Q полимераза меняет свою конформацию,
что помогает ей дальше легко преодолевать терминаторы. С промотора PR’
транскрибируются гены лизиса S и R, а также гены структурных белков вириона
фага.
68. БАКТЕРИОФАГ ЛЯМБДА
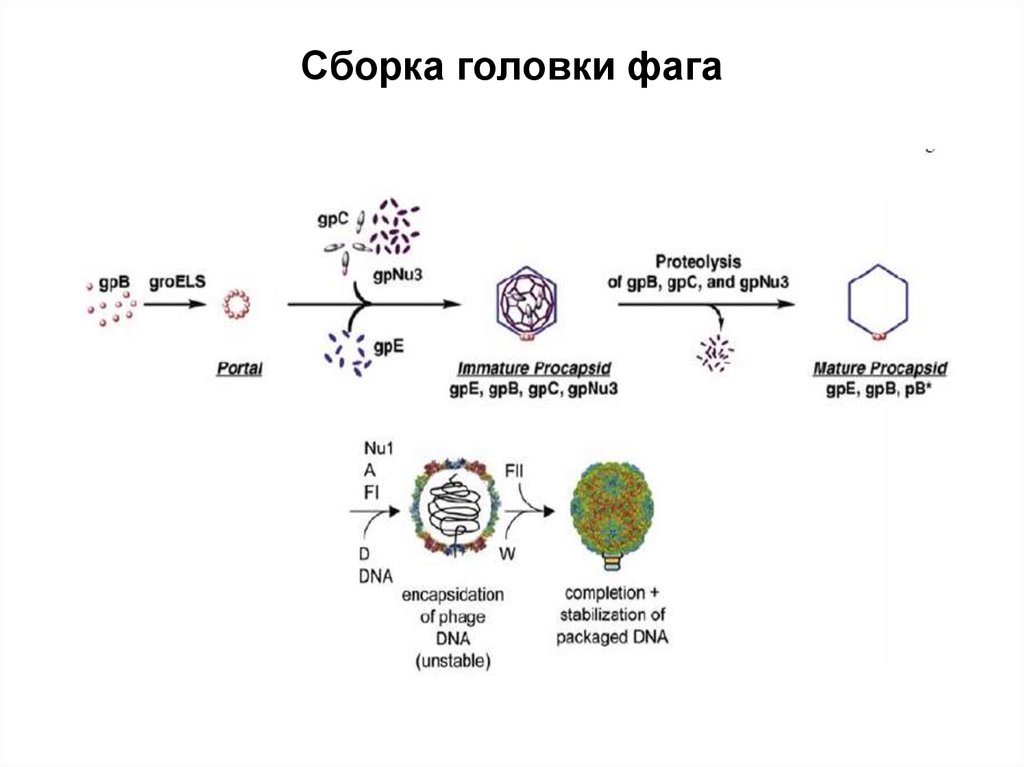
69. Сборка головки фага
70. Сборка хвостового отростка
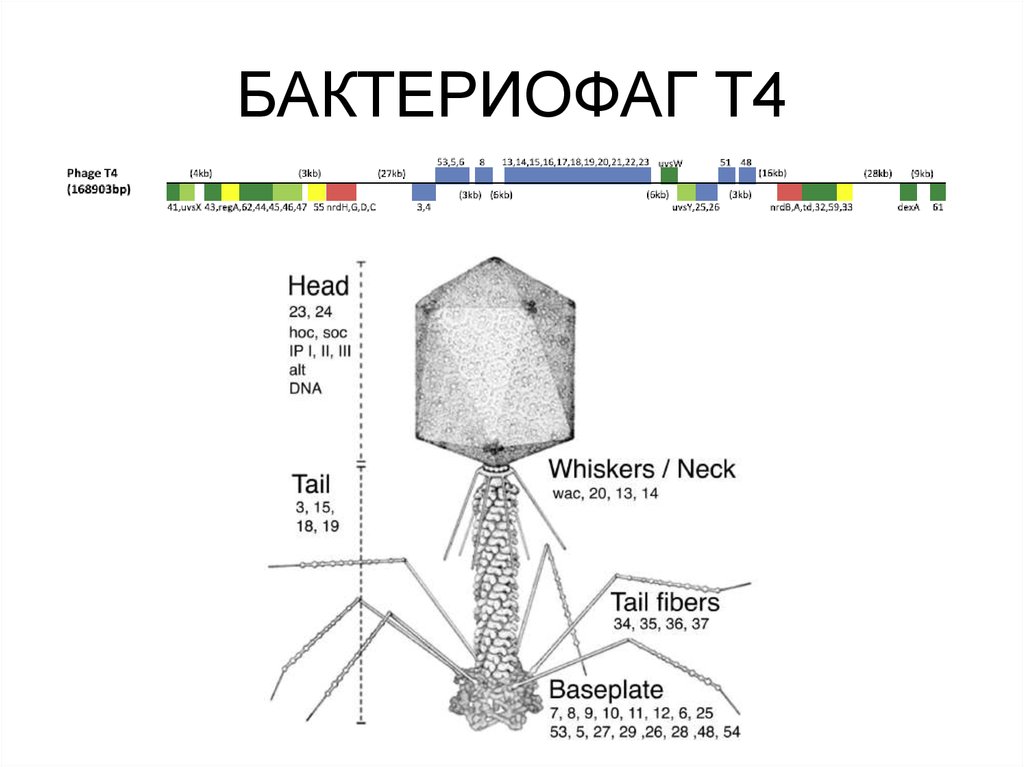
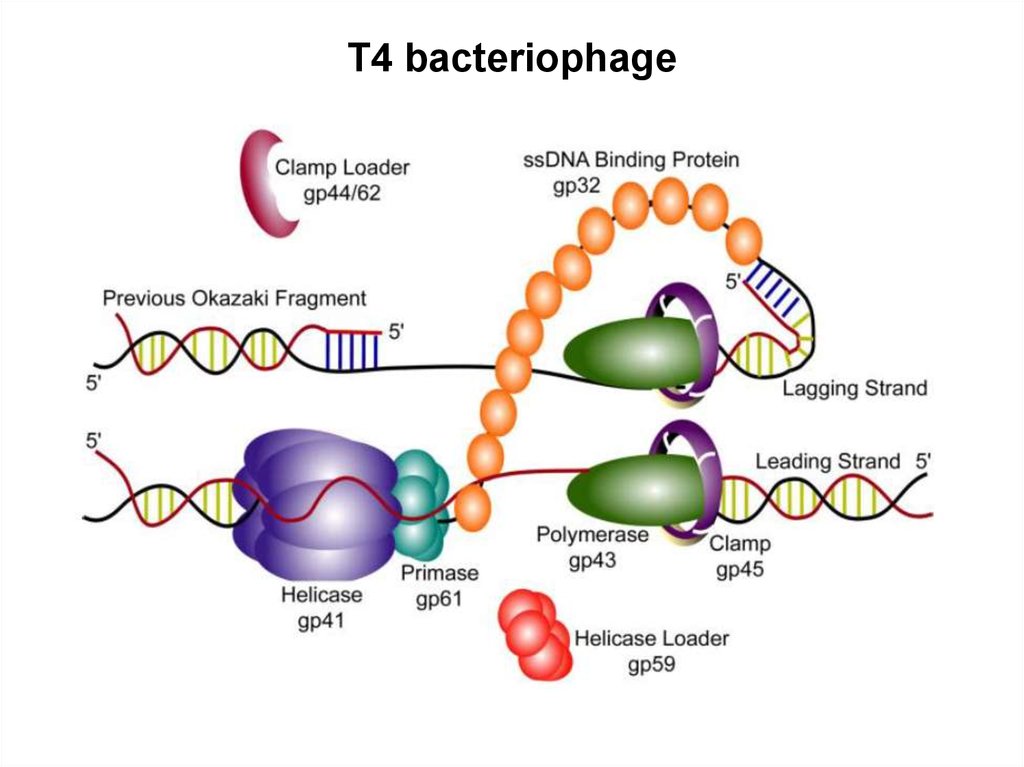
71. БАКТЕРИОФАГ Т4
72.
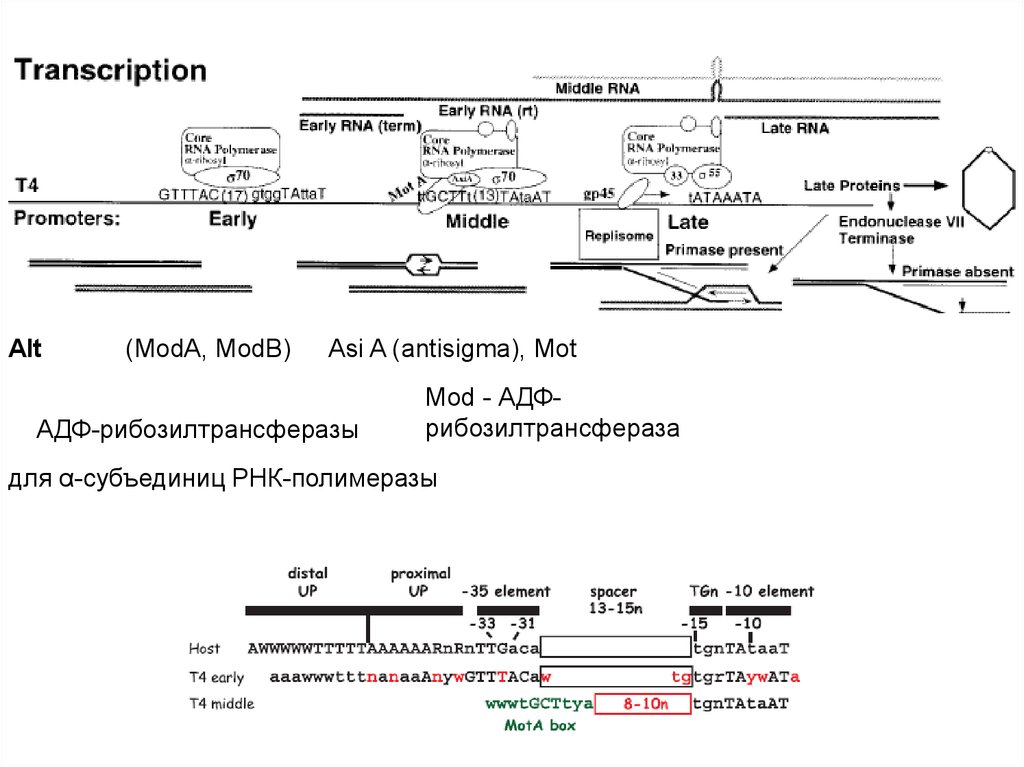
• Гены Т4 делятся на истинно ранние, ранние, средние и поздние.Около 40 промоторов ранних генов узнаются
немодифицированной клеточной РНК-полимеразой. Однако,
для успешной конкуренции с бактериальными промоторами фаг
использует два регуляторных механизма. Во-первых, ранние
промоторы содержат похожие на бактериальные -35 и -10
элементы. Однако, окружение этих элементов отличается от
бактериальных промоторов, что обеспечивает большее их
сродство к РНК-полимеразе и, как следствие,
предпочтительную экспрессию фаговых генов. Во-вторых,
совместно с инъекцией фаговой ДНК в клетку попадает также
вирусный белок Alt (мол. масса около 70 кДа). Он обладает
активностью АДФ-рибозилтрансферазы и на самых ранних
этапах инфекции модифицирует одну из α-субъединиц РНКполимеразы, а также, с несколько меньшей эффективностью,
субъединицы β, β’ и σ. В результате резко усиливается
транскрипция ранних вирусных промоторов по сравнению с
клеточными.
73.
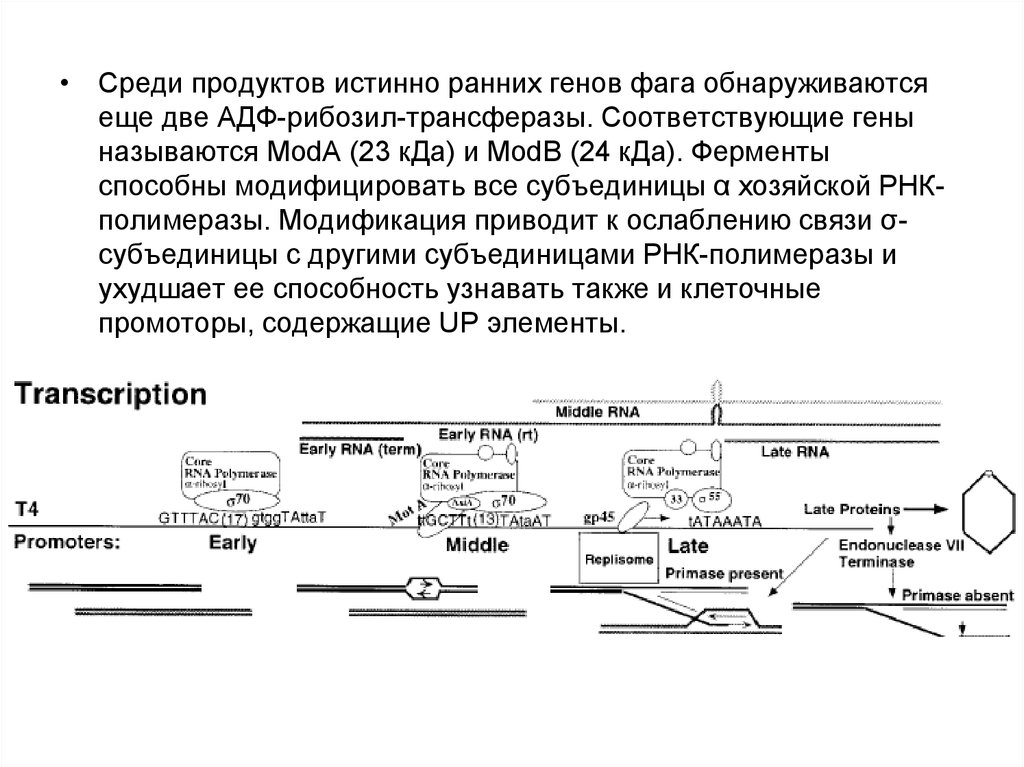
• Среди продуктов истинно ранних генов фага обнаруживаютсяеще две АДФ-рибозил-трансферазы. Соответствующие гены
называются ModA (23 кДа) и ModB (24 кДа). Ферменты
способны модифицировать все субъединицы α хозяйской РНКполимеразы. Модификация приводит к ослаблению связи σсубъединицы с другими субъединицами РНК-полимеразы и
ухудшает ее способность узнавать также и клеточные
промоторы, содержащие UP элементы.
74.
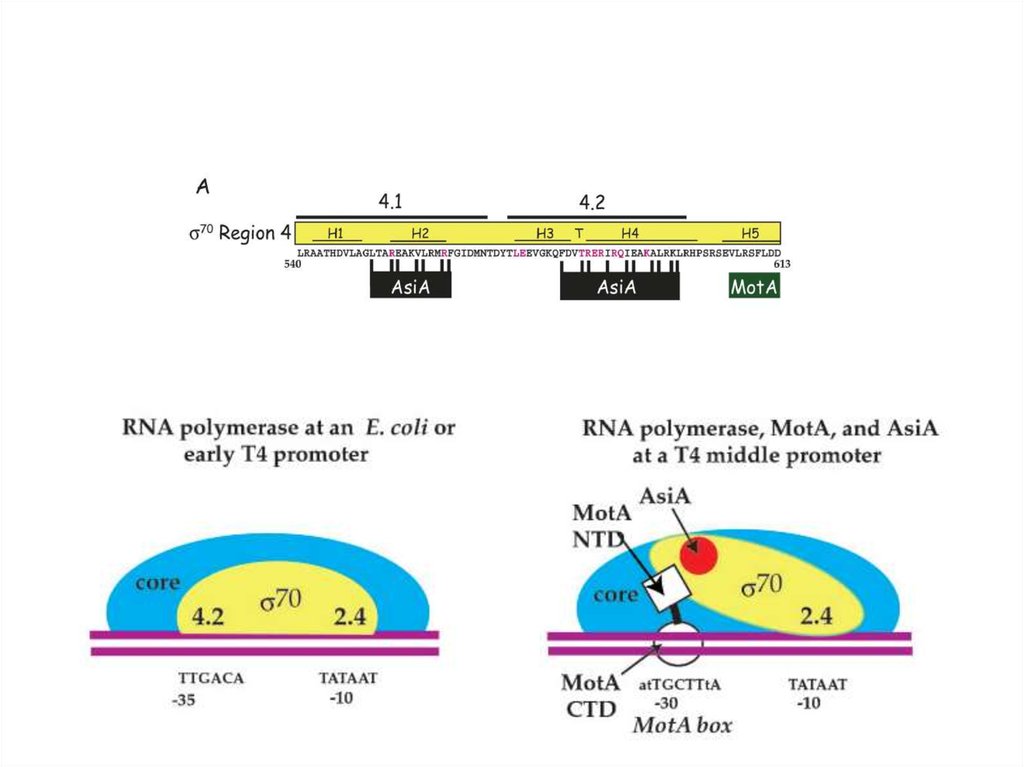
Для транскрипции средних генов нужны вирусные белки Asi A (antisigma)
и Mot (Modification of transcription). Asi A – маленький белок (длиной 90
а.к.), взаимодействующий с σ70-субъединицей. В этом комплексе σсубъединица плохо узнает элементы -35. В результате не узнаются
промоторы ранних генов фага и клеточные промоторы. Однако, полное
ингибирование ранних промоторов наблюдается лишь при модификации
обеих α-субъединиц РНК-полимеразы с помощью Mod. На этапах
инфекционного цикла, когда модифицирована только одна из αсубъединиц, Asi A способствует, как ко-активатор, вместе с белком Mot,
селективной инициации на средних промоторах. Mot нужен для включения
средних генов. Их промоторы имеют в -30 положении участок для
узнавания белка Mot – MotA box (5’-atTGCTTtA-3’). Другим доменом Mot
взаимодействует с σ-субъединицей РНК-полимеразы. Таким образом,
белок Mot по своей функции напоминает белок CII фага λ.
75.
76.
Промоторы поздних генов содержат элементы, существенно
отличающие их от клеточных промоторов. Для их транскрипции
нужны следующие вирусспецифические белки: gp55, который
полностью замещает σ-субъединицу в РНК-полимеразе (важно,
что σ-субъединица слабо связана с другими субъедницами РНКполимеразы из-за АДФ-рибозилирования и взаимодействия с
AsiA) и белок gp33, являющийся коактиватором и
способствующий взаимодействию с gp45 (фактор
процессивности ДНК-полимеразы). В этом случае важно, что
транскрипция поздних генов начинается в ходе репликации ДНК.
И для того, чтобы произошла транскрипция позднего гена нужно,
чтобы в районе его промотора прошел gp45. При этом меняется
конформация этого участка, т.е. происходит расплетание ДНК, а
gp45 действует как подвижный энхансер.
77.
• Известно, что gp55 является фактором,обеспечивающим весьма слабое сродство
к ДНК по сравнению с σ70-субъединицей и
другими подобными факторами РНКполимеразы. В результате, фаг Т4
кодирует 3 дополнительных белка,
участвующие в регуляции транскрипции
на стадии инигибирования
взаимодействия РНК-полимеразы с
хозяйскими факторами σ38 и σ32 на
стадиях цикла до полного расщепления
клеточной ДНК.
78.
Alt(ModA, ModB)
Asi A (antisigma), Mot
АДФ-рибозилтрансферазы
Mod - АДФрибозилтрансфераза
для α-субъединиц РНК-полимеразы
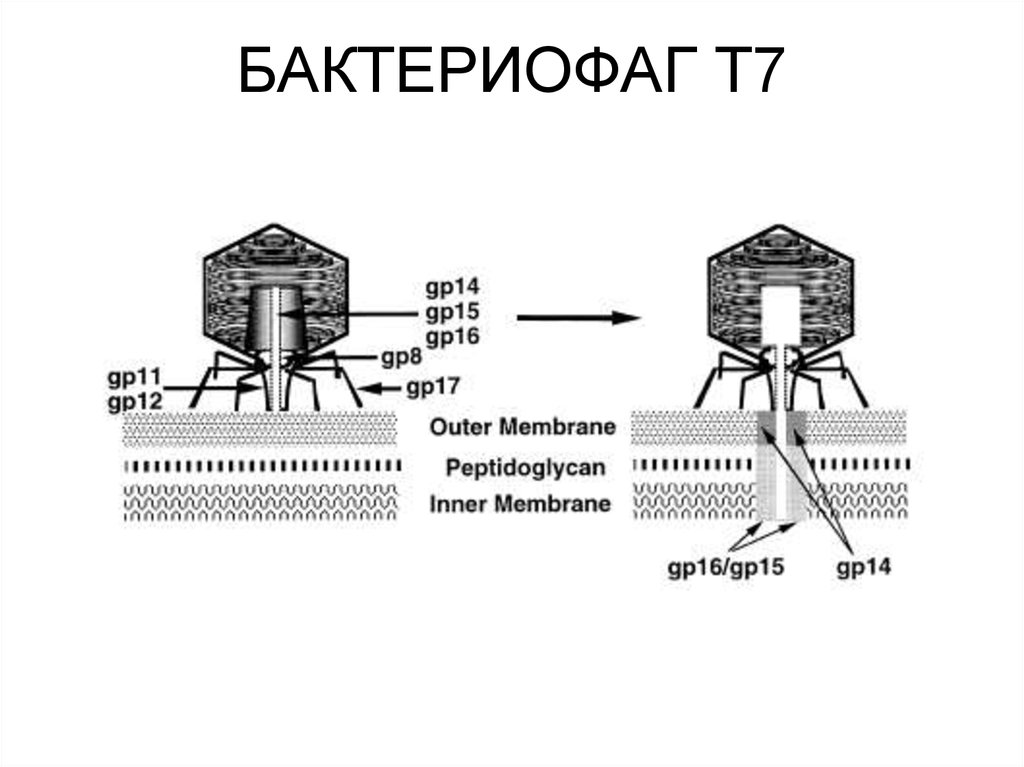
79. БАКТЕРИОФАГ Т7
80. Все гены фага Т7 транскрибируются с одной и той же цепи ДНК слева направо. Ген 0.3 транскрибируется первым в левой части
генома, а ген 19.5 последним в правой части. Геномфага кодирует собственную РНК-полимеразу (ген 1). Эта
полимераза состоит из одной субъединицы и работает
намного быстрее клеточной. Она нужна для транскрипции
около 80% ДНК в правой части генома. Различают 3 класса
генов у фага Т7. Класс I экспрессируется со 2ой по 8ую минуту
после инфицирования бактерий с помощью клеточной ДНКзависимой РНК-полимеразы; класс II – между 6ой и 15ой мин.
с помощью вирусной РНК-полимеразы и класс III – c 8ой по
25ую мин. также с помощью вирусной РНК-полимеразы
81. Первоначально в клетку бактерии попадает левый конец генома размером около 850 пар оснований. Этот район включает промотор
(φOL), узнаваемый только фагоспецифичной РНК-полимеразой ивозможно способствующий репликации вирусной ДНК, и 4
промотора (EcA0, EcA1, EcA2, ECA3) для полимеразы E.coli, из
которых 3 последних являются очень сильными. После попадания
фага в клетку, клеточная РНК-полимераза транскрибирует самый
левый конец генома (19% ДНК, включающих гены класса I) вплоть до
сильного Rho-независимого терминатора, ТЕ (Рис. ХХ). При этом
производится не только мРНК, но и энергия для втягивания в клетку
около 1/5 части генома слева. Скорость проникновения ДНК фага в
клетку на этой стадии равна примерно 50 нп/сек, т.е. равна скорости
движения бактериальной РНК-полимеразы по матрице ДНК.
82.
• Ранние транскрипты у фага Т7 подвергаютсяпроцессингу РНКазой III. Точек разрезания в
ранней области генома имеется 5, однако, только
мРНК гена 1 является моноцистронной. Хотя
экспрессия ранних генов у фага Т7 резко
снижается после 8 минут инфекции,
соответствующие мРНК, процессированные
РНКазой III, обнаруживаются и на поздних этапах
инфекции. Очевидно, существует пока
неизвестный механизм трансляционного
выключения экспрессии ранних фаговых белков.
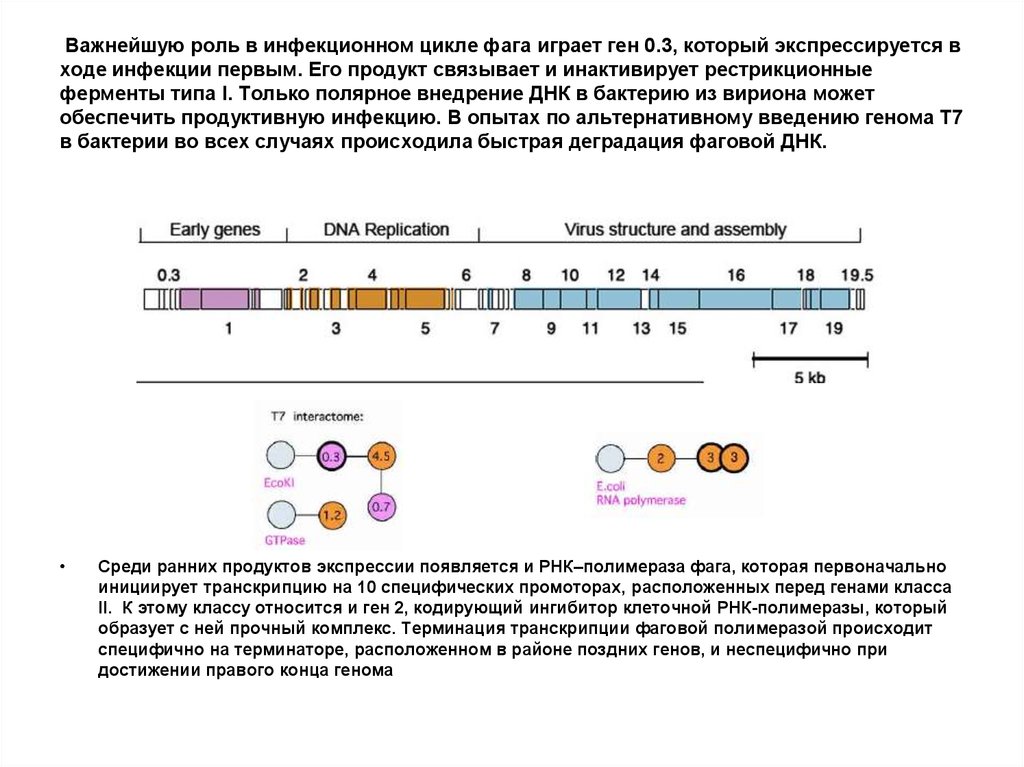
83. Важнейшую роль в инфекционном цикле фага играет ген 0.3, который экспрессируется в ходе инфекции первым. Его продукт связывает
и инактивирует рестрикционныеферменты типа I. Только полярное внедрение ДНК в бактерию из вириона может
обеспечить продуктивную инфекцию. В опытах по альтернативному введению генома Т7
в бактерии во всех случаях происходила быстрая деградация фаговой ДНК.
Среди ранних продуктов экспрессии появляется и РНК–полимераза фага, которая первоначально
инициирует транскрипцию на 10 специфических промоторах, расположенных перед генами класса
II. К этому классу относится и ген 2, кодирующий ингибитор клеточной РНК-полимеразы, который
образует с ней прочный комплекс. Терминация транскрипции фаговой полимеразой происходит
специфично на терминаторе, расположенном в районе поздних генов, и неспецифично при
достижении правого конца генома
84. Пять фагоспецифических промоторов для генов класса III являются гораздо более сильными, чем промоторы класса II. На этом
основанпринцип темпоральной каскадной регуляции транскрипции у фага
Т7. Продукт гена 3.5 (фаговый лизоцим), связываясь с Т7
полимеразой резко увеличивает вероятность образования
абортивных инициаторных комплексов, не переходящих к стадии
элонгации и, таким образом, блокирующих повторные циклы
инициации. Это затрагивает в первую очередь промоторы генов
класса II, но гораздо менее влияет на гены класса III, чьи промоторы
имеют чрезвычайно высокое сродство к молекулам Т7 полимеразы,
что способствует быстрому вытеснению абортивных инициаторных
комплексов.
Транскрипция фаговой полимеразой является, также как и ранняя
транскрипция, движущим механизмом для проникновения ДНК вируса в
клетку. Однако на этой стадии процесс происходит гораздо быстрее – со
скоростью около 250 нп/сек, и весь процесс занимает менее 10 мин.
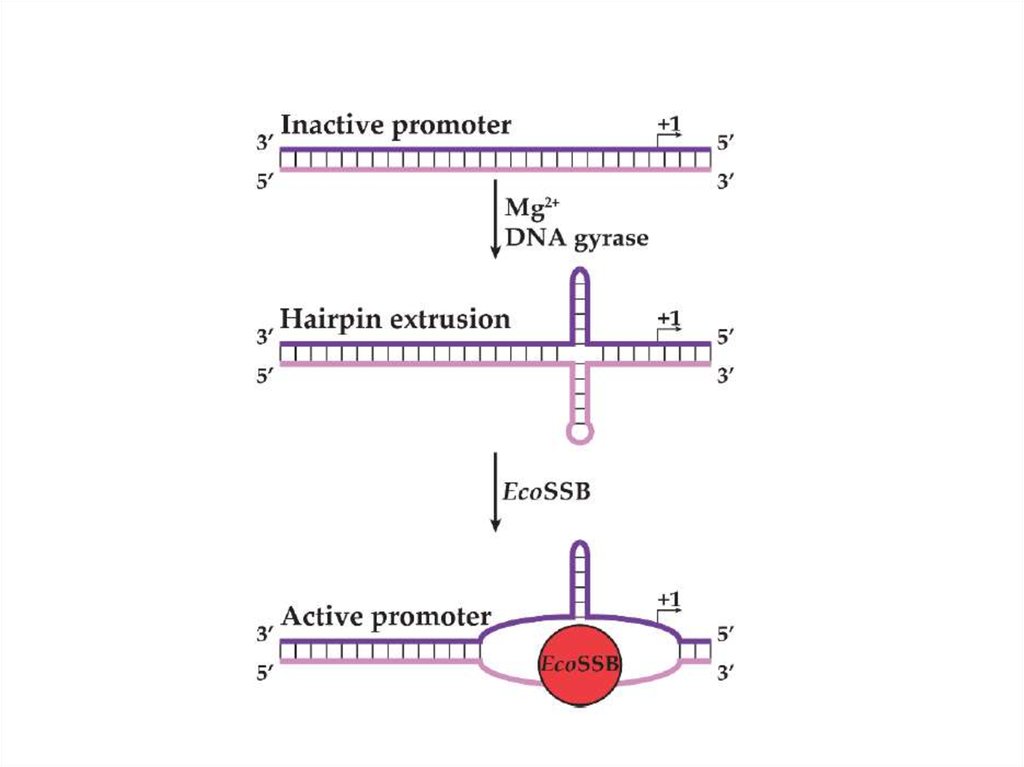
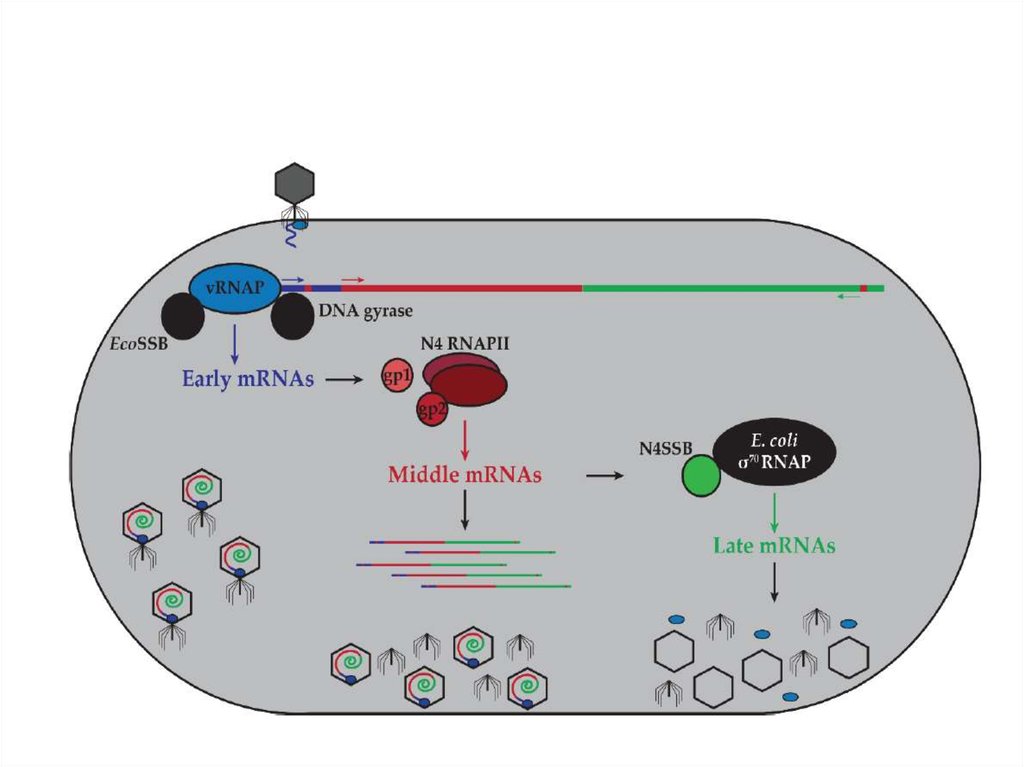
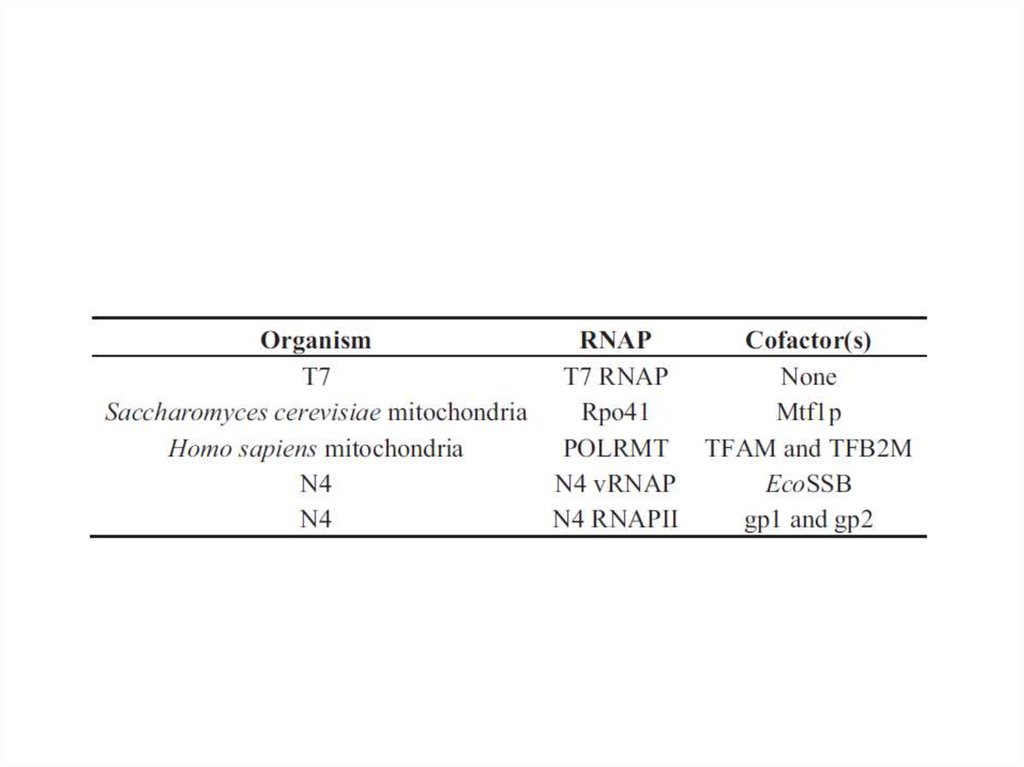
85. Регуляция транскрипции у фага N4 Геном этого фага представлен линейной двуцепочечной ДНК длиной 72 000 п.н. Гены делятся
Регуляция транскрипции у фага N4Геном этого фага представлен линейной двуцепочечной ДНК длиной 72 000 п.н. Гены делятся
условно на ранние, поздние и средние. Этот вирус интересен тем, что хозяйская РНКполимераза используется не на ранних этапах инфекции, как у подавляющего большинства
фагов, кодирующих собственную систему транскрипции, а на поздних.
• Ранние гены транскрибируются фаговой РНК-полимеразой
длиной 3500 аминокислот, которая находится в вирионе в
количестве 1-2 копий и вносится в клетку при инфекции.
Этот фермент эволюционно отдаленно близок Т7 РНКполимеразе. Вирионная РНК-полимераза не способна
узнавать промоторы на двуцепочечной ДНК, и использует
только сверхспирализованную ДНК вируса,
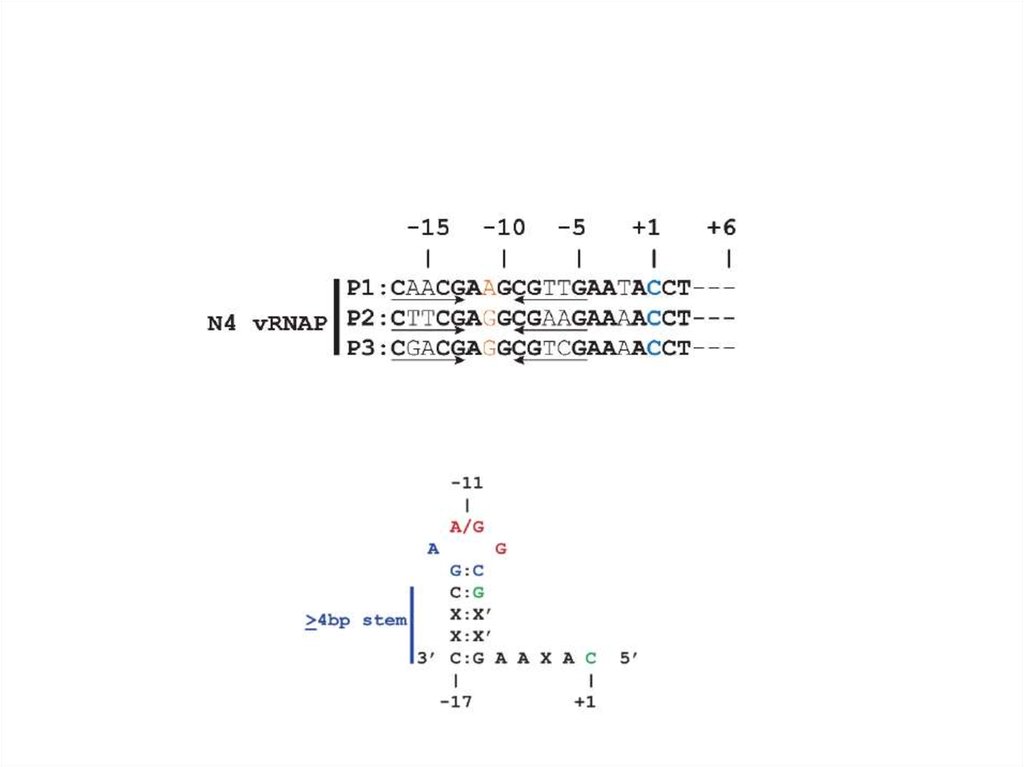
образовавшуюся при действии ДНК-гиразы E.coli. Ранние
промоторы фага представляют собой консервативные
шпилечные структуры, включающие концевую петлю
длиной 3 остатка и двуспиральный стебель длиной 5-7 пар
оснований. Такие шпильки стабилизируются ssb-белком
E.coli, связывающим прилежащие односпиральные
участки.
86.
87.
88.
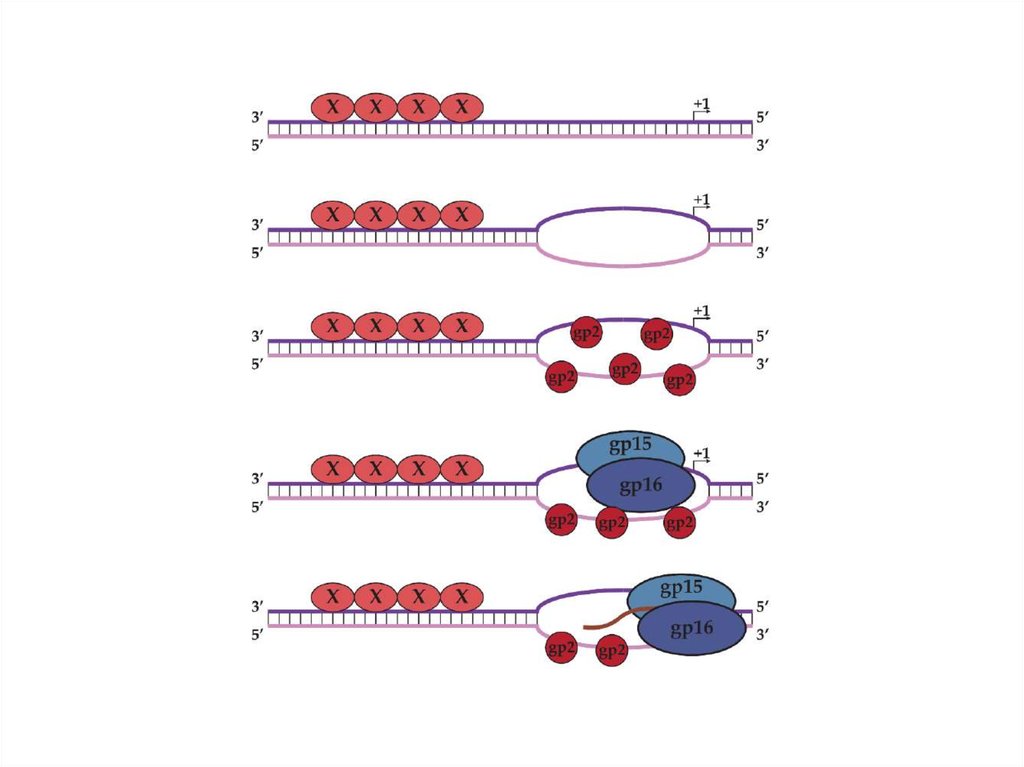
• Средние гены транскрибируются N4 РНКполимеразой II, являющейся продуктом ранних генови состоящей из двух белков gр15 (30 кДа) и gр16 (40
кДа). Важнейшую роль играет также ДНКсвязывающий белок gp2. Подобно вирионной РНКполимеразе РНК-полимераза II узнает только
одноцепочечные промоторные районы. Белок gр2,
связывая преимущественно одноцепочечные
участки, стабилизирует структуру промоторных
районов и непосредственно участвует в узнавании
промоторов, взаимодействуя с самим ферментом.
89.
90.
• Поздние гены транскрибируются клеточной σ70содержащей РНК-полимеразой. Однако, поздниепромоторы N4 проявляют весьма слабую гомологию
консенсусам –10 и –35. Соответственно, in vitro ДНК
фага является очень слабой матрицей для хозяйской
РНК-полимеразы. Оказалось, что фаговый ДНКсвязывающий белок (N4SSB), участвующий в
репликации и рекомбинации, является активатором
поздней транскрипции. С его помощью
стабилизируются специфические шпилечные
структуры в области поздних промоторов.
91.
92.
93. ДНК полимераза III E.coli
Фермент состоит из нескольких субъединиц и представляет
собой гетероолигомер. Состоит из трех групп белков.
1) каталитический “соre” включает каталитические субъединицы
α2 (синтез ДНК) и ε2 (экзонуклеазная 3’-5’активность);
2) β2-фактор процессивности полимеразы (аналог PCNA);
3) τ2, γ2,δ2,δ’2, χ, ψ – clamp loader (загружает фактор
процессивности на ДНК с затратой АТФ). τ в нужный момент
способствует посадке кольца β-субъединицы.
Наоборот, δ,γ,δ’ как «гаечный ключ» раскрывает β2-фактор
Фактор процессивности снимается с ДНК, когда полимераза
сталкивается с затравкой. Затравку затем удаляют РНКазаН и ДНК
полимераза I, которая обладает 5’-3’ экзонуклеазной активностью
и способна съедать последний рибонуклеотид затравки,
связанный с дезоксирибонуклеотидом.
.
94.
95. Enterobacteria phage P2 33.5 Kbp
96. Репликация ДНК бактериофага λ
Инициация репликации. Участок инициации репликации Ori первоначально узнается вирусным
белком – О-белком (продукт гена О). О-белок тетрамеризуется на ori и образует комплекс с ДНК,
называемый О-сомой. Этот комплекс можно наблюдать и в электронном микроскопе.
97. Если ассоциация белка О с комплексом DnaB-Р-белок не произойдет (в случае недостатка DnaB в клетке или посадке О белка на
неспецифические участки ДНК фага)происходит разворачивание О-сомы за счет транскрипции этого участка ДНК и быстрая
деградация белка О протеазным комплексом ClpP/ClpX.
В случае формирования полной препраймосомы РНК-полимераза не
способна разрушить комплекс О-белка с ДНК, однако, необходима
дальнейшая модификация препраймосомы, т.к. в ее составе DnaB
неактивен. В активации DnaB хеликазы участвуют клеточные белки –
шапероны: DnaJ, GrpE, DnaK, которые вызывают диссоциацию белка
Р из комплекса в ходе АТФ-зависимой реакции. После того, как DnaB
начинает расплетать ДНК, на одноцепочечные участки ДНК садится
праймаза DnaG и синтезирует РНК-затравки.
98.
99. В ходе двунаправленной репликации по схеме Кернса в клетках, зараженных фагом λ образуются около 50 молекул дочерних кольцевых
ДНК, некоторые из которых уже через15 минут после начала инфекции могут переходить к репликации по типу
разматывающегося рулона. Это приводит к формированию конкатемерных ДНК молекул,
содержащих около 10 эквивалентов вирусного генома.
Превращение схемы Кернса в схему разматывающегося рулона,
возможно, связано с ослаблением траскрипции в участке ori с промотера
P® и, как следствие, возникновением односторонней репликации.
Причиной ослабления транскрипции c этого промотера может быть
действие возрастающих количеств cro-репрессора. Кроме того,
присутствие в клетке ограниченного количества белка DnaA, приводит к
тому, что при увеличении числа копий фаговой ДНК, он вытитровывается,
и транскрипция с промотера P® ослабляется. Действительно, показано,
что в клетках бактерий, продуцирующих температурочувствительный
мутант DnaA при 43 градусах, даже на очень ранних этапах инфекции
репликация ДНК фага происходит почти исключительно по схеме
разматывающегося рулона.
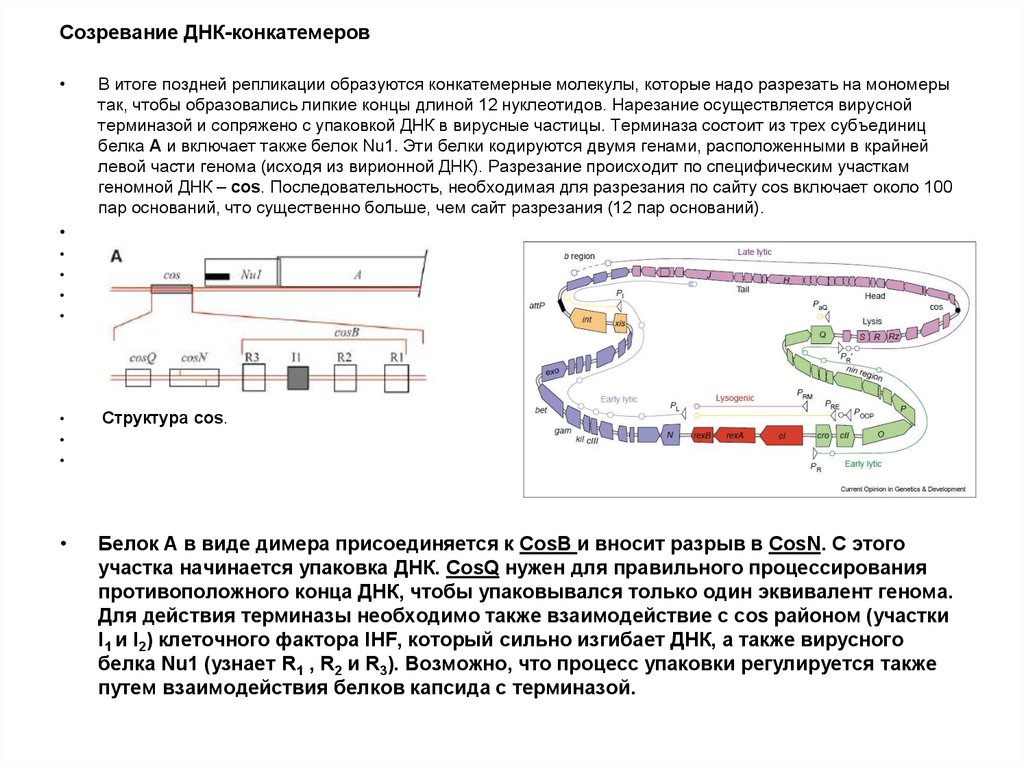
100. Созревание ДНК-конкатемеров
В итоге поздней репликации образуются конкатемерные молекулы, которые надо разрезать на мономеры
так, чтобы образовались липкие концы длиной 12 нуклеотидов. Нарезание осуществляется вирусной
терминазой и сопряжено с упаковкой ДНК в вирусные частицы. Терминаза состоит из трех субъединиц
белка А и включает также белок Nu1. Эти белки кодируются двумя генами, расположенными в крайней
левой части генома (исходя из вирионной ДНК). Разрезание происходит по специфическим участкам
геномной ДНК – cos. Последовательность, необходимая для разрезания по сайту cos включает около 100
пар оснований, что существенно больше, чем сайт разрезания (12 пар оснований).
Структура cos.
Белок А в виде димера присоединяется к CosB и вносит разрыв в CosN. С этого
участка начинается упаковка ДНК. CosQ нужен для правильного процессирования
противоположного конца ДНК, чтобы упаковывался только один эквивалент генома.
Для действия терминазы необходимо также взаимодействие с cos районом (участки
I1 и I2) клеточного фактора IHF, который сильно изгибает ДНК, а также вирусного
белка Nu1 (узнает R1 , R2 и R3). Возможно, что процесс упаковки регулируется также
путем взаимодействия белков капсида с терминазой.












































 biology
biology








