Similar presentations:
Электролиз. Электролит
1. ЭЛЕКТРОЛИЗ
Автор: преподаватель химии лицея-интернатапри СГТУ, доцент Никитина Л. В.
2.
Электролизом называютсовокупность
окислительновосстановительных
процессов, происходящих
на электродах под
действием постоянного
электрического тока.
3.
ЭЛЕКТРОЛИЗЕР –электрохимическая
ячейка, в которой
проводят электролиз
растворов или
расплавов веществ.
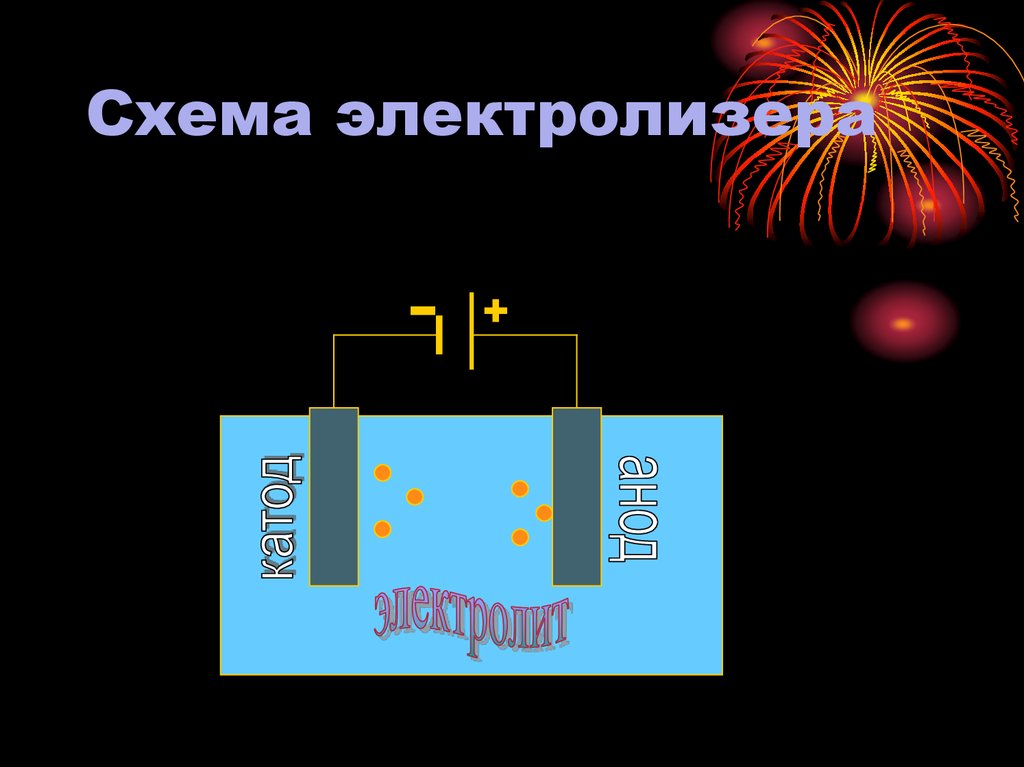
4. СОСТАВ ЭЛЕКТРОЛИЗЕРА
ЭЛЕКТРОЛИТ – раствор илирасплав вещества,
который проводит
электрический ток
вследствие распада
молекул данного вещества
на ионы (катионы и
анионы)
5.
АНОД – электрод, которыйподключен к положительному
полюсу источника питания
(ПРОЦЕСС ОКСИЛЕНИЯ)
КАТОД - электрод, который
подключен отрицательному
полюсу источника питания
(ПРОЦЕСС ВОССТАНОВЛЕНИЯ)
6. Схема электролизера
7. ЭЛЕКТРОЛИЗ РАСПЛАВОВ
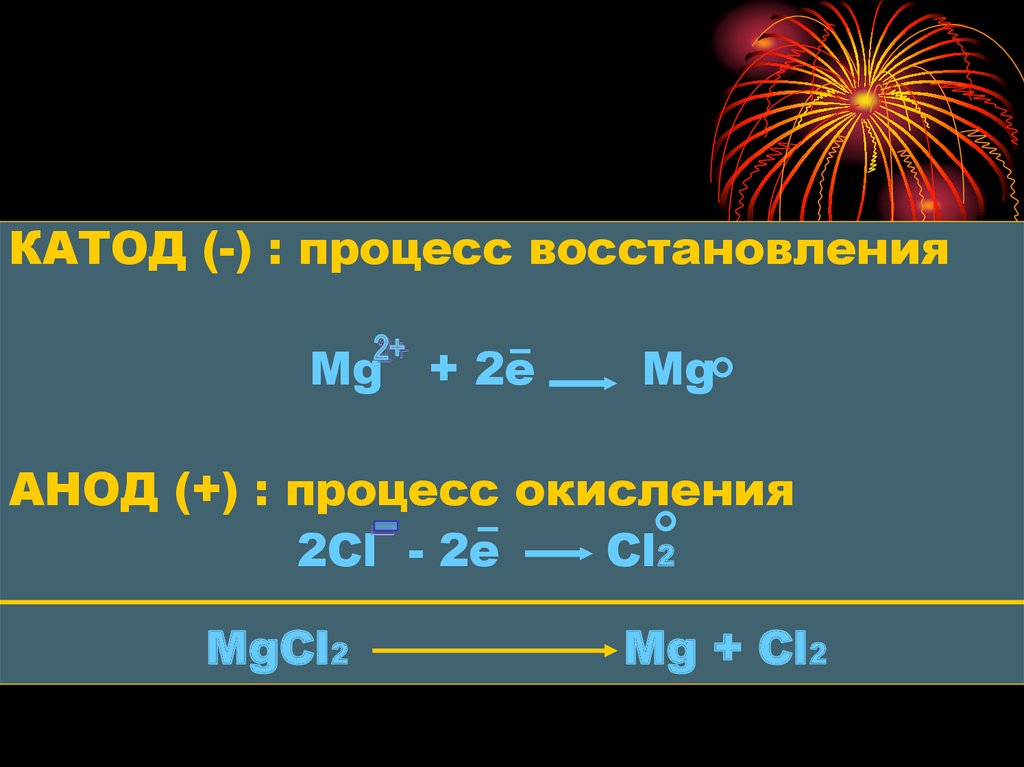
ПРИМЕР: схема электролизарасплава хлорида магния MgCl2
В расплаве данного электролита
содержатся ионы: Mg и Сl.
Катионы Mg движутся к катоду, а
анионы Сl - к аноду
8.
КАТОД (-) : процесс восстановленияMg + 2e
Mg
АНОД (+) : процесс окисления
2Сl - 2e
Cl2
MgCl2
Mg + Cl2
9. ЭЛЕКТРОЛИЗ РАСТВОРОВ
В данном случае вокислительновосстановительных процессах,
происходящих на электродах
возможно участие молекул
ВОДЫ (Н2О)
10. Возможные процессы на катоде
1. Если металл расположен вряду напряжений после
водорода (Cu, Hg, Ag, Pt, Au),
то восстанавливаются
катионы данного металла
Сu + 2e
Cu
11.
2. Если металл расположен отначала ряда напряжений до Al
включительно (Li, Na, K, Mg и др.),
то на катоде происходит процесс
восстановления молекул Н2О:
2Н2О + 2е
H2
+
2OH
12.
3. Если металл расположен вряду напряжений между Al и
водородом (Zn, Fe, Ni, Mn и
др.), то на катоде происходят
процессы восстановления
молекул Н2О и ионов данного
металла:
2Н2О + 2е
H2
+ 2e
Zn
Zn
+
2OH
13.
14. Возможные процессы на аноде
1. Если анод растворимый (Fe,Zn, Al, Сu и др.), то
окисляется металл анода,
несмотря на природу аниона:
Сu - 2e
Cu
15.
2. Если анод не растворяется (инертный –графит, Au, Pt и др.), то:
• анионы, не содержащие кислород (F ,
Cl , S и др.), окисляются на аноде
2Cl - 2e
Cl2
• анионы, содержащие кислород
(SO4 , NO3 и др.) не окисляются на аноде, а
окисляются молекулы воды
2Н2О - 4е
O2
+
4H
16.
ПРИМЕР: схема электролиза растворасульфата магния MgSO4
В растворе существуют ионы Mg и SO4
КАТОД (-) : процесс восстановления
2Н2О + 2е
H2
+
2OH
2
АНОД (+) : процесс окисления
2Н2О - 4е
2MgSO4 + 6Н2О
O2
+
4H
1
2 H2 + O2 + 2Mg(OH)2 + 2H2SO4
17. Применение электролиза
1. Получение металлов (Al, Mg, Na,Cd)2. Получение H2, галогенов, щелочей
3. Очистка металлов
(рафинирование)
4. Нанесение защитных покрытий на
металлические изделия
5. Получение металлических копий















 chemistry
chemistry








