Similar presentations:
Молекулярные механизмы регуляции поведения. Интерфейс между нейронами
1. Молекулярные механизмы регуляции поведения Лекция 2 Интерфейс между нейронами
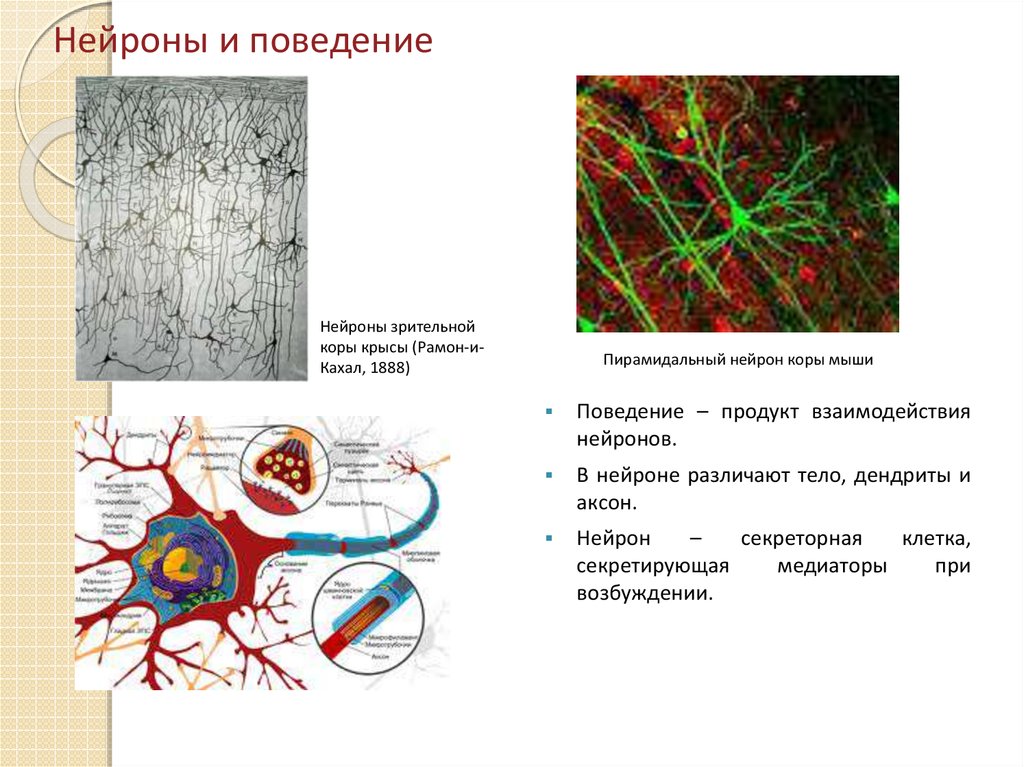
2. Нейроны и поведение
Нейроны зрительнойкоры крысы (Рамон-иКахал, 1888)
Пирамидальный нейрон коры мыши
Поведение – продукт взаимодействия
нейронов.
В нейроне различают тело, дендриты и
аксон.
Нейрон
–
секреторная
клетка,
секретирующая
медиаторы
при
возбуждении.
3. Синаптическая и объемная коммуникации
Синаптическая коммуникацияосуществляется с помощью
специализированной структуры –
синапса. Она обеспечивает
адресную доставку и высокую
эффективность действия
медиатора.
При объемной коммуникации
медиатор секретируется в
межклеточное пространство и
взаимодействует с множеством
нейронов. Это обеспечивает
параллельное управление.
4. Молекулярная структура интерфейса:
В организме клетки являются изолированными объектами, которыевзаимодействуют через специализированный молекулярный
интерфейс.
Молекулярный интерфейс включает сигнальные молекулы, их
рецепторы и сопряженные с ними ферменты.
Рецепторы сигнальных молекул являются основным компонентом
интерфейса, обеспечивающим декодирование информации,
содержащейся в пакете сигнальных молекул.
Различают следующие типы мембранных рецепторов :
Рецепторы трофических факторов и цитокинов (один
трансмембранный домен).
Управляемые лигандом ионные каналы (2 или 4 трансмембранных
домена).
Сопряженные с G-белками (7 трансмембранных домена).
5. Рецепторы цитокинов и факторов роста
Включают рецепторный, трансмембранный и внутриклеточный домены.Различают: A) сопряженные с янус тирозинкиназами, B) рецепторная
тирозинкиназа, C) рецепторная серин/треонинкиназа, D) рецепторная
гуанидилатциклаза и E) рецепторная тирозинфосфатаза.
Присоединение лиганда сопровождается димеризацией с последующей
активацией за счет автофосфорилирования.
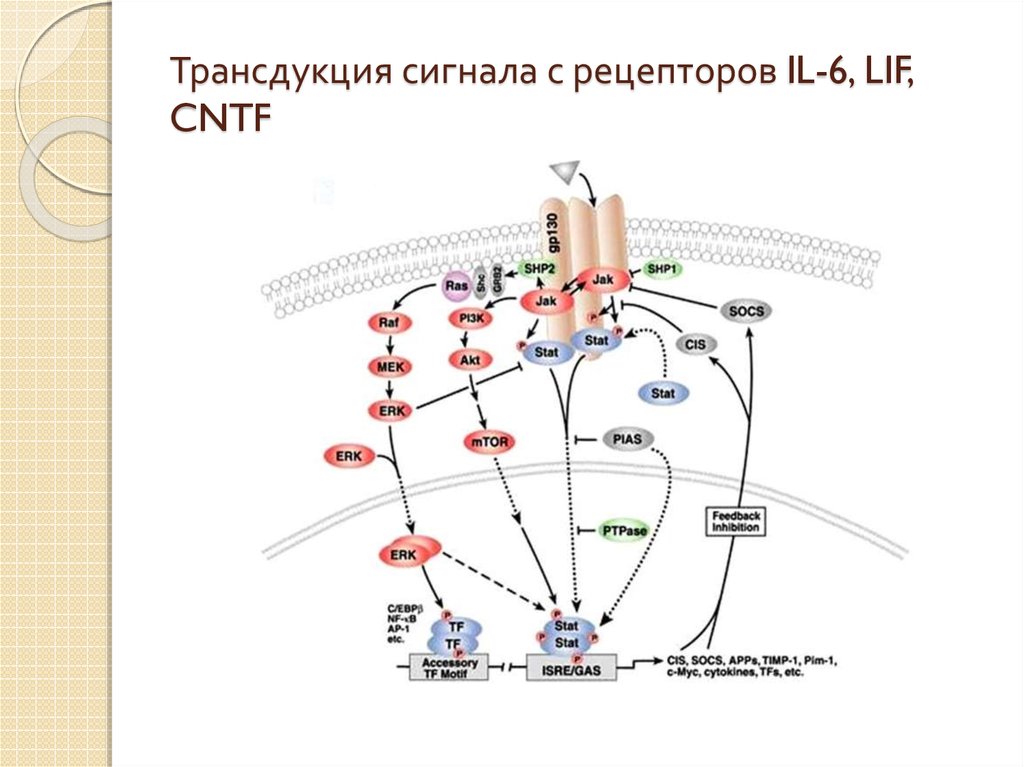
6. Трансдукция сигнала с рецепторов IL-6, LIF, CNTF
7. Трансдукция сигнала с trkB рецепторов
8. Рецепторы – ионные каналы
P2X рецепторы состоят из 3 субъединиц, включающих 2 трансмембранныхдомена. Субъединицы образуют Ca2+ канал в норме закрытый. Присоединение
АТФ вызывает открытие канала и проникновение ионов Ca2+ внутрь нейрона.
Рецепторы глутамата, ГАМК, ацетилхолина и серотонина состоят из 4 (глутамат)
или 5 (остальные) субъединиц, включающих 4 трансмембранных домена.
Субъединицы образуют ионный канал в норме закрытый. При активации
ионный канал открывается и пропускает ионы Na+ (ацетилхолин, серотонин), Cl(ГАМК-А) или Ca2+ / Na+ (NMDA, AMPA).
Вызывают быструю де- или гиперполяризацию мембраны.
Входящий ток Na+ открывает каналы Ca2+, который является внутриклеточным
посредником в трансдукции сигнала.
9. Рецепторы, сопряженные с G-белками
Более 1000 рецепторов медиаторов, гормонов, света, вкуса, запаха.Семь трансмембранных доменов.
Третья цитоплазматическая петля и COOH конец сопряжены с G-белком.
Механизм трансдукции сигнала определяется природой G-белка.
Отмечена конститутивная активность рецепторов в отсутствии лиганда.
Лиганд только усиливает гидролиз G-белка.
10. G-белки
Связывают GTP и GDP.G-белки состоят из 3 субъединиц , и .
Известны 20 генов для , 4 - и 7 - субъединицю.
В неактивном состоянии все субъединицы соединены вместе и с GDP.
Активация рецептора приводит к замещению GDP на GTP.
Активированный G-белок распадается на +GTP субъединицу и фрагмент, каждый
из которых имеет регуляторную активность. И пока субъединицы разделены
регулируют многие процессы в клетке. Работает как усилитель сигнала.
субъединица обладает собственной каталитической активностью медленно
превращает GTP в GDP. Затем все субъединицы объединяются.
Тип G-белка определяется типом его субъединицы (Gs, Gi, Gq).
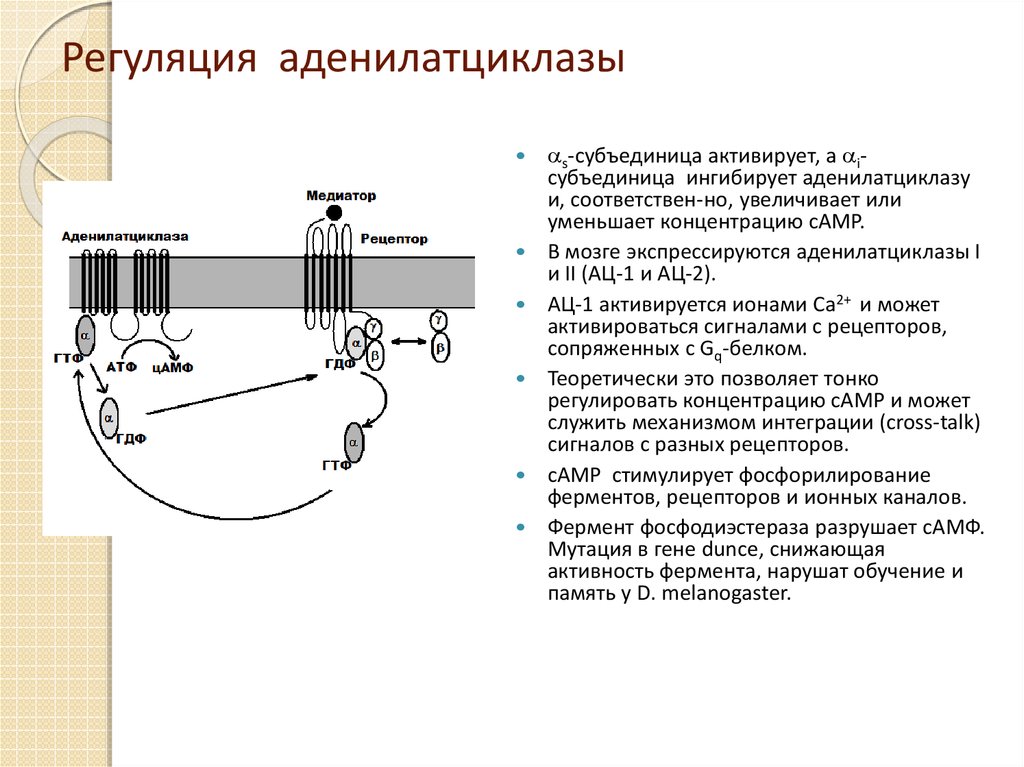
11. Регуляция аденилатциклазы
s-субъединица активирует, а iсубъединица ингибирует аденилатциклазуи, соответствен-но, увеличивает или
уменьшает концентрацию cAMP.
В мозге экспрессируются аденилатциклазы I
и II (АЦ-1 и АЦ-2).
АЦ-1 активируется ионами Ca2+ и может
активироваться сигналами с рецепторов,
сопряженных с Gq-белком.
Теоретически это позволяет тонко
регулировать концентрацию cAMP и может
служить механизмом интеграции (cross-talk)
сигналов с разных рецепторов.
cAMP стимулирует фосфорилирование
ферментов, рецепторов и ионных каналов.
Фермент фосфодиэстераза разрушает сАМФ.
Мутация в гене dunce, снижающая
активность фермента, нарушат обучение и
память у D. melanogaster.
12. Активация фосфолипазы С
Активация рецепторов, сопряженных с Gq-белком, вызывает активацию фосфолипазы С.Это приводит к гидролизу мембранного фосфолипида фосфатидилинозитола 4,5бисфосфата с образованием активных инозитола 1,4,5-трифосфата (IP3) и диацил
глицерола (ДАГ).
IP3 активирует внутриклеточ-ные рецепторы и вызывает освобождение Ca2+.
Вызывает стимуляцию нейрона.
13. Протеинкиназы
Протеинкиназы – ферменты переносящие -фосфатныйостаток от ATP на гидроксильные остатки серина/треонина
(сериновые киназы) или тирозина (тирозиновые киназы) в
молекулах регулируемых белков.
Обычно фосфорилирование активирует белки.
Основные сериновые протеинкиназы:
Протеинкиназа А, регулируемая cAMP.
Протеинкиназа С, регулируемая Ca2+.
Кальций, кальмодулин зависимая протеинкиназа II.
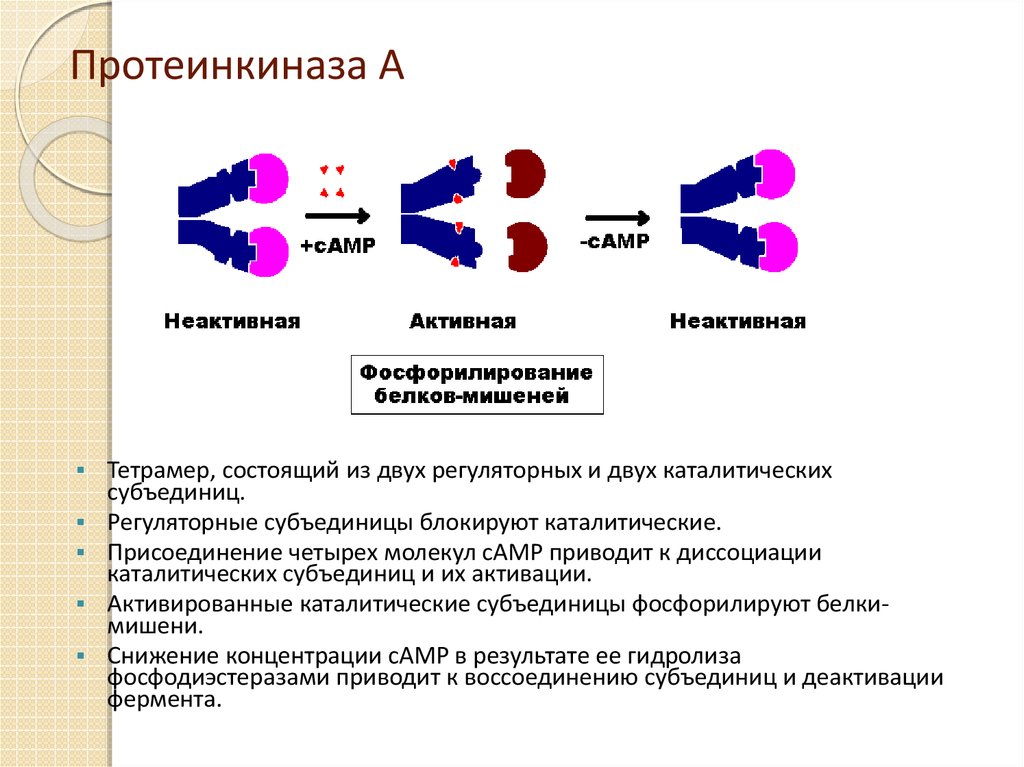
14. Протеинкиназа А
Тетрамер, состоящий из двух регуляторных и двух каталитическихсубъединиц.
Регуляторные субъединицы блокируют каталитические.
Присоединение четырех молекул cAMP приводит к диссоциации
каталитических субъединиц и их активации.
Активированные каталитические субъединицы фосфорилируют белкимишени.
Снижение концентрации cAMP в результате ее гидролиза
фосфодиэстеразами приводит к воссоединению субъединиц и деактивации
фермента.
15. Протеинкиназы С
Мономеры, включающие каталитический (на С-конце) ирегуляторный (на N-конце) домены.
Регуляторный домен включает сайты для связывания Ca2+ и
диацилглицерол (регулятор).
Связывание Ca2+ активирует фермент.
Не обладают субстратной специфичностью.
16. Протеинкиназа II
Состоит из 10-12 субъединиц, кодируемых четырьмя гомологичными генами ( , , и).
Гомо- и гетеромультимеры и изоформ встречаются в основном в мозге, а и повсеместно (и в мозге).
Каждая субъединица состоит из каталитического и регуляторного домена. В
неактивном состоянии регуляторный домен надвинут (закрывает) каталитический.
Присоединение комплекса кальмодулин-(Ca2+)4 смещает регуляторный домен,
открывает каталитический и активирует его.
Удаление Ca2+ закрывает каталитический домен.
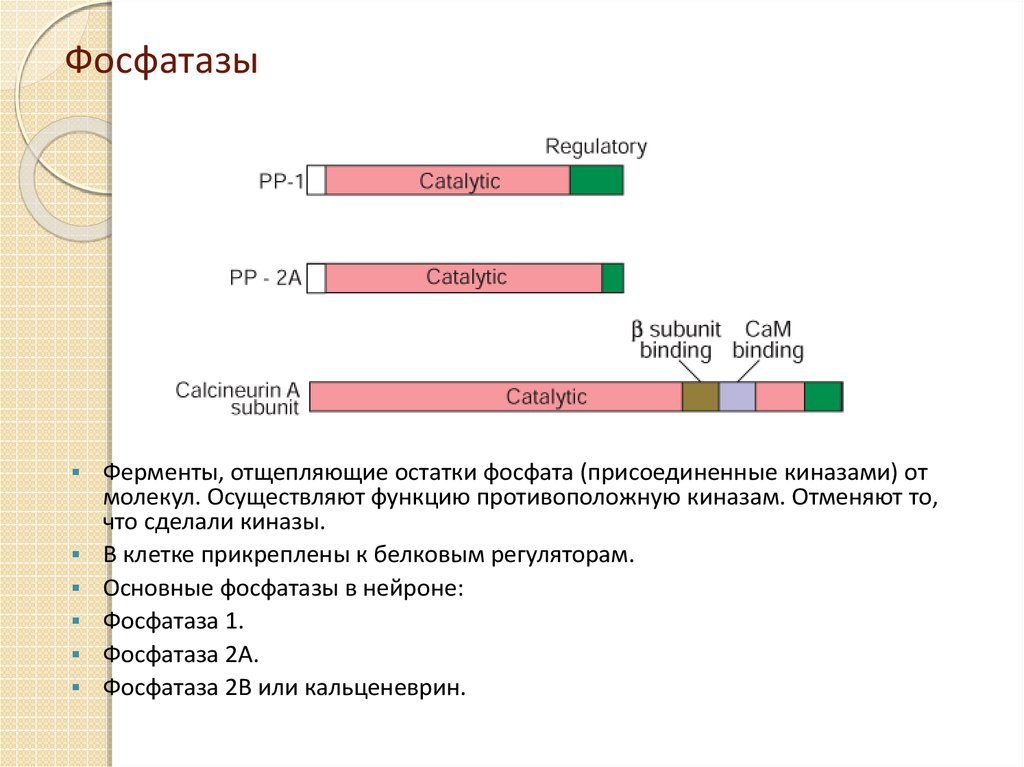
17. Фосфатазы
Ферменты, отщепляющие остатки фосфата (присоединенные киназами) отмолекул. Осуществляют функцию противоположную киназам. Отменяют то,
что сделали киназы.
В клетке прикреплены к белковым регуляторам.
Основные фосфатазы в нейроне:
Фосфатаза 1.
Фосфатаза 2А.
Фосфатаза 2B или кальценеврин.
18. Свойства фосфатазы-1 и кальценеврина
Фосфатаза-1 имеет натуральный белок-ингибитор: DARPP32 (дофамин и цАМФ регулируемый фосфопротеин).Кальценеврин – тетрамер (2А и 2B субъединицы).
Имеет центр связывания Ca2+-КМ комплекса. Частичная
активация при присоединении Ca2+, а сильная – при
связывании комплекса Ca2+-КМ.
Слабая и низкочастотная стимуляция активирует
преимущественно кальценеврин, а сильная и
высокочастотная – кальценеврин и ПК-II.
19. DARPP-32 и молекулярный механизм интеграции
DARPP-32 фосфопротеин (Dopamine and cAMP Regulated PhosphoProtein) участвует вовнутриклеточной интеграции сигналов с рецепторов D1 и NMDA.
Стимуляция D1 рецептора активирует АЦ, увеличивает уровень цАМФ и активность ПКА.
Это вызывает фосфорилирование DARPP-32.
Стимуляция NMDA рецептора увеличивает уровень Ca2+ и активирует кальценеврин,
который дефосфорилирует DARPP-32-P.
Фосфорилированный белок ингибирует фосфатазу-1 и тем самым регулирует процессы в
клетке.
20. Роль вторичных посредников
Вторичные посредники cAMP и Ca2+ осуществляют связь междумембранными рецепторами и процессами в цитоплазме.
Любой сигнал с рецептора перекодируется в концентрации этих
соединений.
Регуляторную функцию вторичные посредники осуществляют через
активацию протеинкиназ и протеинфосфатаз.
Активированные киназы и фосфатазы изменяют функциональные
свойства и активность ферментов, рецепторов и ионных каналов.
Протеинкиназы и фосфатазы участвуют в клеточных механизмах
кратковременной памяти и интеграции.
21. Интерфейс между цитоплазмой и ядром
Длительное сохранение изменений, необходимое дляфизиологических последствий, долговременной памяти,
осуществляется через изменение экспрессии генов.
Вторичные посредники, изменяя функцию клетки, не
могут непосредственно влиять на экспрессию генов.
Имеется интерфейс, передающий изменения в
цитоплазме ядру.
Он включает третичные посредники – белковые
транскрипционные факторы.
Эти белки связываются специфическими участками ДНК и
взаимодействуя с РНК полимеразой II инициируют
транскрипцию.
Наиболее известны транскрипционные факторы CREB и
AP-1. Белки быстрого ответа Fos, Fra, Jun.
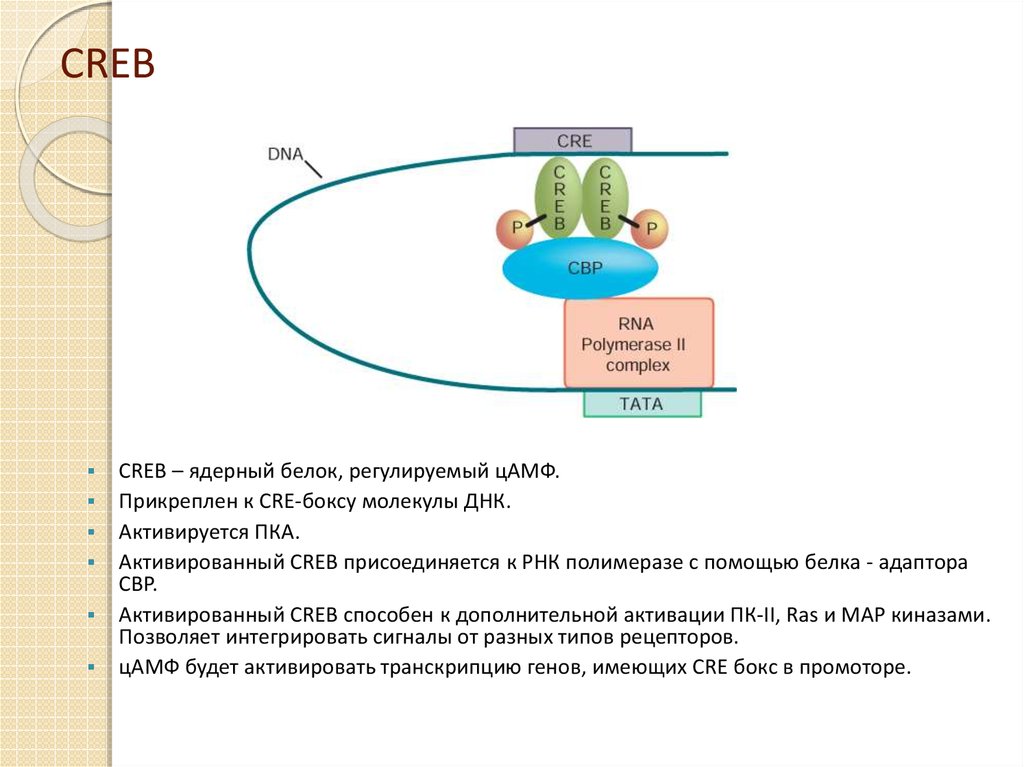
22. CREB
CREB – ядерный белок, регулируемый цАМФ.Прикреплен к CRE-боксу молекулы ДНК.
Активируется ПКА.
Активированный CREB присоединяется к РНК полимеразе с помощью белка - адаптора
CBP.
Активированный CREB способен к дополнительной активации ПК-II, Ras и MAP киназами.
Позволяет интегрировать сигналы от разных типов рецепторов.
цАМФ будет активировать транскрипцию генов, имеющих CRE бокс в промоторе.
23. CREB и AP-1 интегрируют сигналы с cAMP и Ca2+
Активирующий белок 1 (AP-1) не способен активироваться ПКА, носпособен активироваться ПКС.
Промоторы многих генов содержат CRE и AP-1 элементы.
Такие тандемы осуществляют геномную интеграцию сигналов от
cAMP и Ca2+.
24. Факторы быстрого ответа
Белки быстрого ответа способны регулировать экспрессию генов либонепосредственно связываясь с AP-1 боксом, либо образуя комплексы
с CREB.
25. Природа классических медиаторов
Медиаторы – сигнальные молекулы.Сигнальная связь между молекулой и функцией
обеспечивает значительную гибкость: одна и та же
молекула может регулировать противоположные
процессы.
Сигнальное значение молекулы определяется в ходе
эволюции и онтогенеза.
Медиатором может быть любая молекула, для которой
в ходе эволюции созданы механизмы синтеза, рецепции
и трансдукции, то есть интерфейс.
Функция медиатора определяется стадией онтогенеза и
тканью.
26. КРИТЕРИИ МЕДИАТОРА
Чтобы субстанция выполняла функцию медиаторанеобходимо:
1. Существование в мозге системы нейронов,
способных ее синтезировать (отличает медиатор от
гормона).
2. Депонирование субстанции в везикулы и
транспортировка везикул в места секреции.
3. Секреция субстанции Ca+2 -зависимым
экзоцитозом при деполяризации окончания.
4. Воздействие на постсинаптические рецепторы и
уровень вторичных посредников (отличает медиатор
от модулятора).
5. Удаление субстанции из синаптической щели.
27. Классификация медиаторов
КЛАССИФИКАЦИЯ МЕДИАТОРОВАминокислоты (ГАМК, аспартат, глутамат,
глицин, гистамин, таурин).
Ацетилхолин.
Моноамины (адреналин, норадреналин,
дофамин, серотонин).
Пептиды (>2000).
Пурины (аденозин, АМФ, АДФ, АТФ и др.).
28. МЕТАБОЛИЧЕСКАЯ ПРИРОДА МЕДИАТОРОВ
МедиаторХимическая
природа
Предшественник
Путь
метаболизма
Ацетилхолин
Эфир
Холин и ацетилКоА
Цикл Кребса
Глутамат,
ГАМК
Аминокислоты
Трикарбоновые
кислоты
Цикл Кребса
Серотонин,
катехоламины
Амины
Триптофан, тирозин С пищей
Нейропептиды Пептиды
Белки
Синтез белка
29. КОНЦЕНТРАЦИИ (ПОРЯДКИ) РАЗЛИЧНЫХ МЕДИАТОРОВ В МОЗГЕ
МедиаторКонцентрация
(М/г веса)
Глутамат
10-5
ГАМК
10-6
Ацетилхолин
10-8
Моноамины
10-9
Нейропептиды
(энкефалин)
10-10
Локализация
Тотальная
Локальная
30. Принцип Дейла
ПРИНЦИП ДЕЙЛАСогласно Дейлу химическая природа медиатора,
секретируемого из различных окончаний одного и
того же нейрона, специфична для данного нейрона
и неизменна.
Большинство нейронов секретируют несколько
медиаторов, обычно небелковый и белковый.
Основная субстанция называется медиатором, а
сопутствующая – комедиатором.
Процентный состав смеси медиаторов может
варьировать от физиологического состояния
нейрона.
Может ли состав смеси медиаторов быть
индивидуальным маркером нейрона, выделять
конкретный нейрон из множества ему подобных?
31. Обратные медиаторы
Осуществляют обратную связь в синапсе когдапостсинаптический нейрон информирует
пресинаптический о том, что сигнал принят.
Несмотря на то, что обратные медиаторы нарушают
большинство из критериев, предъявляемых к
медиаторам. Однако эти соединения участвуют в
межнейрональной коммуникации и выполняют
медиаторную функцию – позволяют одному нейрону
управлять процессами в другом.
Наиболее известными и важными обратными
медиаторами являются окись азота и производные
арахидоновой кислоты.
32. Окись азота
Отличается от классических медиаторов тем, что:Будучи газом она не депонируется в везикулы, а
синтезируется по как побочный продукт молекулярной
реакции на сигнал от другого нейрона. NO является
побочным продуктом увеличения концентрации ионов
Ca2+, который активирует NO синтазу в тех нейронах,
которые экспрессируют данный фермент.
Не выделяется экзоцитозом, а диффундирует в другие
нейроны-мишени.
4. Не действует на постсинаптические рецепторы и не
изменяет концентрации вторичных посредников. Вместо
этого она необратимо связывается со многими белками и
модифицирует их активность).
5. Не имеется механизма инактивации окиси азота.
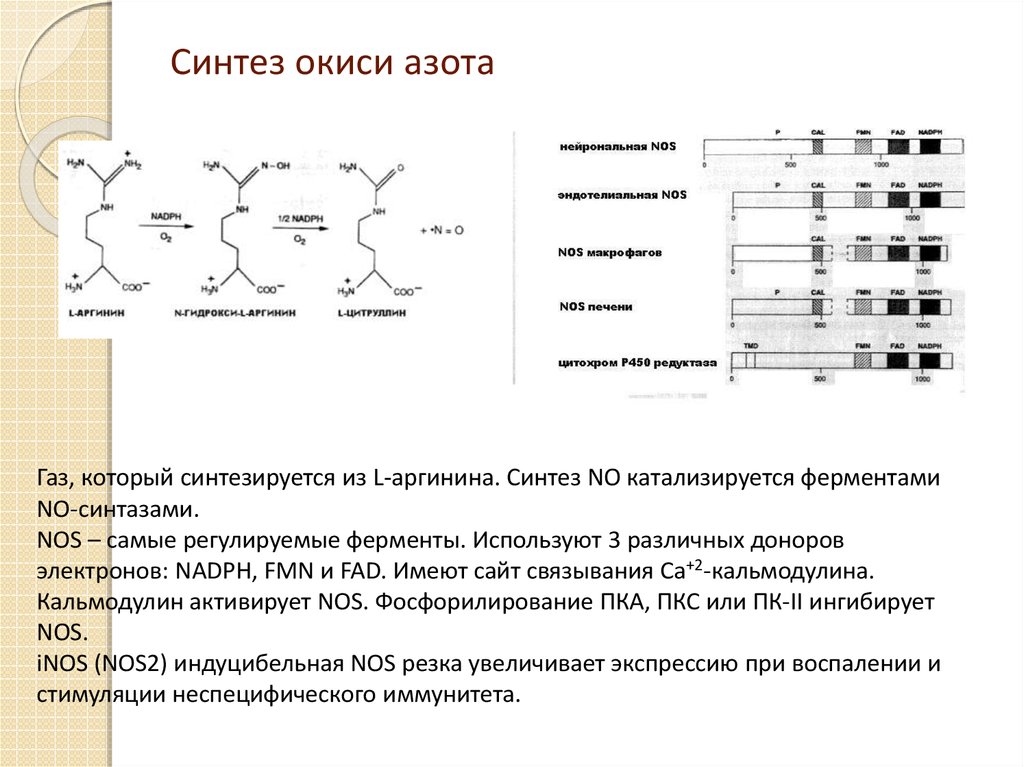
33. Синтез окиси азота
Газ, который синтезируется из L-аргинина. Синтез NO катализируется ферментамиNO-синтазами.
NOS – самые регулируемые ферменты. Используют 3 различных доноров
электронов: NADPH, FMN и FAD. Имеют сайт связывания Ca+2-кальмодулина.
Кальмодулин активирует NOS. Фосфорилирование ПКА, ПКС или ПК-II ингибирует
NOS.
iNOS (NOS2) индуцибельная NOS резка увеличивает экспрессию при воспалении и
стимуляции неспецифического иммунитета.
34. Функции NO в мозге
В мозге nNOS обнаружена исключительно в нейронах.Около 2% нейронов в коре, гиппокампе и стриатуме
экспрессируют NOS.
В гиппокампе NOS не содержится в пирамидальных
нейронах, но в гранулярных.
Многие ГАМК нейроны коры содержат NOS.
NO является активатором растворимой гуанилатциклазы
(аналога аденилатциклазы) и вызывает увеличение
концентрации вторичного посредника цГМФ (аналогичного
цАМФ).
Кроме того NO активирует транскрипционный фактор NFkB.
Формирование долговременной потенциации в гипокампе.
Нитроаргинин блокирует потенциацию.
Нейротоксичность, связанная с глутаматом.
35. Синтез арахидоновой кислоты
36. Эндогенные канабиноиды
Производные арахидоновой к-ты, анандамид и 2-арахидоноилглицерол, являютсяэндогенными лигандами для CB1 и CB2 канабиноидных рецепторов. Оба рецепторы
сопряжены с Gi белком. CB1 рецептор экспрессируется на нейронах, CB2 – на глии.
37. Заключение
Интерфейс нейрона перекодирует информацию,содержащуюся в пакетах медиаторов, в активность
различных генов в молекуле ДНК.
Комплексы мембранных рецепторов с одним
трансмембранным доменом активируют факторы
транскрипции.
Рецепторы с двумя, четырьмя и семью
трансмембранными доменами изменяют концентрацию
вторичных посредников и, через активацию
протеинкиназ, активируют факторы транскрипции.
Ряд генов быстрого ответа являются транскрипционными
факторами.
Взаимодействие регуляторных белков осуществляет
интеграцию сигналов на уровне клетки.






























 biology
biology