Similar presentations:
Направление окислительно-восстановительного процесса
1.
Направлениеокислительно –
восстановительного
процесса
В 1669 году Геннинг Бранд открыл фосфор г. Гамбург
2 Ca3(PO4)2 + 10 C + 6 SiO2 → 6 CaSiO3 + P4 + 10 CO
Картина английского художника
Джозефа Райта, 1771 г: «Алхимик, открывающий фосфор»
2.
Окислительно-восстановительнымиреакциями
называют
реакции,
сопровождающиеся
изменением
степени окисления элементов.
2
3.
Почему одни из окислительно - восстановительныхпротекают, а другие нет?
Почему один и тот же окислитель реагирует с одним
восстановителем и не реагирует с другим?
Полностью ли всякий раз происходит превращение
взятых в реакцию веществ?
Что именно, или какая сила движет эти реакции?
3
4.
Ox + ne RedОкисл.
Восстан.
форма
форма
Ox и Red взаимосвязаны и это есть окислительновосстановительная пара (редоксипара).
4
5.
Общая схема процесса:Ox1+Red2 Red1+Ox2
окислитель I+ восстановитель II= восстановитель I + окислитель II
Окислительно-восстановительные реакции протекают в сторону
образования более слабых окислителей и восстановителей из
более сильных.
5
6.
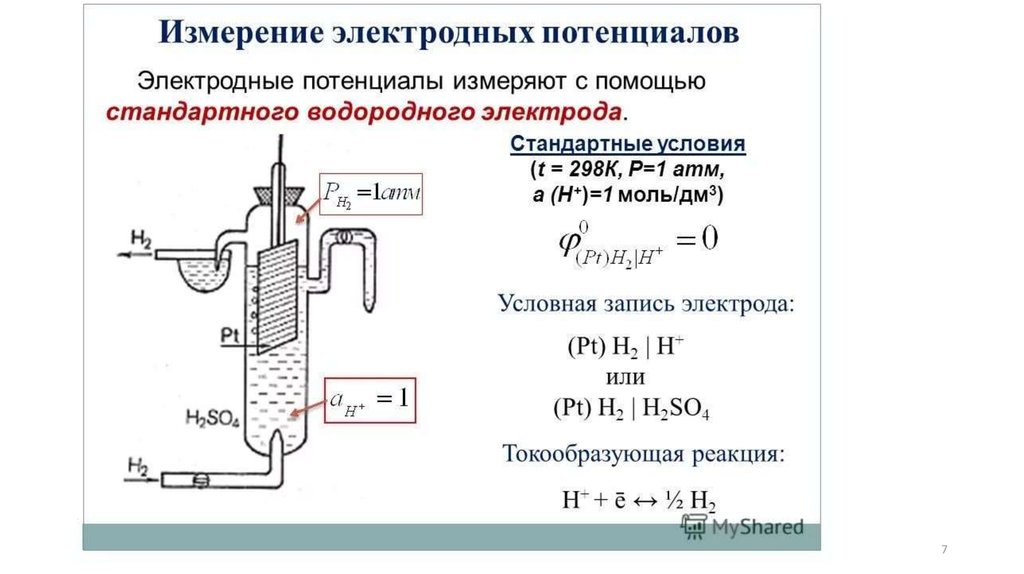
Стандартный(нормальный)
окислительновосстановительный потенциал пар, которые
являются растворимыми формами, - это разница
потенциалов,
которая
возникает
между
стандартным
водородным
и
неактивным
(платиновым) электродом, погруженным в
раствор, который содержит окисленную и
восстановленную формы одной редокс-пары (при
25 °С и активности компонентов пары, равных 1
моль/дм3).
6
7.
78.
Электродвижущая силаЭДС = Е⁰ок-Е⁰вост
ЭДС>0 процесс протекает самопроизвольно в прямом
направлении, при ЭДС<0 обратная.
Чем больше ЭДС, тем энергичнее протекает реакция.
Реакция будет протекать до тех пор, пока потенциалы
обеих пар не станут равными, в системе устанавливается
равновесие.
8
9.
Опыт 1. Сравнение химической активностижелеза и меди. Предварительно обезжиренную и
протравленную в соляной кислоте железную
пластинку опустите в раствор сульфата меди (II).
Медную пластинку опустите в раствор сульфата
железа (II). Спустя некоторое время выньте
пластины из растворов. Объясните наблюдаемое,
указав стандартные электродные потенциалы
соответствующих систем.
9
10.
Сu + FeSO4→ реакция не идет;∆Е= E(Fe+2\Fe)- E(Cu2+\Cu)= -0,44-0,34= -0,78 В,
реакция невозможна, ЭДС‹0
Fe + CuSO4→ Сu+FeSO4
∆Е = E(Cu2+\Cu) - E(Fe+2\Fe) = 0,34-(-0,44)=0,78 В,
реакция протекает самопроизвольно с
выделением металлической меди, ЭДС › 0
10
11.
Опыт 2. Взаимодействие раствора солижелеза (III) с иодидом калия, с бромидом натрия.
• К подкисленному раствору соли Fe(III) прилейте
раствор иодида калия.
• Проверьте, будет ли протекать реакция при
сливании раствора железа (III) и раствора бромида
натрия. Объясните наблюдаемое, указав
стандартные электродные потенциалы
соответствующих систем.
11
12.
KJ + FeCl3 → FeCl2 + KCl + J22J- - 2e → J20
EJ2\2J-= 0,536
восстановитель
Fe+3 + 1e → Fe+2
EFe3+\Fe2+ = 0,771
окислитель
2KJ + 2FeCl3 = 2FeCl2 + 2KCl + J2
ЭДС = 0,235, реакция протекает самопроизвольно
ЭДС › 0
Следовательно, реакция будет идти в сторону
12
13.
KBr + FeCl3 →2Br- - 2e → Br20
Fe+3 + 1e → Fe+2
EBr2\2Br-= 1,065
EFe3+\Fe2+ = 0,771
восстановитель
окислитель
2KBr + 2FeCl3 →
ЭДС ˂ 0
Отрицательное значение э.д.с. показывает, что
хлорид железа (III) не будет окислять бромид калия.
13
14.
Задание 1. Какая из приведенных ниже систембудут восстановителем, если в качестве окислителя
использовать кислый раствор перманганата калия?
Какой из них будет самым сильным
восстановителем?
Fe3+ е = Fe2+
F2 +2e =2FCo3+ +e=Co2+
S +2H+ +2e =H2S
Pb4+ + 2e = Pb2+
I2 +2e = 2IMnO4- +8H+ +5е =Мn2+ +4Н2О
14
15.
Fe3+ е = Fe2+
Е=0,771 В
F2 +2e =2FЕ=2,87 В
S +2H+ +2e =H2S
Е=0,17 В
Pb4+ + 2e = Pb2+
Е=1,694 В
Co3+ +e' =Co2+
Е=1,808
I2 +2e = 2IЕ=0,536 В
MnO4- +8H+ +5е =Мn2+ +4Н2О E=1,507
15
16.
MnO4- +8H+ +5е =Мn2+ +4Н2О E=1,507Восстановителем могут быть системы, где
электродный потенциал меньше электродного
потенциала подкисленного раствора
перманганата калия (ЭДС›0)
Cамым сильным восстановителем будет:
S +2H+ +2e =H2S Е=0,17 В,
∆Е=1,507-0,17=1,337 В
16
17.
• МnО4- + 8Н+ +5е = Мn2++ 4 Н2ОS042- +2Н+ +2е= S032- + Н2О
• МnО4- + 2Н2О - 3е = MnO2 + 4OHS042- +2Н+ +2е= S032- + Н2О
• МnО4-+е= МnО42S042- +2Н+ +2е= S032- + Н2О
в кислой
в нейтральной
в щелочной
• Выясните возможность протекания реакции между растворами
перманганата калия и сульфита натрия в:
а) кислой, б) щелочной и в) нейтральной среде.
• В какой среде окислительные свойства иона МпО4- выражены сильнее?
• В какой среде наиболее энергичнее будет протекать реакция?
17
18.
Вывод:а)МnО4- + 8Н+ +5е = Мn2++ 4 Н2О
S042- +2Н+ +2е= S032- + Н2О
в кислой ∆Е=1,287 В
б)МnО4- + 2Н2О - 3е = MnO2 + 4OHS042- +2Н+ +2е= S032- + Н2О
в нейтральной ∆Е=0,38 В
в)МпО4-+е= МпО42S042- +2Н+ +2е= S032- + Н2О
в щелочной ∆Е=0,344 В
E=1,507 B
Е=0,22 В
Е=0,60В
Е=0,22 В
Е=0,564
Е=0,22 В
18
19.
• Все три реакции протекают самопроизвольно,т.к. ЭДС›0.
• Окислительные свойства иона МпО4выражены сильнее в кислой среде, т.к. самый
высокий стандартный потенциал.
• В кислой среде наиболее энергичнее будет
протекать реакция, т.к. самое большое
значение ЭДС
19
20.
Опыт 3. Окислительные свойства перманганатакалия. В три отдельные пробирки с раствором
перманганата калия добавьте разбавленную серную
кислоту, такой же объем воды и концентрированный
раствор щелочи. Затем в каждую из пробирок прибавьте
раствор сульфита натрия. Объясните наблюдаемое
явление, имея в виду образование
• в кислой среде ионов Mn2+ (слабо-розовая окраска),
• в нейтральной среде- MnO2 (осадок бурого цвета)
• щелочной среде - ионов MnO42- (зеленая окраска).
20
21.
2KMnO4 + H2O+3Na2SO3=
2MnO2↓ + 2K2SO4 +3Na2SO4+2KOH
бурый
• 2KMnO4 +2 KOH+Na2SO3=
2K2MnO4+Na2SO4+H2O
зеленый р-р
• 2KMnO4 + 3H2 SO4+5Na2SO3=
2MnSO4 +K2SO4+5Na2SO4+3H2O
бесцветный р-р
21
22.
Опыт 4. Влияние среды на окислительновосстановительный потенциал.В две пробирки внесите дихромат калия (желтого цвета) и
внесите: в одну - раствор серной кислоты, в другую раствор
щелочи. Изменение окраски раствора в одной пробирки на
оранжевую обусловлено переходом CrO42-,устойчивого в
щелочной среде, в ион Cr2O72-устойчивого в кислой среде. В
каждую пробирку добавьте несколько капель нитрита калия.
В обоих случаях изменилась окраска раствора? В какой среде
произошло изменение степени окисления от +6 до +3 (зеленая
окраска характерна для иона Сr3+). Объясните результаты
опытов.
22
23.
CrO42- + 2H+ = Cr2O7 2- +H2Oжелтая
оранжевая
Cr2O7 2-+ 2OH- = CrO4 2- + H2O
оранжевая
желтая
23
24.
Cr2O7 2-+ 14H+ +6e = 2Cr3+ + 7H2O2J- - 2e → J20
E Cr2O72-/ Сr3+ = 1,33B
EJ2 \2J-= 0,536 B
K2Cr2O7 + 6KI + 7H2SO4 → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
ЭДС›0
Наибольшая окислительная активность хроматов
проявляется в кислой среде, где они присутствуют в
виде дихромат-ионов
24
25.
• 2K2CrO4 + H2SO4=К2Cr2O7+ K2SO4 +H2O• K2Cr2O7+ 2KOH=2K2CrO4 + H2O
K2Cr2O7 + 6KI + 7H2SO4 → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
В кислой среде произошло изменение степени
окисления от +6 до +3 (зеленая окраска характерна для
иона Сr3+). Реакция протекает самопроизвольно, т.к.
ЭДС›0
25
26.
Ограничено ли прогнозирование окислительновосстановительных реакций?Можно ли предсказать точно, будет ли
протекать реакция или нет?
Можно ли «заставить» идти реакцию?
Что можно еще изменить, чтобы изменить ход
реакции?
26
27.
Реакция горения ацетилена:С2Н2 + О2 = 5/2 СО2 + Н2О + 1300 кДж
Почему сварка
ацетиленовая, а не
метановая или этановая?
Почему газовые
фонари в XIX веке были
ацетиленовые?
Картина «Вечерний проспект» современного американского художника
Томаса Кинкейда (Thomas Kinkade )
27
28.
Горение черного пороха изучалось Л.Н. Шишковым в 1857 годуЧерный порох: +5
0
0
0
+4
-2
2 KNO3 + 3 C + S = N2 + 3 CO2 + K2S + 706,4 кДж
K2SO4, K2CO3, CO (другие продукты окисления)
29.
Но обязательно ли в окислительно-восстановительных реакцияхчто-нибудь горит или взрывается? Нет, есть другие, не менее
эффектные реакции.



















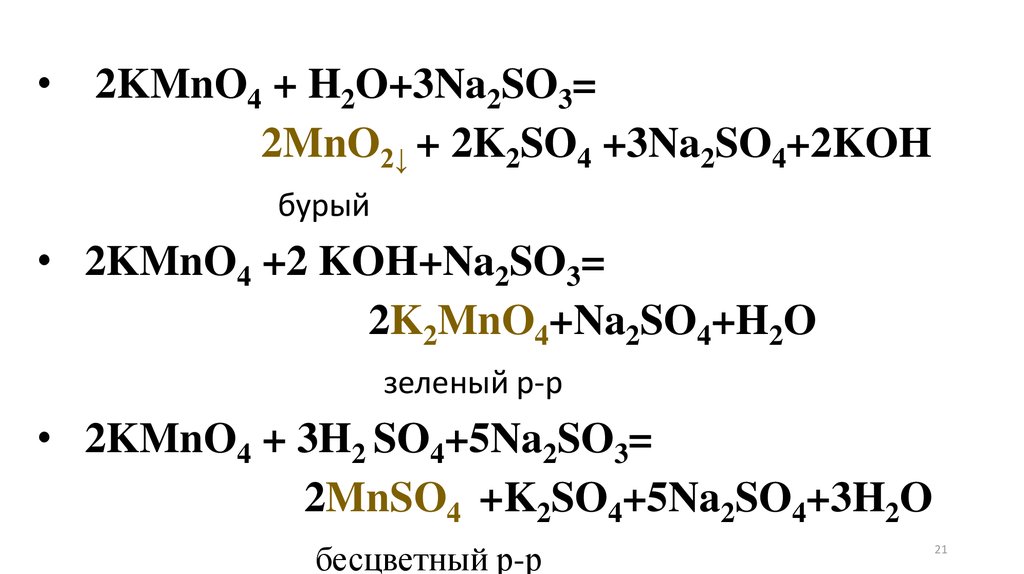

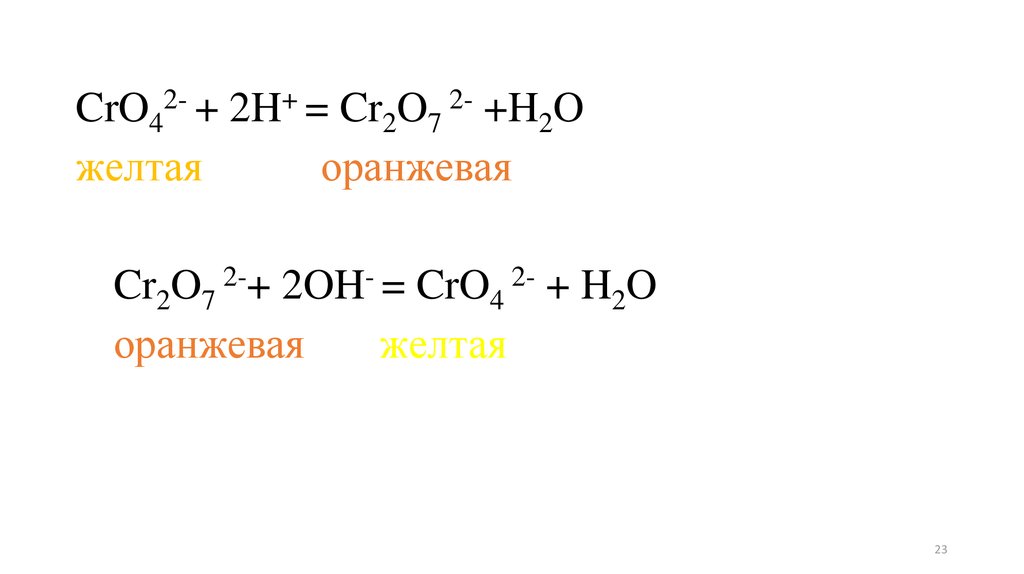






 chemistry
chemistry








