Similar presentations:
Электрофорез. Типы электрофореза
1.
Тема 2Электрофорез
2.
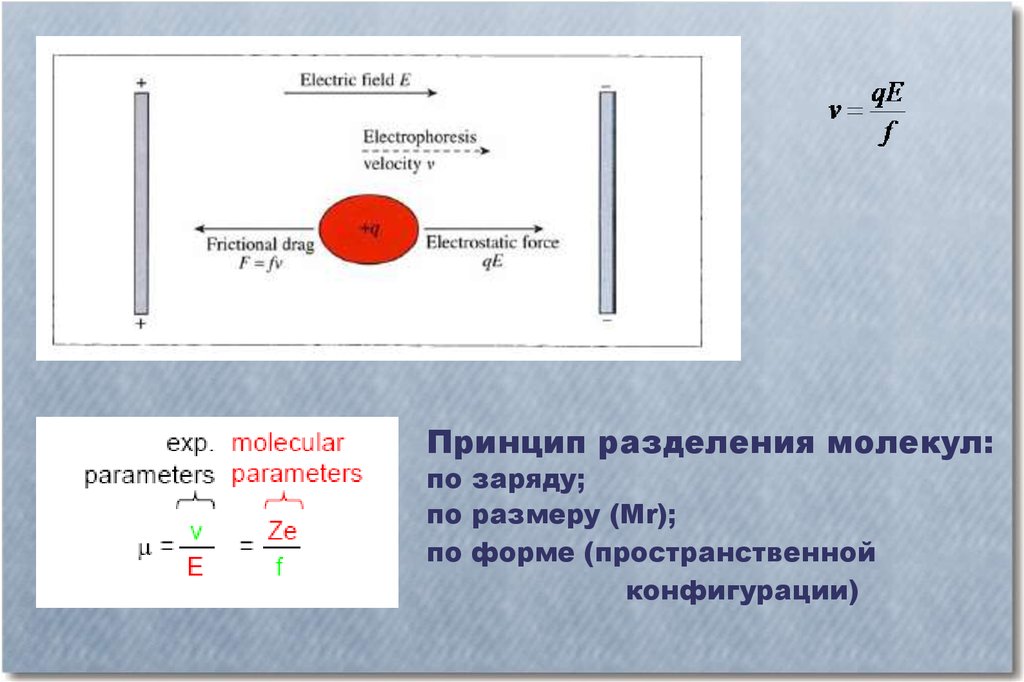
Принцип разделения молекул:по заряду;
по размеру (Mr);
по форме (пространственной
конфигурации)
3.
Электрофорез проводят в однородном электрическом поле, то есть в поле,напряженность E которого во всех точках одинакова. Электрический ток
пропускают через проводник – буферный раствор, налитый в канал из
изолирующего материала (например, стекла) или пропитывающий какую-либо
поддерживающую среду – носитель (например, бумагу или гель). Сопротивление R
буферного раствора задается двумя факторами: концентрацией в нем свободных
ионов и их электрофоретической подвижностью.
Электрофоретической подвижностью (µ) данной молекулы называют скорость
движения заряженной молекулы (выражаемой в см/ч) в электрическом поле с
напряженностью 1 В/см. Именно различия в электрофоретической подвижности
молекул, содержащихся в анализируемой смеси, делают возможным разделить эти
молекулы в пространстве (в разных зонах электрофореграммы).
Скорость V движения молекул к тому или иному электроду снижается из-за их
трения в окружающей среде. Сила трения прямо пропорциональна скорости
движения молекул. Коэффициент трения молекулы, обозначенный как f, зависит
как от размера, формы и степени гидратированности этой молекулы, так и от
свойств самой среды.
Электрофоретическая подвижность молекул зависит:
- от самой молекулы: ее размера (молекулярной массы), формы, электрического
заряда, степени диссоциации и гидратации,
- от концентрации молекул,
- от среды: ее вязкости, рН, температуры и ионной силы,
- от характеристик используемого электрического поля (для крупных макромолекул
применяется электрофорез в пульсирующем электрическом поле).
4.
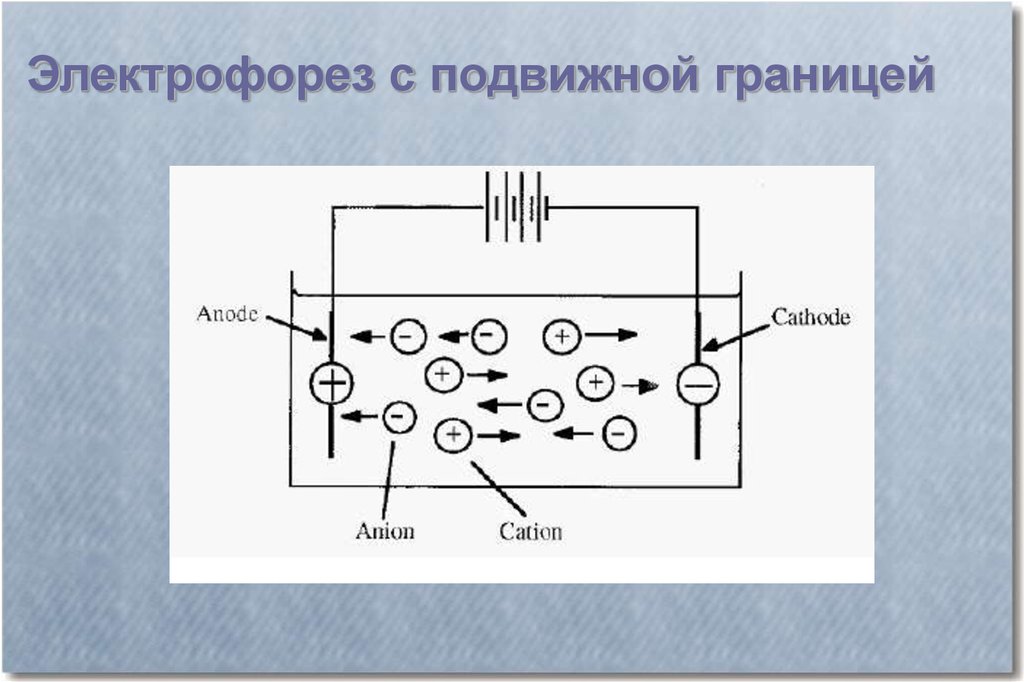
По способу проведения различают 2 типаэлектрофореза:
электрофорез с подвижной границей;
зональный электрофорез
5.
Электрофорез с подвижной границей6.
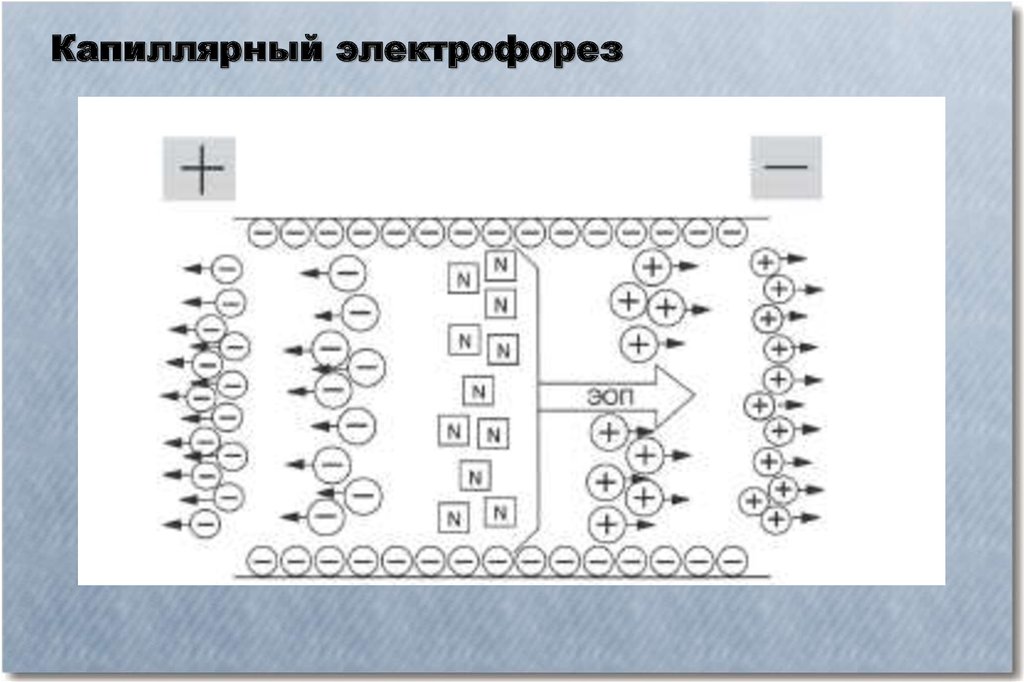
Капиллярный электрофорезКапиллярный электрофорез – метод разделения молекул по заряду и размеру в
тонком капилляре, заполненном электролитом. Для проведения капиллярного
электрофореза требуется относительно простое оборудование. Основные
компоненты системы — флакон для нанесения образца, стартовый флакон,
конечный флакон, капилляр, электроды, мощный источник питания, детектор и
устройство обработки данных. Флакон для нанесения образца, стартовый и
конечный флаконы заполнены электролитом, например, водным буферным
раствором. Для нанесения образца конец капилляра опускают во флакон с
образцом и затем перемещают в стартовый флакон. Миграция молекул
анализируемых веществ осуществляется под действием электрического поля,
которое прилагается между стартовым и конечным флаконами. Ионы
передвигаются по капилляру в одном направлении под действием
электроосмотического тока. Анализируемые вещества разделяются по
электрофоретической мобильности и детектируются около конца капилляра.
7.
Капиллярный электрофорез8.
Капиллярный электрофорез9.
Капиллярный электрофорез10.
Капиллярный электрофорезЭлектроосмотический
поток
11.
Капиллярный электрофорез12.
Капиллярный электрофорез13.
Капиллярный электрофорез14.
Капиллярный электрофорез15.
Зональный электрофорезЗональный электрофорез проводится при постоянном (не
изменяющемся)
значении
рН
буферного
раствора,
заполняющего данный носитель (бумагу, гель, др.).
Исследуемый образец наносится пятном или тонким слоем
на носитель, по которому и перемещается в электрическом
поле. Усложненным вариантом зонального электрофореза
является диск-электрофорез (многофазный зональный
электрофорез), при котором рН и другие характеристики,
постоянные внутри одной “фазы”, при переходе к другой
“фазе” скачкообразно изменяются.
16.
Зональный электрофорезбумага
фильтровальная бумага,
увлажненная буферным раствором
небольшие молекулы,
аминокислоты, нуклеотиды
агароза
поперечно не сшита,
полимеризуется в горизонтальных
ячейках
большие молекулы,
двухцепочечные ДНК,
нативные белки
ПААГ
поперечно сшит,
полимеризуется в вертикальных
пластинах и трубках
белки (нативные и
денатурированные),
короткие фрагменты ДНК,
одноцепочечные НК
гель
17.
Типы зональных электрофорезов:Препаративный и аналитический
Вертикальный и горизонтальный
Одномерный, двумерный, в объеме
Нативный и в присутствии денатурирующих агентов
Изоэлектрическое фокусирование
18.
Электрофорез на бумаге19.
Электрофорез на бумаге20.
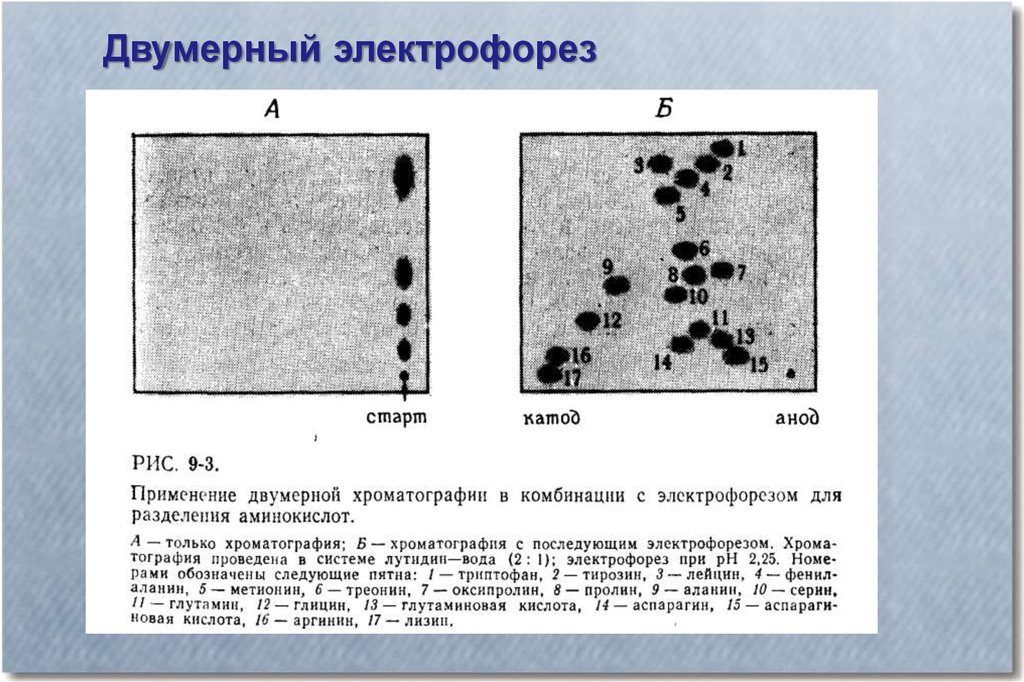
Двумерный электрофорез21.
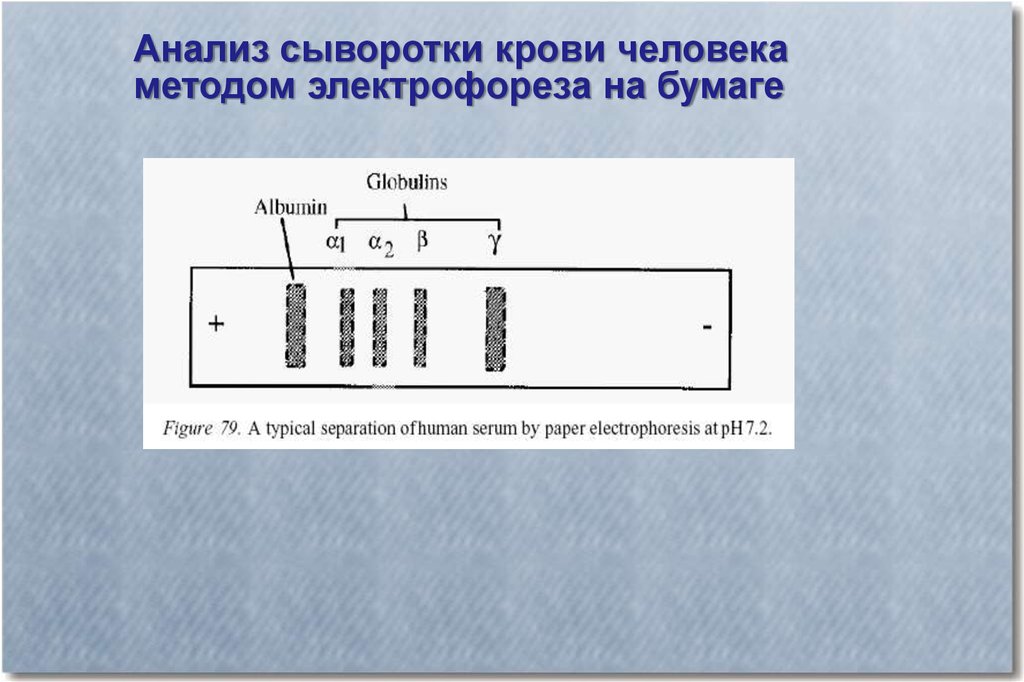
Анализ сыворотки крови человекаметодом электрофореза на бумаге
22.
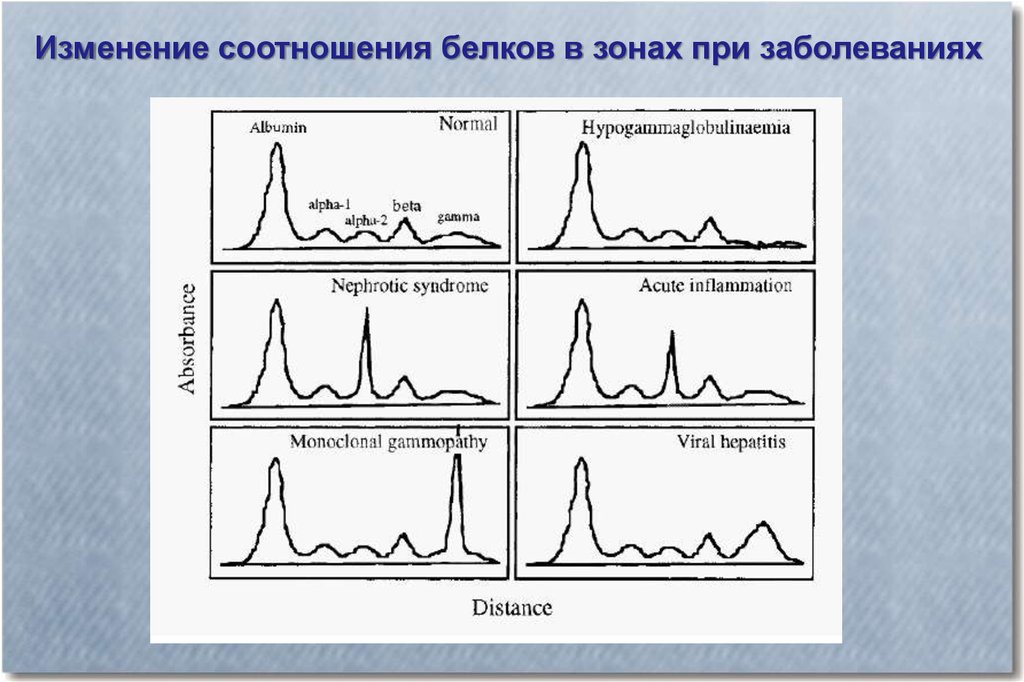
Изменение соотношения белков в зонах при заболеваниях23.
Электрофорез в геле (крахмальный гель,агар, агароза)
Препараты:
нативная ДНК
нативные белки
24.
ИммуноэлектрофорезСочетает электрофоретическое разделение
белков с иммунопреципитацией.
25.
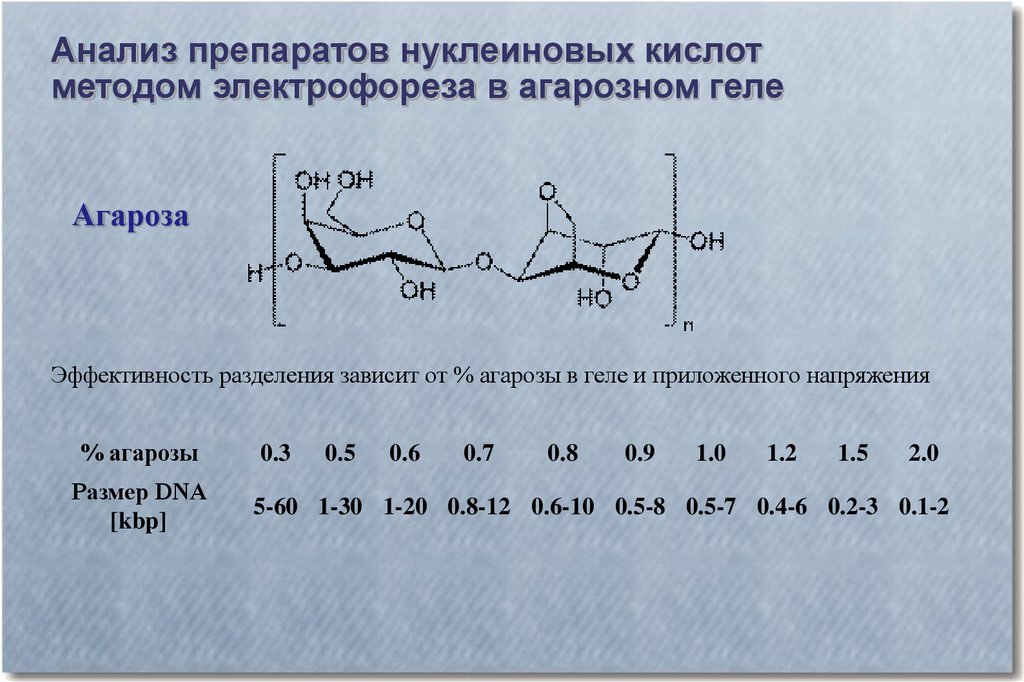
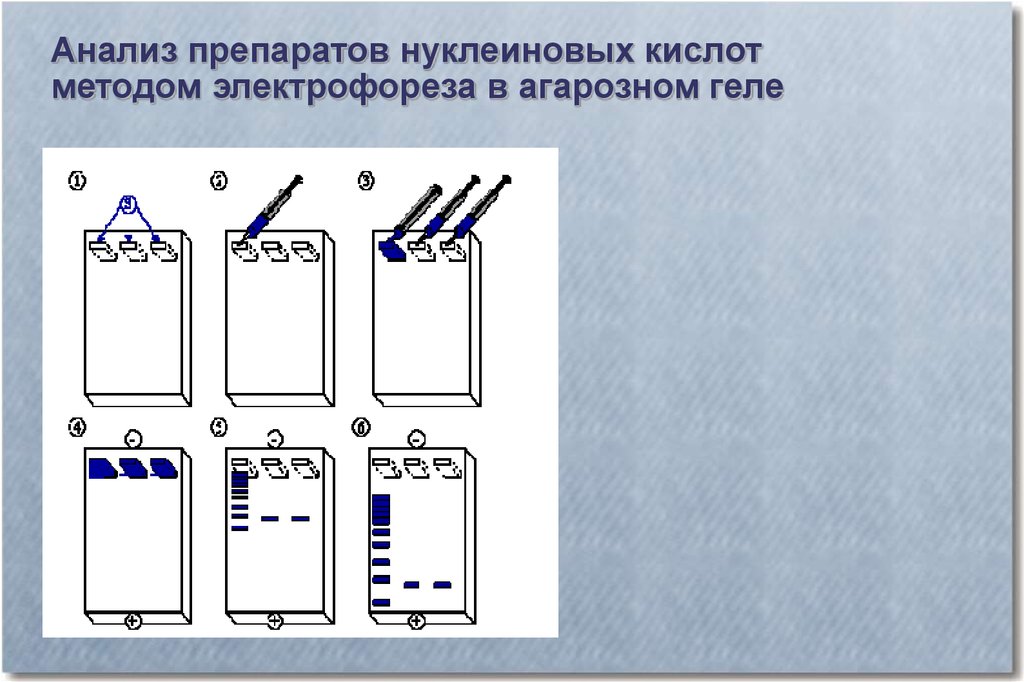
Анализ препаратов нуклеиновых кислотметодом электрофореза в агарозном геле
Агароза
Эффективность разделения зависит от % агарозы в геле и приложенного напряжения
% агарозы
Размер DNA
[kbp]
0.3
0.5
0.6
0.7
0.8
0.9
1.0
1.2
1.5
2.0
5-60 1-30 1-20 0.8-12 0.6-10 0.5-8 0.5-7 0.4-6 0.2-3 0.1-2
26.
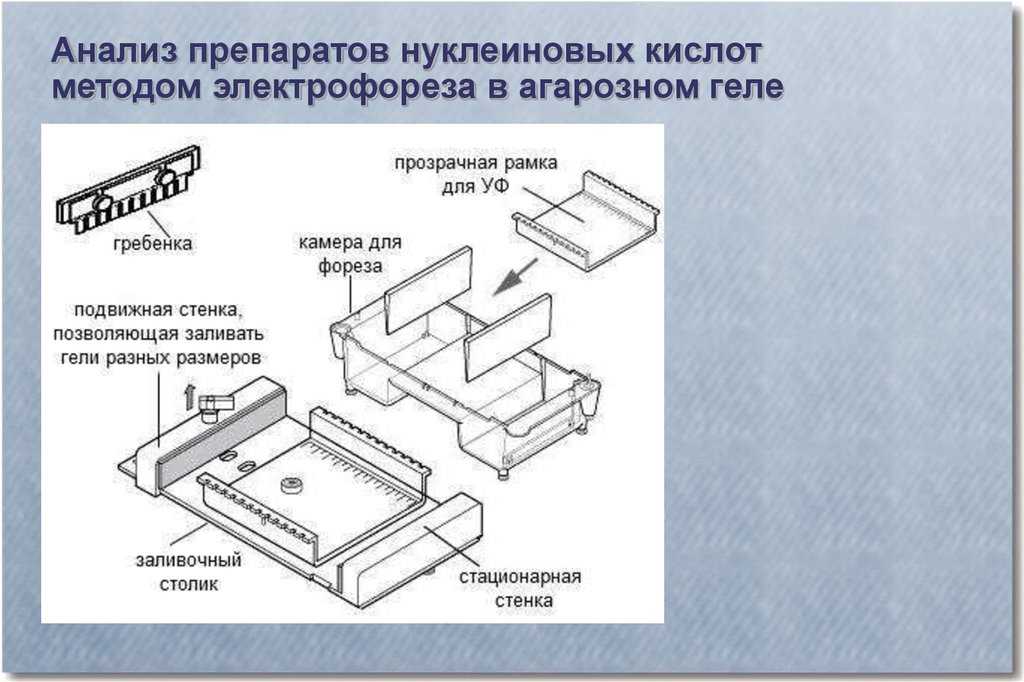
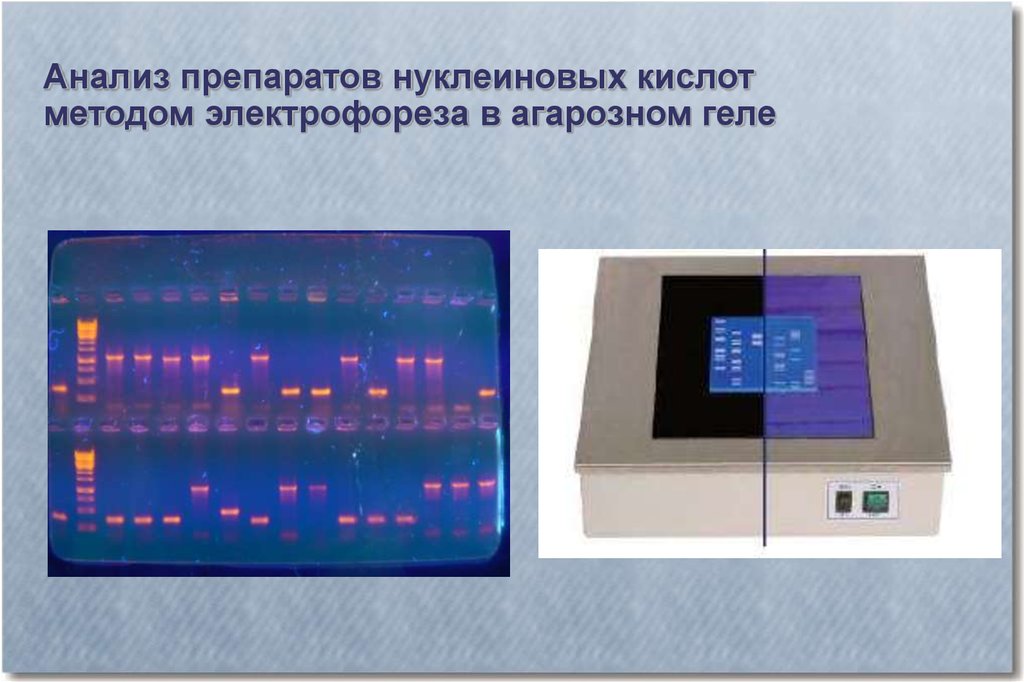
Анализ препаратов нуклеиновых кислотметодом электрофореза в агарозном геле
27.
Анализ препаратов нуклеиновых кислотметодом электрофореза в агарозном геле
28.
Маркеры пробега биомолекул в агарозном геле29.
Визуализация ДНК в агарозном геле30.
Анализ препаратов нуклеиновых кислотметодом электрофореза в агарозном геле
31.
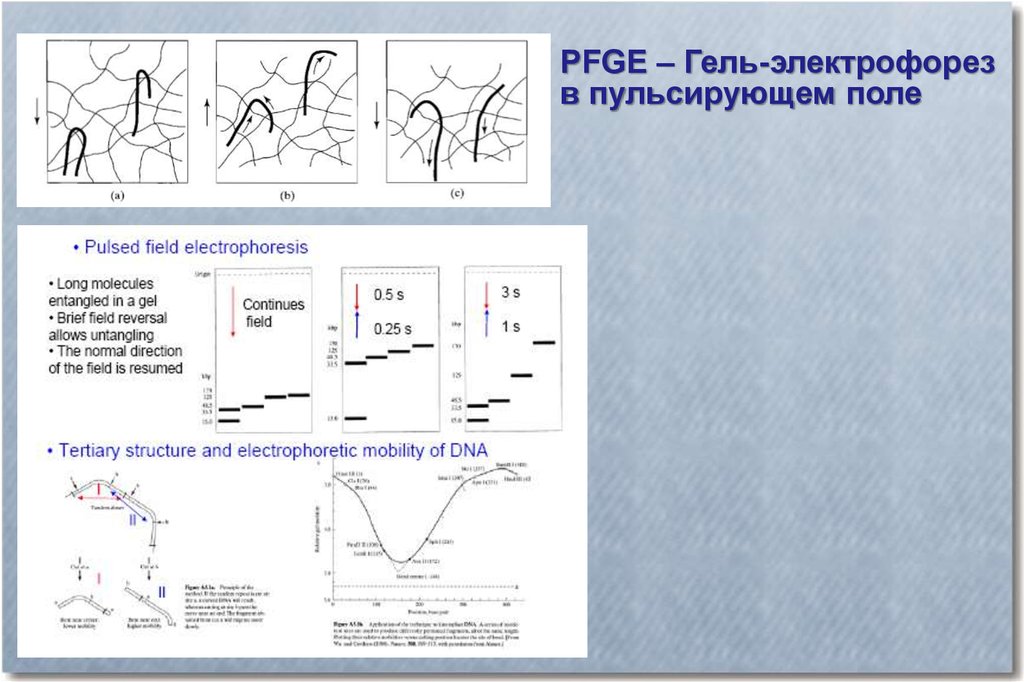
PFGE – Гель-электрофорезв пульсирующем поле
32.
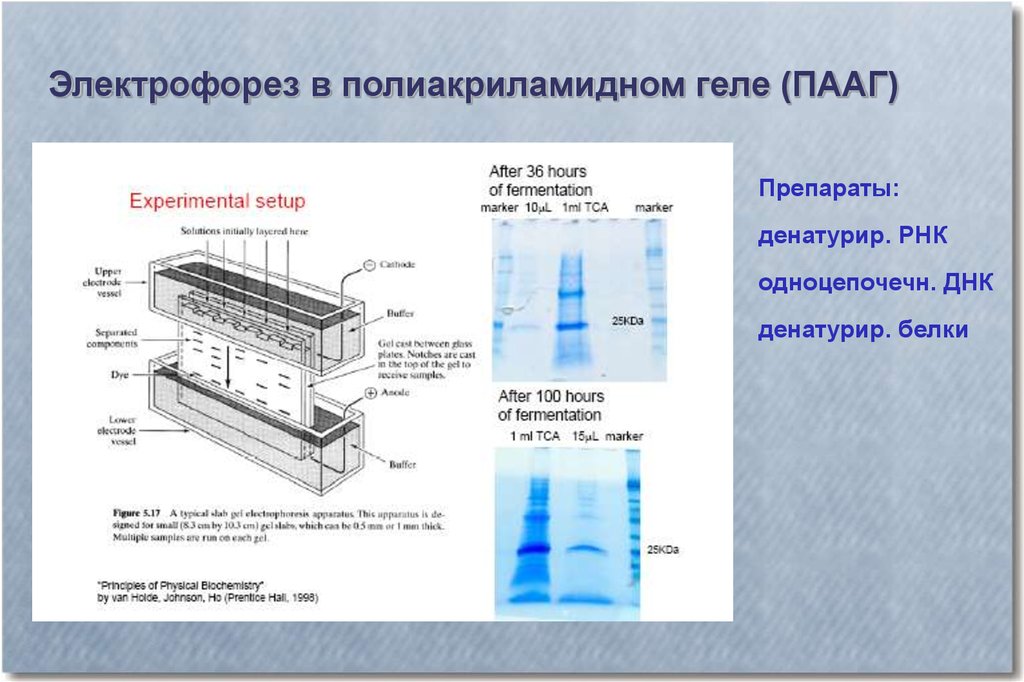
Электрофорез в полиакриламидном геле (ПААГ)Препараты:
денатурир. РНК
одноцепочечн. ДНК
денатурир. белки
33.
Полиакриламид (ПААГ)Для полимеризации необходимы инициатор (персульфат аммония) и катализатор
ТЕМЕД
34.
Секвенирование(определение последовательности нуклеотидов в цепи ДНК)
35.
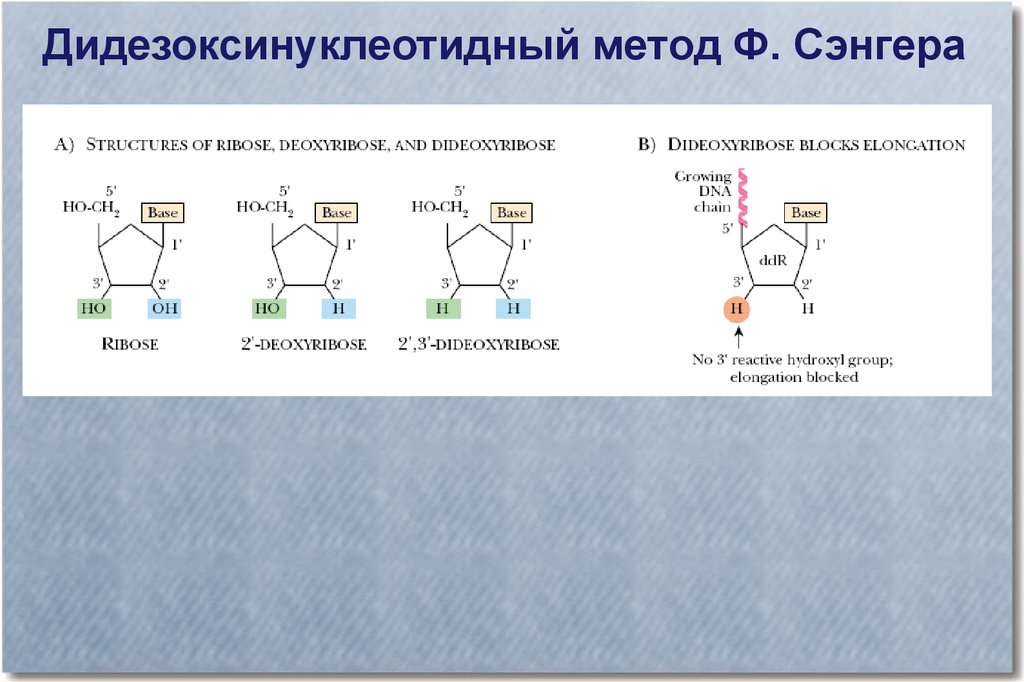
Дидезоксинуклеотидный метод Ф. Сэнгера36.
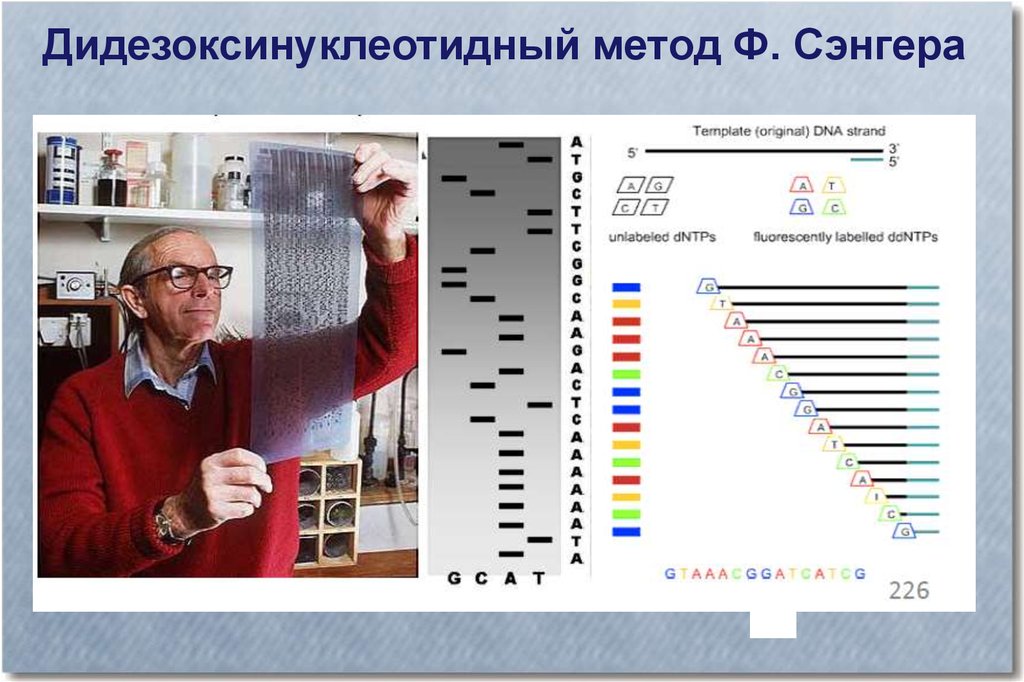
Дидезоксинуклеотидный метод Ф. Сэнгера37.
Дидезоксинуклеотидный метод Ф. Сэнгера38.
Секвенирование39.
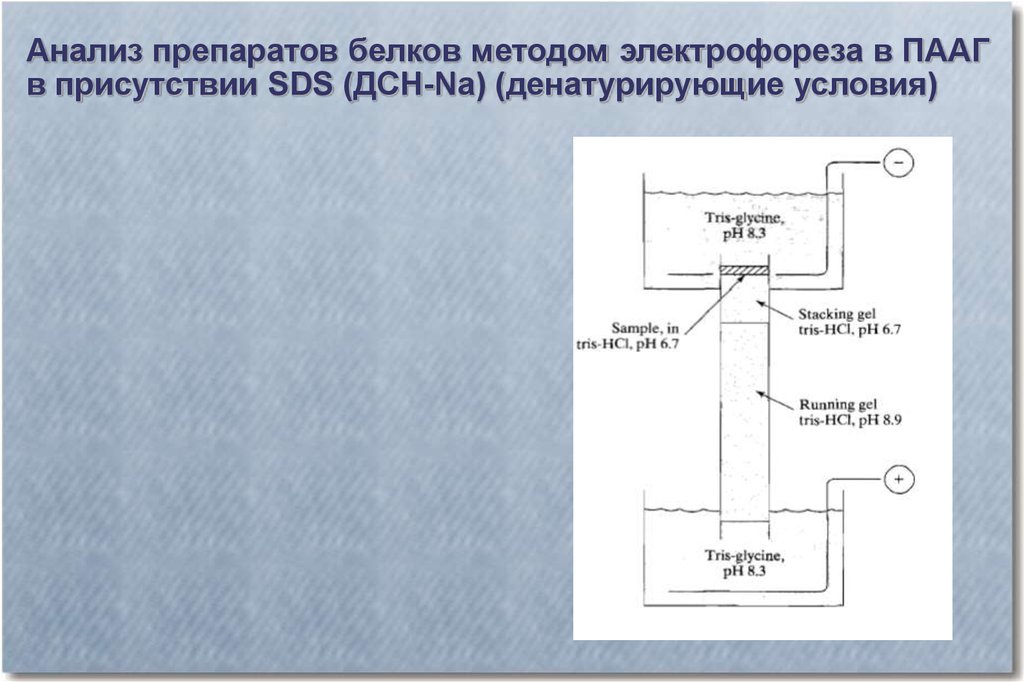
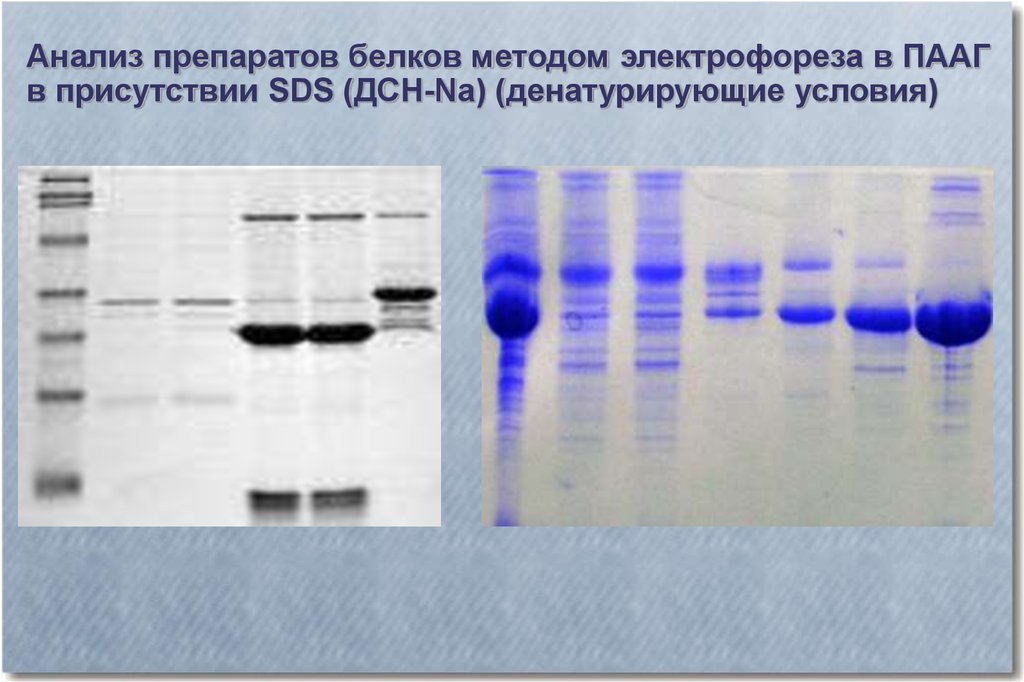
Анализ препаратов белков методом электрофореза в ПААГв присутствии SDS (ДСН-Na) (денатурирующие условия)
Структура SDS
40.
Анализ препаратов белков методом электрофореза в ПААГв присутствии SDS (ДСН-Na) (денатурирующие условия)
41.
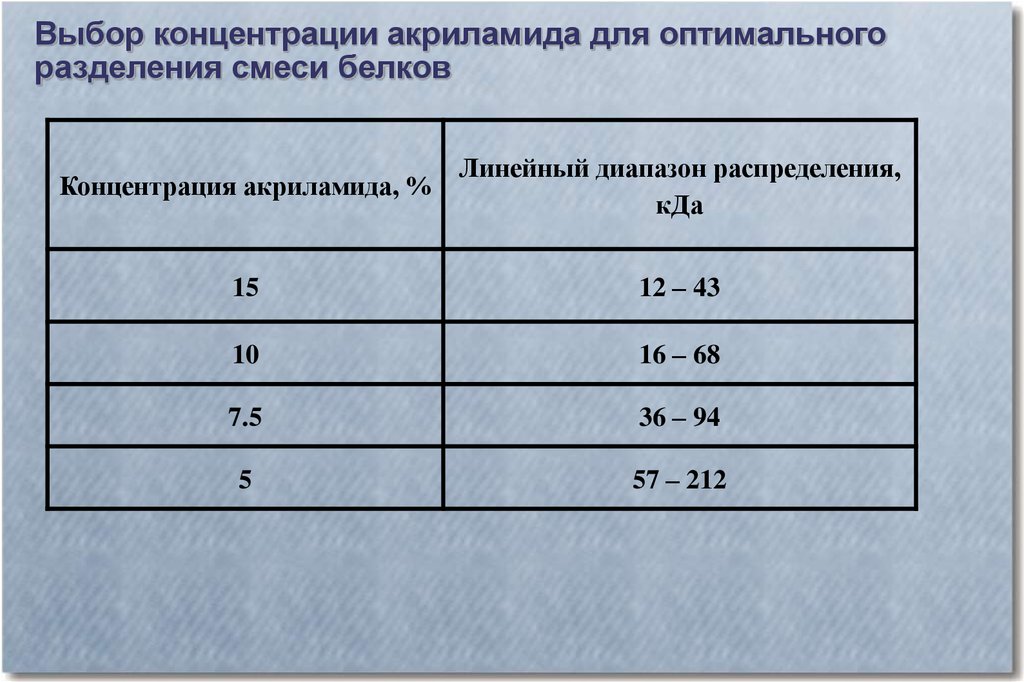
Выбор концентрации акриламида для оптимальногоразделения смеси белков
Концентрация акриламида, %
Линейный диапазон распределения,
кДа
15
12 – 43
10
16 – 68
7.5
36 – 94
5
57 – 212
42.
Анализ препаратов белков методом электрофореза в ПААГв присутствии SDS (ДСН-Na) (денатурирующие условия)
43.
Ионогенные группы в составе аминокислотрК –
характеризует
способность
групп отдавать
ион водорода
(Н+)
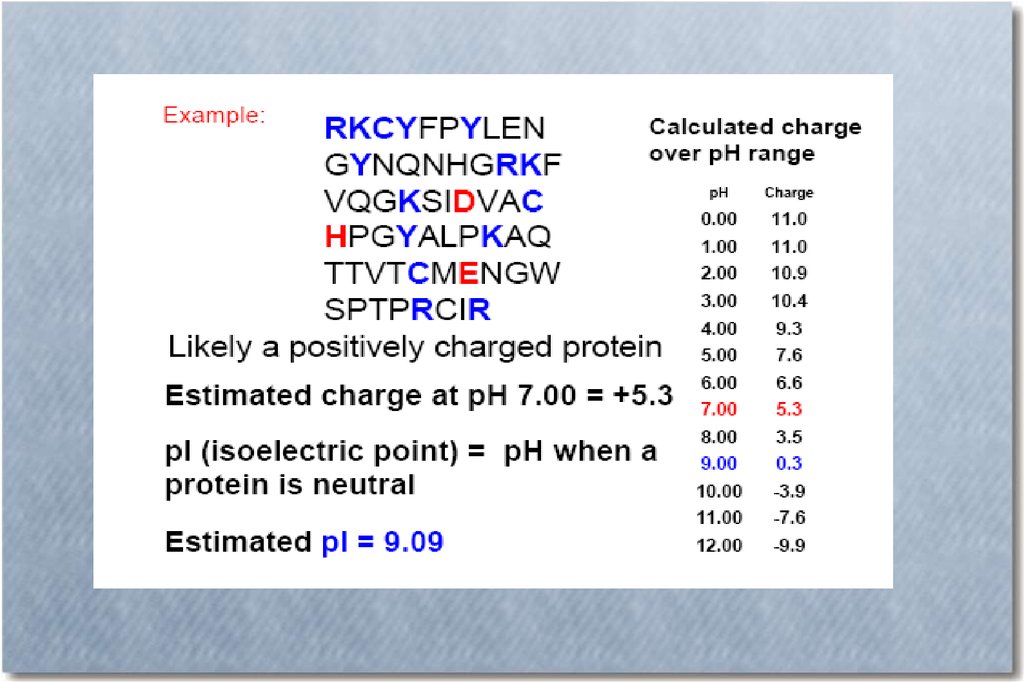
44.
Изоэлектрическаяточка – значение рН,
при котором
суммарный заряд
молекулы равен нулю
В буферном растворе со значением рН = рI изучаемого белка, невозможно
движение белковой молекулы в приложенном электрическом поле.
45.
46.
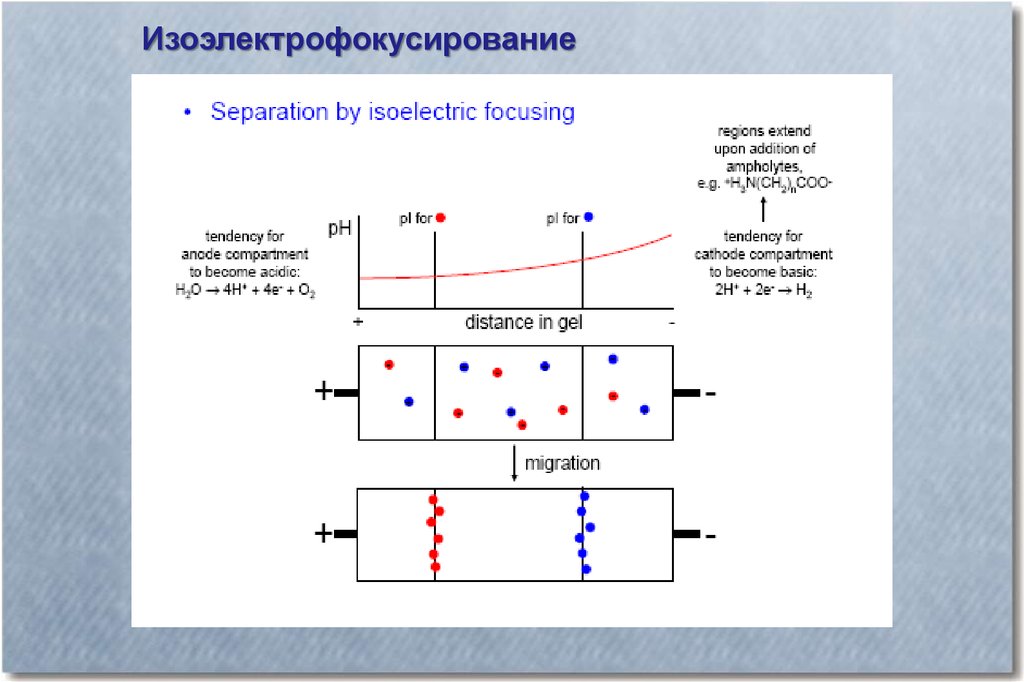
ИзоэлектрофокусированиеПри изоэлектрическом фокусировании в среде для
электрофореза создается плавный градиент рН. Белок
останавливается в зоне, где значение рН равно его
изоэлектрической точке (pI). Для создания градиента рН
обычно используют амфолиты - раствор полиаминополикарбоновых кислот, которыми насыщают носитель. В
отсутствии электрического поля эта смесь обычно имеет
значение рН равное 6.5. При наложении электрического поля
указанные кислоты обеспечивают линейный градиент рН от 3
до 10.
47.
Изоэлектрофокусирование48.
ИзотахофорезВ случае изотахофореза заряженные ионы сначала
разделяются в соответствии с величинами их заряда и
подвижности, а затем перемещаются в электрическом
поле с одинаковыми и постоянными скоростями.






























 biology
biology








