Similar presentations:
Алкины
1.
2.
Составьте уравнения указанных реакций,укажите условия их протекания, назовите
полученные вещества
I и III варианты: этен
II и IV варианты: пропен
Реакци
я
I-В
1)
2)
3)
4)
5) ***
II-В
III-В
IV-В
Горение
Неполное окисление
+ Cl2
+ HBr
+ Br2
+ HCl
+ I2
+ HF
Полимеризация
+ F2
+ HI
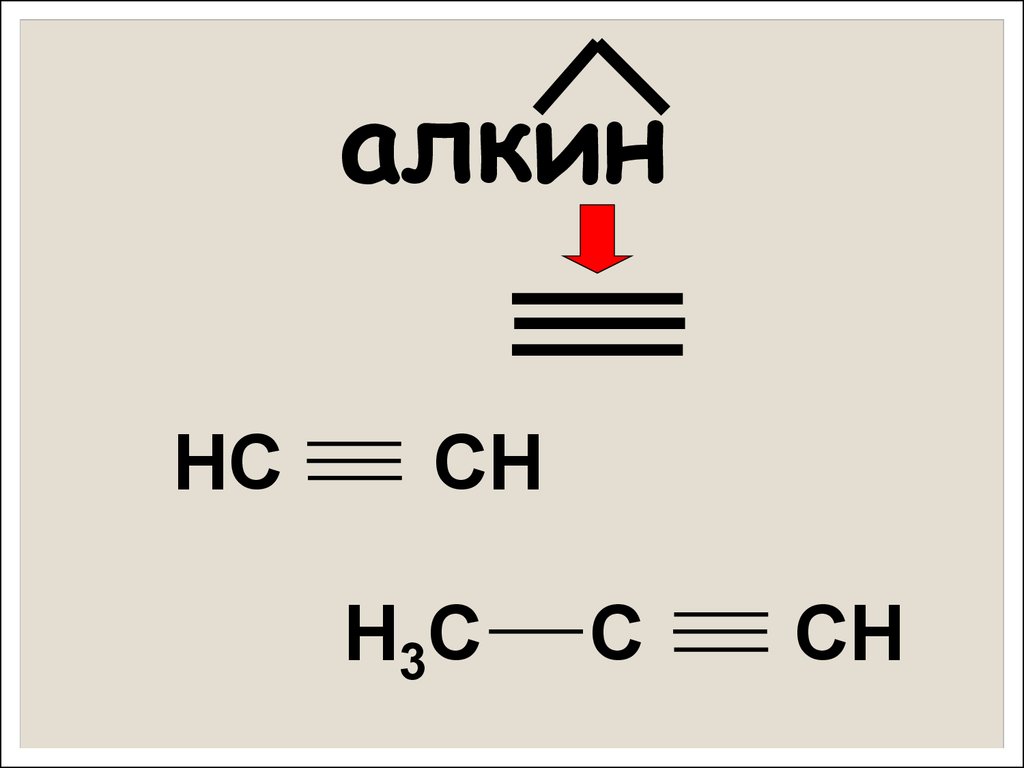
3. Понятие об алкинах
◦АЛКИНЫ – непредельныеуглеводороды, содержащие в
молекуле одну тройную связь с
общей формулой
СnН2n - 2
4.
алкинНС
СН
Н3С
С
СН
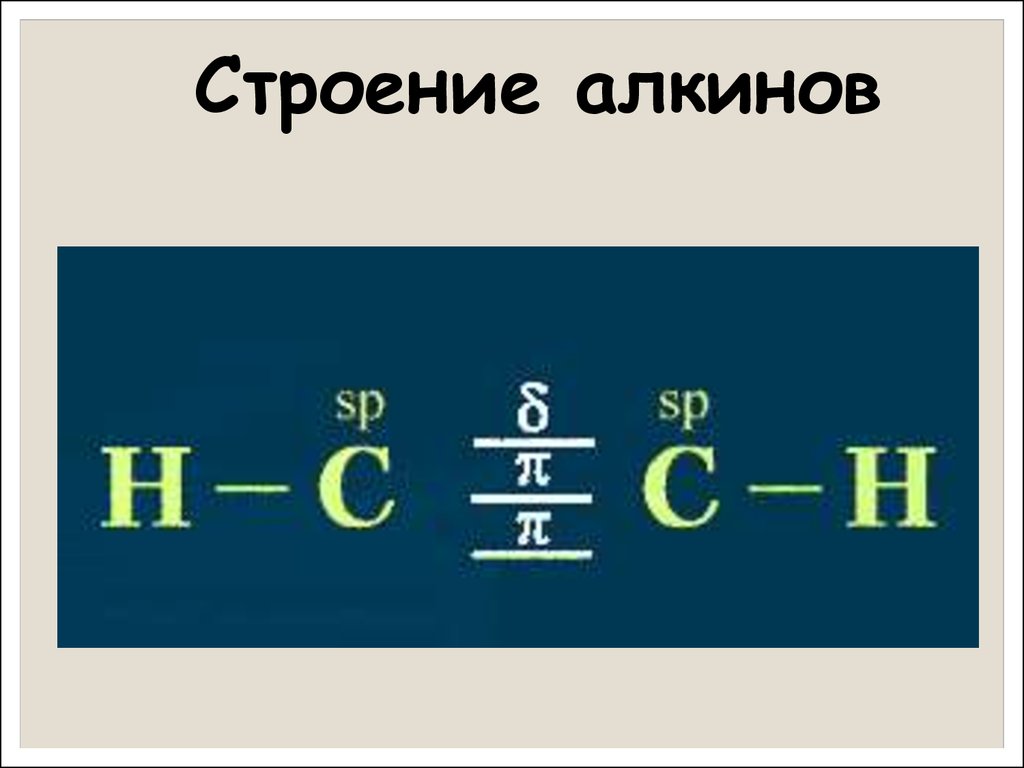
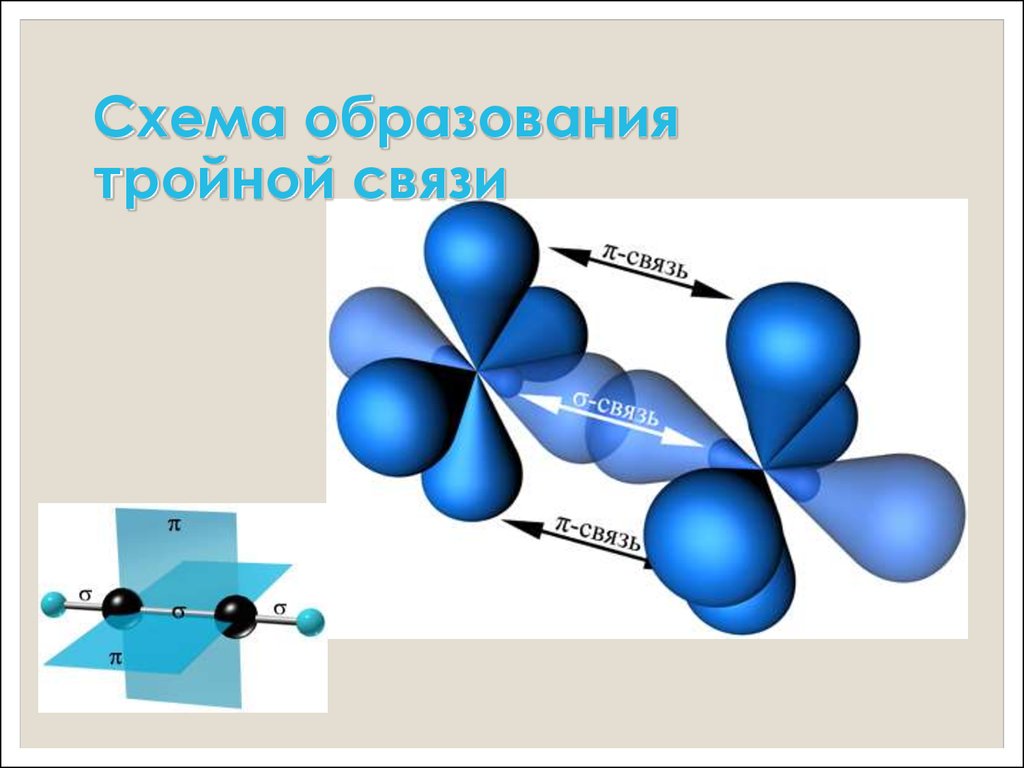
5. Характеристика тройной связи
◦Вид гибридизации – sp◦Вид связи – ковалентная полярная
◦По типу перекрывания – 1δ и 2 π
6.
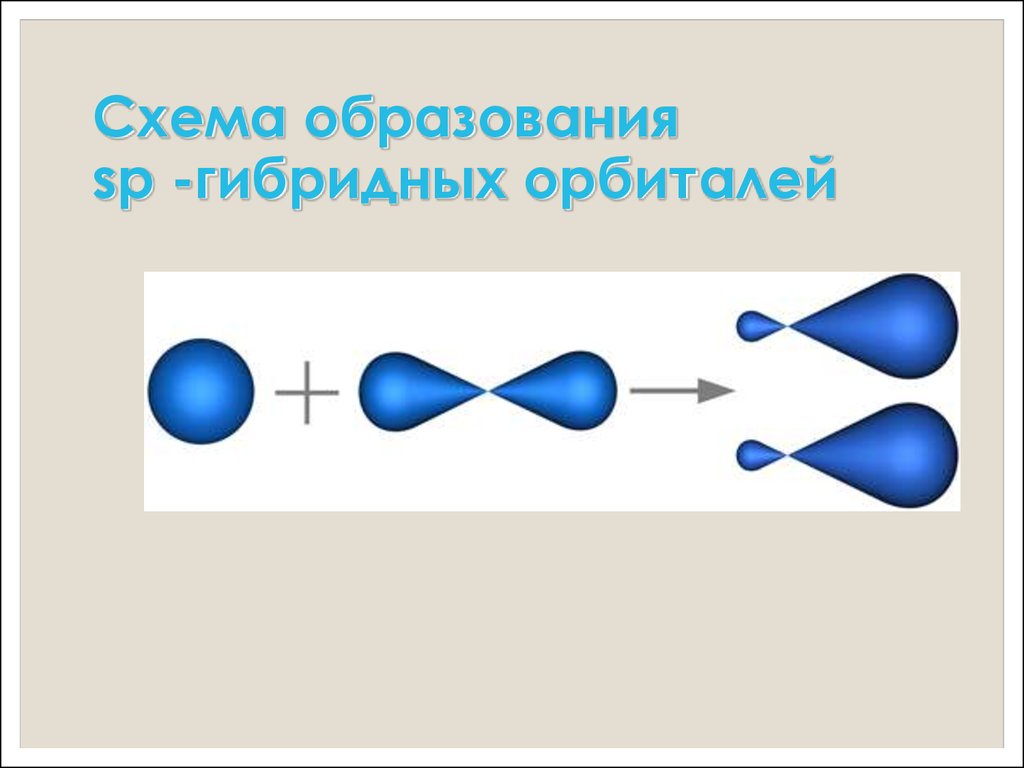
Строение алкинов7. Схема образования sp -гибридных орбиталей
8. Схема образования тройной связи
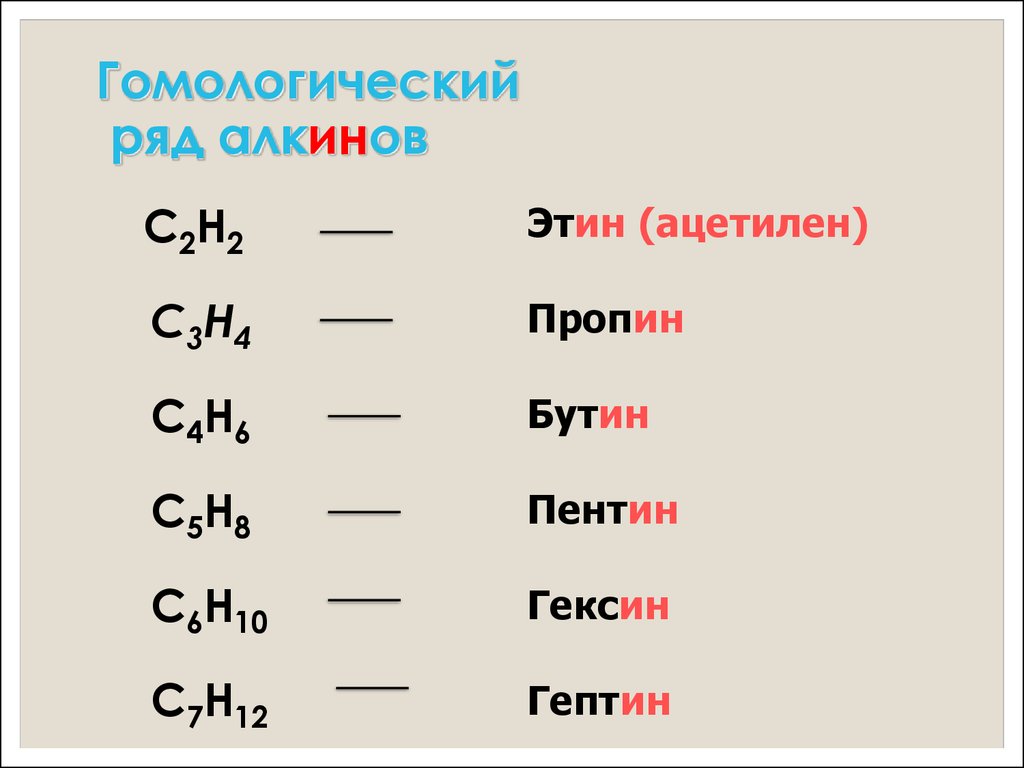
9. Гомологический ряд алкинов
C2H2Этин (ацетилен)
C3H4
Пропин
C4H6
Бутин
C5H8
Пентин
C6H10
Гексин
C7H12
Гептин
10.
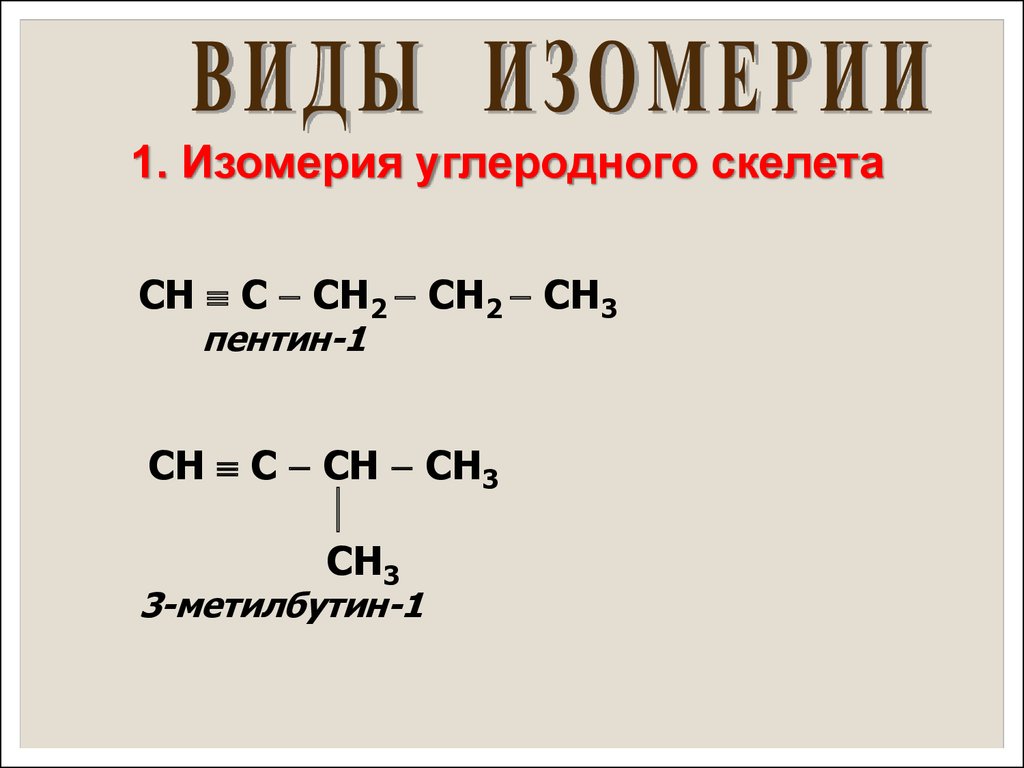
1. Изомерия углеродного скелетаСН С СН2 СН2 СН3
пентин-1
СН С СН СН3
СН3
3-метилбутин-1
11.
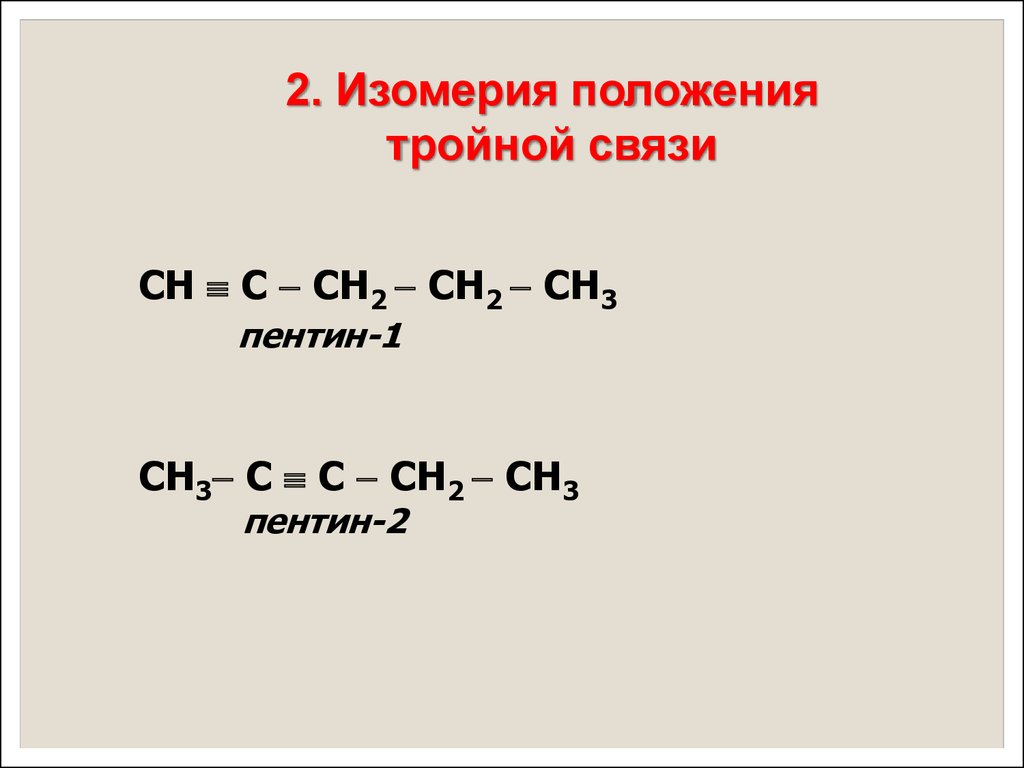
2. Изомерия положениятройной связи
СН С СН2 СН2 СН3
пентин-1
СН3 С С СН2 СН3
пентин-2
12.
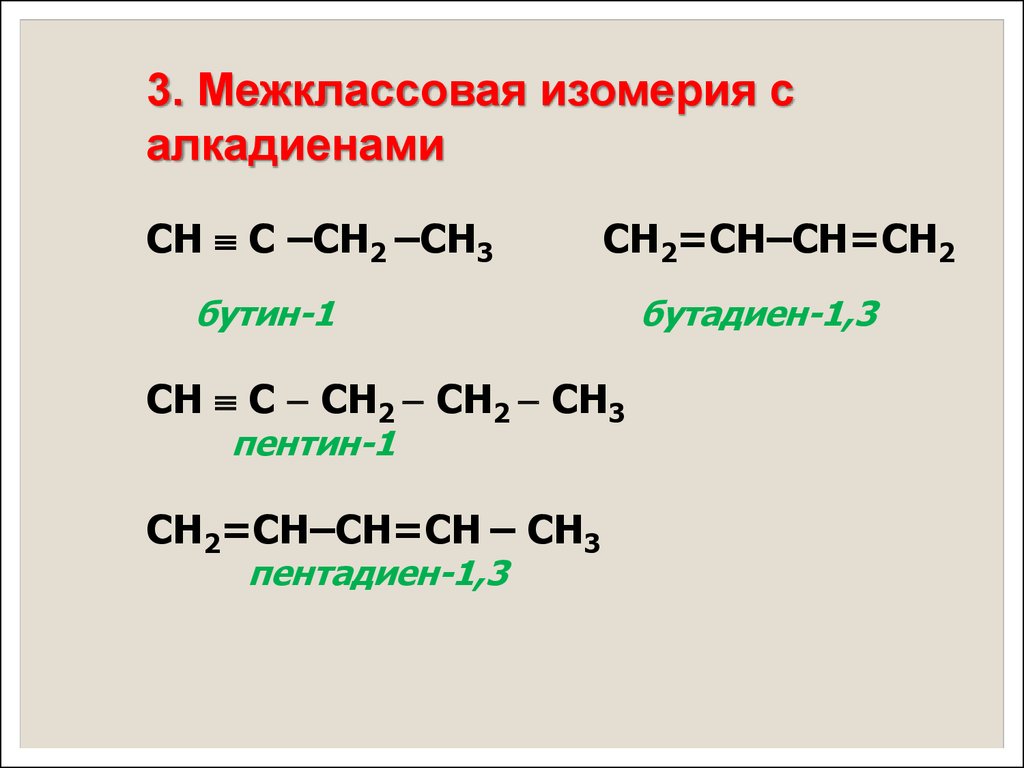
3. Межклассовая изомерия салкадиенами
СН С –СН2 –СН3
СН2=СН–СН=СН2
бутин-1
СН С СН2 СН2 СН3
пентин-1
СН2=СН–СН=СН – СН3
пентадиен-1,3
бутадиен-1,3
13.
Номенклатура алкинов14.
Дайте названия углеводородам:НС
СН
Н3 С
Этин
С
Бутин - 2
Н3С
С
Пропин
С
СН3
СН
15.
Получение алкинов1. Карбидный способ (гидролиз
карбида кальция):
Основной недостаток – большие затраты
электроэнергии на производство карбида
кальция.
16.
2. Термический крекинг метана.17.
3. Дегидрогалогенированиеспиртовым раствором щёлочи:
18.
Физическиесвойства алкинов
19.
Химические свойстваалкинов
1. Гидрирование (присоединение
водорода):
20.
2) Галогенирование. Алкиныобесцвечивают бромную воду
(качественная реакция на тройную
связь). Реакция галогенирования
алкинов протекает медленнее, чем
алкенов.
HC≡CH + Br2 → CHBr=CHBr
CHBr=CHBr + Br2 → CHBr2–
CHBr2
21.
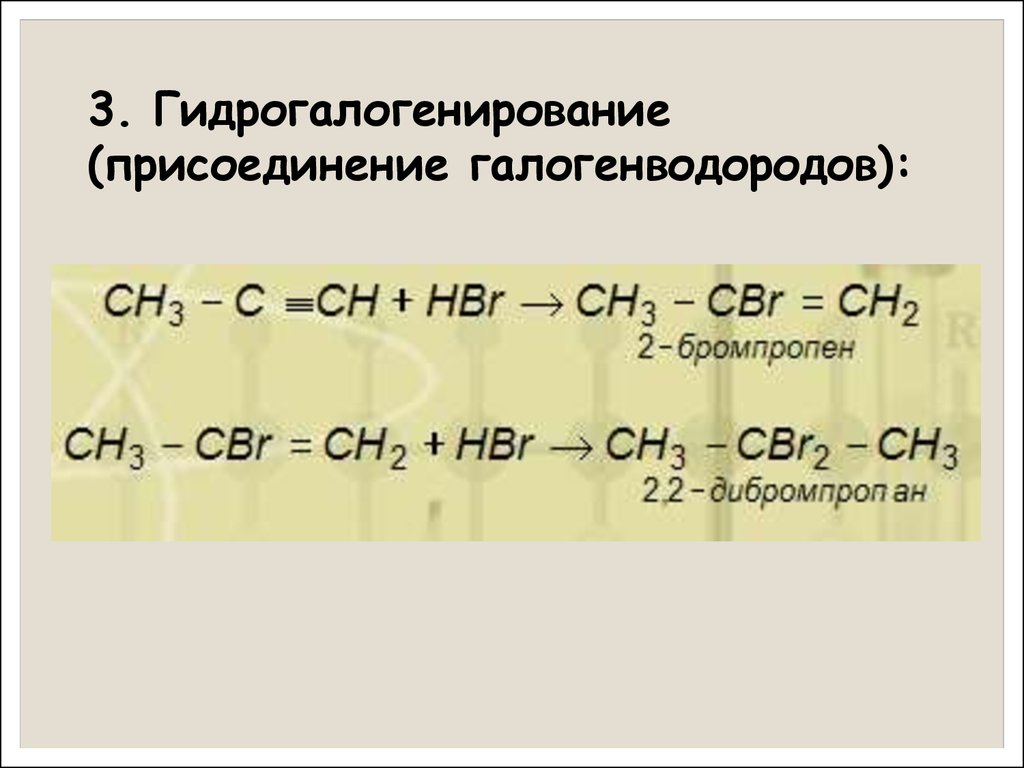
3. Гидрогалогенирование(присоединение галогенводородов):
22.
◦Правило В. В. Марковникова:водород присоединяется к
наиболее гидрогенизированному
атому углерода при двойной связи,
то есть к атому углерода с
наибольшим числом водородных
атомов.
23.
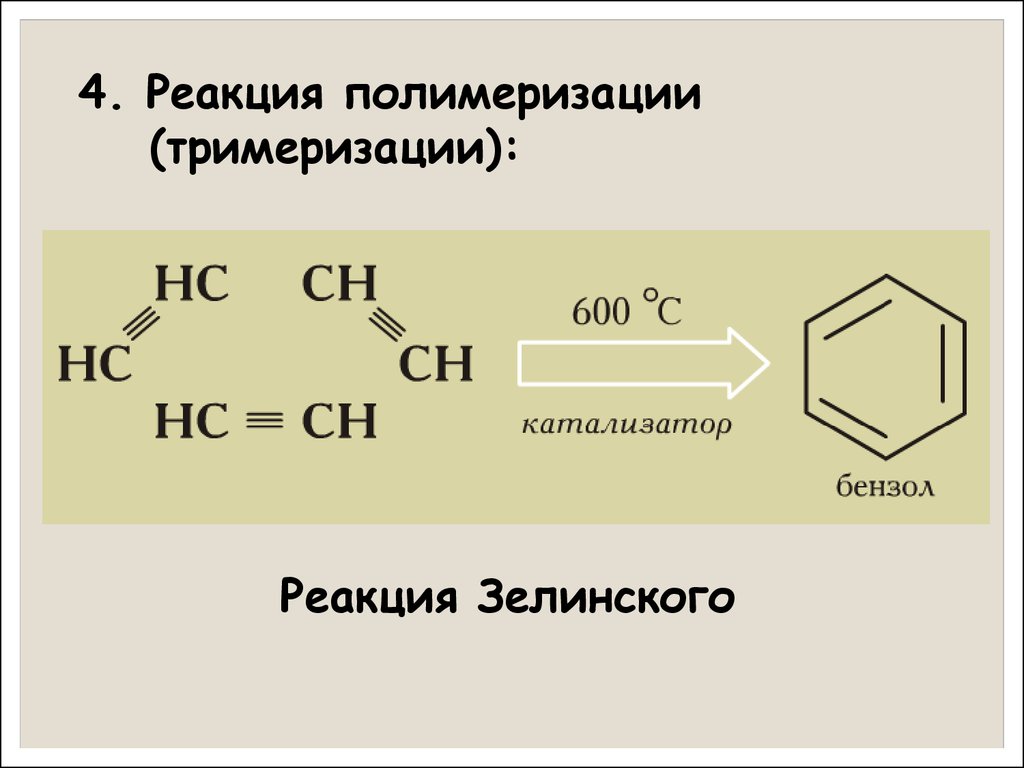
4. Реакция полимеризации(тримеризации):
Реакция Зелинского
24.
5. Реакция Кучерова(присоединение воды к ацетилену в
присутствии солей ртути с
образованием альдегида):
этин
уксусный альдегид
25. 6. Окисление алкинов
1) Горение (горят светящимся и коптящимпламенем с выделением большого
количества тепла)
C2H2 + 2О2 → 2СО2 + Н2О + 2600
кДж
2) Неполное окисление - обесцвечивают
раствор марганцовки KMnO4,
(качественная реакция)
26.
◦ Кислотные свойства.7) Водородные атомы ацетилена
способны замещаться металлами с образованием
ацетиленидов. Так, при действии на ацетилен
металлического натрия или амида натрия
образуется ацетиленид натрия.
HC≡CH + 2Na → NaC≡CNa + H2
Ацетилениды серебра и меди получают
взаимодействием с аммиачными растворами
соответственно оксида серебра и хлорида меди.
HC≡CH + Ag2O → AgC≡CAg↓+ H2O
(аммиачный р-р)
HC≡CH + CuCl2 → CuC≡CCu↓+ 2HCl
(аммиачный р-р)
27.
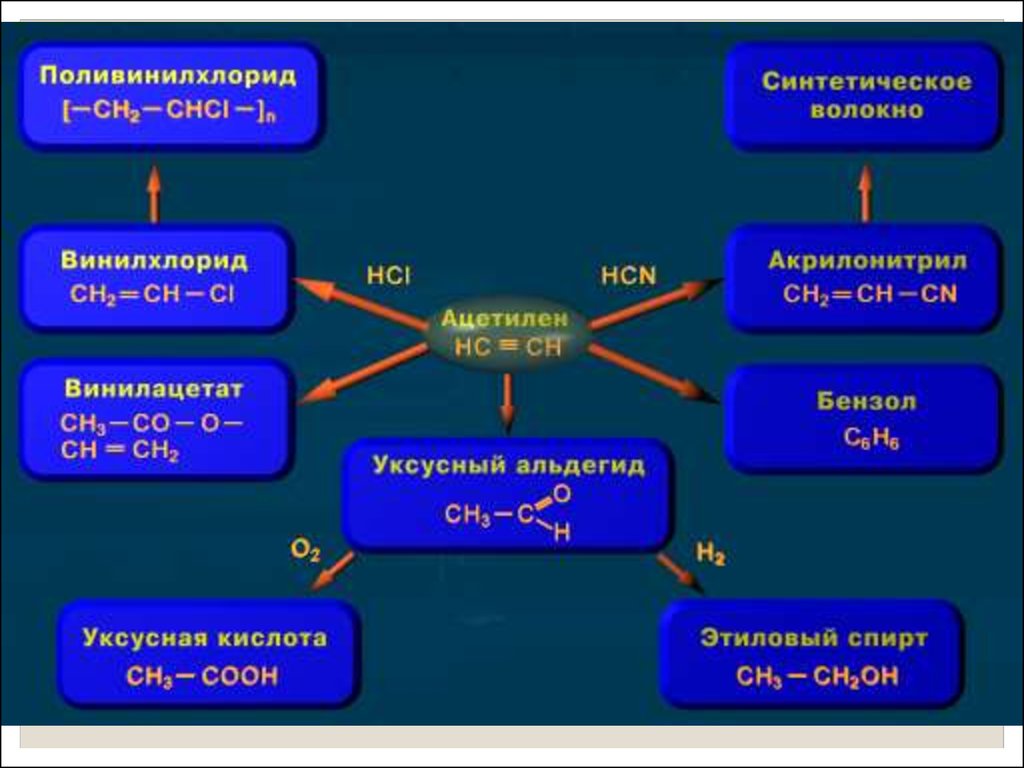
Применение алкинов28.
29.
30.
31.
32.
Выводы:1.Углеводороды с общей формулой СnH2n-2,
в молекулах которых имеется одна тройная
связь, называются алкинами.
2.Наиболее характерной реакцией для алкинов
является реакция присоединения.
3.Присоединение воды к ацетилену в присутствии
солей ртути приводит к образованию альдегида и
называется реакцией Кучерова.
4.Алкины применяются для синтеза
галогенпроизводных, широко используются как
растворители и для получения полимеров.
33. Источники информации
1. Петров А.А., Бальян Х.В., Трощенко А.Т.Органическая химия. Учебник для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
34.
5. Оганесян Э.Т. Руководство по химиипоступающим в вузы. Справочное пособие. – М.:
Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.























 chemistry
chemistry








