Similar presentations:
Загрязнение атмосферного воздуха
1.
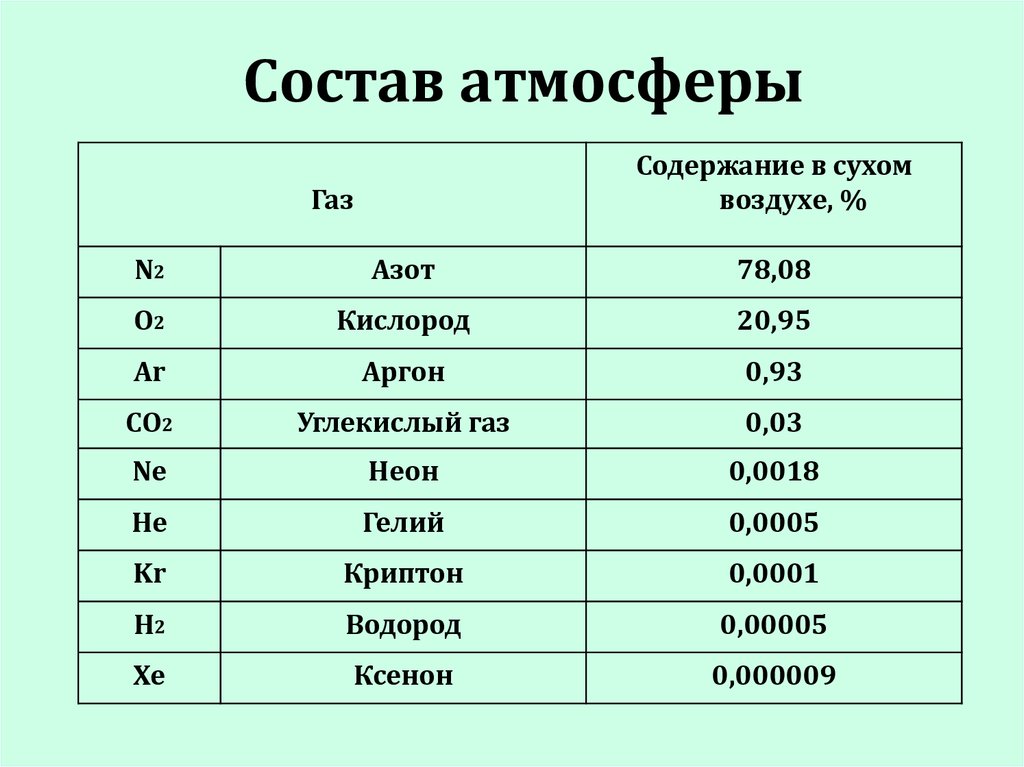
Атмосфера2. Состав атмосферы
Содержание в сухомвоздухе, %
Газ
N2
Азот
78,08
O2
Кислород
20,95
Ar
Аргон
0,93
CO2
Углекислый газ
0,03
Ne
Неон
0,0018
He
Гелий
0,0005
Kr
Криптон
0,0001
H2
Водород
0,00005
Xe
Ксенон
0,000009
3. Основные загрязнители атмосферы:
пыль, SO2, NOx,CO, CO2, CnHm,
аэрозоли тяжелых металлов и др.
4. Источники диоксида серы:
• природные - вулканы и лесные пожары,• антропогенные - сжигание ископаемого
топлива и обжиг сульфидных руд при
производстве меди, никеля и других
цветных металлов.
5. Источники оксидов азота NO и N02:
• природные - электрические разряды,при которых образуется NO, который
впоследствии превращается в N02;
• антропогенные - сгорание топлива,
особенно при высоких температурах (Т >
10000С).
6. СМОГ
- аэрозоль, состоящий из дыма, туманаи пыли. Английское слово «smog» —
производное от «smoke» — дым
и «fog» — туман.
Жители английской столицы
первыми столкнулись с проблемами,
связанными с загрязнением городского
воздуха.
7. Лондонский (влажный) смог
- сочетание газообразных и твердыхпримесей с туманом,
как результат сжигания большого
количества угля или мазута при
высокой влажности.
8. Фотохимический смог:
• разновидность вторичного загрязненияатмосферы, когда из первичных
загрязнителей образуются гораздо более
высокотоксичные соединения;
• автомобильные выхлопы +Солнечный свет +
О2 →О3 + NOx + пероксиды,
пероксинитриты+ CО2 + H2O.
9. Пероксиацилнитриты (ПАН)
где, R - CH3-, C2H5- и т.д.10. Изменение концентраций компонентов фотохимического смога в разное время суток
11. Основные загрязнители атмосферы и источники их поступления
Оксид углерода (СО) :• дымовые газы любой установки сжигания
органического топлива;
• выхлопные газы транспорта с двигателем
внутреннего сгорания.
12. Основные загрязнители атмосферы и источники их поступления
Углеводороды (CnHm ):дымовые газы теплоэнергетических
установок,
из хранилищ жидкого и газообразного
топлива,
выхлопные газы транспорта.
13. Основные загрязнители атмосферы и источники их поступления
Аэрозоли, тяжелые металлы:результат сжигания топлива,
отходящие газы промышленных производств,
в т.ч. дым плавильных печей при производстве
сталей и сплавов цветных металлов.
14. Наиболее сложная экологическая обстановка складывается в регионах, где сосредоточены объекты тяжелой промышленности,
нефтегазовой и горнорудной отраслей,черной и цветной металлургии.
К городам с напряженной экологической
обстановкой относятся:
Новокузнецк и Екатеринбург,
Магнитогорск и Череповец,
Омск и Братск,
Кемерово и Нижний Тагил,
Тюмень и Иркутск,
Братск и Липецк,
Уфа и Чита,
Красноярск и Хабаровск.
15. Особо опасные вещества, искусственно созданные человеком - ксенобиотики, экотоксиканты
Особо опасные вещества, искусственносозданные человеком ксенобиотики, экотоксиканты
КСЕНОБИОТИКИ – любое чужеродное для
данного организма или их сообщества
вещество, могущее вызвать нарушение
биотических процессов, в том числе –
заболевание и гибель живых организмов.
Экотоксиканты – высокотоксичный
особый класс загрязняющих веществ.
16. Особо опасные вещества, искусственно созданные человеком - ксенобиотики, экотоксиканты:
Особо опасные вещества, искусственносозданные человеком ксенобиотики, экотоксиканты:
диоксины-гетероциклические
полихлорированные соединения,
ДДТ –хлоорганические пестициды, в
структуре которых присутствуют
ароматические ядра,
полихлорированные бифенилы (ПХБ).
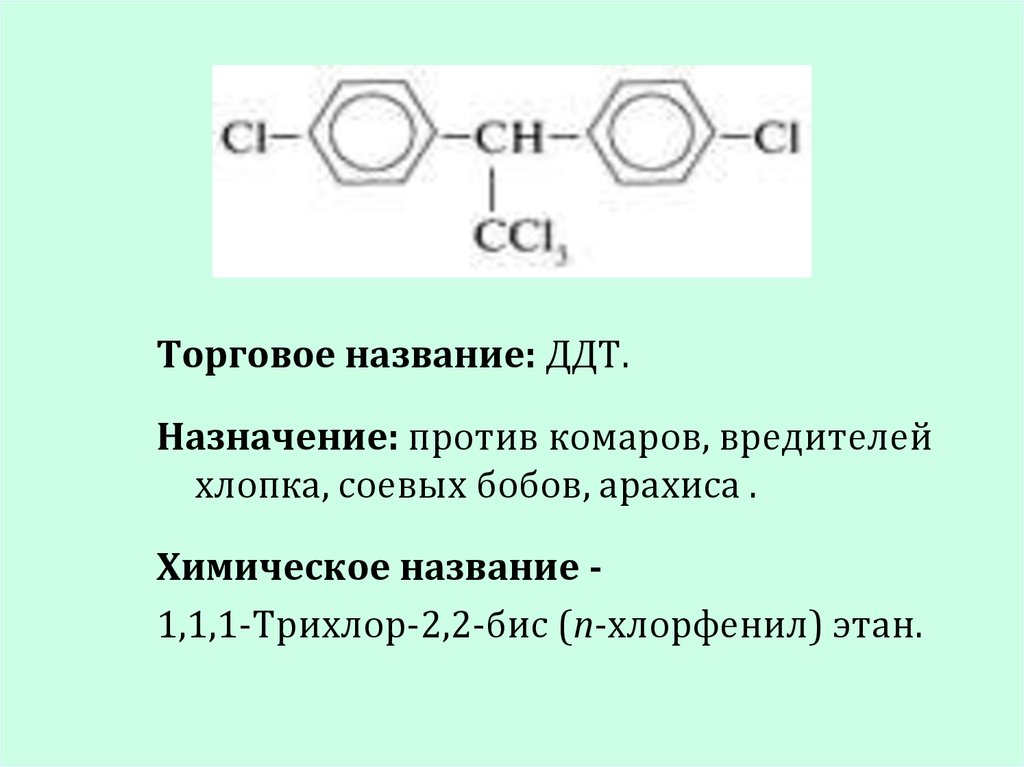
17.
Торговое название: ДДТ.Назначение: против комаров, вредителей
хлопка, соевых бобов, арахиса .
Химическое название 1,1,1-Трихлор-2,2-бис (n-хлорфенил) этан.
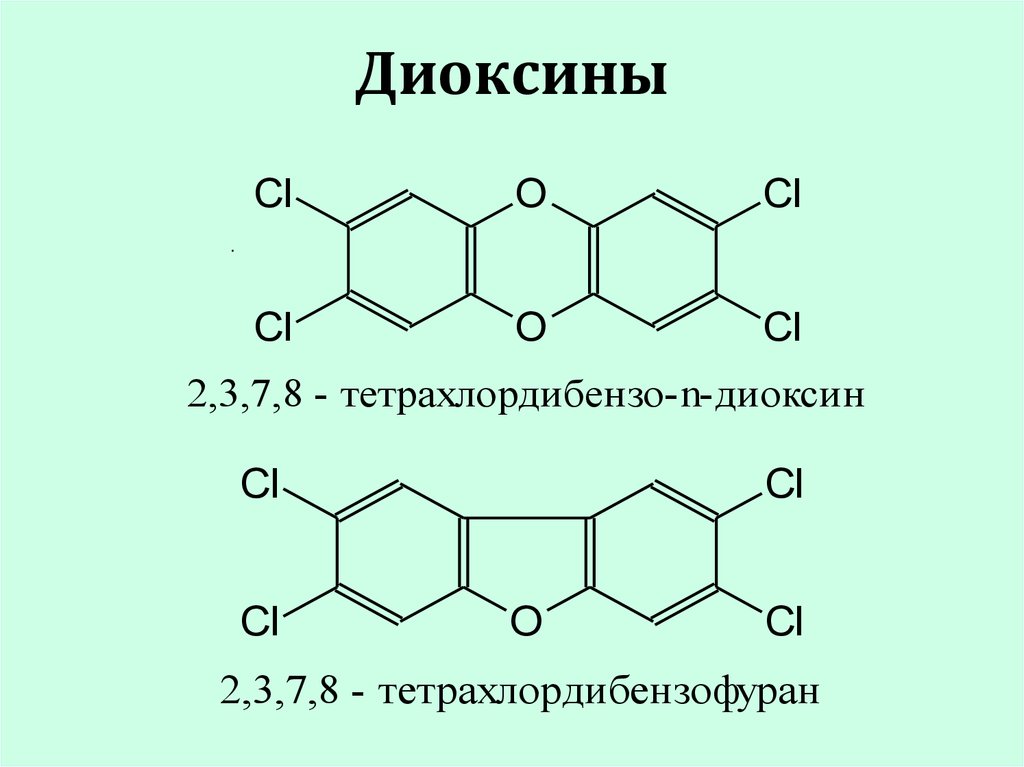
18. Диоксины
ClO
Cl
Cl
O
Cl
.
2,3,7,8 - тетрахлордибензо-n-диоксин
Cl
Cl
Cl
O
Cl
2,3,7,8 - тетрахлордибензофуран
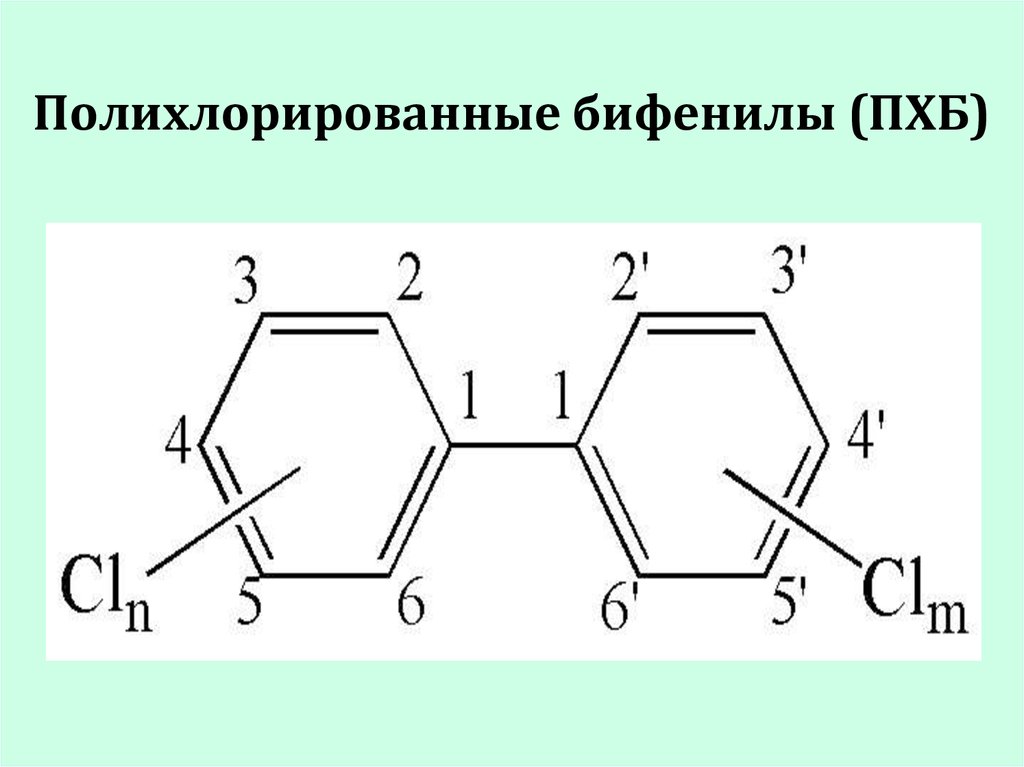
19. Полихлорированные бифенилы (ПХБ)
20.
21. Парниковый эффект
Парниковым может считаться любой газ,
поглощающий в ИК-области и содержащийся в
сколь угодно малых количествах в атмосфере:
водяной пар, находящийся в атмосфере,
углекислый газ (диоксид углерода) (СО2),
метан (СН4),
оксиды азота, в особенности N2O,
озон (О3),
хлорфторуглероды.
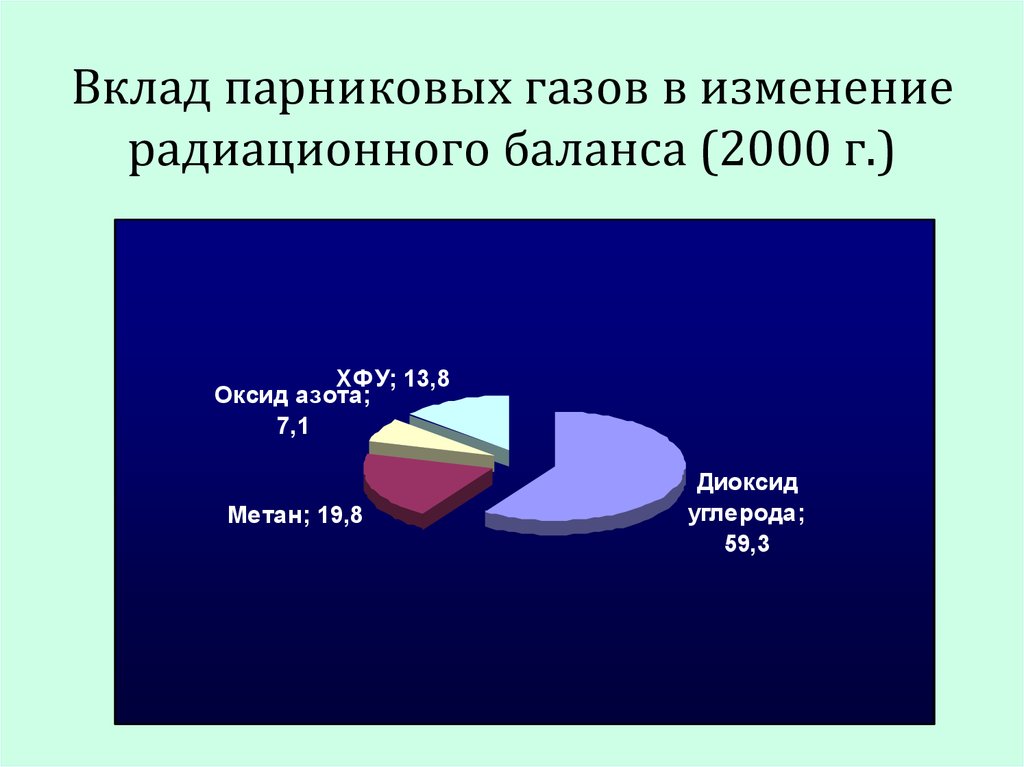
22. Вклад парниковых газов в изменение радиационного баланса (2000 г.)
ХФУ; 13,8Оксид азота;
7,1
Метан; 19,8
Диоксид
углерода;
59,3
23. Кислотные осадки
24.
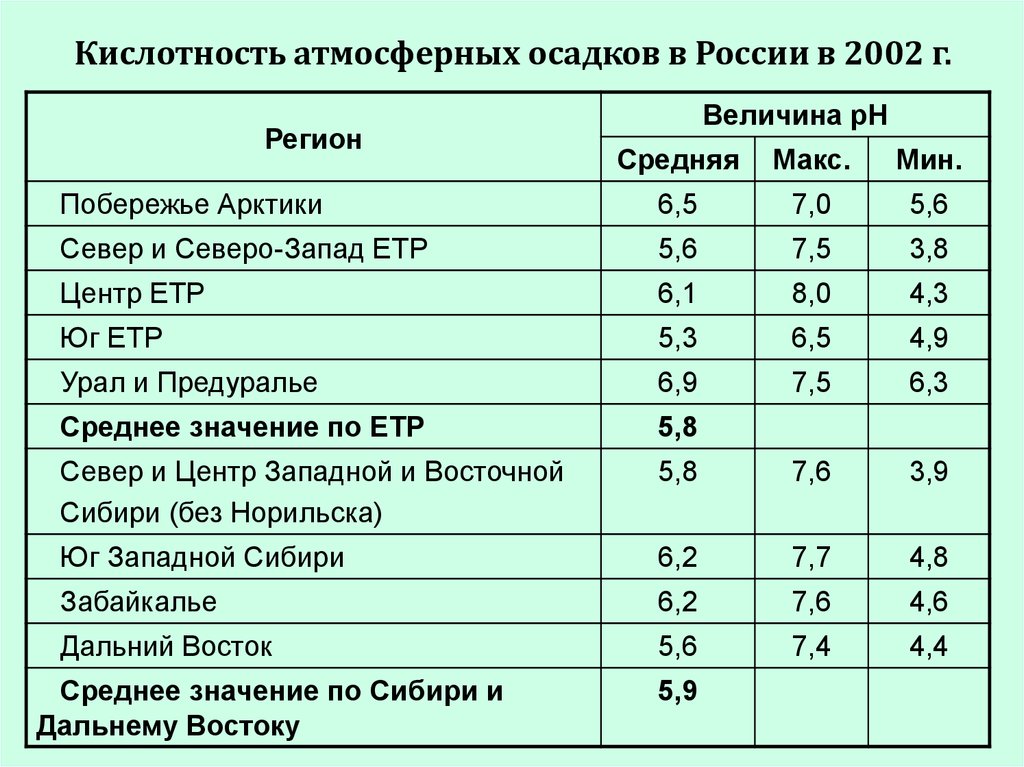
Кислотность атмосферных осадков в России в 2002 г.Регион
Величина рН
Средняя
Макс.
Мин.
Побережье Арктики
6,5
7,0
5,6
Север и Северо-Запад ЕТР
5,6
7,5
3,8
Центр ЕТР
6,1
8,0
4,3
Юг ЕТР
5,3
6,5
4,9
Урал и Предуралье
6,9
7,5
6,3
Среднее значение по ЕТР
5,8
Север и Центр Западной и Восточной
Сибири (без Норильска)
5,8
7,6
3,9
Юг Западной Сибири
6,2
7,7
4,8
Забайкалье
6,2
7,6
4,6
Дальний Восток
5,6
7,4
4,4
Среднее значение по Сибири и
Дальнему Востоку
5,9
25.
В естественных условиях атмосферные осадкиобычно имеют нейтральную или слабо кислую
реакцию, то есть показатель их кислотности/
щелочности обычно меньше 7,0: рН < 7.
В присутствии углекислого газа и при
температуре 20о С дождевая вода имеет
рН = 5,6.
В присутствии других природных газов рН
дождевой воды снижается примерно до
рН = 5,0.
Кислотные осадки (или “кислотные дожди”)
это осадки с рН<5.
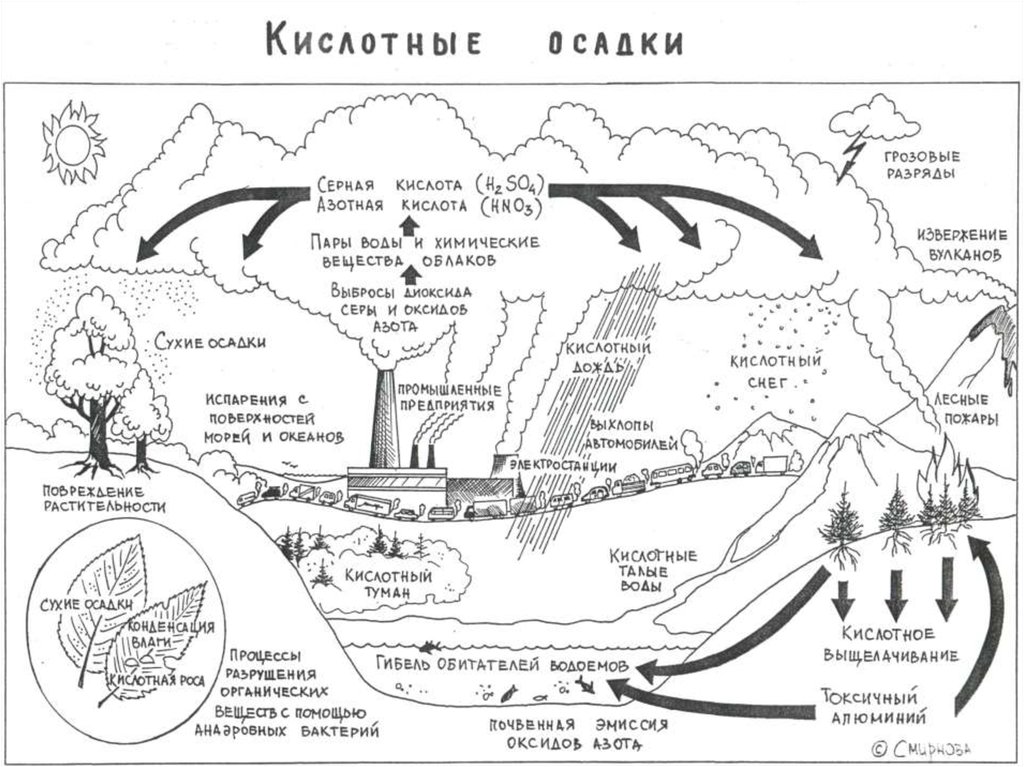
26. Кислотные осадки бывают двух типов:
• сухие, обычно выпадающие невдалеке отисточника их поступления в атмосферу,
• влажные (дождь, снег и пр.),
распространяющиеся на большие
расстояния, соизмеримые с размерами
континентов.
27.
28.
Основные компонентыкислотных осадков:
аэрозоли оксидов серы и азота (SOх и
NОx), которые при взаимодействии с
атмосферной, гидросферной или
почвенной влагой образуют серную,
азотную и другие кислоты.
29.
Основные природныеисточники :
извержения вулканов, лесные
пожары, эрозия почв и др.
30.
Основные антропогенныеисточники:
- процессы сжигания горючих
ископаемых, главным образом угля, в
тепловых электростанциях, в котельных, в
металлургии, нефтехимической
промышленности, на транспорте и пр.,
- сельское хозяйство .
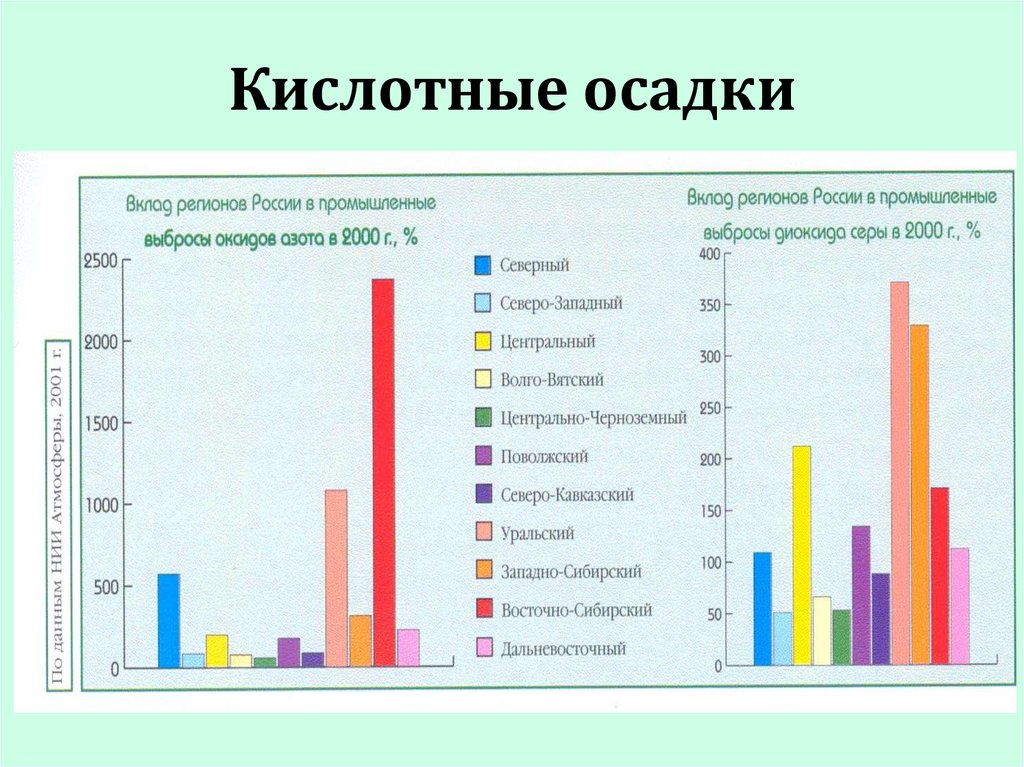
31. Кислотные осадки
32.
33.
34. Основные пути снижения эмиссии оксидов азота и серы:
• понижение температуры сжигания угля,• извлечение серы из отходящих газов,
• экономия использования энергии.
35. Виды ущерба от кислых осадков:
деградация водных систем,
гибель лесов,
возрастание заболеваемость людей,
ущерб зданиям, сооружениям из
мрамора:
CaCO3+H2SO4→CaSO4+H2O.
Мрамор превращается в гипс.
36.
Исторические памятники Греции иРима, простояв тысячелетия, в последние
годы разрушаются прямо на глазах.
37. Такая же судьба грозит и Тадж-Махалу — шедевру индийской архитектуры периода Великих Моголов, в Лондоне — Тауэру и
Вестминстерскому аббатству.38. На соборе Св. Павла в Риме слой портлендского известняка разъеден на 2,5 см. В Голландии статуи на соборе Св. Иоанна тают, как
леденцы. Чернымиотложениями изъеден королевский дворец на
площади Дам в Амстердаме.
39. Рациональное использование воздуха (газоочистка)
«Всё, что попадает в воздух,рано или поздно возвращается
на землю, чтобы принять
участие в природных
процессах, происходящих в
почве и воде».
Барри Коммонер,
Замыкающийся круг
40. Ниже представлен вклад (%) в загрязнение атмосферного воздуха основных отраслей промышленности:
Транспорт40
Электроэнергетика
28,5
Цветная металлургия
Черная металлургия
Нефтедобыча
21,6
15,2
7,9
Нефтепереработка
5,1
Машиностроение
3,6
Угольная промышленность
3,6
Газовая промышленность
3,3
Производство строительных
материалов
3,2
Химическая
промышленность
2,7
Деревообработка
2,6
Пищевая промышленность
1,5
Оборонная промышленность
0,6
Легкая промышленность
0,4
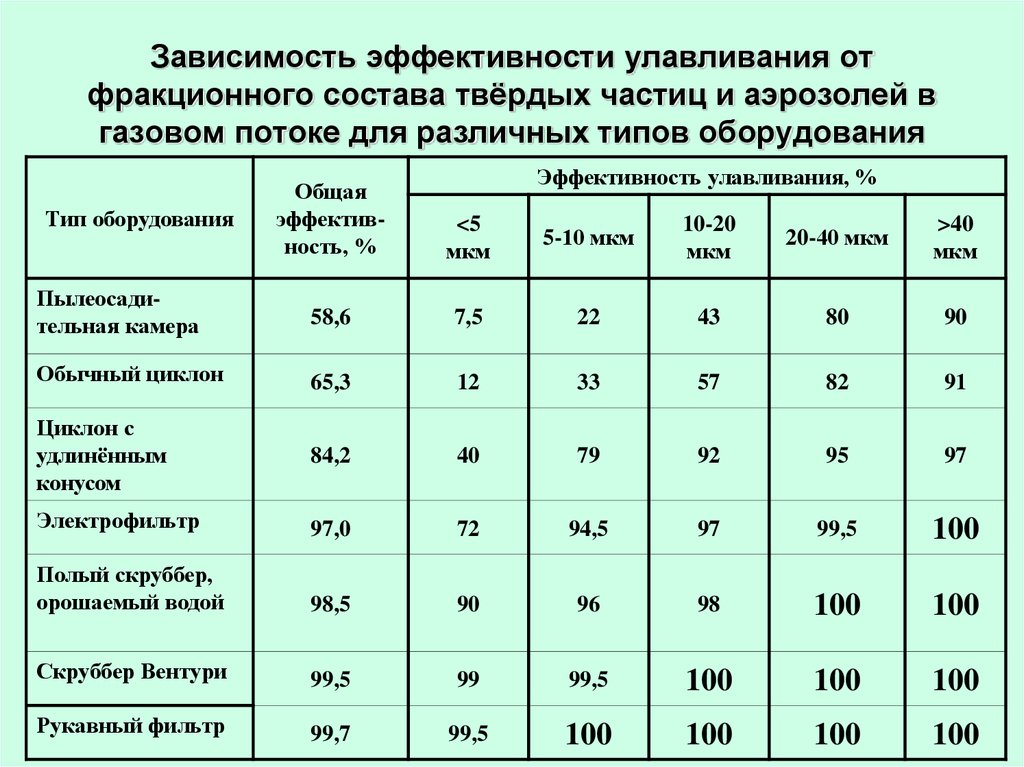
41. Зависимость эффективности улавливания от фракционного состава твёрдых частиц и аэрозолей в газовом потоке для различных типов
оборудованияЭффективность улавливания, %
Общая
эффективность, %
<5
мкм
5-10 мкм
10-20
мкм
20-40 мкм
>40
мкм
Пылеосадительная камера
58,6
7,5
22
43
80
90
Обычный циклон
65,3
12
33
57
82
91
Циклон с
удлинённым
конусом
84,2
40
79
92
95
97
Электрофильтр
97,0
72
94,5
97
99,5
100
Полый скруббер,
орошаемый водой
98,5
90
96
98
100
100
Скруббер Вентури
99,5
99
99,5
100
100
100
Рукавный фильтр
99,7
99,5
100
100
100
100
Тип оборудования
42.
43.
Схема работы рукавного фильтра:а – очистка от пыли,
б – регенерация фильтра сжатым воздухом.
44.
45.
46. Очистка топочных газов от диоксида серы
Известковый и известняковый методыОсновные химические реакции, протекающие при взаимодействии
SО2 с пульпой гидроксида кальция или известняка, описываются
следующими уравнениями:
CaO + H2O
Сa(OH)2
Ca(OH)2 + СO2 СаСО3 + H2O
CaCO3 + CO2 + H2O
Са(НСО3)2
Са(НСО3)2 + SO2 + H2O
CaSO3 * 2 H2O + 2 СO2
CaSO3 * 2 H2O + 1/2 О2
CaSO4 * 2 H2O
47.
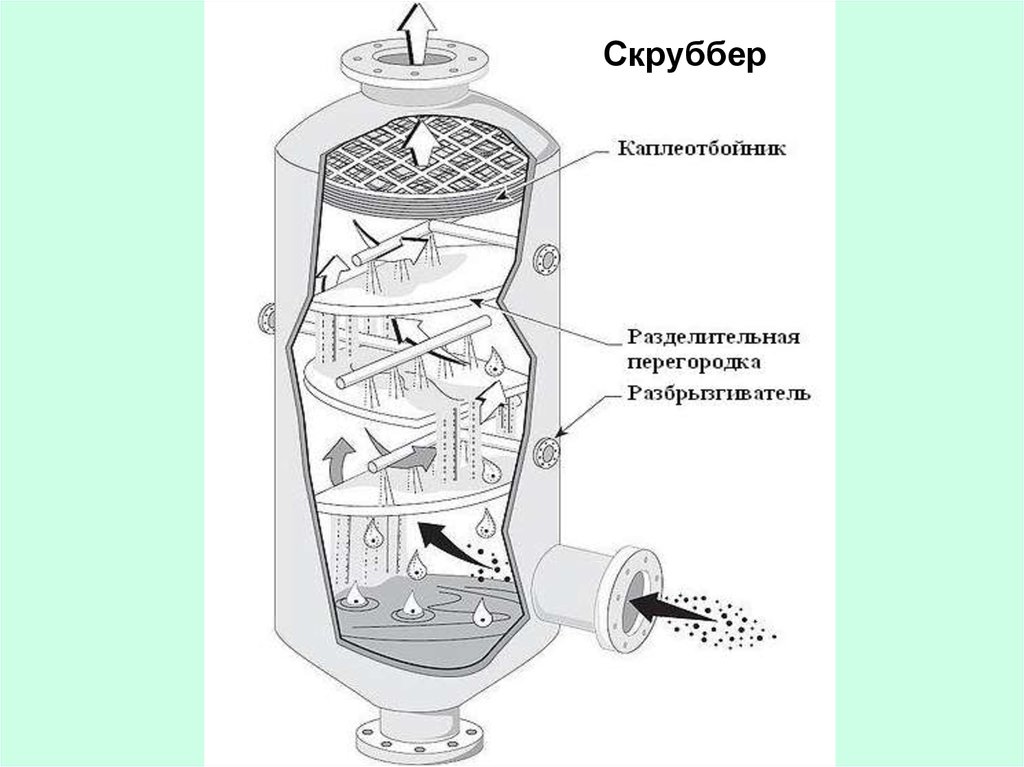
Скруббер48.
Абсорберы:а – форсуночный абсорбер, б – абсорбер с шаровой насадкой, в –
пенный абсорбер.
49.
Магнезитовый методСущность метода состоит во взаимодействии SO2 с
суспензией Мg(ОН)2 по реакции:
Мg(ОН)2 + SO2 + 5 Н2О
МgSО3 * 6 Н2О
Кристаллический сульфит магния подвергают сушке и
обжигу, получая при этом концентрированный поток SO2 и МgО.
Оксид магния возвращается в цикл, а SO2 направляется на
переработку (например, на получение серной кислоты по
стандартной технологии). Часть сульфита магния под
действием кислорода воздуха окисляется до сульфата:
МgSО3 + 1/2О2
МgSО4
50.
Достоинствами магнезитового метода являются егоцикличность, высокая эффективность (степень очистки 9092%), возможность утилизации SO2 Основной недостаток
процесса - большое количество твердофазных стадий, что
приводит к сильному абразивному износу аппаратуры и
загрязнению среды твердыми частицами. Весьма
значительными являются и энергетические затраты на
разложение сульфита и сульфата магния.
Аммиачные методы
В основе этих методов лежит процесс абсорбции SO2
раствором сульфита аммония:
SO2 + (NH4 )2 SO3 + H2O
2 NH4 НSO3
51. Очистка отходящих газов от оксидов азота
Адсорбционные методыВ случае небольших объемов газов нашли применение
адсорбционные методы. Хорошим сорбентом оксидов азота
служит активированный уголь, но его применение
затрудняется из-за легкой окисляемости, что может привести
к сильному разогреву и даже к возгоранию угля (при
значительных концентрациях оксидов азота). Силикагель по
адсорбционным свойствам несколько уступает углю, но он
более прочен и не окисляется кислородом, а окисление NO в
NO2 в его присутствии протекает даже быстрее. Однако
широкому распространению этих методов препятствует то,
что одновременно сорбируются и другие примеси, в
результате снижается адсорбционная емкость сорбентов и
осложняются процесс десорбции и использование ценных
компонентов.
52.
Каталитическое восстановлениеОдним из
основных,
хорошо
освоенных
промышленных методов очистки отходящих газов
от оксидов азота является их восстановление на
катализаторе до молекулярного азота. При
использовании
неселективного
катализатора
восстановитель расходуется не только на
восстановление азота, но и вступает во
взаимодействие
с
кислородом,
обычно
содержащимся в газовом потоке. В качестве
восстановителя применяются водород, природный
газ, оксид углерода и др. Катализаторами обычно
служат
элементы
платиновой
группы.
Температура процесса колеблется от 400 до
800оС.
53.
Наиболее широкое распространение получило селективноекаталитическое восстановление оксидов азота аммиаком:
6 NO + 4NH3 5 N2 + 6 H2О,
6 NO2 + 8NH3 7 N2 + 12 H2O.
В нашей стране для этих целей разработан
специальный алюмо-ванадиевый катализатор (АВК-10).
Процесс восстановления протекает при 200-3600С, степень
очистки составляет 96-98,5%. Основным недостатком
метода является необходимость точного дозирования
аммиака, что при переменном составе отходящих газов
(меняется концентрация оксидов азота) практически
невозможно. При недостатке аммиака происходит проскок
оксидов азота, а при избытке – проскок аммиака, и
отходящие газы загрязняются токсичными соединениями.
54.
Карбамидный методВ РХТУ им. Д.И. Менделеева разработан Карбамидный
метод, позволяющий очищать дымовые газы от оксидов азота на
95% и практически полностью удалять оксиды серы из них.
Процесс не требует предварительной подготовки газов, в
результате очистки образуются нетоксичные продукты - N2, СО2,
Н2О и (NH4)2SO4. Величина рН абсорбционного раствора
колеблется в пределах 5-9, поэтому коррозии аппаратуры не
наблюдается. Эффективность метода практически не зависит от
колебаний входных концентраций оксидов азота и серы.
В общем виде процесс описывается приведенными ниже
уравнениями реакций:
Н2О
NO + NO2 + (NH2)2CO
2 Н2О + СО2 + 2 N2,
SO2 + (NH2)2CO + 2 Н2О + 1/2 О2 (NH4)2SO4 + СО2
55.
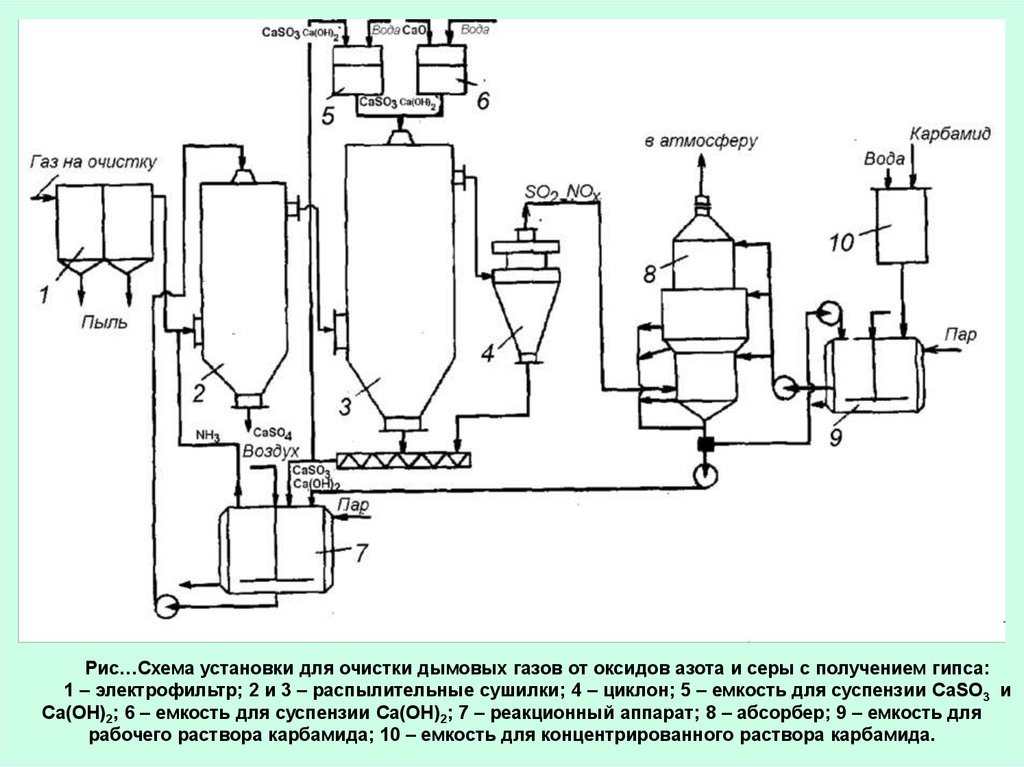
Рис…Схема установки для очистки дымовых газов от оксидов азота и серы с получением гипса:1 – электрофильтр; 2 и 3 – распылительные сушилки; 4 – циклон; 5 – емкость для суспензии CaSO3 и
Ca(OH)2; 6 – емкость для суспензии Ca(OH)2; 7 – реакционный аппарат; 8 – абсорбер; 9 – емкость для
рабочего раствора карбамида; 10 – емкость для концентрированного раствора карбамида.
56.
Снижение выбросов оксидов азота в атмосферупутем регулирования процесса горения
Наряду с установкой газоочистного оборудования в конце
технологического цикла сжигания топлива весьма эффективными
являются ряд режимных и технологических мероприятий,
позволяющих существенно снизить количество образующихся в
процессе горения оксидов азота. К этим мероприятиям относятся:
• сжигание с низким коэффициентом избытка воздуха (а – альфа);
• рециркуляция части дымовых газов в зону горения;
• сжигание топлива в две и три ступени;
• применение горелок, позволяющих понизить выход NOх;
• подача влаги в зону горения;
• интенсификация излучения в топочной камере;
• выбор профиля топочной камеры, которому отвечает наименьший
выход NOх.
Следует отметить, что указанные мероприятия способны в
той или иной мере подавить образование NOх из азота воздуха, но не
могут предотвратить их образования из азотосодержащих соединений,
имеющихся в составе топлива.
57.
Очистка отходящих газов от фтор- и хлорсодержащихсоединений
Очистка от фторсодержащих газов подробно описана в главе 10
при переработке фосфатного сырья, всегда содержащего значительное
количество фтора и в книге. Очистка от газовых выбросов, содержащих,
чаще всего, хлористый водород, в основном, проводится известковым
молоком. При граммовых концентрациях хлористого водорода, его можно
абсорбировать четырёххлористым углеродом или трихлорэтиленом, с
последующим выделением в концентрированном виде при нагревании
смеси (не забывая об исключительной токсичности последних).
Очистка отходящих газов от оксида углерода и
углеводородов
Основным методом очистки от углеводородов и оксида углерода в
промышленности являются сжигание в пламени, а также термическое и
каталитическое окисление. Наиболее известным примером сжигания
является широко применяемое в нефтедобывающей и
нефтеперерабатывающей промышленности сжигание в факеле, т.е. в
открытой горелке, направленной вверх. К недостаткам процесса, помимо
потерь углеводородов при горении следует отнести образование
оксидов азота, а следовательно, вторичное загрязнение атмосферы.
58.
Вусловиях
термического
и
каталитического
окисления
обезвреживание углеводородов и оксида углерода протекает при
более низких температурах и образования значительных количеств
оксидов азота не происходит.
Отходящие газы на очистку
Очищенный газ
Термокаталитический
реактор (ТКР- КС-1):
1 – входной патрубок,
2 – корпус,
3 – рекуператор тепла,
4 – кассета фильтра,
5 – теплоэлектронагреватели,
6 – съемные кассеты,
7,8 – боковая и верхняя
крышки,
9 – защитный кожух,
10 – бункер,
11 – опора.
59.
Содержание загрязняющих веществ в дымовых газах примусоросжигании
Компонент
Типичная
Состав дымовых
концентрация в газов МСЗ № 2,
дымовых газах
мг/нм3
до очистки,
До
После
очистки очистки
мг/нм3
ПДКс.с.,
мг/нм3
Летучая зола
(пыль)
HCl
HF
SO2
NOx
Hg
Cd
Tl
6980
2740
8
0,1
750
10
250
260
0,2
2
(общая)
1220
40
300
420
-
9
0,7
39
98
-
-
0,06
Др. тяжелые
металлы
50
(общая)
-
0,06
СО
Органические
вещества
Диоксины и
фураны
250
100
(общая)
2 ∙ 10-6
(общая)
40
40
4,3
4,2
0,2
0,005
0,05
0,04
0,0003
0,0003
(у каждого)
0,001
(в среднем у
каждого)
3,0
1 ∙ 10-7
(бенз(а)-пирен)
0,5 ∙ 10-9
(общая)
4,1*10-6 9,0 * 10-8
60.
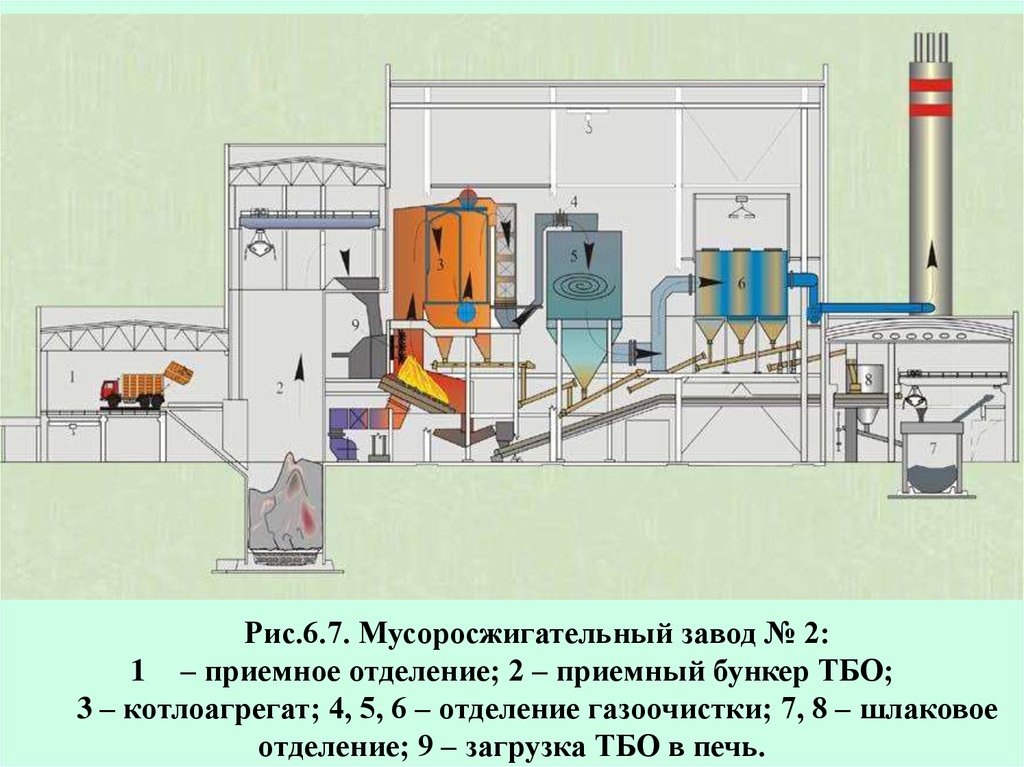
Рис.6.7. Мусоросжигательный завод № 2:1 – приемное отделение; 2 – приемный бункер ТБО;
3 – котлоагрегат; 4, 5, 6 – отделение газоочистки; 7, 8 – шлаковое
отделение; 9 – загрузка ТБО в печь.
61.
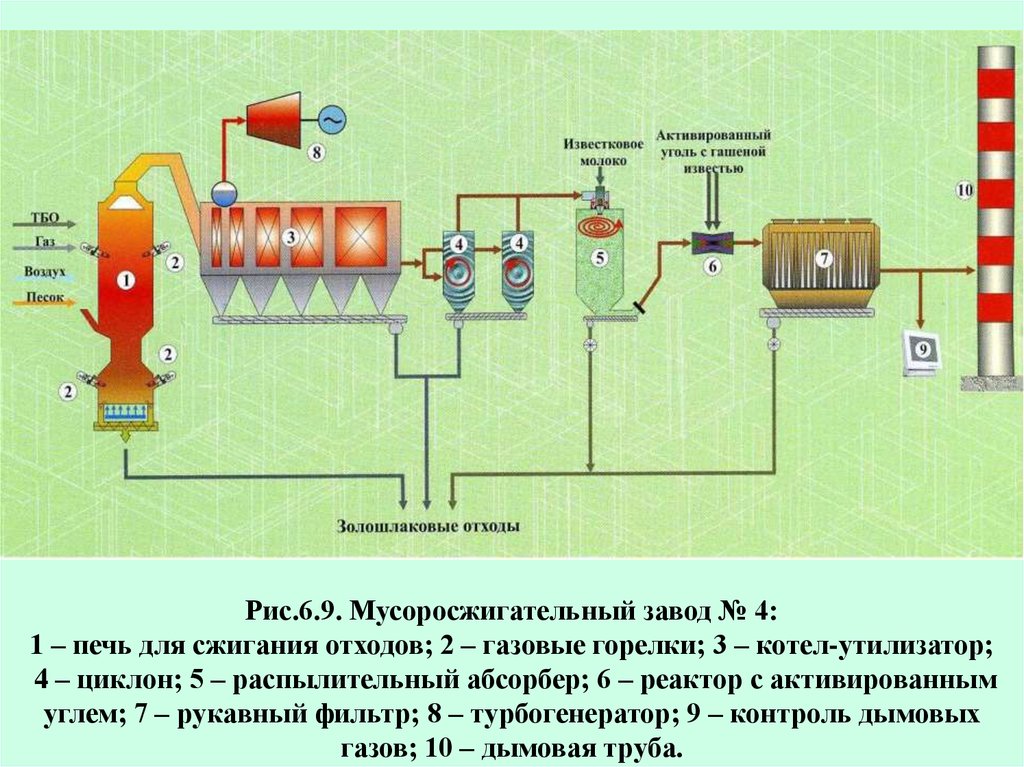
Рис.6.9. Мусоросжигательный завод № 4:1 – печь для сжигания отходов; 2 – газовые горелки; 3 – котел-утилизатор;
4 – циклон; 5 – распылительный абсорбер; 6 – реактор с активированным
углем; 7 – рукавный фильтр; 8 – турбогенератор; 9 – контроль дымовых
газов; 10 – дымовая труба.















































 ecology
ecology








